虎杖苷对小鼠芥子气肺损伤的保护作用
王雨润,岑金凤,孟文琪,裴志鹏,肖 凯,谢 颖*,孙铭学*
1.湖南师范大学医学院分子流行病学湖南省重点实验室,长沙 410000
2.海军军医大学(第二军医大学)海军医学系防化医学教研室,上海 200433
芥子气(sulfur mustard,SM)是难防难治化学战剂的典型代表,自第一次世界大战期间被引入战场后,又多次被用于各种冲突和恐怖袭击[1-2]。尽管目前存在毒性更强的化学战剂,但是SM 具有易于工业化生产、难以预防和治疗的特点,仍然具有较大的军事威胁。肺是SM 损伤的主要靶器官之一,急性肺损伤是导致SM 中毒患者死亡的主要原因之一[3-4]。研究者们认为氧化应激是SM 中毒的关键环节[5-6]。研究表明,炎症因子如IL-1β、IL-6和TNF-α 等与SM 引起的肺损伤密切相关[7-9]。SM中毒的机制尚未完全阐明,目前还没有特效治疗药物,以对症治疗为主。基于SM 的军事威胁和毒性特点,推进SM 中毒机制的研究、寻找新型有效的治疗药物具有重要意义。
虎杖苷(polydatin,PD)是一种白藜芦醇的苷类衍生物,从传统中药虎杖(Polygonum cuspidatumSieb)的根部分离得到。PD 分布广泛,存在于许多常见的食品中,如葡萄、葡萄酒及花生等。研究表明PD 具有抗氧化和抗炎活性,能发挥对肾脏、肝脏和肺功能的保护作用[10-12],可作用于多个系统且不良反应小,具有巨大的应用潜力。Shu 等[13]研究发现PD 可阻断磷脂酶A2 的活性,下调分泌型磷脂酶A2 ⅡA mRNA 的表达,改善内毒素休克大鼠的急性肺损伤。王方岩等[14]观察到PD 可通过降低超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量来减轻缺血/再灌注引起的肺损伤。现有文献中未见PD 对SM 所致肺损伤作用的相关报道。本研究以雄性ICR 小鼠为研究对象,建立SM肺损伤模型,探究PD 对SM 肺损伤的改善作用,并初步探索其作用机制。
1 材料和方法
1.1 动物分组与造模ICR 小鼠(雄性,6~8 周龄,体重25~30 g)由昭衍(苏州)新药研究中心有限公司[生产许可证号:SCXK(苏)2018-0006]提供。小鼠在12 h 光照/12 h 黑暗循环、室温(20±2)℃、自由进食和饮水的条件下饲养1周后使用。在存活率实验中,将小鼠随机分为6 组(n=15):对照(Ctrl)组、SM 组、PD 低剂量(SM+PD100)组、PD 中剂量(SM+PD200)组、PD 高剂量(SM+PD400)组和阳性对照药N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)治疗(SM+NAC)组。SM 以40 mg/kg 的剂量皮下注射给药。在SM 暴露30 min 后,SM+PD100、SM+PD200、SM+PD400 组分别以100、200、400 mg/kg PD 每天灌胃给药1 次,持续给药7 d。SM+NAC 组在SM 暴露30 min 后,以200 mg/kg 的剂量每天灌胃给药1 次,持续给药7 d。连续观察14 d,每天按时记录小鼠的存活情况。
在除存活率外的其他实验中,小鼠被随机分为4 组(n=15):Ctrl 组、SM 组、SM+PD200 组和SM+NAC 组。SM 以30 mg/kg 的剂量皮下注射给药。PD 在SM 暴露30 min 后,以200 mg/kg(SM+PD200 组)的剂量每天灌胃给药1 次,持续给药5 d。SM+NAC 组在SM 暴露30 min 后,以200 mg/kg的剂量每天灌胃给药1 次,持续给药5 d。于第1、3、5、7、10 天处死小鼠,取各组小鼠肺组织制作H-E切片进行组织病理学观察。另取一批小鼠随机分为上述4 组(n=15),处理同前,持续给药5 d 后处死小鼠进行后续实验。
1.2 试剂SM(纯品)由军事科学院防化研究院提供;PD(纯度为95%)和NAC(纯度为99%)购自美国Sigma-Aldrich 公司,货号分别为15721-25G 和A9165。
1.3 肺组织病理学观察处死小鼠后,取左侧最大叶肺组织,在4%多聚甲醛组织固定液中固定24 h,按顺序放入梯度乙醇和二甲苯溶液中脱水(75%乙醇4 h → 85%乙醇2 h → 90%乙醇2 h →95%乙醇1 h → 无水乙醇Ⅰ 30 min → 无水乙醇Ⅱ30 min → 二甲苯Ⅰ 10 min → 二甲苯Ⅱ 10 min),透明处理后将肺组织浸蜡包埋并切成5 µm 厚的切片,H-E 染色。规避分组信息后邀请上海市肺科医院谢惠康副主任医师和高彩霞、张伟2 位中级技师根据肺水肿、肺出血、肺组织炎症细胞浸润、肺泡壁结构、支气管结构和病变面积等情况对H-E 切片进行评分:未见任何病变记为0 分;病理改变轻微、病变面积≤25%记为1 分;病理改变轻度、病变面积>25%~50%记为2 分;病理改变中度、病变面积>50%~75%记为3 分;病理改变重度、病变面积>75%记为4 分。
1.4 肺湿重/干重(W/D)比值检测将小鼠的肺组织完整取出,用吸水纸擦掉肺表面残余的血渍后称量,记为湿重(W)。将肺组织在70 ℃烘箱中干燥72 h 后称量,记为干重(D),计算W/D 比值。
1.5 肺泡灌洗液(bronchoalveolar lavage fluid,BALF)蛋白浓度检测小鼠末次给药后,腹腔注射10%的水合氯醛进行麻醉,固定小鼠后打开腹腔,剪断两侧腹主动脉进行放血,钝性分离出小鼠气管,通过气管将1 mL 预冷的生理盐水缓缓注入小鼠肺中,然后缓慢回抽,循环3 次,最后回抽600 µL 生理盐水。将获得的BALF 离心(4 ℃,400×g,15 min),收集上清,于-80 ℃保存备用。
1.6 氧化应激指标与炎症因子检测采用SOD活性检测试剂盒(WST-8 法)检测小鼠肺组织中SOD 活性,用脂质氧化检测试剂盒检测MDA 含量,用过氧化氢(H2O2)检测试剂盒检测H2O2含量。以上试剂盒均购自上海碧云天生物技术有限公司,货号分别为S0103、S0131S、S0038。还原型谷胱甘肽(glutathione,GSH)含量检测试剂盒与髓过氧化物酶(myeloperoxidase,MPO)活性检测试剂盒均购自南京建成生物工程研究所,货号分别为A006-2-1、A044-1-1。所有检测步骤均依据试剂盒说明书进行。
采用IL-1β ELISA 试剂盒检测小鼠肺组织中IL-1β 水 平,IL-6 ELISA 试 剂 盒 检 测IL-6 水 平,TNF-α ELISA 试剂盒检测TNF-α 水平,以上试剂盒均购自美国R&D 公司,货号分别为SMLB00C、SM6000B、SMTA00B。所有检测步骤均依据试剂盒说明书进行。
1.7 氧化应激与炎症反应相关蛋白表达水平的检测将组织放入含有蛋白酶抑制剂的RIPA缓冲液(上海碧云天生物技术有限公司,货号P0013D)中剪碎,在预冷的组织研磨仪上匀浆至没有肉眼可见的组织块,离心(4 ℃,13 000×g,20 min)后将上清小心转移到新的EP 管中。依据哺乳动物细胞核和细胞质蛋白提取试剂盒(北京全式金生物技术有限公司,货号DE201-01)的说明书提取细胞核和细胞质蛋白。采用BCA 蛋白浓度检测试剂盒(上海碧云天生物技术有限公司,货号P0012S)测定蛋白浓度。将蛋白(40 µg)上样于12% SDS-聚丙烯酰胺凝胶上,电泳分离后转至PVDF 膜(美国Millipore 公司,货号ISEQ00010)。用5%脱脂牛奶封闭2 h,TBST(TBS购自武汉塞维尔生物科技公司,货号G0001-2L;吐温购自上海博光生物科技有限公司,货号BLSJ-0763)洗膜后用相应一抗在4 ℃孵育过夜,洗膜后放入HRP 标记的二抗(1 ∶3 000 TBST 稀释)中在室温下孵育1 h,TBST 清洗,经化学发光法得到条带。GAPDH、β-微管蛋白(β-tubulin)、核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)、NAD(P)H:醌氧化还原酶(NAD(P)H:quinone oxidoreductase 1,NQO1)、Toll 样受体4(Toll-like receptor 4,TLR4)、NF-κB p65 总 蛋白抗体均购自Proteintech 中国公司,货号分别为60004-1-Ig、11224-1-AP、16396-1-AP、11451-1-AP、19811-1-AP、10745-1-AP;TATA 盒 结 合 蛋白(TATA box binding protein,TBP)、 沉 默 信息调节因子1(silencing information regulator 1,SIRT1)、血红素加氧酶1(heme oxygenase 1,HO-1)抗体均购自上海碧云天生物技术有限公司,货号分别为AF5321、AF0282、AF1333;磷酸 化NF-κB p65 抗 体 购 自 美 国CST 公 司,货 号3039;HRP 标记的山羊抗兔/鼠抗体购自上海碧云天生物技术有限公司,货号为A0208、A0216。
1.8 统计学处理应用GraphPad Prism 9 软件进行分析和绘图。数据以±s表示,多组间比较采用单因素方差分析,多样本均数两两之间比较采用SNK-q检验。用Kaplan-Meier 法绘制生存曲线,存活率的比较采用log-rank 检验。检验水准(α)为0.05。
2 结 果
2.1 PD 可以提高SM染毒小鼠的存活率,改善SM所致肺损伤如图1 所示,Ctrl 组无小鼠死亡,SM组小鼠存活率为11.33%(与Ctrl 组比较,P<0.01);与SM 组相比,SM+NAC 组小鼠与SM+PD400组小鼠存活率均提升至26.84%(P均<0.05);SM+PD200 组小鼠存活率提高至48.62%(与SM 组相比,P<0.01;与SM+NAC 组相比,P<0.05);SM+PD100 组小鼠存活率与SM 组相比无明显提升(P>0.05)。以上结果表明,PD 可以提高SM 染毒小鼠的存活率,且PD 最佳给药剂量为200 mg/kg,选用此剂量进行后续PD 作用评价实验。
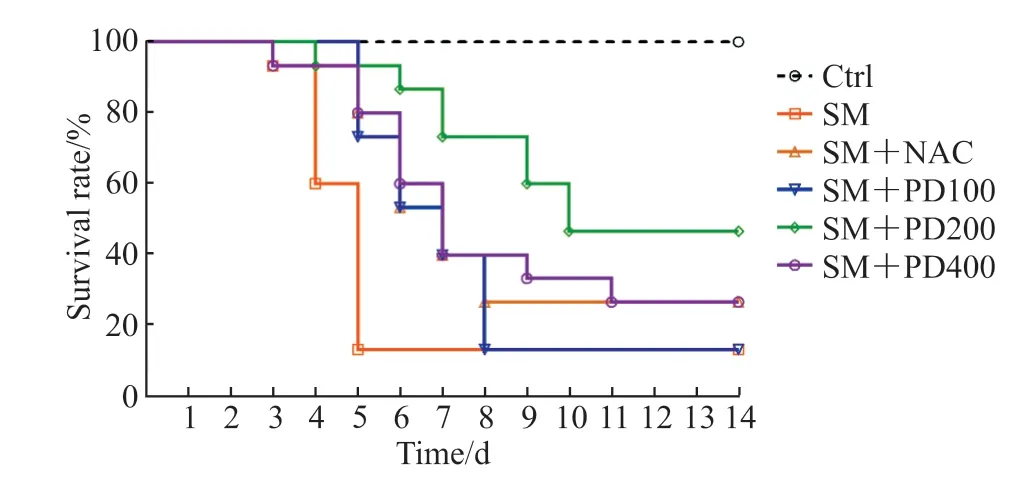
图1 PD 处理对SM 染毒小鼠存活率的影响Fig 1 Effect of PD on survival rate of SM-exposed mice
H-E 染色观察PD 对SM 所致肺损伤的影响,结果如图2、3 所示,Ctrl 组小鼠肺组织形态正常,肺泡和支气管结构完整;SM 组小鼠肺损伤先加重后减轻,在SM 暴露后的第5 天肺组织损伤最为严重(评分与Ctrl 组比较,P<0.01),可见明显的支气管结构破坏和肺间隔增厚,炎症细胞浸润增加;与SM 组相比,SM+NAC 组小鼠肺损伤程度有轻微改善,肺泡腔内有部分炎症细胞浸润,可见少量出血和肺间隔增厚,支气管结构轻微破坏;SM+PD200 组小鼠肺损伤有明显缓解(第5 天评分与SM 组比较,P<0.05),肺泡腔仅有少量的炎症细胞浸润和渗出物,偶见支气管结构轻微破坏。结果表明PD 和NAC 对SM 所致肺损伤均具有一定的保护作用,且前者效果优于后者。
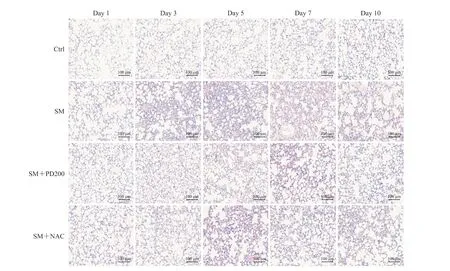
图2 各组小鼠肺组织病理变化Fig 2 Histopathological changes of lung issues in mice in each group
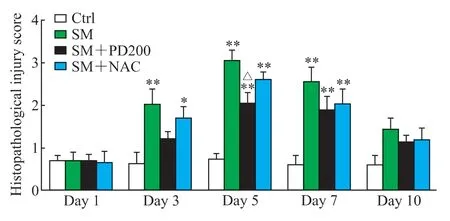
图3 各组小鼠肺组织病理损伤评分Fig 3 Histopathological injury scores of lung tissues in mice in each group
通过小鼠肺W/D 比值和BALF 蛋白浓度来评判肺损伤程度(n=5)。Ctrl 组W/D 比值为4.22±0.22,BALF 蛋白浓度为(349.90±110.14)μg/mL。与Ctrl 组相比,SM 组小鼠W/D 比值(4.91±0.16)和BALF 蛋 白 浓 度[(869.23±73.85)μg/mL]升高(P<0.01),提示SM 可引起肺组织损伤。采用PD200 干预可降低W/D 比值(4.44±0.23)和BALF 蛋白浓度[(545.67±64.28)μg/mL](与SM组相比,P<0.05 或P<0.01),采用NAC 干预不能降低W/D 比值(4.67±0.26;与SM 组相比,P>0.05)但可降低BALF蛋白浓度[(645.77±127.46)μg/mL,与SM 组相比,P<0.05],提示PD 和NAC 可降低SM 染毒小鼠的肺水肿,对SM 所致肺损伤具有保护作用,且PD 的作用效果优于NAC。
2.2 PD 可以降低SM染毒小鼠的氧化应激相关指标水平如图4 所示,与Ctrl 组相比,SM 组小鼠肺组织中MDA 含量、H2O2含量及MPO 活性均升高(P均<0.01),GSH 含量、SOD 活性均降低(P均<0.01);NAC 处理可提高GSH 含量和SOD 活性(与SM 组相比,P均<0.05);PD200 处理后可降低MDA 含量、H2O2含量及MPO 活性(与SM 组相比,P<0.05 或P<0.01),提高GSH 含量、SOD活性(与SM 组相比,P均<0.01)。结果表明PD和NAC 可以不同程度地改善SM 引起的氧化应激。

图4 各组小鼠肺组织中氧化应激相关指标检测结果Fig 4 Results of oxidative stress indexes in lung tissues of mice in each group
2.3 PD 可上调SM染毒小鼠SIRT1蛋白的表达,促进Nrf2的核转移,上调HO-1和NQO1蛋白的表达如图5A 所示,与Ctrl 组相比,SM 组SIRT1蛋白的表达水平下降(P<0.01)。与SM 组相比,SM+PD200 组和SM+NAC 组SIRT1 蛋白的表达水平均有所上升(P<0.01,P<0.05),证明PD和NAC 都可能通过激活SIRT1 蛋白来发挥其保护作用。如图5B、5C 所示,各组细胞胞质的Nrf2 总蛋白水平没有明显变化,但SM+PD200 组和SM+NAC 组Nrf2 蛋白的核转移与SM 组相比增加(P<0.01,P<0.05)。如图6所示,与SM组相比,SM+PD200 组HO-1 和NQO1 蛋白的表达水平增加(P<0.05 或P<0.01),SM+NAC 组的HO-1 蛋白表达水平增加(P<0.05),且SM+PD200 组的变化均较SM+NAC 组更为显著。结果表明PD 可能通过激活SIRT1 蛋白的表达来调控Nrf2 及其下游蛋白发挥抗氧化作用。
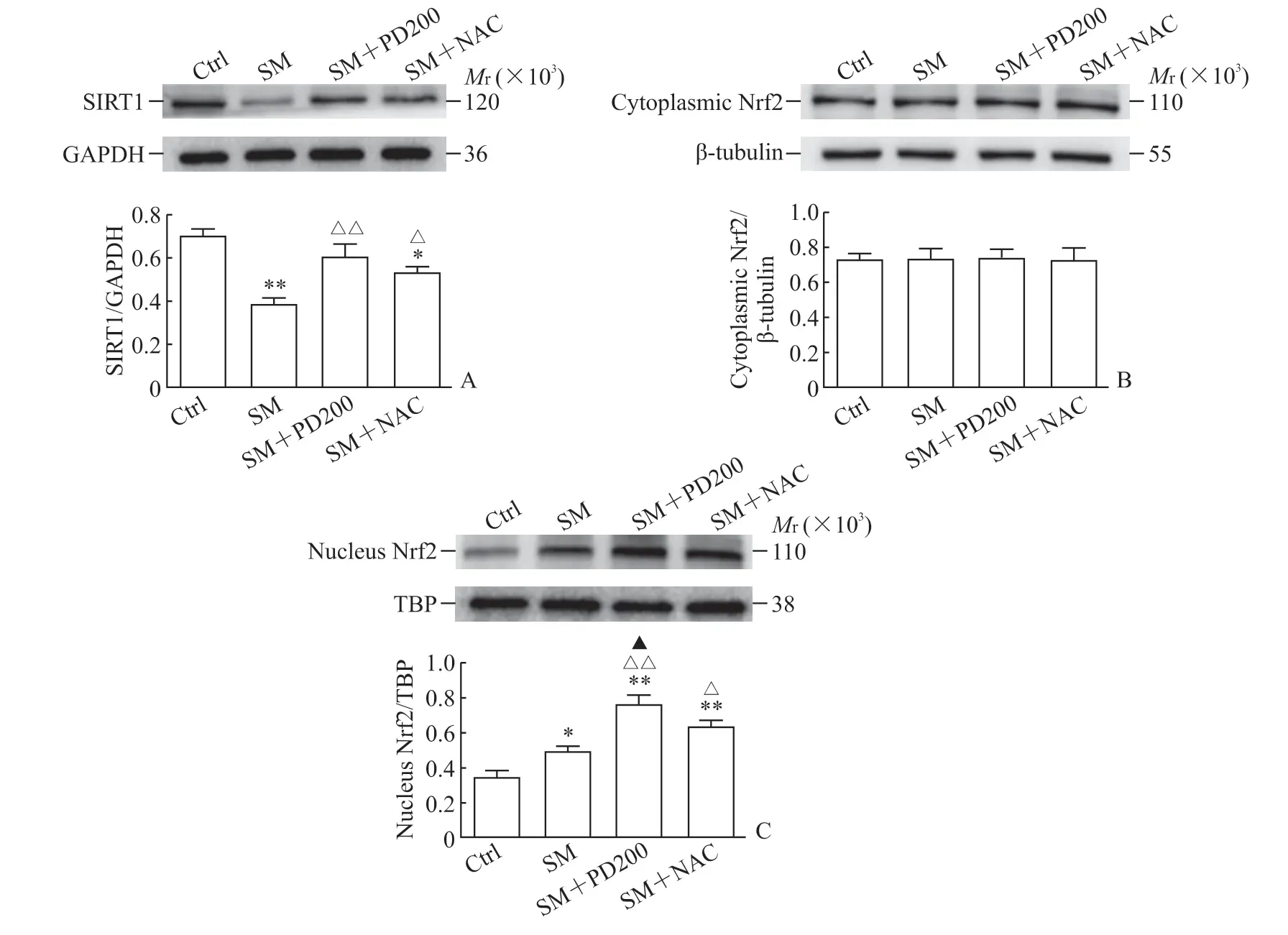
图5 各组小鼠肺组织中SIRT1 与Nrf2 蛋白的表达Fig 5 Protein expression of SIRT1 and Nrf2 in lung tissues of mice in each group
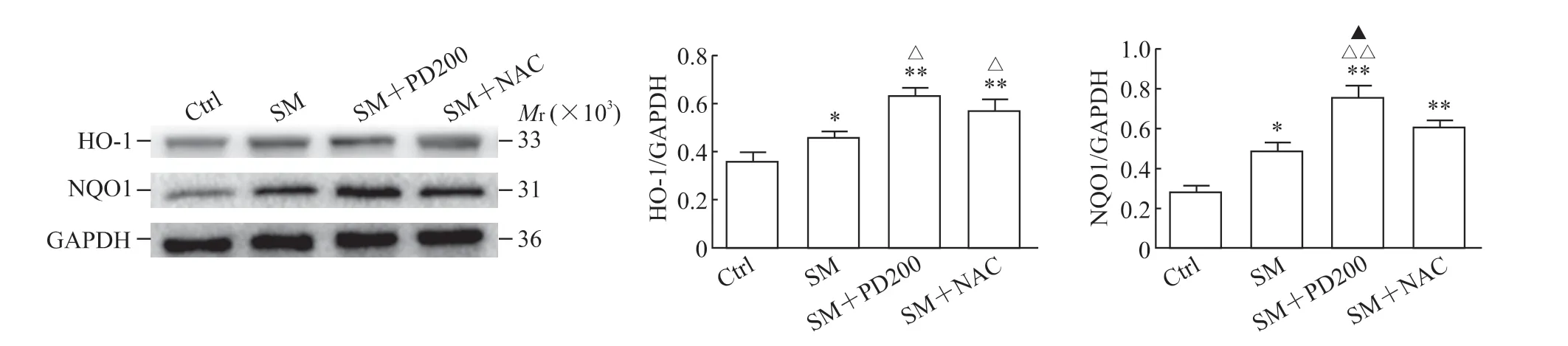
图6 各组小鼠肺组织中HO-1 和NQO1 蛋白的表达Fig 6 Protein expression of HO-1 and NQO1 in lung tissues of mice in each group
2.4 PD 可降低SM染毒小鼠炎症因子水平通过ELISA 试剂盒检测小鼠肺组织中炎症因子TNF-α、IL-1β 和IL-6 的水平变化,结果如图7 所示。与Ctrl组相比,SM 组TNF-α、IL-1β、IL-6 的表达水平均升高(P均<0.01),提示SM 作用后可引起肺组织的炎症反应;PD或NAC处理降低了TNF-α、IL-1β的表达水平 (与SM 组相比,P均<0.05)。SM+PD200组IL-6 水平较SM 组降低(P<0.05),SM+NAC 组IL-6 水平降低不明显。结果说明PD 可以降低SM 染毒小鼠肺组织内的炎症水平,改善小鼠SM肺损伤。

图7 各组小鼠肺组织中炎症因子的检测结果Fig 7 Results of inflammatory factors in lung tissues of mice in each group
2.5 PD 可降低SM染毒小鼠TLR4蛋白、NF-κB p65总蛋白表达及NF-κB p65磷酸化水平如图8所示,与Ctrl 组相比,SM 组小鼠肺组织中TLR4 蛋白和NF-κB p65 总蛋白表达及NF-κB 磷酸化水平升高(P<0.01);与SM 组相比,PD 或NAC 处理后NFκB p65 总蛋白及其磷酸化水平降低(P<0.01 或P<0.05),SM+NAC 组TLR4 蛋白水平下降不明显。结果表明PD 可能通过TLR4/NF-κB 通路来抑制SM所致的炎症反应。
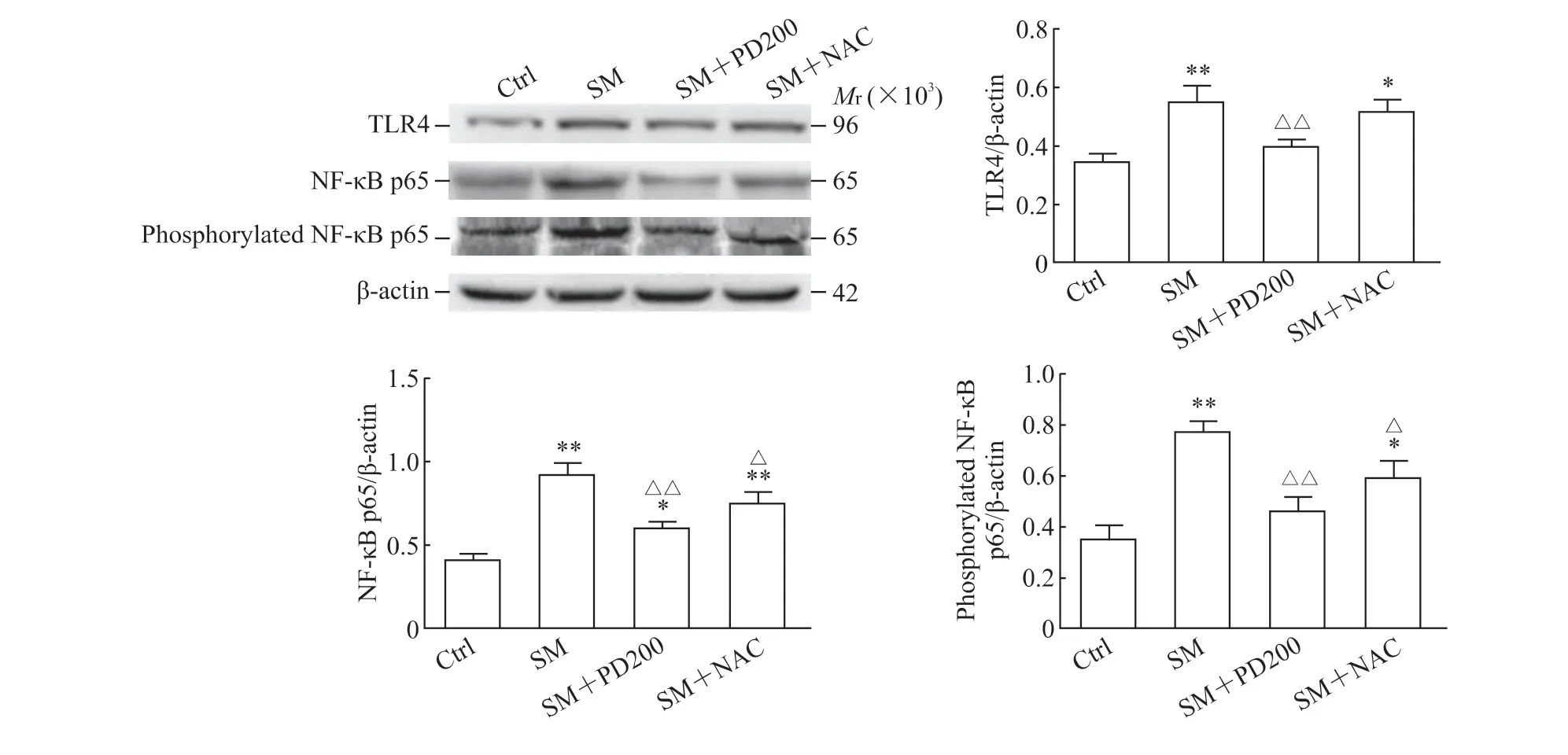
图8 各组小鼠肺组织中TLR4、NF-κB p65 和磷酸化NF-κB p65 蛋白的表达Fig 8 Protein expression of TLR4, NF-κB p65 and phosphorylated NF-κB p65 in lung tissues of mice in each group
3 讨 论
在SM 暴露模型选择上,研究者们根据研究目的选择了不同的染毒方式[15-20],或将SM 制成气溶胶对眼、皮肤和呼吸系统进行直接染毒,或将液态SM 直接滴注到气管进行染毒,或通过皮下、腹腔或静脉注射的方式进行染毒,或通过皮肤涂抹进行染毒,以这些方式进行SM 染毒均可引起肺损伤。本实验选择皮下注射SM 为染毒模型,主要原因是我们认为皮肤暴露可能是SM 中毒更主要的威胁方式,因为和佩戴防毒面具相比及时穿戴好全身防护服的难度更大、更难以实现。由于受实验条件限制,仅能实现皮肤涂抹和皮下注射2 种方式进行SM 皮肤暴露,我们认为皮下注射可以更好地保证动物染毒剂量的一致性。
目前还没有针对SM 损伤的特效治疗药物,减少SM 所致损伤的最好方法是在2 min 内对暴露部位进行去污处理,否则SM 被吸收将造成机体损伤。目前对于SM 损伤主要采用支持性疗法,如抗生素治疗和皮肤烧伤护理等[21]。NAC 也可以通过多种机制减轻SM 损伤,具有较好的效果[22-23],因此本研究选用NAC 作为阳性对照药物。本实验中首先观察了PD 对于SM 肺损伤的作用,结果表明PD 可以提高SM 染毒小鼠的生存率、降低SM 染毒小鼠肺W/D 比值和BALF 蛋白浓度,这与其他PD 对肺损伤保护作用的报道[24-25]一致;NAC 也可缓解SM 所致肺损伤,但整体效果不及PD。
氧化应激是SM 肺损伤的起始和关键环节之一,SM 及其类似物能与各种细胞成分和低分子量代谢物反应,形成单功能和双功能加合物,最终导致活性氧过量产生、脂质过氧化、抗氧化体系失活等[26-27]。MPO 可以将H2O2转化为更高活性的次氯酸;MDA 含量高低用以评价细胞质膜的受损程度;GSH 和SOD 是重要的抗氧化剂,同时也是SM的靶标分子,SM 可以使它们耗损从而加重氧化应激水平,导致毒性效应[28-30]。Liu 等[31]证明PD 可以通过抑制MPO 和MDA 的水平提高SOD 活性,抑制大鼠特发性肺纤维化。Fu 等[32]发现PD 可以提高谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和SOD 的活性,缓解百草枯对人胚胎肺成纤维细胞造成的损伤。在本研究中,SM 组小鼠肺组织MDA 含量、H2O2含量和MPO 活性均高于Ctrl 组,而SOD 活性、GSH 含量均低于Ctrl 组;与SM 组比较,PD 组MDA 含量、H2O2含量和MPO 活性降低,SOD 活性、GSH 含量升高。本研究结果表明PD 可以通过降低氧化酶水平,提高抗氧化酶活性来抑制SM 所致肺损伤的氧化应激反应。
Sirtuin 家族是烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖的组蛋白去乙酰化酶家族,其生物学功能多样。SIRT1 作为Sirtuin 家族的重要成员之一,主要负责调控机体氧化应激与能量代谢等多条信号通路[33]。Nrf2 是抗氧化应激通路中发挥抗氧化作用的关键分子,通常情况下与特异性抑制受体Keap1相结合,大部分以无活性的形式存在于细胞质中;当机体受到刺激时会导致Nrf2 与Keap1 解离,解离的Nrf2向核转移并激活其下游通路蛋白的表达,以此来调节机体的氧化应激[6]。研究表明,PD 可以特异性激活SIRT1 蛋白的表达,调节SIRT1/Nrf2通路发挥抗氧化作用[34-35]。Meng 等[5]还发现Nrf2与其下游抗氧化蛋白HO-1 和NQO1 均参与了SM肺损伤的调节。本实验结果表明,SM 染毒小鼠肺组织的SIRT1 蛋白下调,Nrf2 少量入核。PD 可提升SM 染毒小鼠肺组织中SIRT1 蛋白的表达,促进Nrf2 入核,上调HO-1 和NQO1 蛋白的表达,从而减轻SM 的损伤作用,提示PD 在SM 染毒后可能通过调节SIRT1/Nrf2 通路改善SM 引起的肺损伤。
炎症反应也是SM 继发性损伤的重要标志之一。SM 引 起 的 肺 损 伤 会 导 致TNF-α、IL-1β、IL-6、IL-8 等炎症因子大量释放和炎性细胞的浸润,最终导致炎症反应[36-37]。TLR4 是Toll 样受体家族的成员之一,主要在免疫和炎症反应中发挥 作 用[38]。NF-κB 是TLR4 通 路 激 活 炎 症 反 应的下游关键分子,细胞应激可导致TLR4 蛋白表达提高,从而激活下游NF-κB 通路[39]。NF-κB p65 是NF-κB 家族的成员之一,其表达和磷酸化可间接反映NF-κB 的活性[40-41]。研究表明SM 可以增加肺组织中TLR4 的表达[42],PD 可以通过TLR4-MyD88-NF-κB 通路保护脂多糖诱导的急性肺损伤[24]。本实验结果表明SM 暴露小鼠肺组织中TLR4、NF-κB p65 及磷酸化NF-κB 水平升高,PD 处理可逆转上述变化,表明PD 可能通过调节TLR4/NF-κB 通路对SM 诱导的肺损伤产生抗炎作用。
综上所述,本研究首次明确了PD 对SM 肺损伤具有改善作用,初步阐明PD 治疗SM 肺损伤的机制主要与调节氧化应激、抑制炎症反应有关,为今后PD 治疗SM 肺损伤的临床研究提供了实验依据。

