SPECT-CT导引125Ⅰ粒子植入治疗RAIR-DTC的疗效及对肿瘤血管、血清Ctn、Tg、TGAb的影响*
苏 莉 黄诚刚 杨 明 杨 旺 陈慕华
武汉科技大学附属孝感医院(孝感市中心医院)核医学科 (湖北 孝感 432100)
甲状腺癌是我国总发病率排名第七的恶性肿瘤,在全球女性恶性肿瘤中排第四 位[1-2],其中分化型甲状腺癌(differentiated thyroid cancer,DTC)占全部甲状腺癌的90%以上,多数DTC患者采用积极的手术或选择性131Ⅰ治疗等,通常预后良好[3-4]。研究发现,10%左右的DTC患者综合治疗后复发,多数复发患者可能在发病早期或进行131Ⅰ治疗期间丧失摄碘能力,进而经病情逐渐发展成为碘难治性DTC(radioiodine refractory-DTC,RAIR-DTC)[5]。采用常规放化疗治疗RAIR-DTC,虽有助于控制肿瘤加重,但治疗效果较为局限,且不良反应大、治疗费用高,为这部分患者寻找有效的治疗手段一直是该治疗领域的重点研究内容[6]。目前关于SPECT-CT导引进行125Ⅰ粒子植入治疗主要用于非小细胞肺癌、前列腺癌等,相关报道较为多见,均证实其具有良好疗效[7-8]。但其治疗RAIR-DTC的报道较少,本研究对此进行探讨,并首次分析其对肿瘤血管、血清降钙素(Ctn)、甲状腺球蛋白(Tg)、甲状腺球蛋白抗体(TgAb)的影响,旨在为该疾病的治疗提供一定参考依据。
1 资料与方法
1.1 一般资料选取2018年1月至2020年12月我院98例RAIRDTC患者的临床资料,开展回顾性研究,根据治疗方法的差异划分成对照组和观察组,每组49例。对比两组性别、年龄、体质量指数(body mass index,BMI)、病理类型、临床分期、合并症,均无显著差异(P>0.05),见表1。
表1 两组一般资料比较[(±s), n(%)]
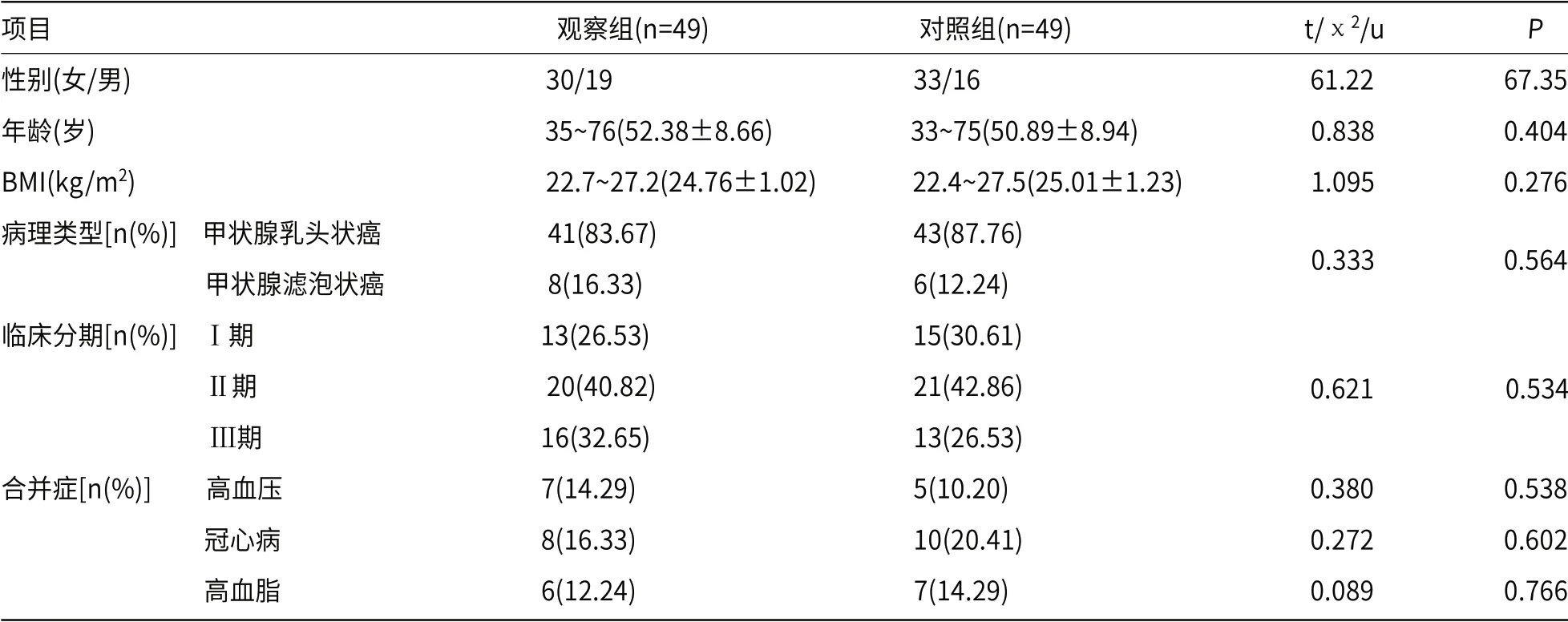
表1 两组一般资料比较[(±s), n(%)]
项目 观察组(n=49) 对照组(n=49) t/χ2/u P性别(女/男) 30/19 33/16 61.22 67.35年龄(岁) 35~76(52.38±8.66) 33~75(50.89±8.94) 0.838 0.404 BMI(kg/m2) 22.7~27.2(24.76±1.02) 22.4~27.5(25.01±1.23) 1.095 0.276病理类型[n(%)] 甲状腺乳头状癌 41(83.67) 43(87.76) 0.333 0.564 甲状腺滤泡状癌 8(16.33) 6(12.24) 临床分期[n(%)] Ⅰ期 13(26.53) 15(30.61) 0.621 0.534 Ⅱ期 20(40.82) 21(42.86) Ⅲ期 16(32.65) 13(26.53) 合并症[n(%)] 高血压 7(14.29) 5(10.20) 0.380 0.538 冠心病 8(16.33) 10(20.41) 0.272 0.602 高血脂 6(12.24) 7(14.29) 0.089 0.766
纳入标准:符合RAIR-DTC诊断标准[9],并经病理诊断确诊;均行甲状腺全切;卡氏功能状态评分(karnofsky performance status,KPS)[10]≥70分;无严重消化系统疾病;自主行为能力良好;临床资料完整,能满足本研究需求。排除标准:合并其他恶性肿瘤者;糖尿病、痛风、代谢疾病者;严重心脑血管疾病患者;血液系统疾病患者;严重感染性疾病患者;不能耐受放化疗或125Ⅰ粒子植入治疗者;妊娠期或哺乳期女性。
1.2 方法对照组:采用常规放化疗治疗,静脉滴注500mg/m2氟尿嘧啶,1次/d,连续给药5d;静脉滴注30mg/m2顺铂,1次/d,连续给药4d;20d为1个化疗周期,共化疗2个周期。化疗期间同步放疗,放疗前行CT模拟定位,对病变部位及周围组织常规行5mm层厚连续扫描,常规行放射治疗。
观察组:采用SPECT-CT导引125Ⅰ粒子植入治疗,选用北京飞天兆业科技有限责任公司放射植入治疗三维计划系统(treatment planning system,TPS),125Ⅰ粒子(1.48×107~2.96×107Bq/颗)及植入枪购自北京原子高科股份有限公司,治疗前采用美国GE公司生产的Discover NM/CT 670 Pro SPECT/CT所配置的16排螺旋CT扫描系统,对患者自颈第1椎体水平向下至主动脉弓上方水平进行常规扫描,同期进行全身131Ⅰ显像,完善血常规、生化、甲状腺功能、血清甲状腺球蛋白(thyroglobulin,Tg)等检查,常规禁饮食,阅片后传输至TPS,精确勾画肿瘤体积,计算计划靶体积、125Ⅰ粒子量、分布等,绘制出剂量-体积直方图,SPECT-CT导引下将125Ⅰ粒子植入,植入后CT图像传输至TPS并验证,若植入不均匀、小于处方剂量的20%,则需进行补种。
1.3 观察指标(1)两组疗效,治疗后6个月评估,参照WHO疗效评价标准[11]评估,分为完全缓解、部分缓解、稳定、进展4个等级,缓解率=(完全缓解+部分缓解)/总例数×100%,疾病控制率=(完全缓解+部分缓解+稳定)/总例数×100%。
(2)两组治疗前、治疗后3个月、6个月血清肿瘤标志物,包括癌胚抗原(carcinoembryonic antigen,CEA)、Ctn、Tg、TgAb,采集各时间段空腹静脉血6mL,以3500r/min离心处理5min,取血清于-70℃保存,取血清标本,采用罗氏电化学发光分析仪cobas e601检测血清CEA、Tg、TgAb水平,试剂盒购自湖北嘉信隆科技有限公司提供的Roche Diagnosties GmbH产品;采用化学发光法检测血清Ctn水平,仪器是深圳市新产业生物医学工程股份有限公司生产的Maglumi 4000PLus,试剂盒也由该公司提供。 检测操作均由专业人员严格按照试剂盒说明书进行。
(3)两组治疗前、治疗后3个月、6个月血清肿瘤血管指标,包括低氧诱导因子-1α(hypoxia inducible factor 1α,HIF-1α)、血管生成素-2(Angiopoietin-2,Ang-2)、血管内皮生长因子(vascular epithelial growth factor,VEGF)、血管性假血友病因子(von willebrand factor,vWF),取各时间段血清标本,采用酶联免疫吸附试验检测血清HIF-1α、Ang-2、VEGF水平,试剂盒均购自北京百奥莱博科技有限公司。
(4)两组治疗前、治疗后3个月、6个月疼痛程度,采用视觉模拟评分法(visual analogue scales,VAS)[12]评估疼痛程度,分值范围0~10分,0分为无痛,1~3分为轻度疼痛,4~6分为中度疼痛,7~10分为重度疼痛。
(5)两组治疗前、治疗后3个月、6个月微小RNA(microRNA,miR)-335、miR-130b、巨噬细胞衍生趋化因子(macrophagederived chemokine,MDC),取血清标本,采用实时逆转录定量聚合酶链反应检测血清miR-335、miR-130b水平,miRNA提取试剂盒购自上海之江生物科技股份有限公司,miRNA检测试剂盒购自美国Applied Biosystem公司,根据公式2-Δct计算miR-335、miR-130b相对表达量。采用酶联免疫吸附试验检测血清MDC水平,试剂盒购自滁州仕诺达生物科技有限公司。
(6)不良反应发生率,包括放射性皮损损伤、淋巴结局部肿胀加重、胃肠道反应。
1.4 统计学方法数据处理采用SPSS 22.0软件,计数资料以例数描述,采用χ2检验,计量资料采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验,均确认具备方差齐性且近似服从正态分布,以(±s)描述,两组间比较采用独立样本t检验,α=0.05。
2 结果
2.1 疗效治疗后6个月观察组缓解率、疾病控制率均较对照组高(P<0.05),见表2。
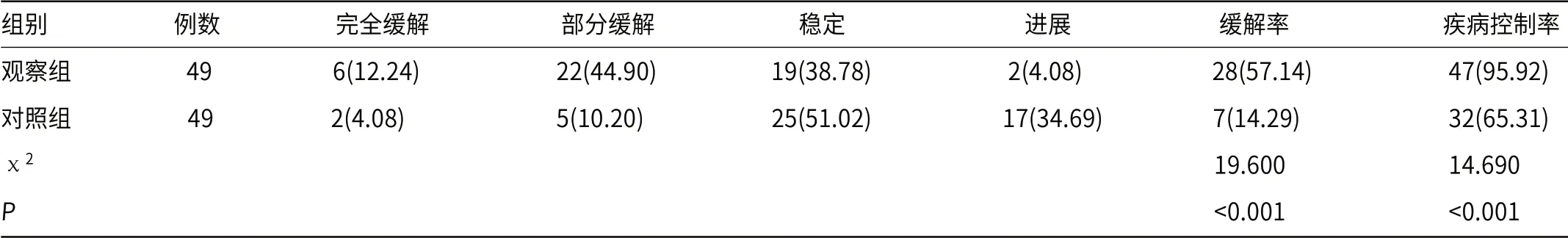
表2 两组疗效比较[n(%)]
2.2 肿瘤标志物两组治疗后3个月、6个月,血清CEA、Ctn、Tg、TgAb水平均低于治疗前,且观察组低于对照组(P<0.05),见表3。
表3 两组肿瘤标志物比较(±s)
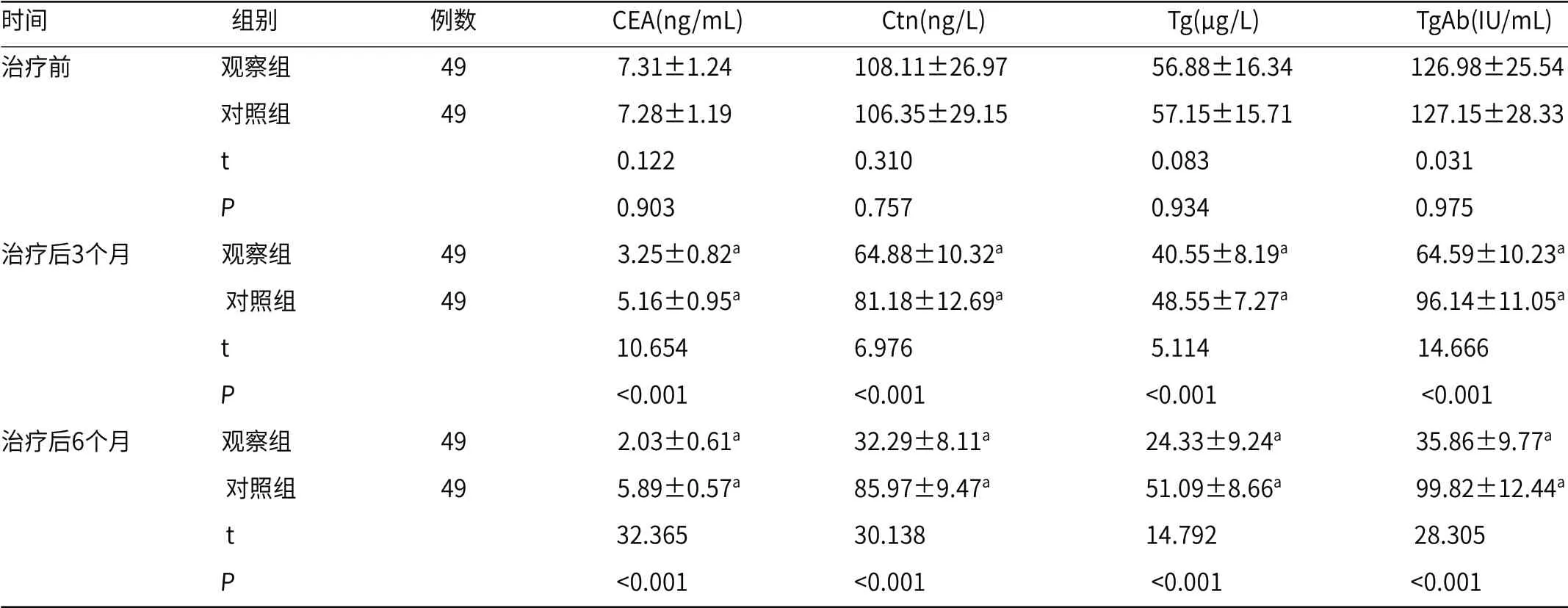
表3 两组肿瘤标志物比较(±s)
注:a表示与同组治疗前相比,差异具有统计学意义(P<0.05)。下同。
时间 组别 例数 CEA(ng/mL) Ctn(ng/L) Tg(μg/L) TgAb(IU/mL)治疗前 观察组 49 7.31±1.24 108.11±26.97 56.88±16.34 126.98±25.54 对照组 49 7.28±1.19 106.35±29.15 57.15±15.71 127.15±28.33 t 0.122 0.310 0.083 0.031 P 0.903 0.757 0.934 0.975治疗后3个月 观察组 49 3.25±0.82a 64.88±10.32a 40.55±8.19a 64.59±10.23a 对照组 49 5.16±0.95a 81.18±12.69a 48.55±7.27a 96.14±11.05a t 10.654 6.976 5.114 14.666 P <0.001 <0.001 <0.001 <0.001治疗后6个月 观察组 49 2.03±0.61a 32.29±8.11a 24.33±9.24a 35.86±9.77a 对照组 49 5.89±0.57a 85.97±9.47a 51.09±8.66a 99.82±12.44a t 32.365 30.138 14.792 28.305 P <0.001 <0.001 <0.001 <0.001
2.3 肿瘤血管指标两组治疗后3个月、6个月,血清HIF-1α、Ang-2、VEGF、vWF水平均低于治疗前,且观察组低于对照组(P<0.05),见表4。
表4 两组肿瘤血管指标比较(±s)
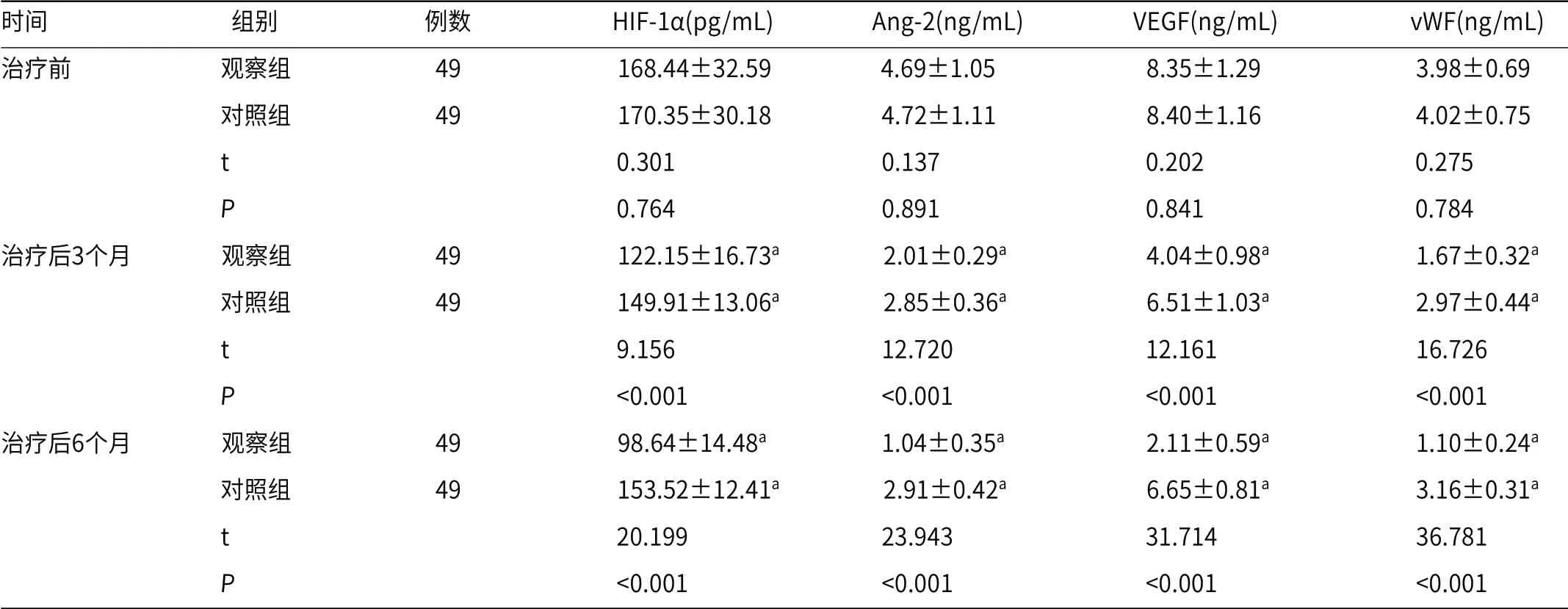
表4 两组肿瘤血管指标比较(±s)
时间 组别 例数 HIF-1α(pg/mL) Ang-2(ng/mL) VEGF(ng/mL) vWF(ng/mL)治疗前 观察组 49 168.44±32.59 4.69±1.05 8.35±1.29 3.98±0.69 对照组 49 170.35±30.18 4.72±1.11 8.40±1.16 4.02±0.75 t 0.301 0.137 0.202 0.275 P 0.764 0.891 0.841 0.784治疗后3个月 观察组 49 122.15±16.73a 2.01±0.29a 4.04±0.98a 1.67±0.32a 对照组 49 149.91±13.06a 2.85±0.36a 6.51±1.03a 2.97±0.44a t 9.156 12.720 12.161 16.726 P <0.001 <0.001 <0.001 <0.001治疗后6个月 观察组 49 98.64±14.48a 1.04±0.35a 2.11±0.59a 1.10±0.24a 对照组 49 153.52±12.41a 2.91±0.42a 6.65±0.81a 3.16±0.31a t 20.199 23.943 31.714 36.781 P <0.001 <0.001 <0.001 <0.001
2.4 疼痛程度两组治疗后3个月、6个月,VAS评分均低于治疗前,且观察组低于对照组(P<0.05),见图1。
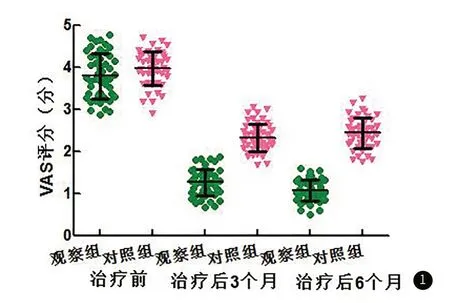
图1 两组VAS评分比较
2.5 miR-335、miR-130b、MDC两组治疗后3个月、6个月血清miR-335、MDC水平均低于治疗前,且观察组低于对照组(P<0.05);两组血清miR-130b水平均高于治疗前,且观察组高于对照组(P<0.05),见表5。
表5 两组miR-335、miR-130b、MDC比较(±s)
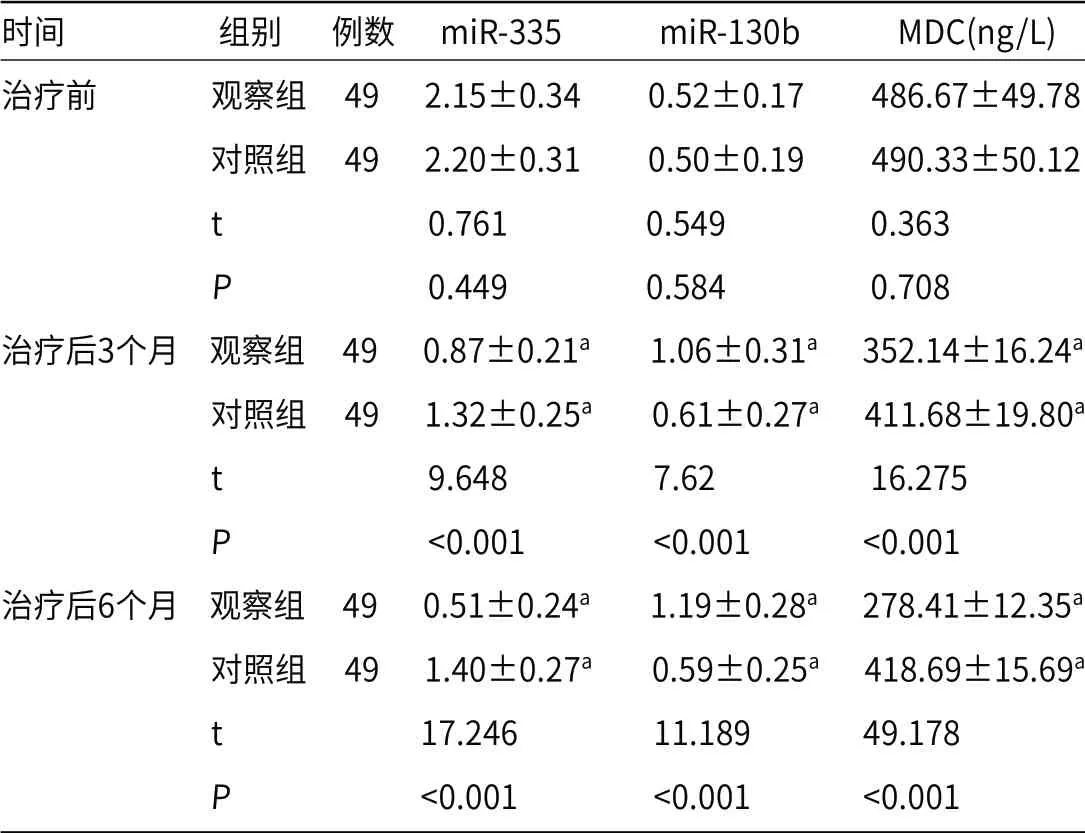
表5 两组miR-335、miR-130b、MDC比较(±s)
时间 组别 例数 miR-335 miR-130b MDC(ng/L)治疗前 观察组 49 2.15±0.34 0.52±0.17 486.67±49.78 对照组 49 2.20±0.31 0.50±0.19 490.33±50.12 t 0.761 0.549 0.363 P 0.449 0.584 0.708治疗后3个月 观察组 49 0.87±0.21a 1.06±0.31a 352.14±16.24a 对照组 49 1.32±0.25a 0.61±0.27a 411.68±19.80a t 9.648 7.62 16.275 P <0.001 <0.001 <0.001治疗后6个月 观察组 49 0.51±0.24a 1.19±0.28a 278.41±12.35a 对照组 49 1.40±0.27a 0.59±0.25a 418.69±15.69a t 17.246 11.189 49.178 P <0.001 <0.001 <0.001
2.6 不良反应观察组不良反应发生率较对照组低(P<0.05),见表6。
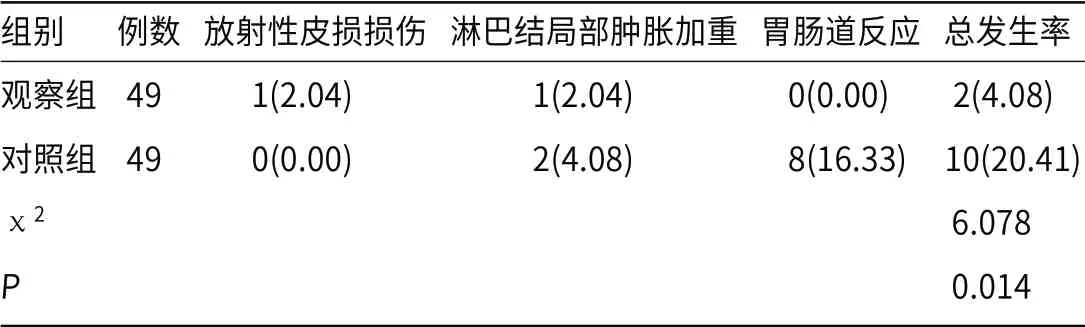
表6 两组不良反应比较[n(%)]
3 讨 论
DTC一般预后较好,5年生存率在98%左右,10年生存率为85%,若发生远处转移,5年生存率将降至50%以下,尤其是RAIR-DTC,具有病情进展快、死亡率高的特点,5年生存率更低,10年生存率不到10%[13-14]。如何积极有效治疗RAIRDTC,延暖疾病进展、减低资料痛苦和负担,已成为临床重点研究的课题。
新近研究指出,病灶内植入125Ⅰ粒子属于近距离放射疗法,125Ⅰ粒子被均匀植入病灶后能持续性发射χ射线、γ射线,从而持续性对肿瘤细胞的增殖进行抑制,达到消除、控制肿瘤的目的[15-16]。125I粒子植入适用性广泛,几乎不受病灶部位及大小的限制,已普遍用于治疗临床无法手术切除的各种器官恶性肿瘤[17-19]。陈磊等[20]研究指出,125Ⅰ粒子植入在各期肝癌治疗中均具有良好疗效。Hasimu等[21]将125Ⅰ粒子植入应用于恶性胆道梗阻患者,也取得了良好治疗效果,可延长患者生存率。但125Ⅰ粒子植入在RAIR-DTC治疗方面的有效性及安全性尚缺乏临床数据支持。本研究采用SPECT-CT导引125Ⅰ粒子植入治疗RAIR-DTC患者,发现其缓解率、疾病控制率均明显高于常规放化疗,且患者血清肿瘤标志物CEA、Ctn、Tg、TgAb水平均得到进一步下调,提示SPECT-CT导引125Ⅰ粒子植入在RAIR-DTC治疗中具有较高有效性。125Ⅰ粒子的精准植入是保证其靶向性和适形度的关键环节,质量保证的重要条件为确定靶区与制定治疗计划[22]。常规CT扫描有助于克服125I粒子植入过程中面临的重叠影像问题,但其存在扫描范围局限性大,无法掌握扫描区域外粒子偏离情况,难以对粒子分布情况进行准确评估,且难以鉴别分布在靶器官内与125Ⅰ粒子密度相近的物体,例如体内结石、金属内置物等。本研究通过SPECT-CT导引进行125Ⅰ粒子植入,与常规CT相比,SPECTCT可通过1次扫描获得SPECT、CT图像,首先通过全身扫描确定粒子所在部位,随后通过局部SPECT-CT扫描明确粒子解剖部位,SPECT可显像125Ⅰ粒子发射出的射线,能显示出粒子具体分布位置,采用局部显像有助于减少CT扫描的范围,采用图像融合得出125Ⅰ粒子在肿瘤内的具体分布情况,且检测过程中无需外加射线,可减少射线对患者的损伤[23]。
文献报道指出,甲状腺肿瘤血管生成良好,是肿瘤生长、浸润、转移的基础,VEGF表达增加驱动肿瘤血管形成,是增加肿瘤内血流供应、促进癌细胞侵袭转移的重要因子[24]。HIF-1α可刺激血管内皮生长因子分泌、释放,促进血管内皮细胞增殖及血管生成,且能增加微血管通透性,为肿瘤细胞转移、浸润等[25]。Ang-2同样具有促进新生血管生成的作用,可刺激肿瘤组织浸润性生长[26]。vWF是一种血管活性分子,可通过介导血管内皮下胶原和血小板黏附作用促进肿瘤血管生成,其水平升高是甲状腺癌预后差的因素之一[27]。本研究发现,SPECT-CT导引125Ⅰ粒子植入治疗能进一步下调RAIR-DTC患者血清HIF-1α、Ang-2、VEGF、vWF水平,提示其能更有效抑制肿瘤内血管生成,从而抑制肿瘤的恶性生物学行为,改善治疗效果。此外,本研究还发现SPECT-CT导引125Ⅰ粒子植入能进一步改善患者血清miR-335、MDC、miR-130b水平,其中miR-335表达与DTC患者的复发密切相关,具有预测肿瘤复发的作用[28]。MDC是一种能够诱导细胞定向运动的低相对分子质量蛋白质,具有促进肿瘤细胞的侵袭和转移的作用[29]。miR-130b在RAIR-DTC患者体内表达明显降低,可能是一种抑癌基因,与甲状腺肿瘤发生有一定关联[30]。由此可见SPECT-CT导引125Ⅰ粒子植入治疗可通过调节患者miR-335、MDC、miR-130b表达水平这一作用机制抑制肿瘤进展。此外,本研究还发现,采用SPECT-CT导引125Ⅰ粒子植入治疗RAIR-DTC的不良反应发生率明显低于常规放化疗,且能进一步减轻患者疼痛程度,提示其安全性、可行性更高,更适用于RAIR-DTC的治疗。 综上可知,SPECT-CT导引125Ⅰ粒子植入在RAIR-DTC治疗方面具有较高有效性及安全性,能有效下调患者血清肿瘤标志物血清浓度,抑制肿瘤新生血管,有效控制疾病进展,具有较高临床应用价值。但受样本量较少的局限,本研究结果可能存在一定偏倚,今后仍需纳入更多样本,以进一步提高研究结果的准确性。

