新型冠状病毒肺炎患者差异表达先天免疫基因及其与24种免疫细胞丰度的关系
余耀华,张兵,张华
(郑州大学附属郑州中心医院 a.呼吸与危重症医学科一病区;b.泌尿外科,河南 郑州 450000)
严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引发了新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)的全球大流行,给人类生命健康和公共安全带来了巨大威胁[1-2]。先天免疫是抗病毒防御的第一道防线,SARS-CoV-2能够激活模式识别受体(pattern-recognition receptors,PRRs)触发下游级联信号分泌干扰素、肿瘤坏死因子和白细胞介素等细胞因子,而细胞因子进一步诱导抗病毒程序并增强适应性免疫反应[3]。在病毒感染持续刺激下,先天免疫和适应性免疫的过度激活,将导致大量炎症细胞因子分泌和T细胞反应失衡,引发“炎症风暴”,加重全身炎症反应[3-5]。研究表明,COVID-19更倾向于一种免疫相关疾病,感染者常伴有中性粒细胞和淋巴细胞减少,以及促炎基因和先天免疫基因的高表达[4,6-8]。然而,COVID-19患者先天免疫基因表达改变及其与免疫细胞丰度的关系仍不清楚。本研究采用生物信息学分析方法,利用GEO公共数据库中公开数据,探讨COVID-19患者外周血先天免疫基因表达改变及其与24种免疫细胞丰度的关系。
1 数据与方法
1.1 数据获取使用NCBI GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)[9],以“COVID-19”为关键词进行检索。筛选条件:(1)转录组测序数据集;(2)外周血样本;(3)样本来源的患者年龄、性别和人种信息完整。最终选择了基于Illumina NovaSeq 6000测序平台的GSE161731数据集,共包括198例外周血样本,本研究选取了其中77例COVID-19患者样本和19例健康对照样本纳入分析。
1.2 基因重注释和差异表达基因筛选下载GENCODE(https://www.gencodegenes.org/)[10]人类基因组GRCh38注释文件对GSE161731数据集原始测序数据进行重注释,并以校正后P<0.05及差异倍数[log2(fold change),log2FC]绝对值>2为阈值,采用DESeq2包[11]筛选COVID-19患者和健康对照之间的差异表达基因(differentially expressed genes,DEGs)。
1.3 差异表达先天免疫基因筛选基于筛选出的DEGs,与InnateDB数据库(https://www.innatedb.ca/)[12]中的人类先天免疫基因集取交集,鉴别出差异表达的先天免疫基因(differentially expressed innate immunity genes,DEIIGs)。
1.4 DEIIGs功能富集分析基于筛选出的DEIIGs,采用Metascape(http://metascape.org)[13]在线分析平台,以P<0.01,富集因子>1.5,最小匹配count值>3为阈值,进行GO[14]和KEGG[15]功能富集分析。
1.5 外周血免疫细胞丰度估计采用ImmuCellAI(http://bioinfo.life.hust.edu.cn/web/ImmuCellAI/)[16]平台预测24种免疫细胞丰度,包括CD4+T细胞,CD8+T细胞,幼稚CD4+T细胞,幼稚CD8+T细胞,中枢记忆性T细胞(central memory T cells,Tcm),效应T细胞(effector memory T cells,Tem),Ⅰ型调节性T细胞(type 1 regulatory T cells,Tr1),诱导性调节性T细胞(inducible regulatory T cells,iTreg),天然调节性T细胞(natural regulatory T cells,nTreg),辅助性T细胞1(T helper 1 cells,Th1),辅助性T细胞2(T helper 2 cells,Th2),辅助性T细胞17(T helper 2 cells,Th17),滤泡辅助性T细胞(T follicular helper cells,Tfh),细胞毒性T细胞(cytotoxic T cells,Tc),黏膜相关恒定T细胞(mucosal-associated invariant T cells,MAIT),耗竭性T细胞(exhausted T cells,Tex),gamma delta T细胞(gamma delta T cells,γδT)和天然杀伤T细胞(natural killer T cells,NKT)共18个T细胞亚型,以及B细胞、NK细胞、单核细胞、巨噬细胞、中性粒细胞和树突状细胞6种重要免疫细胞。
1.6 统计处理及可视化采用R软件(4.0.2)进行基因重注释、统计学分析和可视化。组间比较采用独立样本t检验、χ2检验或H检验,相关性分析采用校正后的Spearman相关,采用ggplot2包绘制火山图,corrplot包和pheatmap包进行相关性分析可视化。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料COVID-19患者与健康对照年龄、种族差异有统计学意义(P<0.05),性别差异无统计学意义(P>0.05)。见表1。
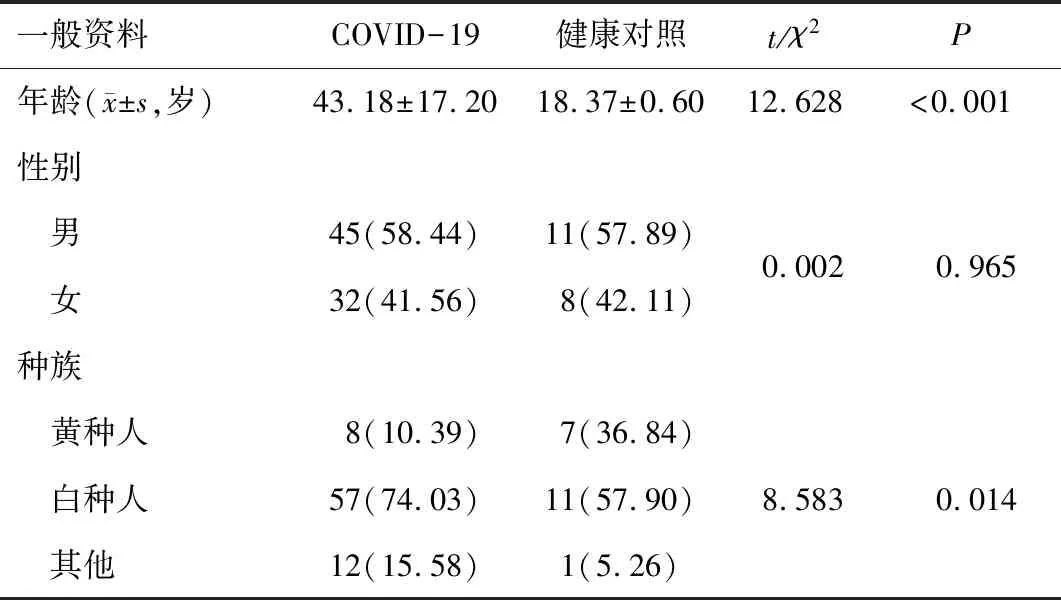
表1 COVID-19患者与健康对照一般资料比较
2.2 基因重注释和DEGs表达共重新注释到55 586条基因,差异分析筛选出88个DEGs,包括 49个上调基因和39个下调基因。见图1。
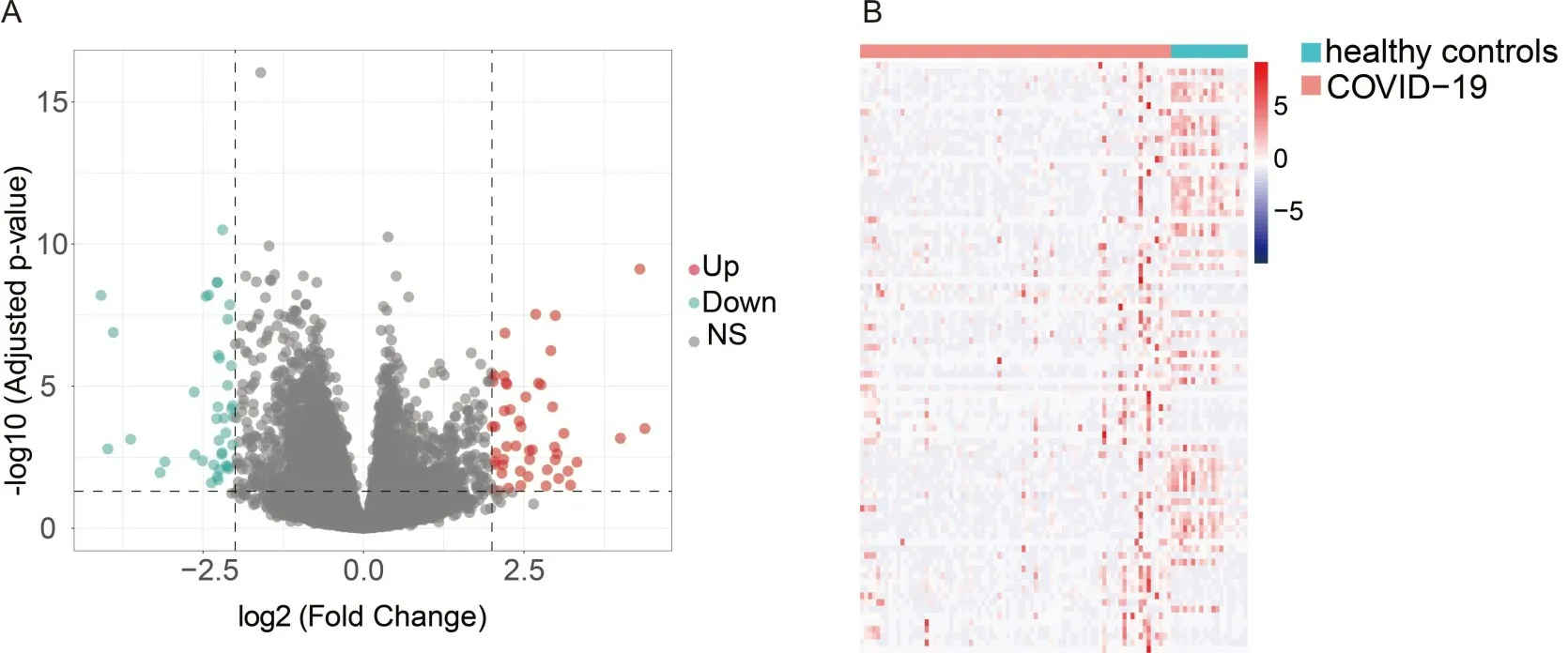
A为DEGs火山图(Down为下调基因,Up为上调基因,Ns为无表达差异基因);B为DEGs相对丰度热图。图1 COVID-19患者DEGs及其相对丰度
2.3 DEIIGs及其表达将人类先天免疫基因数据集的1 378个先天免疫基因与88个DEGs取交集,共鉴定出7个DEIIGs,包括UCHL1,IFI27,PPARG,CCL2,IGF1,BIRC5和IGHG1,其表达量在COVID-19患者中均上调。见图2A。
2.4 DEIIGs功能富集GO分析富集于STAT受体信号通路、淋巴细胞活化的正向调控和细胞因子介导的信号通路;KEGG分析富集于癌症代谢途径。见表2、图2B。

表2 COVID-19患者DEIIGs GO、KEGG功能富集分析

A为7个DEIIGs表达;B为7个DEIIGs GO、KEGG功能分析。图2 DEIIGs及其功能分析
2.5 24种外周血免疫细胞丰度改变COVID-19患者外周血幼稚CD4+T、Th1和Tcm细胞丰度降低,而Tr1和nTreg细胞丰度升高,差异有统计学意义(P<0.05),其余免疫细胞差异均无统计学意义(P>0.05)。见图3。
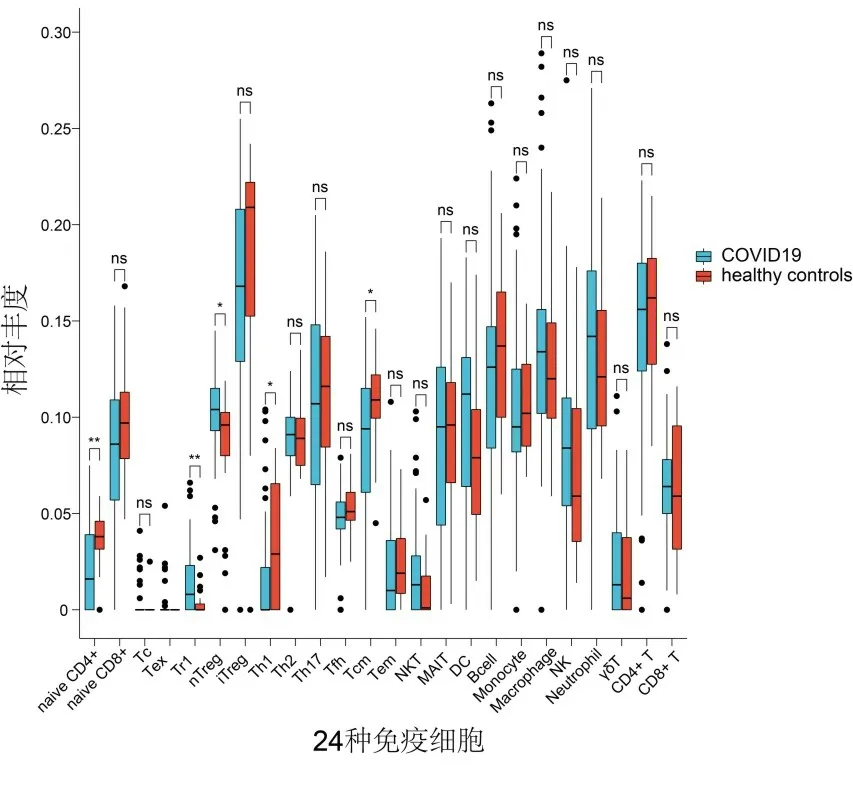
注:*P<0.05;**P<0.01;ns为差异无统计学意义。图3 COVID-19患者外周血24种免疫细胞丰度改变
2.6 免疫细胞丰度改变与DEIIGs的关系外周血幼稚CD4+T细胞丰度与PPARG、IGHG1表达呈负相关,Tr1丰度与IGHG1表达呈正相关,nTreg丰度与BIRC5表达呈正相关,Th1与IFI27表达呈正相关,差异有统计学意义(P<0.05)。见图4。

注:*P<0.05;**P<0.01。图4 DEIIGs与免疫细胞的相关性
3 讨论
先天免疫在SARS-CoV-2感染中至关重要,干扰素作为先天免疫防御中抵抗病毒感染的重要细胞因子,主要经由Jak/STAT信号通路,诱导干扰素刺激基因的转录和抗病毒蛋白的表达,限制SARS-CoV-2复制并发挥抗病毒功能[17-18]。但与此同时,SARS-CoV-2也进化出多种机制逃避先天免疫感知,例如逃避PRRs感应和抑制干扰素信号传递,引发先天免疫反应不足或延迟,使得病毒在感染早期大量复制,导致过度激活的促炎反应并损伤组织器官[19-20]。SARS-CoV-2主要通过血管紧张素转换酶2受体进入靶细胞,由于其对先天免疫的逃避机制,机体通常无法短时间内清除病毒,而先天免疫细胞则进一步通过上调组织相容性复合体MHC Ⅱ 和免疫检查点分子表达来增强处理和呈递抗原的能力,形成抗原呈递细胞并激活适应性免疫程序,以此促进组织炎症、损伤修复和免疫消退[21-22]。
先天免疫和适应性免疫细胞均起源于骨髓的多能造血干细胞,有共同的生理发育基础,且在功能上相辅相成、互相促进,共同构成了机体牢固的免疫防御体系[23]。因此,我们假设SARS-CoV-2感染导致的先天免疫基因改变可能与免疫细胞丰度相关。本研究通过生物信息学分析,鉴别出COVID-19患者7个DEIIGs,基因功能主要富集于STAT受体信号通路、淋巴细胞活化的正向调控和细胞因子介导的信号通路3个生物学过程;同时,对免疫细胞丰度的估计结果显示,COVID-19患者外周血幼稚CD4+T细胞、Th1和Tcm丰度降低,而Tr1和nTreg丰度升高,一方面反映了外周免疫细胞的耗竭,另一方面也反映出了强烈的免疫抑制。这些结果与已报道的COVID-19患者干扰素水平下降、淋巴细胞减少以及促炎因子分泌增多的临床参数改变相关[19,24-27],且与Huang等[28]的研究发现有一致性。而KEGG功能富集到了癌症信号通路,其中IFI27是COVID-19与癌症中被鉴别到的共性DEG[28-29],表明SARS-CoV-2感染造成的免疫改变可能与癌症引起的免疫反应有一致性。此外,Liang等[30]研究结果也显示,相较于非癌症患者,癌症患者感染COVID-19的风险更高,且预后更差,暗示了COVID-19与癌症的内部联系,而这种关联可能来源于免疫改变。
研究表明,PPARG与抑制促炎反应有关[31],而IGHG1的高表达能够促进癌细胞的增殖、迁移和侵袭[32]。此外,BIRC5和IFI27也被发现在多种癌症中高表达,能够抑制凋亡并促进细胞增殖[33-34],且与病毒感染有关[35-36]。本研究发现,PPARG、IGHG1表达与COVID-19患者外周血幼稚CD4+T细胞丰度呈负相关,可能参与了对幼稚CD4+T细胞的负向调控,抑制了幼稚CD4+T细胞的分化与增殖;而IGHG1、BIRC5和IFI27表达分别与Tr1、nTreg和Th1丰度呈正相关,可能与基因的正向调控有关,COVID-19引发的免疫紊乱导致了促炎与抗炎效应分子的“风暴”状态。然而,具体的分子调控机制和因果关系仍有待进一步探索和验证。
综上所述,本研究鉴别出了COVID-19患者中差异表达的7个先天免疫基因,探究了其参与的主要生物学过程和代谢途径,并揭示了先天免疫基因改变与免疫细胞丰度的关系,为进一步研究SARS-CoV-2感染引发的免疫分子机制提供生物信息学证据和实验方向。

