卵白蛋白与绿原酸分子互作对蛋白结构及乳液稳定性的影响
温鹤迪,宁珍珍,李金铭,关 玉,贺家华,赵颂宁,刘静波,张 婷*
(1 吉林省营养与功能食品重点实验室 长春 130062 2 吉林大学食品科学与工程学院 长春 130062)
卵白蛋白(OVA)是蛋清蛋白中含量最高的蛋白质,占总蛋白含量的54%~63%,其分子质量为45 ku,由385 个氨基酸残基构成,等电点在4.5~4.8 之间[1]。OVA 是蛋清蛋白中唯一含有自由巯基的蛋白,具有优良的结构和生物活性以及易得性,能够有效调节多相体系的质地和结构[2]。同时,OVA 含有合适比例的疏水基团和亲水基团,可以快速吸附在油滴表面,从而形成良好的乳液[3]。与化学合成的乳化剂相比,蛋白质乳液更加安全、健康。稳定的蛋白质乳液体系可广泛用于食品、化妆品和医药领域。然而,当体系的温度、pH 值和离子强度等环境条件发生变化时,由于维持乳液稳定性的主要作用力被破坏,乳液会出现聚集、沉淀、析出、破乳等现象,使得产品稳定性下降[4-7]。Li 等[8]发现加热和环境pH 值会显著破坏OVA 乳液的稳定性,在60 ℃加热条件下,乳液会出现破乳现象,同时在到达等电点时会出现较大粒径,乳液发生聚集。Ozturk 等[9]发现环境pH 值和盐离子浓度显著影响乳清蛋白乳化体系的稳定性,在pH 值接近等电点时会发生明显分层,在盐离子浓度大于200 mmol/L 时,乳液也会出现稀薄的油脂分层。李宛蓉等[10]研究发现,乳清分离蛋白-稻米油Pickering 乳液热稳定性差,在盐离子环境下,粒径显著增大,稳定性降低。蛋白质乳液稳定性的降低,会严重影响其在食品工业中的应用。如何有效提升蛋白质乳液的稳定性,是当前研究的热点问题。
研究表明,在乳液体系中添加多酚类化合物,可促使多酚-蛋白复合物的形成,从而提高蛋白质乳液的稳定性。多酚是植物体内的次级代谢产物,是具有不同数量羟基芳香环化合物的统称,广泛存在于水果、蔬菜、茶、豆科类以及中草药等植物内[11]。多酚与蛋白质分子间发生氢键、疏水相互作用,π 键、离子键和共价键等多种相互作用[12]。多酚种类及结构导致的蛋白结合能力和结合方式的变化,极大地影响蛋白质-多酚复合物的乳化稳定性等加工功能特性[13]。顾璐萍[3]利用儿茶素修饰蛋清蛋白并制备儿茶素-蛋清蛋白接枝物乳液,发现该乳液体系具有良好的耐热性,50~90 ℃处理时乳液粒径变化较小,液滴分散性良好;物理稳定性更高,不易聚集;盐离子稳定性也有较好地提升,在100 mmol/L 浓度下才开始出现粒径急剧增加的现象。Chen 等[14]制备OVA-单宁酸(TA)复合物,发现虽然OVA-TA 复合物的乳化性有所降低,但是其乳化稳定性显著增强,利用该复合物制备的纳米乳液,在OVA 等电点附近的稳定性明显提高。刘雷等[15]将表没食子儿茶素没食子酸酯(EGCG)添加至α-乳白蛋白为乳化剂的乳液中,结果发现加入适宜比例的EGCG 可以显著提高乳液稳定性。鞠梦楠等[16]制备大豆分离蛋白与花青素的共价复合物,以此制备Pickering 乳液,乳液脂滴状态得到明显改善,稳定性提高。
绿原酸(CA)是肉桂酸和奎宁酸缩合酯化形成的酚酸类化合物,广泛存在于咖啡和杜仲等植物中[17]。研究表明,CA 可与蛋白质相互作用,改善蛋白质的乳化特性,从而提高蛋白质乳液的乳化稳定性。陈卫军等[18]利用CA 制备乳清分离蛋白-CA 复合物,发现该复合物的热稳定性、抗氧化活性、乳化性和乳化稳定性均显著提高。李杨等[19]研究了不同CA 浓度对黑芸豆蛋白乳化性的影响,随着CA 浓度的增加,复合物的粒径分布变得更加均匀,乳化性显著提高。Liu 等[20]发现利用乳清蛋白-CA 复合物制得的乳液具有良好的乳化性,同时乳液的冻融稳定性、盐离子稳定性、热稳定性和贮藏稳定性均得到改善。
本研究以OVA 与CA 为研究对象,通过非共价结合方式制备OVA-CA 复合物,利用多种光谱学方法分析OVA 和CA 之间的相互作用,明确二者间分子互作对OVA 蛋白结构的影响。以OVACA 复合物为原料制备W/O 乳液,并考察该体系的pH 稳定性和盐离子稳定性,进一步明确OVA和CA 分子互作对其乳液稳定性的影响,为OVA乳液的开发应用提供参考,为OVA 在食品加工中的应用拓展提供新思路。
1 材料与方法
1.1 材料与试剂
卵白蛋白(Ovalbumin,OVA,98%),美国Sigma 公司;绿原酸(Chlorogenic acid,CA,≥98%),上海源叶生物技术有限公司;大豆油(金龙鱼),长春市欧亚超市(西安大路店)。其余试剂均为分析纯级。
1.2 仪器与设备
FJ300-SH 高速分散机,上海标本模型厂;纳米激光粒度仪,美国贝克曼库尔特有限公司;HYQ-3110 涡旋混合器,赛伯乐(上海)仪器有限公司;F-7100 荧光光谱仪,日本日立公司;MOS-500 圆二色光谱仪,法国Biologic 公司;IRPrestige-21 傅立叶变换红外光谱仪,日本岛津公司。
1.3 方法
1.3.1 OVA-CA 复合物的制备 使用磷酸盐缓冲溶液(PBS)(0.02 mol/L,pH 7.0)溶解OVA,放置在4 ℃冰箱过夜储藏以确保完全水合,得到100 μmol/L 的OVA 储备液。使用磷酸盐缓冲溶液(0.02 mol/L,pH 7.0)溶解CA,分别配制得到10,100,1 000,2 000,3 000 μmol/L 的CA 溶液,使用时现配现用,避光保存。将OVA 与不同浓度的CA以体积比1∶1 混合,充分混匀后在室温下(25 ℃)反应1 h,即得到OVA-CA 复合物溶液,此时蛋白质终浓度为50 μmol/L。
1.3.2 荧光光谱 利用PBS 缓冲液将OVA-CA复合物溶液稀释至蛋白质终浓度为10 μmol/L,采用荧光分光光度计测定。参数设定:激发波长分别为280 nm 和295 nm,激发和发射狭缝宽度为5 nm,电压为400 kV,收集速率为1 200 nm/min。扫描范围为290~450 nm 和300~450 nm。测定OVA溶液、CA 溶液和OVA-CA 复合溶液的荧光强度。溶液中OVA 作为荧光物质分子和猝灭剂CA 分子发生相互碰撞引起的荧光猝灭过程由Stern-Volmer 方程描述[21]:

式中,F0和F——不存在猝灭剂和存在猝灭剂时,OVA 溶液的荧光强度;[Q]——猝灭剂浓度,mol/L;Kq——双分子猝灭速率常数,L/(mol·s);τ0——不存在猝灭剂时荧光分子的寿命,通常为1×10-8s。
当荧光物质分子为生物大分子时,其最大扩散碰撞猝灭常数为2×1010L/(mol·s),因此,将上述公式计算得到的Kq与之比较,若Kq>2×1010L/(mol·s),则属于静态猝灭,若Kq<2×1010L/(mol·s)则属于动态猝灭。
对于静态猝灭,可通过下式计算得到结合常数Ka和结合位点数n:
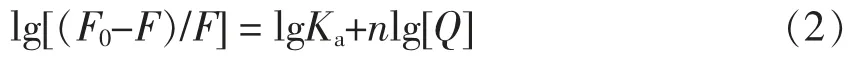
式中,F0和F——不存在猝灭剂和存在猝灭剂时,OVA 溶液的荧光强度;Ka——表观结合常数,L/mol;n——结合位点数;[Q]——猝灭剂浓度,mol/L。
1.3.3 同步荧光光谱 利用同步荧光光谱测定OVA-CA 复合物的色氨酸与酪氨酸残基的荧光光谱。利用PBS 缓冲液将OVA-CA 复合物溶液稀释至蛋白质终浓度为10 μmol/L,分别扫描△λ=15 nm 和△λ=60 nm。
1.3.4 圆二色谱 利用PBS 缓冲液将OVA-CA复合物溶液稀释至蛋白质终浓度为10 μmol/L。在室温下,磷酸盐缓冲体系(0.02 mol/L,pH 7.0)中,分别扫描190~250 nm 范围内OVA 溶液和OVAC A 复合物溶液的圆二色谱,通过在线DICHROWEB 网站(http://dichroweb.cryst.bbk.au.uk/html/home.shtml)计算样品中α-螺旋、β-折叠、β-转角和无规则卷曲的比例。
1.3.5 红外光谱法 称取2 mg 冻干的OVA-CA复合物固体样品,再加入一定量的溴化钾,研磨成均匀粉末,压制成薄片,再用红外光谱仪做全波段扫描(400~4 000 cm-1),扫描次数32 次[22]。
1.3.6 表面疏水性测定 参考Liu 等[23]的方法测定OVA-CA 复合物的表面疏水性。将样品溶液用PBS 溶液分别稀释到OVA 终浓度为5,10,15,20,25 μmol/L。取上述稀释液1 mL 分别加入5 μL 的ANS 溶液,混匀后避光反应15 min,测定样品的荧光强度。参数设定:激发波长390 nm,发射波长470 nm,激发和发射狭缝宽度5 nm,电压700 kV,收集速率2 400 nm/min,扫描范围400~650 nm。以蛋白质浓度为自变量,荧光强度为因变量,拟合得到一次函数,拟合线斜率为表面疏水性的数值H0。
1.3.7 乳液的制备 使用PBS 溶液分别配制1.1 mmol/L 的OVA(Acros organics)溶液和0.11,1.1,11,22,33 mmol/L 的CA 溶液。将OVA 与CA 以体积比1∶1 混合,充分混匀后在室温下(25 ℃)避光反应过夜。选择大豆油作为油相,油/水比为10%(体积分数),使用高速均质机在12 000 r/min 下均质1 min,得到不同浓度CA 浓度的乳液。
1.3.8 粒径、电位的测定 用Zetasizer 纳米粒度仪测定乳液的平均粒径和电位。使用PBS 缓冲溶液将OVA 乳液及OVA-CA 乳液稀释20 倍,稀释液在仪器内进行120 s 的平衡,然后在25 ℃下收集至少8 次连续读数。参数设定为颗粒吸收率0.001,颗粒折射率1.470,分散剂折射率1.330[24]。
1.3.9 物理稳定性 储藏稳定性:将新鲜制备的乳液放置在常温环境下(25 ℃),在固定时间进行拍照并观察乳液状态。
盐离子稳定性:分别取OVA 乳液OVA-CA乳液3 mL,分别向其中添加0.05,0.1,0.5 mol/L NaCl 溶液1 mL。混匀后在室温下静置6 h,分别测定不同NaCl 浓度下的粒径及其PDI 值。
pH 稳定性:分别取OVA 乳液和OVA-CA 乳液,使用1 mol/L NaOH/HCl 调节乳液pH 值至2,4,6,7,8。摇匀后在室温下静置6 h,分别测定不同pH 值条件下的粒径及其PDI 值[25]。
1.4 数据统计分析
试验数据采用3 次平行试验结果的平均值,试验数据用平均值±标准差(±s,n=3)表示。用SPSS 18.0 软件对数据进行显著性分析,P <0.05为有显著性差异。
2 结果与分析
2.1 荧光光谱分析
在280 nm 和295 nm 的激发波长下,蛋白质分子中的色氨酸和酪氨酸残基会产生荧光。在蛋白质溶液中加入多酚,多酚作为猝灭剂会导致荧光强度降低,因而可以通过荧光强度的变化考察蛋白质与多酚之间的相互作用。OVA 与CA 的荧光猝灭图见图1a 和图1b。加入CA 后,OVA 的荧光强度随CA 浓度的增加而逐渐降低。且CA 的加入引起了最大发射峰出现了轻微的红移现象(从332 nm 至335 nm),这说明色氨酸和酪氨酸残基的微环境发生了轻微改变,色氨酸和酪氨酸残基逐渐从内源疏水区转移至亲水性区域,这可能是由OVA 和CA 之间的疏水相互作用引起的[8]。
小分子与蛋白质相互作用过程中会出现蛋白质荧光猝灭现象,猝灭类型包括动态猝灭和静态猝灭。由图1c 可以看出,CA 和OVA 相互作用的Stern-Volmer 曲线为非典型的直线关系,R2=0.796/0.779,表明二者的相互作用并非由分子扩散和碰撞导致的动态猝灭主导[26-27]。此外,由表1可以看出猝灭速率常数Kq值为4.28×1010L/(mol·s)/24.84±0.27×1010L/(mol·s),大于最大动态猝灭速率2.0×1010L/(mol·s)。因此,可以看出CA 和OVA 在结合过程中形成了复合物,从而引起静态荧光猝灭[28]。由280 nm 下结合位点数n=1.04 可知(表1),CA 和OVA 的结合比例为1∶1。同时,2 个氨基酸残基的结合位点数之间存在一定差异,表明CA 的结合位点可能更接近OVA 分子中的色氨酸残基,这也与OVA 分子中色氨酸主要分布在OVA 外层,而酪氨酸主要存在于OVA 内部有关。
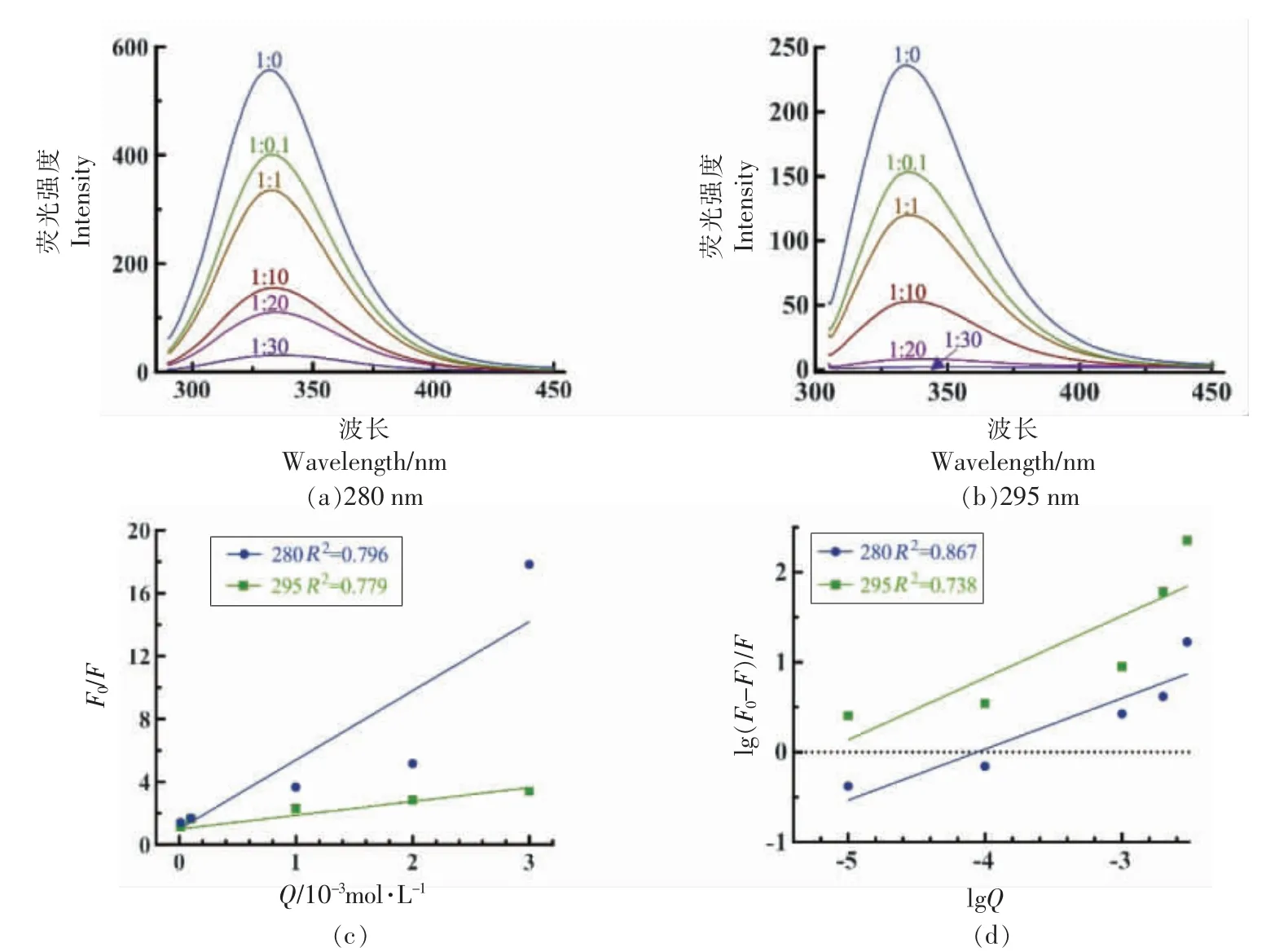
图1 CA 对OVA 内源荧光的猝灭作用Fig.1 Quenching effect of CA on OVA's intrinsic fluorescence

表1 CA 与OVA 相互作用的相关常数Table 1 Correlation constants for the interaction between CA and OVA
2.2 同步荧光光谱分析
同步荧光光谱可以用于判断OVA-CA 复合物的色氨酸和酪氨酸残基周围微观环境的变化,其中△λ=15 nm 表示酪氨酸残基的特性,△λ=60 nm 表示色氨酸残基的特性。由图2可知,随着CA浓度的增加,OVA 的2 种荧光均产生猝灭现象。CA 的引入不会改变峰形,而最大发射峰的位置会有一定的偏移,说明CA 使得色氨酸和酪氨酸残基所处的微环境发生了改变。此外,对比2 种氨基酸残基的荧光猝灭程度,可以发现,色氨酸的荧光猝灭程度更强,因此猜测色氨酸残基的位置更接近CA 的结合位点,其结果与荧光光谱结果一致。

图2 不同CA 浓度的OVA-CA 复合物的同步荧光光谱Fig.2 Synchronous fluorescence spectra of OVA-CA complexes with different CA concentrations
2.3 表面疏水性分析
如图3所示,当OVA 与CA 的摩尔比为1 ∶0.1 时,疏水性显著增加(P <0.05)。这可能是低浓度多酚条件下,CA 的引入改变了OVA 的空间结构,使得内部的疏水基团暴露出来,导致表面疏水性H0增加。而当OVA 与CA 的摩尔比从1∶1 逐渐增加到1∶30 时,蛋白质表面疏水性随着CA 浓度的增加而降低,Chang 等[29]和Wei 等[30]也有类似的发现,随着多酚浓度增加,OVA-阿魏酸复合物和牛奶蛋白-茶多酚复合物的表面疏水性也逐渐降低。CA 的加入改变了OVA 的三级结构,使得OVA 的聚集形态发生了变化。CA 很可能通过疏水相互作用与OVA 的疏水区域结合,因此ANS荧光探针的结合位点逐渐减少,从而降低了表面疏水值。这也表明疏水相互作用是OVA-CA 复合物的主要作用力之一。
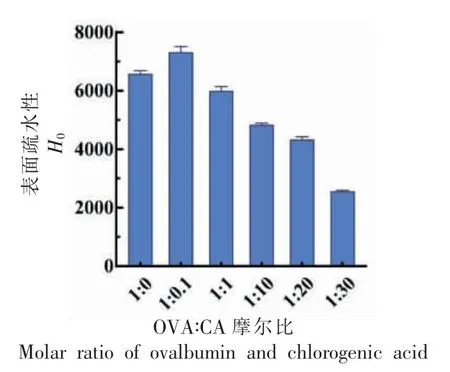
图3 不同CA 浓度的OVA-CA 复合物的表面疏水性Fig.3 Surface hydrophobicity of OVA-CA complexes with different CA concentrations
2.4 圆二色谱分析
圆二色谱是分析多酚与蛋白质相互作用,以及表征蛋白质二级结构变化的一个重要分析手段。由图4a 可以看出,加入不同浓度CA 后,OVA在210~230 nm 波长处的吸收峰强度发生改变,且呈现浓度依赖性,说明CA 与OVA 发生了相互作用,并对OVA 的二级结构产生了影响。加入CA后,α-螺旋的含量从1.3%±0.29%提高至1.93%±0.21%,β-折叠的含量从31.65%±0.35%降低至27.93%±0.84%。当OVA∶CA 小于1∶1 时,CA 的引入对α-螺旋和β-折叠的含量影响较小。而随着CA 逐渐增加(>1∶10),OVA 的二级结构出现显著变化(P <0.05)。CA 主要影响OVA 结构中的α-螺旋和β-折叠。α-螺旋的变化主要是由于蛋白质分子内氢键导致的,α-螺旋含量越高,蛋白质分子内氢键作用越强,分子结构越紧密。此时,OVA 蛋白中的疏水性位点被更多地包裹起来,从而表现出较低的表面疏水性,这与表面疏水性的结果(图3) 一致。而β-折叠的变化主要与分子间氢键有关,β-折叠含量降低表示蛋白质分子间氢键作用减弱,蛋白质分子间的聚集程度有所降低[31-32]。这也进一步表明,CA 与OVA 之间产生氢键相互作用,并改变OVA 的二级结构。

图4 不同CA 浓度的OVA-CA 复合物的圆二色谱图Fig.4 Circular Di chromatograms of OVA-CA complexes with different CA concentrations
2.5 红外光谱分析
红外光谱可以进一步分析OVA 构象的变化。酰胺Ⅰ带(1 600~1 700 cm-1)和酰胺Ⅱ带(1 500~1 600 cm-1)常被广泛用于定性和定量评估蛋白质的二级结构。如图5所示,不同浓度的CA 与OVA形成的复合物的红外光谱图显示出比较明显的差异。首先,3 300 cm-1位置出现偏移,这表明OVA与CA 之间同时存在氢键相互作用[33]。另外,酰胺Ⅰ带和酰胺Ⅱ带的峰值均出现红移现象,这说明OVA 与CA 发生了疏水相互作用,并且OVA 的二级结构发生改变[34]。进一步对OVA 以及OVA-CA复合物的蛋白质二级结构进行定量分析,结果如表2所示。CA 的引入主要改变了β-折叠的含量,β-折叠的比例从0.50 逐渐减小至0.36,猜测这可能与OVA 和CA 反应产生的氢键作用有关。
图5 不同CA 浓度的OVA-CA 复合物的红外光谱图Fig.5 Infrared spectra of OVA-CA complexes with different CA concentrations

表2 不同CA 浓度的OVA-CA 复合物的酰胺Ι 带红外光谱拟合结果Table 2 Fitting results of amide I band infrared spectra of OVA-CA complexes with different CA concentrations
2.6 乳液粒径电位的变化
如图6所示,乳液的粒径与CA 浓度成正相关关系,随着多酚浓度的增加,粒径逐渐增大。当OVA∶CA=1∶0.1 时,乳液粒径最小,且显著小于OVA 乳液粒径;当OVA∶CA=1∶30 时,乳液粒径最大,且超过OVA 乳液粒径的大小。当OVA∶CA=1∶0.1 时,OVA-CA 复合物的表面疏水性增加,乳化能力随即提高。此时OVA-CA 复合物的界面性质提高,为乳液的油水界面提供了更强的相互作用,从而起到抑制乳液聚集的作用,最终导致乳液粒径减小[16]。随着CA 浓度的增加,OVA 的结构更加紧密,卵白蛋白的球形结构在乳液的油水界面难以展开,因此乳化能力逐渐降低[35]。此外,随着CA浓度的增加,过多的羟基可能会导致更大聚集体的形成[36],乳液粒径逐渐增加。同样,CA 的加入使得PDI 值出现了与粒径相同的变化趋势,当OVA∶CA=1 ∶0.1 时,乳液粒径最小且PDI 值最小,此时的乳液具有更强的稳定性以及更好的分散性。
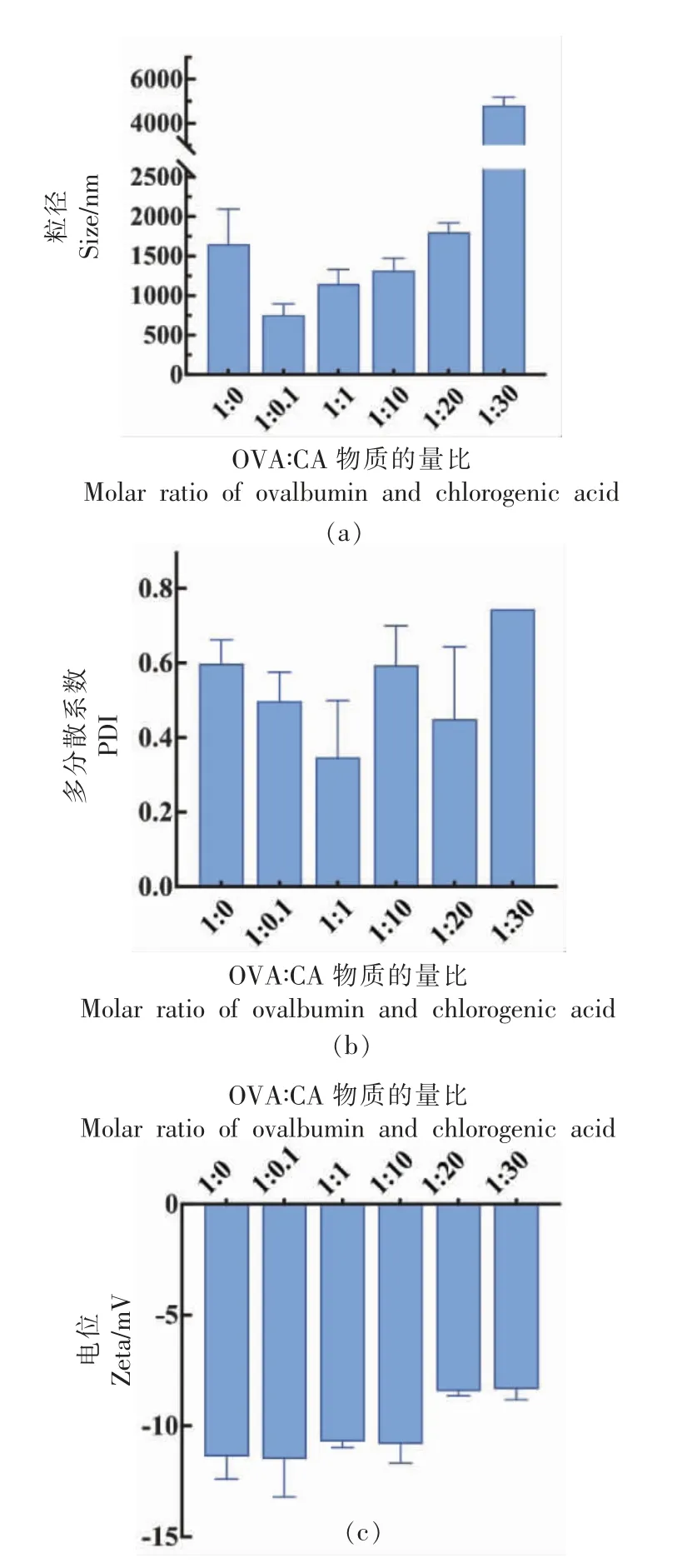
图6 不同CA 浓度下乳液粒径、PDI 值、电位的变化Fig.6 Changes of emulsion particle size,PDI value,and potential under different CA concentrations
乳液体系均为负电,表明液滴之间存在静电排斥作用,而随着CA 浓度的增加,电位出现了逐渐减小的趋势。因此,低浓度的CA 制备的OVACA 复合物乳液更加稳定。故本研究选择OVA∶CA为1∶0.1 的比例,用于后续乳液的表征及稳定性的研究。
2.7 乳液稳定性分析
储藏稳定性的提高对扩展乳液的应用有着重要影响。如图7a 所示,分别记录OVA 乳液和OVA-CA 乳液在0,3,5,7 d 的状态。OVA 乳液在3 d 出现了显著的改变,乳液出现结块分层的现象,此时乳液状态不稳定。这可能是由于卵白蛋白单独作为乳化剂无法起到长时间稳定油脂的作用。OVA 乳液的液滴在储藏过程中会发生聚集,从而导致乳液状态不稳定。而OVA-CA 乳液在室温条件下始终保持乳液状态稳定,在储藏7 d 内没有发生显著变化。此外,储藏期内,OVA 乳液的颜色有变黄的趋势,这可能与蛋白质及油脂氧化有关。CA 是一种具有抗氧化活性的多酚,CA 的引入极有可能增强OVA-CA 复合物抗氧化活性,从而抑制乳液中的蛋白质和油脂的氧化,因此颜色没有明显变化。综上所述,OVA-VA 乳液具有比OVA乳液更好的储藏稳定性。
盐离子和pH 值是影响乳液稳定性的关键因素,同时也是生产加工过程中不可避免的加工手段。盐离子和pH 稳定性将决定乳液的使用领域和应用范围。通过考察不同盐离子浓度和不同pH 环境下的乳液粒径和PDI 值的变化,来评价乳液的稳定性。不同pH 值处理会改变蛋白质表面的电荷数,从而影响静电相互作用和氢键的稳定性,进而影响乳液的稳定性。如图7b 所示,在pH=2~8 范围内,OVA-CA 复合物乳液的粒径和PDI 值均小于OVA 乳液,OVA-CA 复合物乳液表现出更强的pH 稳定性。在pH 4 时,OVA 乳液和OVA-CA 乳液的粒径增大,此时可能由于接近OVA 的等电点所致,而OVA-CA 的粒径仍然小于OVA 乳液,稳定性更高。在pH 7 时,OVA 乳液的粒径和PDI 值最大,说明此时OVA 出现了聚集现象,而OVACA 乳液的粒径变化较小,这可能是由于OVA-CA的静电相互作用抑制了OVA 的聚集。如图7c 可知,CA 的加入显著提高了乳液的盐离子稳定性。在OVA 乳液中,随着盐离子浓度的增加,OVA 乳液的粒径先增加后减少。盐离子的加入产生的静电屏蔽效应影响了液滴之间的静电相互作用[37],在不同盐离子浓度下,乳液的粒径变化十分明显,表现出不稳定的趋势。而在OVA-CA 复合物乳液中,盐离子浓度对乳液粒径的影响并不明显,表明OVA-CA 复合物可以有效地提高乳液的盐离子稳定性。

图7 OVA 乳液和OVA-CA 的物理稳定性:常温条件下乳液储藏7 d 的样品图(a)、pH 值对乳液粒径的影响(b)、不同盐离子浓度对乳液粒径的影响(c)Fig.7 The physical stability of OVA emulsion and OVA-CA emulsion:Sample pictures of emulsion stored for 7-day at room temperature (a),effect of pH value on emulsion particle size (b),different salt ion concentration on emulsion particle (c)
3 结论
利用OVA-CA 复合物制备得到具有良好物理稳定性的乳液体系。通过荧光光谱法、同步荧光光谱法、圆二色谱法、红外光谱法明确了OVA 与CA 之间的相互作用。与OVA 乳液相比,OVA-CA乳液具有更好的pH 稳定性和盐离子稳定性。该研究结果有望为以OVA 为代表的蛋清蛋白加工功能性提升提供一定数据支持,为蛋清蛋白在食品乳液体系中的应用提供一定参考,为OVA 在食品加工中的应用领域拓展提供新思路。

