加工方式对豆芋有效组分及抗氧化、α-葡萄糖苷酶抑制活性的影响
邓 珂,杨良缘,胡 钰,许光治,王 艳,张有做,倪勤学
(浙江农林大学食品与健康学院 杭州 311300)
豆芋(Apios americana Medik)是一种起源于北美洲东部地区的可食用性豆科土圞儿属植物[1],也是几千年前印地安人的主要食物,又称之为“印第安马铃薯”。豆芋块茎富含蛋白质、亚油酸、矿物质等多组营养素[2],同时富含异黄酮、多酚、皂苷、生物碱、抗性淀粉等生理活性物质[3-8],是一种营养丰富的健康食品。国外研究表明,豆芋块茎具有抗氧化、抗肿瘤、抗炎、抗病毒的功效,特别对代谢紊乱造成的高血糖、高血压、高血脂、肥胖等病症具有明显的防治作用[2]。
食物经加工后,物理特性、营养特性均会发生改变[9]。如:豆芋块茎中总酚、总黄酮、总糖、异黄酮和生物碱等活性成分会随着加工温度等条件的变化而变化,然而,至今国内外未有关于加工方式对豆芋块茎中有效组分含量及抗氧化、α-葡萄糖苷酶的影响,且有效组分进入消化系统后,其稳定性和抗氧化活性易受环境中的pH 值、温度、酶和其它相关因素的影响,导致有效组分的吸收释放各不相同[10]。因体内环境复杂,难以控制,故引入体外模拟消化这一方法,体外模拟人体消化道的pH值、温度、酶等易控制的条件,使其尽可能接近体内环境,该方法快速、安全、简单且重现性好,已广泛应用于研究各种活性物质在消化过程中的变化[11]。Huang 等[12]通过模拟胃肠消化,检测7 种海藻酚类含量和抗氧化的变化,结果发现海藻中游离酚类含量在肠消化中显著增加,因酚类物质增加而抗氧化明显增强;Liang 等[13]发现模拟消化后桑树提取物清除自由基的能力显著增加,具有良好的抗氧化活性。
因通常情况下,在食用马铃薯、葛根、山药等块根时均要做去表皮处理,故选用去皮豆芋作对照组,采用带皮、发酵、膨化、炒制等加工方法处理豆芋块茎,借助体外模拟消化法评估豆芋块茎中总酚、总黄酮、总糖、异黄酮、生物碱含量及抗氧化(DPPH、ABTS+、FRAP)、α-葡萄糖苷酶抑制活性的变化,为最大限度地保留豆芋的营养成分,将其作为新型功能性食品原料提供参考。
1 材料与方法
1.1 材料与试剂
豆芋7月采自浙江农林大学平山基地。
福林酚试剂、α-淀粉酶(α-Amylase)、胃蛋白酶(Pepsin)、胰酶(Pancreatin)、α-葡萄糖苷酶,Sigma 公司;染料木苷、盐酸小檗碱、芦丁、没食子酸、葡萄糖,上海源叶生物科技有限公司;抗坏血酸、硝酸铝,国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-以及苯并噻唑林-6-磺酸(ABTS),阿拉丁化学试剂有限公司;对硝基苯基-β-D-吡喃葡萄糖苷(PNPG),上海惠诚生物科技有限公司;其余试剂均为分析纯级。
1.2 仪器与设备
UV-5500 紫外-可见分光光度计,上海元析仪器有限公司;DHG-9240A 电热恒温鼓风干燥箱,沙鹰科学仪器(上海)有限公司;BSA224S 电子分析天平,赛多利斯科学仪器 (北京) 有限公司;PHS-3F 实验室pH 计,上海精密科学仪器有限公司;摇床,华利达实验设备有限公司;YB-1000A高速多功能粉碎机,永康速锋工贸有限公司;SLG65-Ш 同向旋转双螺杆挤压机,济南赛百诺科技开发有限公司;Velocity18R 台式冷冻离心机,Dynamica 公司。
1.3 试验方法
1.3.1 处理方法
1) 对照组(去皮) 新鲜的豆芋块茎洗净,除去表皮后切成约20 mm 厚的薄片,于60 ℃烘箱干燥,全部干燥后冷却,经多功能粉碎机粉碎,过80目筛,备用。
2) 带皮组 新鲜的豆芋块茎洗净、晾干,切成约20 mm 厚的薄片,60 ℃烘箱干燥,全部干燥后冷却,经多功能粉碎机粉碎,过80 目筛,备用。
3) 炒制组 将“去皮豆芋”于95 ℃炒锅中不断翻炒,至锅内产生焙烤的豆芋香味,原料颜色变化至黄色,再炒制5 min[14],冷却后密封,备用。
4) 挤压膨化组 将“去皮豆芋”加入螺旋双杆挤出机中,通过喷淋和搅拌的方式调节水分,使原料含水率约20%,设置挤压机前、中、后段温度分别为50,125,135 ℃,螺杆旋转速率为28 Hz,结束后于60 ℃烘箱干燥,冷却后密封,备用[15]。
5) 发酵组 将“去皮豆芋”与酵母水混合,搅拌至黏稠状,揉成直径约5 cm 的实心团,于37℃、湿度为70%的恒温发酵箱中发酵2 h,60 ℃烘箱干燥,多次粉碎后过80 目筛,备用。
1.3.2 体外模拟消化处理 体外模拟消化液的配制:参考龚凌霄[16]的方法,略有改动,具体如下:
1) 人工唾液 分别称取Na2HPO42.38 g、KH2PO40.19 g、NaCl 8.00 g,加水溶解,调pH 值至6.75,加入α-淀粉酶(1.30 g)。
2) 人工胃液 称取NaCl 2.0 g、胃蛋白酶3.2 g,溶于含7.0 mL HCl 溶液的1 000 mL 水溶液中(pH≈1.2)。
3) 人工肠液 称取KH2PO46.8 g 溶于250 mL 水中,加入77 mL 0.1 mol/L NaOH 和500 mL水,混匀,加入10.0 g 胰酶,调pH 值至6.8±0.1,加水稀释至1 000 mL。
体外模拟消化过程:分别取5.0 g 不同加工处理的豆芋样品,于37 ℃水浴孵育,模拟消化从唾液开始,加入2.5 mL 人工唾液,调pH 值至7.0,37℃恒温水浴振荡10 min;加入50 mL 人工胃液,调pH 值至2.5,37 ℃恒温水浴振荡2 h,模拟胃消化阶段;加入50 mL 人工肠液,调pH 值至7.5,37 ℃恒温水浴振荡2 h,模拟小肠消化阶段。冰浴中放置10 min 终止反应。将反应液于10 000 r/min、4℃离心30 min,取上清液供分析用。
对照组:分别取5.0 g 不同加工处理的豆芋样品,步骤同上,添加消化液的地方均改为加盐水,将得到的反应液于10 000 r/min、4 ℃离心30 min,取上清液供分析用。
1.4 豆芋主要组分测定方法
1) 总酚含量的测定 参考Singleton 等[17]略有改动。称取25.0 mg 没食子酸,加水定容至100 mL,分别取0.05,0.10,0.20,0.40,0.80,1.20 mL,用蒸馏水稀释至10 mL,加入0.5 mL 福林酚试剂和2 mL 20%Na2CO3溶液,40 ℃水浴加热30 min,冷却后稀释至25 mL。以不含没食子酸为空白对照,于波长760 nm 处测定吸光度值,以吸光度值为纵坐标,没食子酸浓度为横坐标绘制标准曲线。
将1.3.2 节所得上清液重复上述操作,带入标准曲线公式计算总酚含量。
2) 生物碱含量的测定 参考Fazel 等[18]的方法并略有改动。称取2.0 mg 盐酸小檗碱,乙醇定容至100 mL,吸取1.0,2.0,3.0,4.0,6.0 mL,乙醇定容至10 mL,以乙醇试剂为空白,于波长350 nm下测吸光度值,以盐酸小檗碱浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
将1.3.2 节体外模拟消化和对照组所得上清液重复上述操作,带入标准曲线公式计算生物碱含量。
3) 总黄酮含量的测定 采用硝酸-亚硝酸钠比色法,参考郑媛媛等[19]的方法并稍作修改。称取15.0 mg 芦丁,用水定容100 mL,分别取0.5,1.0,2.0,3.0,4.0 mL,定容至5 mL,加5%亚硝酸钠溶液(0.3 mL),混匀静置5 min,加入10%硝酸铝溶液(0.3 mL),混匀静置6 min,加2 mL 1.0 mol/L 氢氧化钠溶液,用水定容10 mL,静置10 min。以不含芦丁的溶液为空白对照,于波长510 nm 处测定吸光值,以吸光值为纵坐标,芦丁浓度为横坐标绘制标准曲线。
将2.2 节所得上清液重复上述操作,带入标准曲线公式计算总黄酮含量。
4) 异黄酮含量的测定 采用紫外(UV)比色法测定异黄酮含量,参考Shinde 等[20]稍加改动。以染料木苷为对照品,称取6.0 mg 染料木苷,用乙醇溶解并定容25 mL。分别移取0.1,0.2,0.4,0.6,0.8 mL,稀释至10 mL,于波长268 nm 处测定吸光度,以染料木苷浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
将2.2 节所得上清液重复上述操作,带入标准曲线公式计算总异黄酮含量。
5) 总糖含量的测定 参考Tsukakoshi 等[21]的苯酚硫酸法并略有改动。取8.0 mg 葡萄糖溶于100 mL 水中,分别吸取葡萄糖标准溶液0,0.2,0.4,0.6,1.0,1.4,1.6,1.8 mL,加水补至2.0 mL,反应20 min,于波长490 nm 处测吸光值。以葡萄糖浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
将2.2 节所得上清液重复上述操作,带入标准曲线公式计算总糖含量。
1.5 豆芋抗氧化的测定方法
1.5.1 DPPH 自由基清除率的测定 参考Hou 等[22]的方法并略加改动。
试验组:将2 mL 样品与等体积的0.1 mmol/L DPPH 混合,避光反应30 min。对照组:2 mL 样品与等体积乙醇混合避光反应30 min。空白对照组:2 mL 乙醇与等体积0.1 mmol/L DPPH 混合,避光反应30 min。以L-抗坏血酸为阳性对照,于波长517 nm 处测定吸光度值。按公式(1)计算DPPH 自由基清除率。

式中,A0——空白对照组吸光度;Ai——试验组吸光度;Aj——对照组吸光度。
1.5.2 ABTS+自由基清除率的测定 参考Hou等[22]的方法并略有改动。试验组:将0.1 mL 豆芋样品与3.9 mL ABTS+工作液混合,避光静置反应7 min。对照组:将0.1 mL 样品与3.9 mL 乙醇混合,避光静置反应7 min。空白对照组:将0.1 mL 乙醇与3.9 mL ABTS+工作液混合,避光静置7 min。以L-抗坏血酸为阳性对照,于波长734 nm 处测定吸光度值,按照公式(2)计算ABTS+清除率:
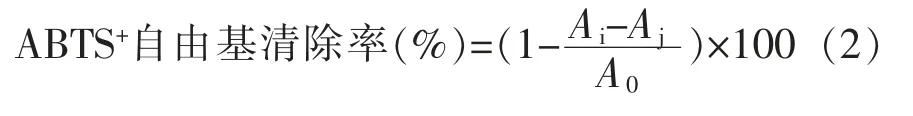
式中,A0——空白对照组吸光度;Ai——试验组吸光度;Aj——对照组吸光度。
1.5.3 铁离子还原力测定(FRAP 法) 参考赵建等[23]的方法并略有改动。FRAP 工作液的配制:由300 mmol/L 乙酸钠溶液、10 mmol/L TPTZ 溶液和20 mmol/L 三氯化铁溶液按体积比10∶1∶1 配制而成,现用现配。
标准曲线制作:分别取0.07,0.14,0.28,0.42,0.56,0.70,0.84 mmol/L 硫酸亚铁 (各0.1 mL),加入0.3 mL 水和3.0 mL FRAP 工作液,充分混匀,室温避光反应50 min,以水作空白对照,于波长593 nm 处测定吸光度值,以硫酸亚铁浓度为横坐标,吸光度值为纵坐标制作标准曲线。
样品铁离子还原力测定:取0.4 mL 供试品溶液,加入3.0 mL FRAP 工作液,步骤同标准曲线制作,将得到的吸光度值带入标准曲线求等体积情况下对铁离子的还原能力。
1.5.4 α-葡萄糖苷酶抑制率的测定 参考王静等[24]的方法并加以改进。试验组:将100 μL 样品溶液与等体积0.01 mg/mL α-葡萄糖苷酶混合,37℃反应10 min,加入100 μL 对硝基苯基-α-D-吡喃葡萄糖(2.5 mmol/L PNPG)溶液,37 ℃反应10 min,加入5 mL 0.1 mmol/L NaCO2溶液终止反应,于波长405 nm 处测定吸光度值。空白组:用去离子水代替样品,步骤同试验组。对照组:缓冲液代替酶,步骤同试验组。按照公式(3)计算抑制率:

式中,A样品——试验组吸光度;A对照——对照组吸光度;A空白——空白对照组吸光度。
1.6 数据处理
2 结果与分析
2.1 加工方式对豆芋有效组分含量的影响
加工方式对豆芋总酚、总黄酮、总糖、异黄酮、生物碱含量的影响如表1所示。模拟消化后,豆芋中总酚、总黄酮、总糖、异黄酮和生物碱含量均显著高于对照组,且生物碱增幅最大,增加83.22%~148.83%,说明模拟消化可促进总酚、总黄酮、总糖、异黄酮和生物碱的释放,并且生物碱的促进释放作用最大。因模拟消化后总酚、总黄酮、总糖、异黄酮、生物碱含量显著增加,且更接近人体利用度,故采用体外模拟消化法评估加工方式对有效组分含量的影响。

表1 加工方式对豆芋有效组分含量的影响Table 1 Effects of processing method on contents of effective components of Apios americana Medik
模拟消化后,总酚含量由大到小的加工方式是发酵>带皮>挤压膨化>炒制>对照组,分别增加73.46%,34.13%,6.32%,3.85%,其中发酵和带皮处理是保留总酚最好的加工方式;挤压膨化、带皮处理使总黄酮含量分别增加19.68%,11.82%。挤压膨化处理时,高温、高压作用使结合态黄酮、酚类物质转变为游离态被释放出来,从而使总黄酮、总酚含量升高[25]。总糖含量由大到小的加工方式是炒制>挤压膨化>发酵>带皮>加工对照组,分别增加31.19%,13.28%,10.62%,2.37%。炒制处理时高温等环境条件使部分淀粉转化为糖类,从而使总糖含量增加。发酵处理的样品中异黄酮含量增加42.02%,可见发酵处理能很好地促进异黄酮物质的溶出,带皮处理也使异黄酮含量增加9.52%。生物碱含量由大到小的加工方式是发酵>挤压膨化>带皮>炒制>对照组,其中发酵、挤压膨化处理生物碱含量增幅最大,分别增加56.61%和38.91%。
2.2 加工方式对豆芋抗氧化活性的影响
加工方式对豆芋抗氧化能力的影响如图1所示。模拟消化后,去皮、带皮、挤压膨化、发酵、炒制处理清除DPPH、ABTS+自由基和FRAP 的能力均显著高于对照组。最终采用体外模拟消化法评估加工方式对豆芋抗氧化的影响。
从图1b 可知,清除ABTS+自由基的能力在模拟消化后显著高于对照组,其中,发酵处理清除效果最显著,较对照组增加41.96%,这可能是因为发酵处理后总酚、总黄酮、异黄酮、生物碱等活性物质含量增加,起抗氧化作用的物质更多,所以清除ABTS+自由基的能力强,带皮、挤压膨化处理分别使清除ABTS+自由基能力增加26.76%和21.02%。

图1 不同加工方式对抗氧化能力的影响Fig.1 Effects of different processing methods on oxidation resistance
清除DPPH 自由基能力由强到弱的加工方式是带皮>发酵>挤压膨化>炒制>对照组,较对照组分别增加19.77%,13.94%,8.57%,6.81%;铁离子还原力的增加趋势基本与DPPH 相符,由强到弱依次是带皮>发酵>挤压膨化>对照组,分别增加35.99%,19.70%,3.24%。其中,DPPH 和FRAP 代表的抗氧化能力,均是带皮处理最显著,说明豆芋块茎的表皮中也含有抗氧化活性物质。
2.3 加工方式对α-葡萄糖苷酶抑制性影响
加工方式对α-葡萄糖苷酶活性抑制的影响如表2所示。由于对照组抑制α-葡萄糖苷酶活性所需浓度太高,在有限浓度内未检出。模拟消化后,发酵处理对α-葡萄糖苷酶的半抑制质量浓度为621.31 μg/mL,抑制能力增加33.6%,这可能因为是发酵处理使活性物质溶出更多,对α-葡萄糖苷酶抑制率大。
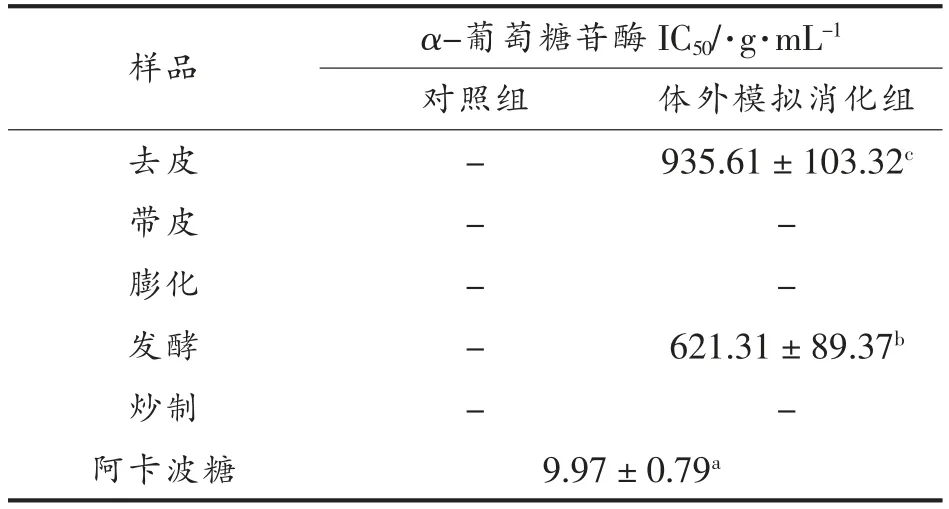
表2 加工方式对α-葡萄糖苷酶抑制活性的影响Table 2 Effects of processing methods on α-glucosidase on inhibitory activity
2.4 相关性分析
总酚、总黄酮、总糖、异黄酮、生物碱含量与抗氧化指标(清除DPPH、ABTS+自由基、FRAP)之间的相关性分析见表3。总酚含量与DPPH、ABTS+自由基、FRAP 之间均呈正相关。DPPH、ABTS+自由基清除率与有效组分之间的相关性趋势一致,相关性由大到小依次是总酚>生物碱>异黄酮>总糖>总黄酮,其中总酚含量与ABTS+自由基清除率之间的相关性为0.895,这与发酵处理组总酚含量最高、清除ABTS+自由基能力最强的事实相符合。FRAP 与异黄酮含量相关性最大,相关系数为0.722,说明异黄酮含量对铁离子还原能力起主要作用。

表3 有效组分含量与抗氧化指标的相关性分析Table 3 Correlation analysis of effective component content and antioxidant index
3 讨论
采用体外模拟胃、肠消化评估加工方式对豆芋块茎中总酚、总黄酮、异黄酮、总糖、生物碱含量及抗氧化(DPPH、ABTS+清除及FRAP 体系)、α-葡萄糖苷酶抑制活性的影响,结果表明,模拟消化后有效组分含量、抗氧化能力、对α-葡萄糖苷酶活性抑制率均显著增加。其中,FRAP 与DPPH 代表的抗氧化能力趋势接近,均是带皮处理抗氧化能力最强,较对照组分别增加19.77%,35.99%,抗氧化能力由强到弱的加工方式是带皮>发酵>挤压膨化>对照组;发酵处理组清除ABTS+自由基、α-葡萄糖苷酶抑制效果最显著,较对照组分别增加41.96%,33.6%。
发酵处理是保留豆芋总酚、异黄酮、生物碱的最适加工方法,较对照组分别增加73.46%,42.02%,56.61%。挤压膨化处理是保留总黄酮的最适加工方法,含量增加19.68%。炒制处理是保留总糖的最适加工方法,含量增加31.19%。
有效组分含量与DPPH、ABTS+、FRAP 之间呈正相关,其中总酚含量与DPPH、ABTS+自由基清除率之间的相关性最大,相关系数分别为0.674,0.895,FRAP 与异黄酮含量相关性最大,相关系数为0.722,说明清除DPPH、ABTS+自由基起主要作用的物质是总酚,铁离子还原力的决定物质是异黄酮。

