海洋毒素软骨藻酸厌氧生物转化研究
杜 苗 苗, 金 媛, 昝 帅 君, 顾 晨, 张 宇 晴, 王 竞*
( 1.大连理工大学 环境学院, 辽宁 大连 116024;2.国家海洋环境监测中心, 辽宁 大连 116023 )
0 引 言
软骨藻酸(domoic acid,DA)主要是由硅藻中的拟菱形藻属产生的一种兴奋性神经毒素,是记忆缺失性贝类毒素(ASP)的主要成分,被列为危害人类健康的四大主要海洋生物毒素之一[1].研究表明,DA可以在贝类、软体动物、鱼类、虾等滤食性生物体内富集,并通过海洋食物链传递给高营养级生物[2].误食受DA污染的海产品会造成人类、海洋哺乳动物以及鸟类神经性中毒,引起神经坏死和众多病理性疾病,甚至死亡[3-5].近年来,产毒拟菱形藻在全球海域暴发频次和规模不断扩大[6-7].环境监测结果表明,DA毒素广泛分布于国内外各大海域以及沉积物等环境介质,严重威胁人类健康、生态安全和社会经济发展[8].
迄今为止,关于DA的环境行为和归趋尚不清晰,目前研究仅局限于DA的光解行为[9-13].然而,赤潮暴发过程中富营养化的海水表层覆盖大量的藻华和高等浮游植物,阻碍阳光透射,因此DA光降解作用被大大削弱.事实上,由于产毒拟菱形藻具有垂直向下迁移的特性,其沉降速率为117~173 m/d,DA不会积累在海水表层,大部分毒素随着硅藻海洋雪沉入海底无光区[14-16].据报道,圣巴巴拉盆地沉积物样品中溶解态DA浓度高达4.19 mg/L[14,17].因此,生物降解成为海洋环境中消除DA的重要途径.鉴于下沉的海洋雪颗粒内部以及沉积物-水界面可以形成厌氧微环境,这为DA的厌氧生物转化提供了天然的场所[18-19].然而,目前关于DA厌氧生物转化的研究很少.此外,考虑到自然海洋环境中营养基质的多样性,DA的厌氧共代谢生物转化变得复杂多样.基于此,本研究以近海沉积物作为海洋微生物来源,以牛血清白蛋白为共代谢基质,通过生物富集技术驯化出具有厌氧共代谢降解DA能力的菌群,命名为BH1.从DA厌氧生物转化动力学、DA生物转化产物鉴定、DA厌氧生物转化途径以及微生物群落结构组成四个方面开展研究,为全面了解DA在海洋环境中的行为和归趋奠定理论基础.
1 材料与方法
1.1 实验材料
1.1.1 近海沉积物样品 实验用近海表层沉积物取自中国辽宁省大连市大连湾近海海域,样品混匀备用.
1.1.2 厌氧菌群 实验所用菌群BH1分离自大连市大连湾近海沉积物.将4 g沉积物(湿重)加入共代谢培养基中混匀,静置于厌氧箱(25±1) ℃厌氧避光连续培养,每隔14 d从降解体系中以体积分数10%的接种量转接到新配制的厌氧培养基.经过14个月的富集,获得了稳定且具有高效厌氧降解DA能力的菌群,命名为BH1.
共代谢培养基:厌氧人工海水中加入50 mg/L牛血清白蛋白和1 mg/L DA,调节pH 8.0.人工海水配方(g/L):23.476 NaCl,10.635 MgCl2·6H2O,3.917 Na2SO4,1.102 CaCl2,0.664 KCl,0.192 NaHCO3,0.096 KBr,0.026 H3BO3,0.04 SrCl2·6H2O和0.003 NaF.人工海水用高纯氮曝气20 min去除氧气,然后放置于高压灭菌锅121 ℃灭菌20 min备用.50 g/L牛血清白蛋白储备液用高温灭菌、曝氮气的人工海水配制备用.购买自美国Enzo公司的1 mg DA标准品固体粉末(95%纯度)用灭菌、曝氮气的超纯水配制成10 mg/L 的DA储备液备用.分别将50 g/L牛血清白蛋白和10 mg/L的DA储备液用0.22 μm滤膜灭菌后,移取适量体积配制成浓度为50 mg/L牛血清白蛋白和1 mg/L DA的共代谢培养基.培养开始时,用溶氧仪和氧化还原电位计分别测得培养基的溶解氧含量为0 mg/L,氧化还原电位小于-313 mV,以确保菌群培养在严格的厌氧条件下进行.
1.2 实验方法
DA厌氧生物转化实验:在25 mL厌氧瓶里加入9 mL共代谢培养基,1 mL菌群BH1培养液,其中DA浓度为1 mg/L,牛血清白蛋白浓度为50 mg/L,反应体积为10 mL.DA厌氧生物转化实验在严格的厌氧、25 ℃、避光条件下进行,用一次性灭菌的注射器取样和接种,在厌氧箱内操作.固定时间取样,用高效液相色谱(HPLC)检测DA剩余含量.此外,进行了非生物和热灭活空白对照实验,用以考察DA的非生物转化.
1.3 分析方法
1.3.1 软骨藻酸分析 采用高效液相色谱和二极管阵列检测器(HPLC-DAD)检测DA浓度.色谱柱为Elite Hypersil BDS C18色谱柱(4.6 mm×250 mm,5 μm粒径);流动相采用乙腈(含体积分数为0.1%的三氟乙酸)与超纯水(含体积分数为0.1%的三氟乙酸)混合液,体积比20∶80,流速0.9 mL/min;进样量为10 μL;检测波长为242 nm.
1.3.2 软骨藻酸生物转化产物分析 使用自动固相萃取仪(Dionex AutoTrace-280,Thermo Fisher,美国)从产物混合液中萃取DA产物,并用Oasis HLB小柱(6 mL,500 mg,60 μm;Waters,美国)进行产物浓缩.取降解中期和末期的产物混合液,用2%甲酸酸化,涡旋混匀后用自动固相萃取仪进行产物萃取.具体步骤是萃取小柱首先用2 mL甲醇(含2%甲酸)和2 mL超纯水(含2%甲酸)活化;然后,60 mL 2%甲酸酸化后的产物混合液以5 mL/min流速流经固相萃取小柱;全部上样完成后,用1 mL超纯水淋洗小柱进行脱盐;随后将萃取小柱用氮气干燥1 min;最后,用1 mL 90%甲醇水溶液淋洗4次.有机萃取液用氮吹仪吹至近干,重溶于100 μL超纯水,4 ℃ 保存.DA及其生物转化产物的固相萃取率为96%±3%.
使用高分辨质谱LTQ-Orbitrap XL与Accela HPLC系统(Thermo Scientific,美国)在正离子模式下测定DA中间产物.色谱柱为Hypersil GOLD C18柱(150 mm×2.1 mm,5 μm粒径,Thermo Scientific,美国),通过梯度方法进行色谱分离.流动相A为乙腈,流动相B为含0.1%甲酸的超纯水,流速为0.2 mL/min.液相洗脱梯度如下:在0~10 min内流动相B的线性梯度从95%下降到88%;在10~15 min内流动相B的线性梯度从88%下降到80%;在15~20 min内流动相B的线性梯度从80%下降到50%;在20~25 min内流动相B保持在50%;在0.1 min内流动相B梯度迅速从50%上升到95%,随后在95%梯度下保持5 min;进样量为10 μL.在本研究中,所有检测到的DA产物均以其相对分子质量命名.HPLC-LTQ-Orbitrap MS检测限为1 μg/L.
使用三重四极杆液质联用仪(Thermo Fisher Scientific,美国),在正离子模式下进行DA同分异构体定量分析.色谱柱为Hypersil GOLD C18柱(150 mm×2.1 mm,5 μm粒径).洗脱液由乙腈(12%)和含0.5%甲酸的超纯水(88%)组成,流速为0.2 mL/min,进样体积为5 μL.DA及其同分异构体在SRM模式下进行鉴定和定量:母离子m/z为312,子离子m/z为266和161.HPLC-MS/MS检测限为0.96 μg/L.
1.3.3 微生物群落分析 为了研究DA厌氧降解过程中微生物群落的组成变化,选取降解中期的微生物样本进行16S rRNA基因高通量测序.其中添加DA的厌氧共代谢降解体系为软骨藻酸组;只添加菌群和共代谢基质而不添加DA的体系为空白对照组.采用MP Biomedicals FastDNA SPIN Kit for Soil试剂盒对微生物菌群样本的基因组DNA进行提取.16S rRNA扩增子测序由北京诺禾致源生物科技有限公司完成,测序区域为V3-V4区.
2 结果与讨论
2.1 软骨藻酸厌氧生物转化特性
本研究考察了DA厌氧生物转化动力学特性.如图1所示,在以牛血清白蛋白为共代谢基质条件下,经过11 d的培养,菌群BH1对DA厌氧生物转化率可达80%.在非生物和热灭活空白对照实验中,DA含量未发生变化,这表明DA的厌氧降解是微生物介导的酶催化反应.此外,在前期的DA生物转化实验中发现,DA不能作为唯一碳源和能源被微生物利用.以上结果表明,DA可以通过共代谢的方式厌氧转化.基于Ct(DA)/C0(DA)取对数,按照准一级动力学模型将DA厌氧生物转化数据进行线性拟合,拟合度R2值为0.983(见图2).结果表明DA厌氧生物转化符合准一级动力学反应.DA厌氧生物转化速率常数为0.099 2 d-1,半衰期为7.0 d.

图1 菌群BH1厌氧生物转化DA

图2 准一级动力学线性拟合
2.2 软骨藻酸厌氧生物转化产物鉴定
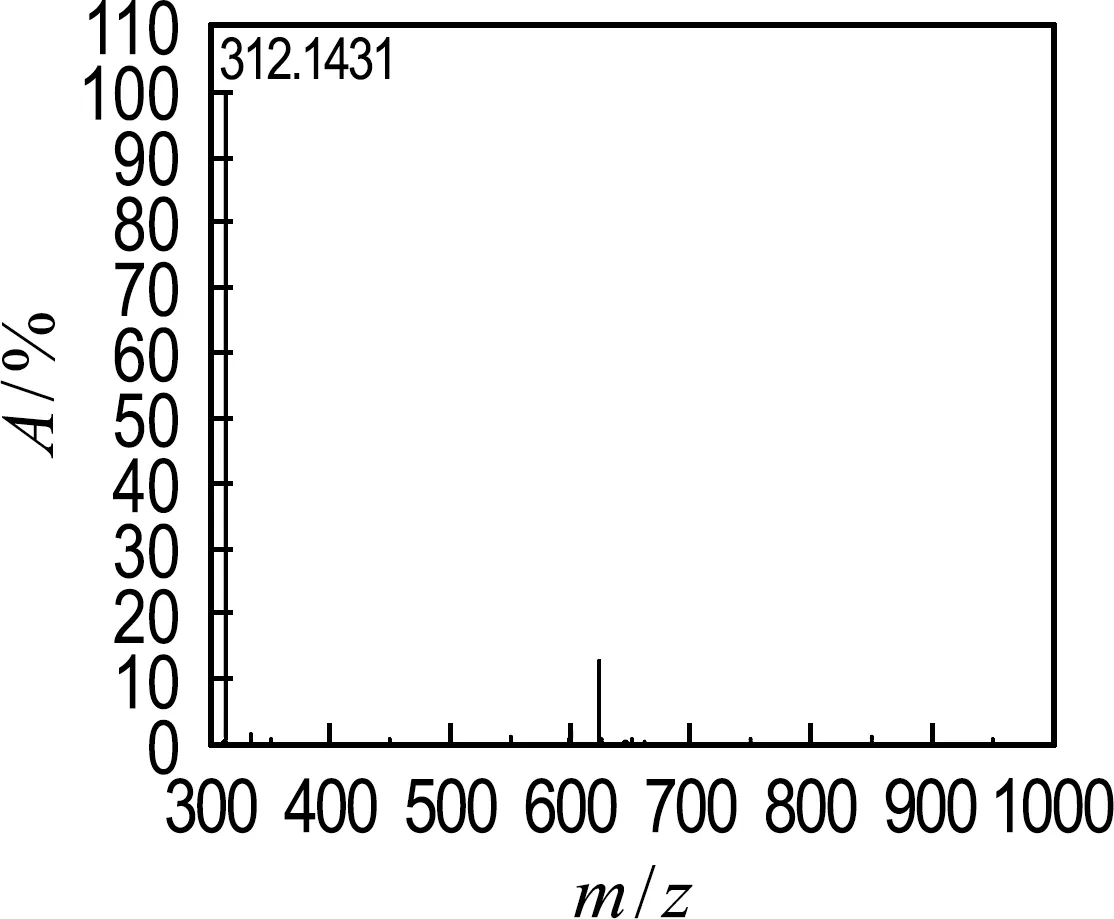
本研究通过固相萃取技术浓缩和纯化DA产物,并使用HPLC-HRMS/MS鉴定DA厌氧生物转化产物.如图3所示,DA厌氧生物转化过程中有同分异构体生成.DA在C18色谱柱上的保留时间为13.04 min,m/z=312.143 1(C15H22O6N,[M+H]+).通过比较DA产物与DA标准品溶液中同分异构体在色谱柱上的保留时间得出,iso-DA E是主要的DA异构体产物,保留时间为11.68 min,m/z=312.143 3,这与之前研究结果一致[20].如图4所示,DA与iso-DA E的HRMS/MS离子碎片主要包括m/z=294.133 1/294.132 2(—H2O),m/z=276.122 3/276.121 6(—2H2O),m/z=266.138 2/266.137 5(—H2CO2),m/z=248.127 7/248.127 0(—(H2CO2+H2O))和m/z=220.132 6/220.132 1(—2H2CO2).以上结果表明,在DA厌氧生物转化过程中,存在生物异构化途径.此外,HPLC-MS/MS定量分析结果表明,经过11 d的厌氧降解,70%的DA及其同分异构体被生物转化(见图3).由此可知,除了异构化途径外,存在其他DA厌氧生物转化途径.

图3 厌氧生物转化过程中DA及其同分异构体质量分数的变化
为了探索DA厌氧生物转化途径,捕捉到一些DA中间产物(见图4、5及表1).脱羧产物P267,保留时间为14.00 min,m/z=268.153 9(C14H22O4N,[M+H]+),HRMS/MS离子碎片主要包括m/z=250.142 8(—H2O),m/z=232.132 5(—2H2O)和m/z=222.148 3(—CH2O2).甲基酮产物P281,保留时间5.41 min,m/z=282.132 9(C14H20O5N,[M+H]+),HRMS/MS离子碎片主要包括m/z=264.121 4(—H2O),m/z=240.121 5(—C2H2O),m/z=236.126 7(—CH2O2)和m/z=224.090 4(—C3H6O).小分子产物P215,保留时间2.48 min,m/z=216.087 1(C9H14O5N,[M+H]+).在菌群GLY厌氧生物转化DA过程中,同样捕捉到上述产物P267、P281和P215[20].由此推测,菌群BH1厌氧生物转化DA存在脱羧途径.此外,在菌群BH1厌氧生物转化DA过程中,首次捕捉到脯氨酸环脱氢产物P309(见图5).脱氢产物P309,保留时间为7.22 min,m/z=310.127 7(C15H20O6N,[M+H]+),HRMS/MS离子碎片主要包括m/z=274.106 2(—2H2O),m/z=264.121 9(—CH2O2),m/z=246.111 1(—(CH2O2+H2O))和m/z=228.100 7(—(CH2O2+2H2O))(见图4).据文献报道,DA的主要活性位点包括共轭双键、羧基和脯氨酸环[9-10,12].Jin等研究表明,在DA光降解过程中可以发生脯氨酸环脱氢反应,生成相对分子质量为309的脱氢产物[9].然而,在DA生物转化过程中,产物P309此前没有被报道过.由此推测,菌群BH1厌氧生物转化DA存在脯氨酸环脱氢途径.
(a) DA-HRMS
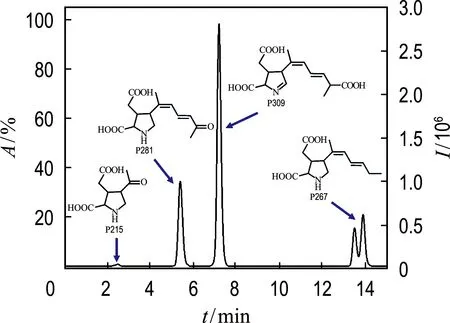
图5 DA中间产物HPLC图
2.3 软骨藻酸厌氧生物转化途径
基于已鉴定的DA产物,本研究推测了DA厌氧生物转化途径(见图6).
如图6所示,DA厌氧生物转化包括3个途径.(1)生物异构化.iso-DA E为主要异构化产物.由于iso-DA E的毒性低于DA[21],这可能对厌氧条件下DA脱毒起重要作用.(2)脯氨酸环脱氢.由于L-脯氨酸和DA在结构上具有相似性[22],因此推测DA厌氧生物转化可能遵循类似的脯氨酸环脱氢机理[23].在脯氨酸脱氢酶的催化下,DA脯氨酸环上发生脱氢反应生成P309.(3)脱羧途径.在DA厌氧生物转化过程中,可能通过脱羧酶催化DA脂肪族侧链生成脱羧产物P267;在脱氢酶作用下,P267发生脱氢反应,生成甲基酮产物P281;P281进一步发生羧化反应和β氧化反应,最终生成脱毒产物P215[20].以上结果表明,厌氧生物转化是DA的重要脱毒过程.
2.4 软骨藻酸厌氧降解过程中微生物群落组成变化
本实验通过Illumina高通量测序技术分析了DA厌氧生物转化过程中的微生物群落组成变化.
微生物菌群在门水平分类如图7所示.空白对照组主要优势物种为厚壁菌门,相对丰度P为99.2%.软骨藻酸组中主要优势门包括厚壁菌门、变形菌门、拟杆菌门和互养菌门,相对丰度分别为71.1%、19.4%、3.8%和1.4%.据文献报道,厚壁菌门和拟杆菌门是常见的水解菌.在厌氧发酵过程中含量丰富,能将蛋白质等复杂的有机大分子降解为小分子的有机酸[24].互养菌门是一类中温严格厌氧氨基酸及丙酮酸降解菌[25].变形菌门在厌氧消化中发挥着重要的代谢功能,许多种群与丁酸盐、丙酸盐、乙酸盐等小分子化合物的利用有关[26].由此推测,厌氧共代谢降解牛血清白蛋白-DA可能是由水解酸化菌驱动的厌氧消化过程.以上结果表明,厚壁菌门、变形菌门、拟杆菌门和互养菌门可能在DA的厌氧共代谢降解中发挥重要作用.
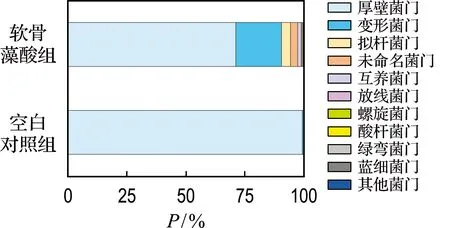
图7 微生物菌群在门水平的物种分类
微生物菌群在属水平分类如图8所示.空白对照组主要优势物种为芽孢杆菌属和海洋杆菌属,相对丰度分别为85.1%和13.7%.软骨藻酸组主要优势属包括瘤胃解蛋白质菌属、脱硫弧菌属、硫单胞菌属和寡养单胞菌属,相对丰度分别为61.5%、13.3%、3.0%和2.7%.瘤胃解蛋白质菌属具有厌氧降解蛋白胨和氨基酸的功能,主要发酵产物是乙酸盐、丙酸盐和异丁酸盐[27].脱硫弧菌属能以脂肪酸为碳源及能源,将硫酸盐还原为硫化氢[28].由此推测,DA厌氧降解需要不同功能微生物共同作用,混合菌群可以弥补种群功能差异,具有热力学优势.以上结果表明,优势物种瘤胃解蛋白质菌属和脱硫弧菌属对DA具有良好的耐受性,可能是潜在的DA厌氧降解菌.在以甘氨酸为共代谢基质条件下,菌群GLY可以厌氧共代谢生物转化DA,其主要优势物种为芽孢杆菌属,相对丰度为76%[20].与菌群GLY相比,菌群BH1具有不同的群落组成,其中瘤胃解蛋白质菌属为优势物种.以上结果表明不同的共代谢基质可以富集不同的微生物,从而存在不同的DA降解菌群.

图8 微生物菌群在属水平的物种分类
3 结 论
(1)以牛血清白蛋白为共代谢基质富集的海洋菌群BH1具有厌氧共代谢生物转化DA的能力,1 mg/L DA生物转化率可达80%.菌群BH1厌氧生物转化DA符合准一级动力学反应,DA生物转化速率常数为0.099 2 d-1,半衰期为7.0 d.
(2)通过HPLC-HRMS/MS技术分析DA生物转化产物,并首次捕捉到脯氨酸环脱氢产物P309.基于鉴定的中间产物推测了DA厌氧生物转化途径,包括生物异构化、脯氨酸环脱氢及脱羧途径,表明厌氧生物转化是DA重要脱毒过程.
(3)16S rRNA扩增子测序分析结果表明,DA的加入导致微生物菌群物种组成发生明显变化.其中优势菌属瘤胃解蛋白质菌属和脱硫弧菌属可能在厌氧共代谢生物转化DA过程中发挥着重要的作用.

