氨化纤维素基气凝胶的制备及其对阿散酸的吸附行为研究
郑雪琴 吴志浩 杨桂芳 叶晓霞,*
(1.福建船政交通职业学院安全与环境学院,福建福州,350007;2.福州大学环境与安全工程学院,福建福州,350108;3.福建省海洋生物多样性保护与永续利用重点实验室,福建福州,350108;4.闽江学院海洋研究院,福建福州,350108)
芳香族有机砷化物如对氨基苯胂酸(又名阿散酸,p-ASA)具有治疗球虫肠道寄生虫、提高饲养效率、促进畜禽快速生长和改善肉类色素沉着等作用,已被广泛用作饲料添加剂[1-3]。畜禽摄入的p-ASA经消化后,最终随粪便排出体外[4],通过禽畜垃圾进入环境中[5]。然而,p-ASA可通过非生物和生物转化为有毒的无机砷[6],进入到周围环境中造成污染,影响植物和微生物的生长发育,甚至通过食物链的传递,危及人类健康[7]。因此,为降低p-ASA的污染,需要开发一种环境友好、成本低廉的处理方式。目前,对于p-ASA的去除方法主要有氧化[8]、吸附[9]、光催化降解[10]和高级氧化降解等[11]。虽然降解法对p-ASA的降解效率很高,几乎可达到完全降解,但是为了避免降解产物的二次污染,还需要设置后续处理过程;另外,降解过程中的催化剂制备困难、成本高、回收难度大,所以降解法在实际应用中仍存在较大的限制。在上述处理方法中,吸附法具有高效简便的特点,同时不会产生对环境造成二次污染的中间产物,且当污染物浓度较低时,吸附剂仍可以有效地去除污染物,是目前处理p-ASA的主要方法之一[12]。近年来,锰氧化物[13]、铁氧化物[14]、金属有机框架物[15]等被作为p-ASA的主要吸附材料,且有一些已被证实具有良好的吸附效果,但成本高、回收难等缺点限制了这些材料在实际中的应用。为了解决这些问题,研究人员开始研究磁性复合碳材料[16]和宏观块状材料[17-18]作为吸附剂的效果,特别是气凝胶[19]和膜材料[20]等具有高吸收性和可回收性的宏观材料引起了广泛关注。
纤维素基气凝胶作为独立于无机气凝胶和有机聚合物气凝胶的第三代气凝胶,具有低成本和优异性能,如密度低、比表面积大(108~1039 m2/g)、孔隙率高、廉价易回收、可生物降解和生物相容性佳等优点[21-23]。目前,纤维素基气凝胶已被用于去除各种污染物,如金属离子(Cu2+[24]),水产品养殖废水中的硝酸盐、亚硝酸盐和磷酸盐[25],废水中的染料(亚甲基蓝[26]、酸性红[27]、刚果红[28]等)。纤维素基气凝胶不仅可以处理废水,还可以作为捕获剂来捕获CO2[29]。然而,原始纤维素基气凝胶在吸附有机污染物时仅具有羟基官能团,羟基活性远低于其他基团(如氨基和羧基),吸附能力有限。因此,需对原始纤维素表面进行化学修饰引入活性吸附位点以增强其对有机物的吸附能力,如通过氨化、磺化、赋磁[30-32]等方式,提高纤维素基气凝胶的吸附量、机械强度,并简化制备工艺流程。
本研究在纤维素基气凝胶的基础上,以环氧氯丙烷为交联剂,通过交联反应和冷冻干燥制备聚乙烯亚胺(PEI)功能化纤维素基气凝胶Cell@PEI,对Cell@PEI进行结构表征,同时通过改变pH值、吸附时间和吸附温度等反应条件,考察Cell@PEI对p-ASA的吸附性能及吸附机理。
1 实验
1.1 主要试剂
纤维素粉末(粒径90 µm)、PEI(纯度99%)、环氧氯丙烷(ECH)和p-ASA,均购自上海阿拉丁生物科技股份有限公司;尿素、氢氧化钠(NaOH)、盐酸,均购自国药化学试剂有限公司;以上药品均为分析纯。
1.2 主要仪器
紫外可见分光光度计,T6型,北京普析通用仪器有限责任公司;Zeta电位与纳米粒度仪,Nano⁃Plus3型,美国Micromeritics公司;傅里叶变换红外光谱仪(FT-IR),AVAT-AR 360型,美国Nicolet公司;扫描电子显微镜(SEM),Quanta250型,美国FEI公司;比表面积分析仪,ASAP2020型,美国Mi⁃cromeritics公司;X射线衍射仪(XRD),Miniflex 600型,日本株式会社Rigaku;X射线光电子能谱仪(XPS),ESCALAB 250型,美国ThermoFisher公司;智能恒温培养振荡器,ZWYR-2012C型,上海智城分析仪器制造有限公司;冷冻干燥机,Lab-1A-50型,北京博医康实验仪器有限公司;精密增力电动搅拌器,JJ-1型,金坛市富华仪器有限公司。
1.3 吸附剂的制备
将4.0 g纤维素粉末分散在NaOH、尿素和水的混合溶液(质量比7∶12∶81)中。将混合溶液放入25℃的水浴中进行超声处理,得到质量分数为4%的纤维素悬浮液。将悬浮液预冷却至−13.5℃并用电动搅拌器强烈搅拌,得到透明的纤维素溶液。将50.0 g纤维素溶液和4.0 g PEI置于三颈烧瓶中混合,搅拌30 min后加入交联剂ECH(10.0 g),将混合物在70℃条件下反应4 h,形成水凝胶,随后经超纯水置换和循环冷冻干燥(−70℃,12 h),最终制得Cell@PEI,其反应过程如图1所示。
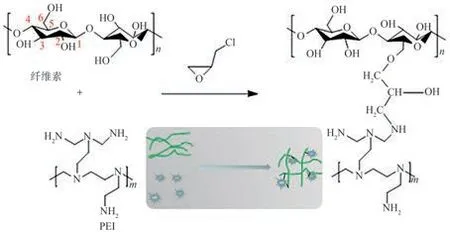
图1 Cell@PEI的制备反应过程示意图Fig.1 Schematic diagram of Cell@PEI preparation reaction process
1.4 分析表征
采用SEM表征样品的表面微观形貌;采用比表面积分析仪的BET模型表征样品的孔径分布和比表面积;采用XRD测定样品晶型结构;采用FT-IR测定样品表面官能团,对600~4000 cm−1范围内扫描36次,拟合后得到红外吸收光谱。
1.5 吸附实验
吸附过程在恒温振荡培养箱(温度25℃、转速160 r/min、时间6 h)中进行,用0.1 mol/L NaOH溶液和0.1 mol/L盐酸调节p-ASA溶液的pH值。将一定量Cell@PEI置于50 mL的p-ASA溶液(50 mg/L)中一定时间,以确保达到吸附平衡。研究吸附剂用量(0.01~0.07 g)、pH值(3~10)、p-ASA的初始浓度和共存离子对吸附参数的影响。反应后,利用紫外-可见分光光度计测定上清液中p-ASA的浓度。随后,分别采用式(1)和式(2)计算p-ASA的去除效率(η,%)和Cell@PEI的平衡吸附量(Qe,mg/g)。

式中,C0表示溶液中吸附质的初始浓度,mg/L;Ce表示吸附质剩余浓度,mg/L;m表示吸附剂用量,g;V表示吸附质溶液体积,L。
1.6 吸附再生实验
采用0.2 mol/L和0.5 mol/L NaOH溶液为解吸剂对吸附p-ASA后的Cell@PEI进行5次解吸再生。每次再生后抽滤、用去离子水洗涤Cell@PEI至pH值为7并干燥(70℃,12 h),重复吸附实验同1.5部分。计算每次再生吸附后的Cell@PEI对p-ASA的去除率和Cell@PEI的平衡吸附量。
2 结果与讨论
2.1 Cell@PEI的表征
2.1.1 SEM分析
利用SEM观察纤维素粉末原料和Cell@PEI的表面微观形貌,结果如图2(a)和图2(b)所示。从图2(a)可以看出,纤维素粉末表面粗糙,呈分散状;而纤维素与PEI交联接枝后,制备的Cell@PEI呈疏松的多孔网状结构,孔道结构发达(见图2(b)),这使得Cell@PEI具有较大的比表面积,增加其与污染物的接触面积,为p-ASA的吸附提供足够吸附位点,从而提高吸附效率。
由吸附前后Cell@PEI的EDS图(见图2(c))可知,N元素存在于Cell@PEI表面上,证明氨基已经成功引入气凝胶材料中。在Cell@PEI吸附p-ASA后,As均匀分布在其表面上,证明p-ASA被Cell@PEI成功吸附。
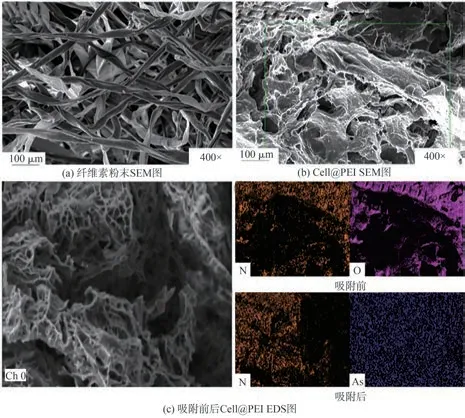
图2 纤维素粉末及Cell@PEI的SEM图和改性及吸附前后Cell@PEI的EDS图Fig.2 SEM images of cellulose powder and Cell@PEI;EDS images of Cell@PEI before and after modification
2.1.2 孔结构分析
采用比表面积分析仪,根据BET模型和N2吸附-脱附方法测定Cell@PEI和纤维素粉末的孔径分布和比表面积,结果如图3所示。根据国际纯粹与应用化学联合会(IUPAC)公布的气体吸附等温线分类标准,Cell@PEI符合V型等温线的特征,比表面积达241.4 m2/g,平均孔径为6.27 nm,孔隙率为91%,是典型的介孔材料。与纤维素粉末相比,Cell@PEI的比表面积显著提升,更有利于吸附污染物,这与SEM的分析结果一致。

图3 纤维素粉末和Cell@PEI的N2吸附-脱附等温线Fig.3 N2 adsorption-desorption isotherm curves of cellulose powder and Cell@PEI
2.1.3 XRD分析
图4为纤维素粉末和Cell@PEI的XRD谱图。从图4可以看出,Cell@PEI的结晶度有所下降。纤维素粉末为I型结晶结构,在2θ=15.0°、16.4°、22.6°及34.2°处出现的峰分别对应纤维素I型结构的典型晶面(101)(101)(002)及(040);而Cell@PEI的XRD谱图呈现出典型的纤维素II型结构,其分别在2θ=20°和22°时出现II型结构的典型晶面(101)。这说明经过PEI改性后,纤维素的晶型结构发生了明显变化,同时也说明PEI已经成功接枝到了纤维素上。

图4 纤维素粉末和Cell@PEI的XRD谱图Fig.4 XRD patterns of cellulose powder and Cell@PEI
2.1.4 FT-IR分析
图5为纤维素粉末、PEI、Cell@PEI吸附p-ASA前后的FT-IR谱图。经PEI改性的纤维素气凝胶在2920和1030 cm−1出现的吸收峰分别与C—H和C—O键的拉伸振动相关,是典型的纤维素特征峰,证实PEI改性并未改变纤维素的基本官能团。此外,Cell@PEI在1601和3290 cm−1处的吸收峰与N—H拉伸振动及纤维素中的O—H拉伸振动有关。另外,从吸附后材料(Cell@PEI-p-ASA)的谱图可以看出,与Cell@PEI相比,Cell@PEI-p-ASA在1093和826 cm−1处出现C—As和As—O的特征吸收峰,证明吸附后的Cell@PEI中存在As,p-ASA被成功吸附。
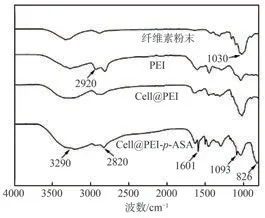
图5 改性及吸附前后纤维素材料的FT-IR谱图Fig.5 FT-IR spectra of cellulose materials before and after modification and adsorption
2.2 Cell@PEI对p-ASA的静态吸附性能分析
2.2.1 pH值对Cell@PEI吸附性能的影响
图6为不同吸附条件对Cell@PEI吸附p-ASA的影响。添加0.02 g Cell@PEI,控制p-ASA初始浓度为60 mg/L,吸附时间为250 min,改变溶液pH值,得到不同吸附量和去除率,结果如图6(a)所示。由图6(a)可知,pH值的变化对Cell@PEI的吸附效果影响显著。当pH值<4.0时,p-ASA平衡吸附量及去除率随pH值的升高而增大;当pH值=4.0时,p-ASA平衡吸附量及去除率最大;当pH值>4.0时,p-ASA的平衡吸附量和去除率呈明显下降趋势。由此可知,酸性条件有利于Cell@PEI对p-ASA的吸附,而碱性条件不利于吸附反应的进行。这是因为不同pH值下,p-ASA对应3个不同的pKa值(1.9、4.1和9.2)[33],即表面所带电荷不同;酸性条件下,Cell@PEI在水溶液中可发生氨基表面质子化反应,使其表面带正电荷,与带负电荷的p-ASA发生静电吸附,因而可提高其对p-ASA的去除率和平衡吸附量;碱性条件下,Cell@PEI表面携带的负电荷增多,与p-ASA之间形成的静电斥力增大;另外,溶液中OH−增多也会对p-ASA的吸附造成一定的竞争效应,导致p-ASA的吸附受到抑制,因而去除率和平衡吸附量降低。综上所述,溶液pH值会严重影响p-ASA的化学形态、溶解度、亲水性等性能,最终影响其吸附特性。因此选取pH值=4.0为优选条件,此时p-ASA去除率为78.4%,Cell@PEI对p-ASA的平衡吸附量为98.0 mg/g。
2.2.2 吸附剂用量对Cell@PEI吸附性能的影响
当溶液pH值为4.0,p-ASA初始浓度为60 mg/L,吸附时间为250 min时,改变吸附剂用量,得到不同吸附量和去除率。图6(b)为吸附剂用量对Cell@PEI吸附p-ASA的影响。从图6(b)可知,随吸附剂用量的增加,Cell@PEI对p-ASA的去除率逐渐增加,在吸附剂用量为0.07 g时达92.2%。这是因为溶液中吸附剂用量增加,p-ASA与吸附剂的接触面积增大,吸附剂上活性位点增多;而平衡吸附量的降低可能是因为吸附剂用量的增加使Cell@PEI上的吸附位点呈不饱和状态。

图6 不同吸附条件对Cell@PEI吸附性能的影响Fig.6 Effects of different adsorption conditions on the adsorption perfomance of Cell@PEI
2.2.3p-ASA初始浓度对Cell@PEI吸附性能的影响
当吸附剂用量为0.02 g,吸附时间为250 min时,Cell@PEI对pH值为4.0的不同初始浓度下p-ASA的吸附性能如图6(c)所示。由图6(c)可知,随着p-ASA初始浓度的增加(从10 mg/L提高至100 mg/L),平衡吸附量明显提高,从6.78 mg/g提高至205.6 mg/g(从10 mg/L提高至100 mg/L)。这是因为当p-ASA初始浓度较低时,Cell@PEI表面的吸附位点多于p-ASA,此时平衡吸附量较低;而随着p-ASA初始浓度的增加,吸附质和吸附剂的接触机会增多,导致平衡吸附量增加。当p-ASA初始质量浓度增大时,其去除率整体呈先上升后略有降低的趋势,并在25~100 mg/L范围内趋于平衡。
2.2.4 共存离子对Cell@PEI吸附性能的影响
共存离子可与p-ASA竞争吸附剂上的吸附位点,本研究探究了3种常见的共存阴离子对Cell@PEI吸附p-ASA的影响,添加0.02 g Cell@PEI,控制p-ASA溶液pH值为4.0,初始浓度为60 mg/L,吸附时间为250 min,改变共存阴离子种类和浓度,进行吸附实验,结果如图6(d)所示。由图6(d)可知,3种共存阴离子对Cell@PEI吸附p-ASA均有一定抑制作用,影响程度依次是:SO42−>CO32−>Cl−。随着共存阴离子浓度的增加,抑制效果也愈加明显,且SO42−比另2种阴离子对Cell@PEI吸附p-ASA的影响更大。这可能是由于氨基对SO42−有更高的亲和力,使得SO42−可与p-ASA分子竞争活性吸附位点[34]。
2.2.5 吸附动力学分析
当吸附剂用量为0.02 g,对pH值为4.0、初始浓度为60 mg/L的p-ASA进行吸附实验,探究吸附时间对Cell@PEI吸附p-ASA的影响,结果如图7(a)所示。由图7(a)可知,随着吸附时间的延长,Cell@PEI吸附p-ASA的过程可分为:快速吸附过程(<60 min)和慢速吸附过程(>60 min)。Cell@PEI对于p-ASA的吸附主要集中在快速吸附过程,此时由于Cell@PEI表面具有丰富的活性吸附位点,吸附剂表面与溶液间有较大的浓度差,促使Cell@PEI吸附p-ASA,所以在此阶段Cell@PEI对p-ASA的吸附速率较快,即其对p-ASA的去除快速增加。吸附60 min后,p-ASA的去除率和Cell@PEI的吸附量分别达80.9%和101.2 mg/g。随着吸附反应的进行,Cell@PEI表面的有效活性位点随之减少,固液界面浓度差下降,导致Cell@PEI对p-ASA的吸附速率下降,吸附反应趋于平衡。
将Cell@PEI对p-ASA的吸附量随时间变化的数据用准一级动力学模型和准二级动力学模型进行拟合,结果如图7(b)和图7(c)所示。由图7(b)和图7(c)可以看出,准二级动力学模型的相关系数(R2)优于准一级动力学模型R2,说明准二级动力学模型能更好地描述Cell@PEI对p-ASA的吸附过程,表明吸附材料在吸附p-ASA的过程中,二者之间发生了静电吸引和氢键连接,即Cell@PEI对p-ASA的吸附过程是化学吸附过程。
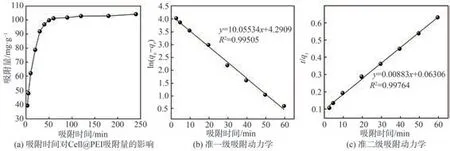
图7 吸附动力学分析Fig.7 Adsorption kinetics analysis
2.2.6 吸附等温线分析
为进一步研究Cell@PEI与p-ASA的相互作用机制,利用Langmuir和Freundlich模型分析其吸附过程,对不同温度下的等温吸附数据进行拟合,拟合结果如图8所示。从图8可以看出,Freundlich模型的相关系数(R2)高于Langmuir模型的R2,说明Freundlich吸附模型更适用于描述Cell@PEI对p-ASA的吸附过程,即Cell@PEI对p-ASA的吸附为非均匀、多分子层吸附。这可能是由于PEI作为官能化材料,为纤维素气凝胶表面提供了更丰富的吸附作用力,快速吸附p-ASA至Cell@PEI表面后,吸附质进入气凝胶三维结构内部再次扩散和物理吸附。表1和表2分别为Cell@PEI吸附p-ASA的Langmuir和Freundlich等温吸附拟合参数。由表1和表2可知,Freundlich等温式的吸附强度常数(1/n)小于1,Langmuir等温式的RL在0~1之间,表明吸附容易进行。Langmuir等温式和Freundlich等温式的吸附平衡常数(KL、KF)及Qe均随着温度的升高而减小,表明低温有利于Cell@PEI对p-ASA的吸附。

图8 吸附等温线分析Fig.8 Adsorption isotherm analysis
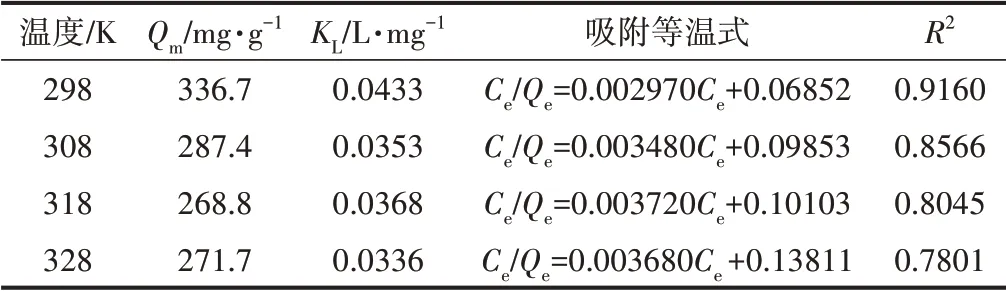
表1 Cell@PEI吸附p-ASA的Langmuir吸附等温式Table 1 Langmuir adsorption isotherm for Cell@PEI towards p-ASA

表2 Cell@PEI吸附p-ASA的Freundlich吸附等温式Table 2 Freundlich adsorption isotherm for Cell@PEI towards p-ASA
2.3 Cell@PEI吸附p-ASA的吸附机理研究
为了阐明p-ASA与Cell@PEI的分子间相互作用,本研究通过吸附前后Cell@PEI的XPS谱图探究了p-ASA的吸附机理,结果如图9所示。
2.3.1 氢键作用
分析FT-IR谱图(见图5)可知,Cell@PEI和p-ASA分子富含H—供体和H—受体基团(如C—H、—OH和N—H),这表明二者之间可以形成大量氢键。图9(a)~(f)为吸附p-ASA前后Cell@PEI的各元素XPS谱图。图9(a)和图9(d)分别为吸附p-ASA前后Cell@PEI C 1s谱图,其中284.8、286.2和287.9 eV处的吸收峰分别对应Cell@PEI中的C—C/C==C、C—O/C==N和C==O的特征峰[35]。吸附p-ASA后,C—C/C==C占比由59.3%降至44.5%,C—O/C==N和C==O占比分别由36.3%和4.4%升至48.8%和6.7%,这可能是因为它们参与了氢键的形成。图9(b)和图9(e)显示,将Cell@PEI的N 1s谱图去卷积后得到2个峰,分别为399.0 eV的NH2/N—H和401.4 eV的NH3+[36],在吸附p-ASA后,NH2/N—H的占比由86.8%降至77.2%,而NH3+的占比由13.2%升至22.8%,这也表明了在吸附过程中氨基态发生了变化。从Cell@PEI的O 1s谱图(见图9(c)和图9(f))可知,Cell@PEI中含有2种O峰,分别是532.3 eV的C—OH和531.2 eV的O…H[37],在吸附p-ASA后,C—OH的占比由70.4%升至88.7%,O…H的占比由29.6%降至11.3%,表明官能团C—OH参与了p-ASA吸附过程中O…H氢键的形成。因此,Cell@PEI与p-ASA之间存在氢键作用。
2.3.2 静电引力
Cell@PEI对p-ASA的吸附是气凝胶界面上发生的静电相互作用的化学吸附过程。在吸附过程中p-ASA上具有较强还原活性的极性氨基,其偶极矩是由极性氨基的表面电荷分布不均匀所致。图9(g)为不同pH值条件下Cell@PEI的Zeta电位图。如图9(g)所示,在pH值为2~10间,Cell@PEI Zata电位呈正电性。在pH值>4.0的条件下,p-ASA表面基本带负电。而PEI是一种水溶性聚胺,在水中呈碱性,其分子链上拥有大量氨基N原子(伯、仲、叔胺的比例一般为1∶2∶1),具有很强的亲质子性能[38]。结合pH值对吸附量的影响(详见2.2.1),推测静电作用是Cell@PEI吸附p-ASA过程的主要作用力之一。

图9 Cell@PEI吸附机理研究Fig.9 Adsorption mechanism analysis of Cell@PEI
2.4 再生使用性能分析
本研究分别选用0.2 mol/L和0.5 mol/L的NaOH溶液为解吸剂,对吸附p-ASA后的Cell@PEI进行解吸再生研究。图10为不同浓度解吸剂对Cell@PEI进行5次解吸再生后的使用效果。由图10所示,随着解吸再生次数的增多,Cell@PEI对p-ASA的平衡吸附量和去除率均逐渐下降。5次解吸再生后,2种解吸液浓度下Cell@PEI对p-ASA的平衡吸附量分别保持在110.9 mg/g和105.4 mg/g,去除率分别达77.2%和73.4%。结果表明,Cell@PEI具有良好的可重复使用性和应用潜能。

图10 Cell@PEI解吸再生分析Fig.10 Analysis of desorption and regeneration of Cell@PEI
3 结论
本研究以纤维素为原料,利用聚乙烯亚胺(PEI)进行氨基改性,合成具有阿散酸(p-ASA)吸附功能的新型三维块状氨化纤维素气凝胶(Cell@PEI),对Cell@PEI进行了理化性能分析及吸附机理探索。
3.1 在Cell@PEI对p-ASA的最佳吸附条件(p-ASA溶液pH值4.0,初始浓度为60 mg/L,吸附时间6 h,吸附温度25℃,Cell@PEI添加量0.02 g)下,最大吸附量为205.6 mg/g。
3.2 Cell@PEI对p-ASA的吸附过程是化学吸附过程,符合准二级动力学方程;同时符合Freundlich等温吸附方程,属于非均匀、多分子层吸附,且吸附更易在低温下进行。
3.3 吸附再生实验结果表明,用2种不同浓度NaOH溶液循环再生5次后,Cell@PEI的平衡吸附量分别为110.9 mg/g和105.4 mg/g,去除率分别达77.2%和73.4%,表明Cell@PEI再生5次后仍可对水体中大部分p-ASA进行吸附,具有良好的再生使用效果。

