白蛋白结合型紫杉醇治疗晚期非小细胞肺癌的有效性和安全性Δ
季 鹏,宁丽娟,陈泳伍,朱鹏里,吴 菲,吴颖其,颜 辉,耿亚迪,张圣雨,沈爱宗[中国科学技术大学附属第一医院(安徽省立医院)药学部/安徽省药品临床综合评价技术中心,合肥 230001]
2022年2月,国家癌症中心发布的最新一期全国癌症统计数据显示,肺癌发病率位列第二,病死率位列第一;2020年我国癌症死亡总人数为300万,肺癌死亡人数(约71万)遥遥领先,占癌症死亡总人数的23.8%[1]。紫杉类药物是晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的主要化疗药物,美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)《非小细胞肺癌临床实践指南(2022,V1)》、中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)《2021 CSCO非小细胞肺癌诊疗指南》等国内外临床指南均推荐紫杉醇作为NSCLC的一线治疗药物[2―3]。传统的溶剂型紫杉醇由于疏水性强,需要以聚氧乙烯蓖麻油为溶剂,而后者容易引发严重的过敏反应和肾毒性、心脏毒性等不良反应,使得临床用药的安全性受到影响;结合型紫杉醇为新型紫杉醇制剂,以人血白蛋白为载体,药物溶解度有所增加,且不会存在由聚氧乙烯蓖麻油所造成的不良反应,在临床上显示出较好的疗效和较低的毒性[4]。2012年,结合型紫杉醇被美国FDA批准用于NSCLC的临床治疗。
NCCN《非小细胞肺癌临床实践指南(2022,V1)》指出,患者在必要时(如发生过敏反应时)可使用白蛋白结合型紫杉醇替代紫杉醇或多西他赛[2]。对于无驱动基因突变的晚期(Ⅳ期)NSCLC患者,《2021 CSCO非小细胞肺癌诊疗指南》推荐一线使用紫杉类药物,包括紫杉醇、多西他赛、白蛋白结合型紫杉醇[3]。虽然国内外临床指南均推荐紫杉类药物作为NSCLC的一线治疗药物,但白蛋白结合型紫杉醇尚未在我国获批用于NSCLC;同时,NSCLC患者使用白蛋白结合型紫杉醇无法获得医保报销,加之该药上市时间短、价格相对较高,使得其临床应用受限,因此有必要从药物有效性、安全性等多方面入手对其进行综合评估。基于此,本研究采用真实世界研究方法,回顾性分析了我院2018年1月-2021年12月收治的使用含紫杉醇制剂(白蛋白结合型紫杉醇和普通紫杉醇)化疗方案的晚期NSCLC患者的临床资料,对两种紫杉醇制剂的有效性和安全性进行比较,旨在为保障临床合理、规范地使用抗肿瘤药物提供参考。
1 资料与方法
1.1 一般资料
使用我院临床药学管理系统PASS PharmAssist 2.0抽取2018年1月-2021年12月我院收治的使用含紫杉醇制剂化疗方案治疗的200例晚期NSCLC患者的临床资料。纳入标准包括:(1)经病理组织学或细胞学检查确诊为NSCLC Ⅳ期,诊断标准参照《2021 CSCO非小细胞肺癌诊疗指南》[3],病理学分期参照国际肺癌研究协会第7版TNM分期[5];(2)有CT扫描或磁共振成像(mag‐netic resonance imaging,MRI)可测量的客观病灶;(3)美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~2分,完成化疗周期≥2个;(4)从治疗开始预计生存期>3个月;(5)无化疗禁忌证;(6)获得患者超说明书用药知情同意。排除标准包括:(1)严重的心脑血管、糖尿病及精神疾病患者;(2)严重的全身性感染患者;(3)伴有重度肺纤维化的患者;(4)大量胸腔积液、心包积液无法控制者;(5)乙肝表面抗原阳性者。根据患者所用化疗方案,将其分为白蛋白结合型紫杉醇组和紫杉醇组,各100例。本研究方案经我院医学伦理委员会审核通过,伦理批件号为2022-RE-060。
1.2 治疗方案
医师根据患者的体表面积和预后评分选择适宜的方案化疗。化疗前,所有患者均进行血常规、肝肾功能、电解质检查,排除化疗禁忌证。白蛋白结合型紫杉醇组患者接受注射用紫杉醇(白蛋白结合型)(江苏恒瑞医药股份有限公司,国药准字H20183378,规格100 mg)治疗,用法用量为130 mg/m2,d1+d8,每次滴注30 min,给药前均未预防性使用抗过敏药。紫杉醇组患者接受紫杉醇注射液(哈药集团生物工程有限公司,国药准字H20059962,规格 5 mL∶30 mg)治疗,用法用量为 175 mg/m2,滴注时间长于3 h,给药前使用抗过敏药处理[给药前30~60 min静脉滴注地塞米松磷酸钠注射液(辰欣药业股份有限公司,国药准字H37021969,规格1 mL∶5 mg)20 mg]。每21 d为1个周期。所有患者至少完成2个周期的治疗,且严格按照给药方案执行,无患者减量。
1.3 疗效及安全性评价
治疗2个周期后,依照实体肿瘤疗效评价标准1.1(Response Evaluation Criteria in Solid Tumours,RECIST 1.1)评价两组患者的近期客观疗效,包括完全缓解(com‐plete remission,CR)、部分缓解(partial remission,PR)、病情稳定(stable disease,SD)和疾病进展(progressive disease,PD),并按下式计算有效率(response rate,RR)和疾病控制率(disease control rate,DCR):RR=(CR患者数+PR患者数)/患者总数×100%,DCR=(CR患者数+PR患者数+SD患者数)/患者总数×100%[6]。记录两组患者的无进展生存期(progression-free survival,PFS),PFS定义为从化疗开始至PD或任何原因导致死亡的时间。记录两者患者的毒副反应发生情况,并按常见不良事件评价标准5.0版(Common Terminology Criteria for Adverse Events,CTCAE 5.0)进行分级(1~5级)判定[7]。
1.4 统计学方法
采用SPSS 25.0软件对数据进行统计分析。符合正态分布的计量资料以±s表示,采用t检验;不符合正态分布的计量资料以M(P25,P75)表示,采用秩和检验。计数资料以例数或率表示,采用χ2检验、Fisher检验或R×C列联表检验。采用Kaplan-Meier法分析两组患者的生存情况,绘制生存曲线并进行Log-rank检验。检验水准α=0.05。
2 结果
2.1 两组患者的一般资料比较
本研究共纳入男性患者159例、女性患者41例;年龄为38~80岁;所有患者均为Ⅳ期,其中鳞癌92例、非鳞癌108例。两组患者的性别、ECOG评分、治疗方案等一般资料比较,差异均无统计学意义(P>0.05);白蛋白结合型紫杉醇组年龄显著高于紫杉醇组(P<0.05)。结果见表1。

表1 两组患者的一般资料比较
2.2 两组患者的化疗完成情况和PFS比较
白蛋白结合型紫杉醇组患者共完成化疗430个周期,平均4.3个周期,中位PFS为4.0个月。紫杉醇组患者共完成化疗476个周期,平均4.8个周期,中位PFS为4.0个月。两组患者的中位PFS比较,差异无统计学意义(经Log-rank检验,P=0.936 9)。结果见图1。
2.3 两组患者的疗效比较
治疗2个周期后,两组均无CR患者,共有PR患者22例、SD患者166例、PD患者12例,总RR为11.00%,总DCR为94.00%。白蛋白结合型紫杉醇组患者的RR为13.00%,与紫杉醇组的9.00%比较,差异无统计学意义(P>0.05);白蛋白结合型紫杉醇组患者的DCR为99.00%,显著高于对照组的89.00%(P<0.05)。结果见表2。
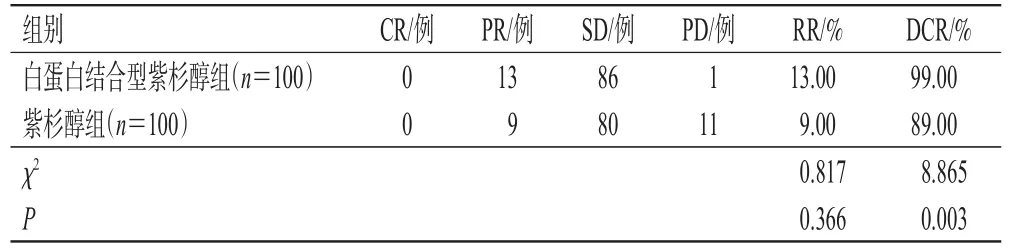
表2 两组患者的疗效比较
2.4 两组患者的毒副反应比较
两组患者的血液毒性反应主要包括白细胞减少、中性粒细胞减少、血小板减少和贫血,大多为1~2级;非血液毒性反应主要是为感觉神经病变、关节肌痛、恶心呕吐和乏力,均为1~2级;两组均无患者发生5级毒副反应。紫杉醇组患者上述各毒副反应的发生率均显著高于白蛋白结合型紫杉醇组(P<0.05)。结果见表3。

表3 两组患者的毒副反应比较
3 讨论
紫杉醇是从红豆杉类植物中分离得到的天然产物,具有抗肿瘤活性,其作用机制是在细胞增殖过程中抑制纺锤体的形成和DNA的复制,从而诱导肿瘤细胞凋亡;另外,紫杉醇还可以与微管蛋白结合,稳定微管蛋白构象,抑制微管蛋白解聚,使肿瘤细胞阻滞在分裂期,从而抑制有丝分裂[8]。传统的紫杉醇注射液在水中的溶解度极低,所以制剂中加入了聚氧乙烯蓖麻油作为增溶剂。聚氧乙烯蓖麻油可在体内被降解并释放组胺类致敏物质,引起全身皮疹等过敏反应;同时,其也可引起神经细胞内颗粒释放及脱髓鞘改变,加重紫杉醇的外周神经毒性[9―10]。白蛋白结合型紫杉醇由美国Abraxis Bio-Science,LLC研发,是以人血白蛋白为载体的新型纳米制剂(粒径约130 nm),可通过与细胞膜上的白蛋白受体糖蛋白60结合来激活细胞膜上的小窝蛋白,再经血管内皮细胞将药物转移至肿瘤组织中,从而发挥抑瘤作用[11―13]。由于不需要聚氧乙烯蓖麻油等增溶剂,患者在使用白蛋白结合型紫杉醇时无须行抗过敏等预处理,且输注时间短、使用方便。
有报道指出,白蛋白结合型紫杉醇治疗晚期NSCLC患者的客观缓解率(objective response rate,ORR)为26.09%,DCR为67.39%,中位PFS为4.80个月;治疗鳞癌患者的ORR为27.78%,DCR为69.44%,中位PFS为5.30个月;在二线及以上化疗方案中,患者的ORR和DCR可分别达到23.81%和61.90%,中位PFS为4.30个月[14]。另一项回顾性研究显示,白蛋白结合型紫杉醇组患者接受该药二线治疗的DCR为73.1%,中位PFS为6个月;普通紫杉醇组患者的DCR为57.7%,中位PFS为4.5个月[15]。杨宇等[16]的研究显示,经白蛋白结合型紫杉醇二线治疗3个疗程后,晚期NSCLC患者的ORR为61.29%,高于对照组的29.03%。本研究结果显示,白蛋白结合型紫杉醇组患者的RR(13.00%)虽略高于紫杉醇组(9.00%),但差异无统计学意义(P>0.05),提示两药疗效相当;白蛋白结合型紫杉醇组患者的DCR(99.00%)显著高于紫杉醇组(89.00%),表明白蛋白结合型紫杉醇比普通紫杉醇能更好地控制疾病的进展。
骨髓抑制和神经毒性是紫杉类药物常见的不良反应,一般以白细胞计数下降为主[17]。有文献报道,白蛋白结合型紫杉醇致复发难治性小细胞肺癌患者发生3~4级中性粒细胞减少的概率为35.5%[18]。本研究结果显示,200例患者发生的血液毒性反应以贫血、中性粒细胞减少和白细胞减少居多,总发生率分别为65.00%、39.50%和39.50%。紫杉醇组患者的血液毒性反应以贫血和白细胞减少为主,各不良反应的发生率均显著高于白蛋白结合型紫杉醇组,分别是77.00% vs.53.00%、57.00% vs.22.00%(P<0.05)。200例患者发生的非血液毒性反应以关节肌痛和乏力为主,总发生率均为32.00%。紫杉醇组患者感觉神经病变、乏力、恶心呕吐、关节肌痛的发生率均显著高于白蛋白结合型紫杉醇组(21.00% vs.8.00%、48.00% vs.16.00%、31.00% vs.18.00%、57.00% vs.7.00%,P<0.05)。总之,白蛋白结合型紫杉醇组的各毒副反应发生率均显著低于紫杉醇组,提示其在治疗晚期NSCLC安全性方面有一定优势。
综上所述,与紫杉醇相比,白蛋白结合型紫杉醇治疗晚期NSCLC的疗效较好,在安全性方面有一定优势。但本研究存在一定的局限性:由于本研究为回顾性、单中心设计,其研究结果可能存在一定的偏倚;同时,本研究并未对患者的生存质量变化进行评估,部分患者的治疗目标是延长生存期,有的则是改善生存质量,不同治疗目标对研究结局均有一定的影响,故有待后续研究予以完善。

