多巴胺D4受体对酒精依赖大鼠海马区cAMP/PKA通路的影响
刘洪凤,安子宜,董泽嵩,霍楠楠,韩智学,荣胜忠,杨 勇,李 齐,关利新
酒精依赖是一种慢性多因素脑疾病,具有无法控制饮酒的特征,是世界性公共卫生问题之一[1]。酒精依赖可以导致多种躯体和精神疾病,不仅损害了个人的健康,更是家庭暴力以及犯罪的重要因素,加重了个体及社会的经济负担和心理负担。酒精依赖主要表现为长期饮酒及自我调节失控,进而导致病人的生理、心理和社会适应能力下降[2],可能会带来许多不利的健康后果,可能会通过许多机制损害神经系统[3],因此,酒精依赖导致的大脑结构和功能改变的各项研究逐渐成为科研热点。
DRD4是多巴胺信号转导的关键组成部分,由于酒精影响多巴胺信号转导的方式而被选择作为酒精依赖的候选因子[4-5]。DRD4广泛分布于海马,在调节海马区神经传递中起关键作用,其与配体结合后可调节cAMP的水平,cAMP/PKA的改变影响酒精依赖有关的行为反应[6],因此,DRD4介导的cAMP/PKA信号转导异常可能是产生酒精依赖的原因。本研究旨在研究DRD4对酒精依赖大鼠海马区cAMP/PKA通路的影响,进一步揭示酒精依赖相关的神经生物学机制,为酒精依赖的防治提供依据。
1 材料与方法
1.1 实验动物 SPF级6周龄雄性SD大鼠42只,体质量170~200 g,购自辽宁长生生物技术有限公司[SCXK(辽)2015-0001]。于SPF级鼠类实验室牡丹江医学院实验动物中心[SYXK(黑)2019-006]进行动物模型的构建。本次动物实验经牡丹江医学院伦理委员会审核批准,符合实验动物伦理要求。
1.2 主要试剂 Marker(美国Thermo公司);ECL显色液(大连美仑生物技术有限公司);DRD4、AC、DKA、CREB、β-actin、一抗(兔抗大鼠)、二抗(山羊抗兔)(北京Bioss 公司);总RNA提取试剂盒(北京Solarbio公司);逆转录试剂盒(大连Takara公司);引物(上海生物工程股份有限公司);转染试剂(北京Engreen公司);siRNA序列(武汉金拓思生物科技有限公司)。
1.3 主要仪器 Step One Real-Time PCR System(美国Applied Biosystems公司);转膜仪(美国BIO-RAD公司);脑立体定位仪(上海玉妍科学仪器有限公司);Amersham Imager 600(美国GE 公司)。
1.4 方法
1.4.1 模型的构建 将SPF级雄性SD大鼠42只随机分为正常对照组(n=8)和10%酒精依赖模型组(n=34),大鼠适应1周后制备模型。对照组为2瓶100 mL蒸馏水,模型组为1瓶10%乙醇100 mL和1瓶蒸馏水100 mL,每天记录大鼠的饮水量、饮酒量,每天更换水瓶和酒精瓶的位置、更新溶液,连续造模4周。每周检测大鼠体质量。饮酒组大鼠的酒精摄入量(>3.15 g·kg-1·24 h-1)和酒精偏好(=饮酒量占总液体摄入量的百分比)逐渐稳定时,即成功制备SD大鼠酒精依赖模型[7]。在34只SD大鼠中,共有32只SD大鼠建模成功(1只由于饮酒量低未成瘾而剔除,1只由于体质量显著下降、未成瘾而剔除),随机取8只作为酒精依赖模型对照组,取24只构建DRD4 siRNA低表达组模型。
1.4.2 体内转染 将酒精依赖模型制备成功大鼠,进行DRD4 siRNA体内转染。 配制体内转染复合物:按照转染试剂说明书要求,将siRNA(NC序列:5′-UUC UCC GAA CGU GUC ACG UTT-3′;DRD4 siRNA序列:5′-CCG CUC AUGC UAC UGC UUU TT-3′)5 μL(1 g/L)、2.5 μL转染试剂以及12.5 μL稀释溶液混匀,配成20 μL siRNA体内转染体系,室温静置15 min后备用。
DRD4 siRNA低表达组模型的构建:将24只酒精依赖模型组大鼠随机分为3组,每组8只,分别为空白对照组(SD-No siRNA)、阴性对照组(SD-Ctr siRNA)和DRD4 siRNA低表达组(SD-DRD4 siRNA)。将大鼠麻醉后置于脑立体定位仪中,将20 μL 0.9%氯化钠溶液/NC siRNA转染复合物/DRD4 siRNA转染复合物分别缓慢注入SD-No siRNA组、SD-Ctr siRNA组和SD-DRD4 siRNA组右侧脑室。在24 h后,检测DRD4的表达情况,与SD-Ctr siRNA组比较,SD-DRD4 siRNA组大鼠DRD4的表达下降50%~60%,即成功构建DRD4 siRNA低表达组大鼠模型[8]。
1.4.3 大鼠海马区相关基因mRNA表达的qPCR检测 将大鼠吸入七氟烷麻醉后行安乐死,取出脑组织中的海马区备用,根据总RNA提取试剂盒说明书提取SD大鼠海马区的总RNA;根据逆转录试剂盒说明书进行逆转录样品配制,通过S1000 Thermal Cycler PCR进行逆转录;采用Step One Real-Time PCR System qPCR检测DRD4、AC、PKA、CREB的mRNA表达水平。
引物序列:β-actin(上游序列:5′-AGG CCA ACC GTG AAA AGA TG-3′,下游序列:5′-ACC AGA GGC ATA CAG GGA CAA-3′);DRD4(上游序列:5′-TGA TGT GTT GGA CGC CTT TCT TCG-3′,下游序列:5′-ACA TAG CCC AGC CAG GTG ACA -3′);AC(上游序列:5′-AGG GCA AGG GAG AGA TGC TA-3′,下游序列:5′-AGA GAG CCC CGG TTT GAT TG-3′);PKA(上游序列:5′-ACT TCC CGT TCC TGG TCA AAC TTG-3′,下游序列:5′-GGC TCG CTG AAC CTT CCA ATC C-3′);CREB(上游序列:5′-AAC TGA TTC CCA AAA ACG AAG G-3′,下游序列:5′-CAC TGC TAG TTT GGT AAA TGG G-3′)。
反应体系:根据TB Green®Premix Ex TaqTM说明书配制20 μL反应液,包括TB GREEN 10 μL,上、下游引物(10 mmol/L)各0.4 μL,ROX Reference Dye(50×)0.4 μL,cDNA 2 μL,灭菌水6.8 μL。反应条件:预变性(95 ℃ 30 s);PCR反应(95 ℃ 5 s,60 ℃ 30 s,循环40次);Melt Curve(95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s)。mRNA的表达水平以2-△△Ct表示,在Excel中计算出△Ct,△Ct=Ct(目的基因)-Ct(β-actin),再计算出2-△Ct,算出2-△Ct的平均值后,将每个2-△Ct除以2-△Ct的平均值,得出2-△△Ct。
1.4.4 大鼠海马区相关蛋白表达的Western blotting检测 取100 mg海马组织加150 μL裂解缓冲液,充分裂解后,冰上摇床30 min,4 ℃ 13 000 r/min离心10 min,提取上清总蛋白;用移液枪吸取2 μL总蛋白,在NanoDrop2000中测定蛋白浓度,重复3次,取平均值;将各组蛋白浓度定量为40 μg/15 μL,煮蛋白10 min;在上样孔上样后,采用80 V电压电泳;电泳结束后,进行转膜;将PVDF膜用5%脱脂奶粉封闭1 h,一抗(兔抗大鼠)、二抗(山羊抗兔)孵育后,用Amersham Imager 600显色并进行灰度值分析,蛋白的相对表达水平以目的抗体条带灰度值/β-actin条带灰度值表示。
1.5 统计学方法 采用t检验、方差分析和q检验。
2 结果
2.1 酒精依赖动物模型的建立 经过连续饮酒28次循环,模型组乙醇摄入量在最后7 d稳定在(6.58±0.41)g·kg-1·24 h-1,在最后7次饮酒之间的乙醇摄入量差异无统计学意义(P>0.05);乙醇偏好稳定在(63.61±2.16)%,在最后7次饮酒的乙醇偏好差异无统计学意义(P>0.05)。
2.2 DRD4/cAMP/PKA通路在酒精依赖大鼠海马区的mRNA表达情况 与正常对照组比较,模型对照组DRD4 mRNA明显升高(P<0.01),AC、PKA、CREB mRNA明显下降(P<0.01)(见表1)。
2.3 DRD4/cAMP/PKA通路在酒精依赖大鼠海马区的蛋白表达情况 与正常对照组比较,模型对照组DRD4蛋白表达水平明显升高(P<0.01),AC、PKA、CREB蛋白表达水平明显下降(P<0.01)(见图1、表2)。
2.4 体内转染24 h后大鼠海马区DRD4、AC、PKA、CREB mRNA的表达情况 在体内转染24 h后,SD-DRD4 siRNA组DRD4、CREB mRNA表达水平均低于SD-No siRNA组和SD-Ctr siRNA组(P<0.01),AC、PKA mRNA表达水平均高于siRNA组和SD-Ctr siRNA组(P<0.01)(见表3)。
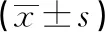
表1 酒精依赖大鼠海马区相关基因的mRNA相对表达情况

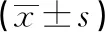
表2 酒精依赖大鼠海马区相关蛋白表达的灰度值分析
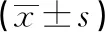
表3 体内转染24 h后海马区相关基因mRNA的相对表达情况
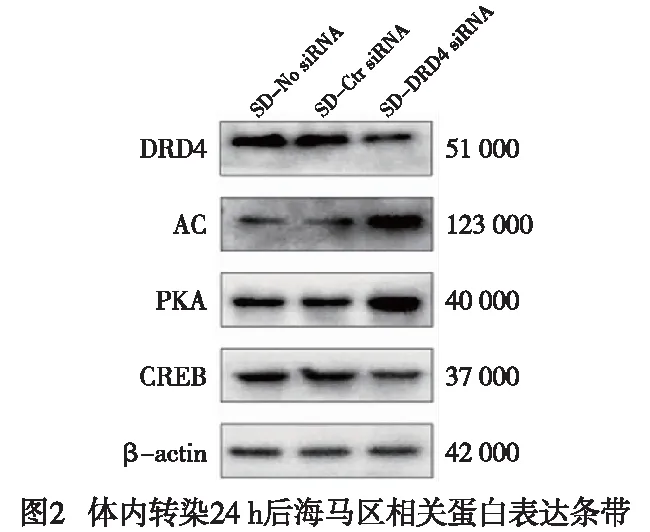
2.5 DRD4/cAMP/PKA途径在体内转染24 h后大鼠海马区蛋白的表达情况 在体内转染24 h后,SD-DRD4 siRNA组DRD4和CREB蛋白表达水平均低于SD-No siRNA组和SD-Ctr siRNA组(P<0.01),AC、PKA蛋白表达水平均高于siRNA组和SD-Ctr siRNA组,差异均有统计学意义(P<0.01)(见图2、表4)。
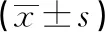
表4 酒精依赖大鼠海马区相关蛋白表达的灰度值分析
3 讨论
目前,有学者[9]研究发现多巴胺奖赏途径参与酒精依赖的形成,CLAY等[10]研究表明,长期饮酒会导致多巴胺奖赏途径的神经适应和神经内分泌反应性的增加。乙醇的奖励作用是由中脑多巴胺能奖赏系统的改变导致伏隔核、海马和杏仁核等多巴胺水平的增加所介导的,即当乙醇在药理学剂量下,激活中脑多巴胺能奖赏回路,增加伏隔核、海马和杏仁核中多巴胺的含量,引发对乙醇厌恶反应的减少和奖赏反应的相对增加[11-12]。中脑边缘多巴胺是一种具有5种受体亚型的神经递质,通过结合5个不同的受体参与奖赏反应,故多巴胺受体成为研究物质成瘾的重要靶标[13]。cAMP/PKA信号通路参与各种神经递质(5-羟色胺、乙酰胆碱、谷氨酸和多巴胺)的传递,并在认知功能中发挥重要作用[14]。据报道[15],cAMP/PKA信号转导通路介导与物质(乙醇、吗啡、尼古丁等)成瘾有关的行为反应。
本实验结果显示,在酒精依赖大鼠海马区,DRD4 mRNA及蛋白表达明显升高,这与TARASKINA等[16]的报道一致;AC、PKA、CREB mRNA及蛋白表达明显下降,这与MUNTEAN等[17]的报道一致。通过体内转染进行DRD4敲减,验证酒精依赖时DRD4与cAMP/PKA通路的调控关系后发现,在酒精依赖大鼠海马区,DRD4 mRNA及蛋白水平明显下降,AC、PKA、的mRNA及蛋白水平明显升高,CREB mRNA及蛋白仍然保持下降水平,这可能是由于磷酸化的CREB增加,例如,KONAR等[18]通过体内激肽释放酶8 siRNA转染发现在改善认知障碍时,海马区的PKA和磷酸化CREB增高。
综上所述,酒精依赖时,大鼠海马区DRD4高表达,AC、PKA、CREB低表达,敲减DRD4后,AC、PKA高表达。本研究结果表明酒精依赖中DRD4与cAMP/PKA通路具有调控关系,DRD4介导的cAMP/PKA通路可能在酒精依赖产生的神经适应性改变中发挥重要作用,可以为酒精依赖相关的神经生物学机制研究提供新思路。

