碳酸酐酶胞外酶影响下的岩溶湖泊微藻碳汇研究
李海涛 ,吴沿友 ,付 兵
(1. 贵州农业职业学院, 贵州 贵阳 551400;2. 中国科学院地球化学研究所,环境地球化学国家重点实验室, 贵州 贵阳 550081)
0 引 言
微藻是水生生态系统的初级生产者,是指一类生活在水中,营浮游生活方式的微小植物的总称。碳酸酐酶(Carbonic anhydrase, CA) (EC4.2.1.1)是一种含Zn 的金属酶,它具有高效、专一地快速催化CO2和HCO3-之间的相互转化的特点,在无CA 的条件下,CO2和HCO3-之间的平衡需要一分钟;而在有CA 催化的条件下,CO2和HCO3-之间的平衡只需要10-6秒[1]。碳酸酐酶在促进大气CO2水合反应进入水体中具有重要作用,其次,碳酸酐酶在促进碳酸盐岩溶蚀,加速水生植物光合作用等方面都具有重要意义[2-7]。
岩溶碳汇是指以微藻为代表的水生生物吸收利用碳酸盐岩溶蚀的以HCO3-为代表的无机碳的过程。岩溶湖泊水体的溶质大多受流域的溶蚀作用的控制,水-岩-气之间存在天然的相互转化,且它们之间始终处于动态平衡之中(CaCO3+CO2+H2O ↔Ca2++HCO3-+CO32-+H+),并最终影响气候变化[3,5,8]。岩溶地区水体的pH 大多为弱碱性(pH 介于7.2~8.5之间),且具有广泛的时空异质性[2]。不同的pH 和HC浓度的岩溶水体环境,能够显著地影响水体微藻的种群结构[9-10]。
岩溶湖泊微藻属于自然状态下的多种微藻的混合物。本研究区域的红枫湖已发现微藻种类有7门102 种(属),具有明显的种群多样性[11]。从时间上看,微藻类群具有典型的季节更替规律,春夏以绿藻为主、秋季开始,硅藻开始增加[5];从空间上看,微藻存在地域的异质性,张陶等[4]发现广西上林县大龙洞岩溶水库中,发现微藻种类有5 门17 属 ,由于气候、地质背景和岩溶等共同作用所带来的水环境差异,造成自然水体的微藻种群差异较大。总之,湖泊微藻也存在典型的季节性周期波动和空间的异质性。
岩溶流域自然水体常出现高浓度的重碳酸盐和低浓度的溶解二氧化碳,这严重影响着以微藻为代表的水生浮游植物的生长。微藻为应对岩溶流域的水体环境,慢慢进化出了通过碳酸酐酶来加快无机碳代谢过程的方法。不同微藻的碳酸酐酶的活力差异悬殊,碳酸酐酶胞外酶活性强的微藻能够敏感捕捉进入水体的大气CO2,并快速被微藻的光合作用所利用(即光合碳汇)。而碳酸酐酶活性弱的微藻,在无机碳的转化利用方面存在严重不足。由于不同微藻的碳酸酐酶活性差异较大,并由此带来了不同种属微藻生长的巨大差异,进而影响微藻的光合碳汇能力差异悬殊。
稳定碳同位素组成分析 (δ13C)是一种区分不同无机碳来源的重要手段[12-14]。在无碳酸酐酶催化的条件下,微藻吸收利用重碳酸盐(HCO3-)的过程会产生大约10‰的稳定碳同位素分馏[15];然而,由碳酸酐酶胞外酶催化的碳酸氢根离子的转运过程只存在约1.1‰的碳同位素分馏[16]。结合已有研究获知,在微藻吸收利用重碳酸盐的过程中,因碳酸酐酶胞外酶的催化与否,两者之间存在约9‰的稳定碳同位素分馏差异[17]。因此,通过稳定碳同位素技术来识别各种微藻碳酸酐酶胞外酶的差异具有可行性。
本研究通过向微藻培养液中添加不同浓度的碳酸酐酶胞外酶特异性抑制剂乙酰唑胺(Acetazolamide,AZ),来模拟岩溶湖泊水体中碳酸酐酶胞外酶活性差异悬殊的各种微藻。通过向培养液中添加两种δ13C差异较大的碳酸氢钠来模拟岩溶地区自然水体中固有的(即碳酸盐岩溶蚀产生的)HCO3-,利用双同位素示踪模型,区分出微藻利用水体中固有的HCO3-和利用大气CO2两种来源[18],并结合微藻的生物量,分别定量计算微藻的岩溶碳汇和光合碳汇,来探讨自然水体中的不同微藻对不同碳汇的贡献。
1 材料与方法
1.1 实验材料
本研究选择西南岩溶区域-贵阳市著名的红枫湖(N26°26′- N26°35′,E106°19′- E106°28′)为研究对象,使用浮游生物网多点采集湖泊表层水体中的微藻样品。打捞到的湖泊微藻尽快带回实验室,去除杂质,作为实验处理的储备藻种。
1.2 实验设计
微藻培养液采用改良的SE 液体培养基,通过添加少量NaOH 或HCl 调节灭菌后的各个处理液pH值都稳定在8.0±0.1。培养条件如下:光照强度200 umol · m-2· s-1,光照12 h,温度保持在22.0±1.0 ℃;夜间12 h,温度保持18.0±1.0 ℃。碳酸氢钠浓度设置参照红枫湖水体中的可溶性无机碳(Dissolved Inorganic Carbon, DIC)含量,多年观测普遍在1.6~2.7 mmol · L-1之间,本研究取多年观测的平均值,设置为2.2 mmol · L-1,所添加的标记的两种碳酸氢钠的δ13C 值分别为-17.4‰和-28.4‰,乙酰唑胺(Acetazolamide, AZ)浓 度 梯 度 设 置:0,0.5 mmol · L-1,1.0 mmol · L-1,2.0 mmol · L-1,10.0 mmol · L-1。
岩溶湖泊微藻新鲜储备液经充分混合均匀,并严格控制各个处理的初始微藻接种量,尽可能消除微藻浓度及种群的差异,以便精确探讨AZ 浓度梯度实验处理对岩溶湖泊微藻稳定碳同位素组成的影响。各个实验处理同时同批次平行培养6 瓶,培养周期为5 d。且在实验处理过程中,不断随机调换位置,以消除培养室局部的温度、光照差异对微藻生长的影响。
1.3 微藻蛋白质含量的测定及生物量增殖倍数
微藻蛋白质含量的测定采用考马斯亮蓝比色法[19]。为了更直观地比较各个处理下的微藻增殖情况,本研究采用微藻蛋白质含量的增殖倍数(M)的形式来表示微藻的生长情况,具体如下:
式中:Ne为处理结束时的微藻蛋白质含量;N0为处理开始时的微藻蛋白质含量。
1.4 稳定碳同位素的测定
离心收集处理后的微藻样品,加入适量1.0 mol · L-1盐酸洗涤微藻,以去除微藻表面所携带的无机碳的影响,接下来用超纯水多次洗涤、离心收集待测微藻,直至中性。最后,用冷冻干燥仪充分干燥待测微藻样品。
稳定碳同位素的测定方法参照参考文献[20],最后以δ13C(Pee Dee Belemnite, PDB)的形式表示。
1.5 微藻的岩溶碳汇和光合碳汇
本研究基于实验处理后的微藻稳定碳同位素组成的信息,通过构建双同位素示踪模型,计算出了微藻吸收利用培养液中添加的碳源份额fB[18]。
结合实验处理前后,微藻的生物量增殖倍数M。分别计算出微藻的岩溶碳汇能力(CSk)和光合碳汇能力(CSp),具体如下:
式中:CSk为岩溶碳汇能力;CSp为光合碳汇能力;M为微藻生物量的增殖倍数;fB微藻吸收利用培养液中添加碳源的份额。
2 结果与讨论
2.1 碳酸酐酶胞外酶对微藻生物量的影响
如表1 所示,在添加碳酸酐酶胞外酶特异性抑制剂(AZ)处理下,受添加AZ 浓度增加影响,藻液的蛋白质含量呈不断下降的趋势。各个实验处理的微藻初始接种时的蛋白质浓度都严格控制在0.50 mg · L-1附近,实验处理5 d,未添加AZ 处理的藻液蛋白质浓度增长到了3.07±0.15 mg · L-1,而添加10.0 mmol · L-1AZ 处理的微藻增长缓慢,藻液蛋白质浓度仅达到了1.05±0.37 mg · L-1,两者之间差异显著(n=3, P<0.05)。由此可见,在微藻碳酸酐酶胞外酶活性强的条件下,能够显著促进微藻的生长。随着添加AZ 浓度的增加,微藻的碳酸酐酶胞外酶活性受到了越来越大的抑制。徐涛等[21]通过研究AZ 对莱氏衣藻光合放氧和生长的影响,也得到了同样的抑制效果。
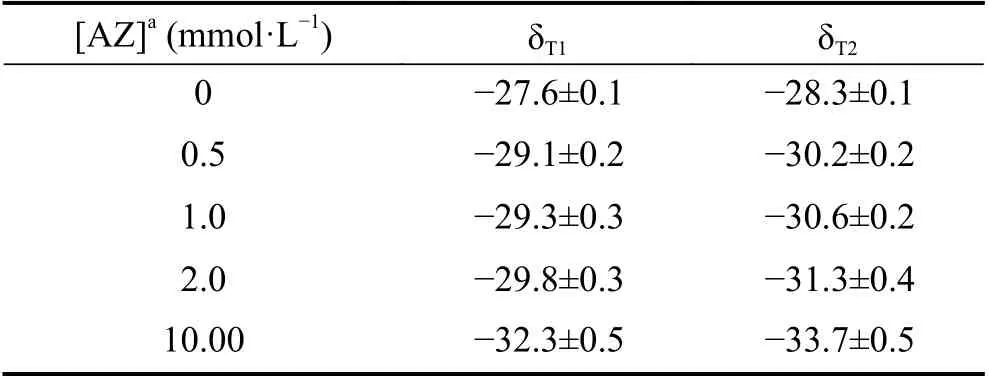
表1 AZ 浓度梯度处理下的微藻碳同位素组成(‰, PDB)Table 1 δ13C value of the microalgae under different concentrations of AZ (‰, PDB)
本研究发现,以添加2.0 mmol · L-1AZ 的浓度处理为分界线,各个处理间的微藻蛋白质含量达到了差异显著(n=3, P<0.05)。总之,添加AZ,碳酸酐酶胞外酶受到了抑制,微藻的生长受到了影响,随着添加AZ 浓度的增加,其对微藻生长影响带来了显著的差异,直至AZ 在培养液中达到过饱和状态(10.0 mmol · L-1),AZ 对微藻碳酸酐酶胞外酶活性的抑制能力达到了上限,其对微藻生长的影响也达到了最大(图1)。
2.2 碳酸酐酶胞外酶对微藻稳定碳同位素组成的影响
从处理后的微藻稳定碳同位素组成来看,微藻δ13C 值随添加AZ 浓度的增加,呈不断偏负的趋势(表1),尤其是在添加高浓度AZ 条件下,对微藻藻体的δ13C 值影响最大。与未添加AZ 条件下的微藻δ13C 相比,添加高浓度AZ,微藻δ13C 偏负约5‰。结合相关研究,添加高浓度AZ 处理下,纯培养的莱茵衣藻和蛋白核小球藻的稳定碳同位素分馏-9‰左右[17]。相同的是:添加AZ,对微藻δ13C 都是产生偏负的影响;不同的是:AZ 对微藻δ13C 产生的影响程度跟微藻本身固有的碳酸酐酶活性有关,微藻碳酸酐酶活性越强,AZ 对其产生的影响越大。岩溶湖泊微藻属于多种微藻的混合物,既有以绿藻为代表的碳酸酐酶胞外酶活性强的微藻,也有以硅藻为代表的碳酸酐酶胞外酶活性微弱的微藻,甚至还存在以铜绿微囊藻等为代表的没有碳酸酐酶的微藻[21]。总之,岩溶湖泊微藻的碳酸酐酶胞外酶活性远低于室内纯培养的莱茵衣藻的碳酸酐酶胞外酶活性。
2.3 微藻碳酸酐酶胞外酶对不同碳源利用及碳汇能力估算
随着添加AZ 浓度的增加,微藻利用培养液中添加的无机碳的比例(fB)呈增长态势(表2),未添加AZ 条件下,微藻利用无机碳的比例是0.06;添加高浓度AZ 条件下,微藻利用无机碳的比例最高达到了0.14。但是,微藻对添加无机碳的利用比例普遍较低。由此可知,岩溶湖泊微藻所利用的碳源主要来自大气CO2,它占到了微藻利用总无机碳份额的94%。碳酸酐酶对岩溶系统碳碳循环具有明显的驱动作用[22],且碳酸酐酶胞外酶主要是促进微藻利用大气无机碳源,并快速增加微藻进行光合作用的能力[4-5]。总之,微藻碳酸酐酶胞外酶能够促进微藻的光合碳汇能力(CSp)。[AZ]a-培养液中添加的AZ浓度; M-微藻生物量的增殖倍数; fB-微藻吸收利用培养液中添加的碳源的份额 ;CSk-岩溶碳汇能力; CSp-光合碳汇能力; P-相比于未添加AZ的湖泊自然状态下的微藻碳汇能力的比例。

表2 AZ 浓度梯度处理下的微藻对不同碳源的利用及碳汇估算Table 2 Utilization of different carbon source and estimation of carbon sinks by microalgae under different concentrations of AZ
基于以上结果,获得了微藻对添加无机碳的利用比例,结合处理期间,以微藻蛋白质为代表的生物量净增加数据,我们估算出了不同碳酸酐酶胞外酶活力条件下的微藻碳汇能力。在岩溶湖泊的自然水体中,碳酸酐酶胞外酶活性强的微藻碳汇能力是缺乏碳酸酐酶胞外酶的微藻碳汇能力的5 倍。碳酸酐酶胞外酶对微藻碳汇能力的影响显著。蒋忠诚等对水生植物体光合固碳效应的研究也获得了生物过程的参与,加快了岩溶区碳汇的贡献[23]。
3 结 论
本研究基于双同位素示踪技术,通过构建计算模型,量化出了微藻对添加无机碳的利用比例,并获得了微藻对大气碳源的吸收利用比例。通过添加不同浓度的碳酸酐酶胞外酶特异性抑制剂AZ,模拟了碳酸酐酶胞外酶活性差异的各类微藻,并获得了不同微藻对大气碳源的利用能力差异悬殊。
岩溶湖泊水体中,虽然固有的重碳酸盐含量很高,但是,微藻利用的无机碳依然是主要来自于大气二氧化碳(光合碳汇),而只是少量利用水体中固有的重碳酸盐(岩溶碳汇)。碳酸酐酶胞外酶的主要贡献是加快微藻对大气二氧化碳的吸收利用及转化效率,最终达到了促进微藻的生长,固碳增汇。这对人类科学选择利用碳酸酐酶胞外酶活性强的微藻来增加碳汇,服务于“碳中和”国家战略,具有重要现实意义。

