阿替普酶早期静脉溶栓治疗急性脑梗塞的疗效观察
周博华
(平顶山市第一人民医院 急诊科,河南 平顶山 467000)
急性脑梗塞属于缺血性脑血管疾病,具备起病迅速、病情发展速度快等特点,部分患者还可出现不同程度的神经功能缺损情况,不仅患病率日益增长,同时存在较高的致残率与病死率,成为危害人们生命的急危重症[1-2]。由于急性脑梗塞是因多种原因导致脑供血不足,且脑功能受损,使得脑部缺血坏死。若未能够尽快予以合适的救治方式,可造成严重后果,给患者身心健康造成威胁,甚至降低生活质量[3-4]。针对此,目前临床治疗方案较多,例如调节水电解质、抗血小板、降颅内压、营养神经、脱水降脂等,如何选择成为关键。随着医学技术的进步,研究指出阿替普酶早期静脉溶栓的效果更好,其中静脉溶栓作为疾病治疗的常见方式,能够改善脑组织血流灌注情况,同时促进神经功能恢复,加上阿替普酶能够刺激血栓位置的纤溶酶原,使血栓尽快溶解,进一步改善神经功能缺损的情况,在改善预后上具有积极作用[5-6]。但部分学者对其安全性存在争议,本文对此展开分析,选择平顶山市第一人民医院接收的70例急性脑梗塞患者纳入试验,探究阿替普酶早期静脉溶栓运用在急性脑梗塞中的价值,结果阐述如下。
1 资料与方法
1.1 一般资料
经回顾性分析法将2020年7月至2022年1月本院接收的70例急性脑梗塞患者纳入试验,将其中35例接受阿替普酶早期静脉溶栓治疗者归于研究组,另35例开展常规治疗者归于对照组。研究组男19例,女16例;年 龄44~75岁,平 均(62.18±3.26)岁;体 重52~80 kg,平均(69.85±2.45)kg。对照组男17例,女18例;年龄45~73岁,平均(62.77±3.45)岁;体重50~77 kg,平均(7.11±2.60)kg。两组基础信息相比差异无统计学意义(P>0.05)。本研究经本院伦理委员会审核通过。
纳入标准:发病至治疗时间不超出6 h;符合《中国脑血管病防治指南》[7]中诊断标准;经核磁共振、头颅CT等检查确诊;病历资料完整。
排除标准:合并凝血功能障碍、免疫性疾病者;存在溶栓禁忌症;对药物过敏;试验前接受其他治疗者;出血性转化者。
1.2 方法
对照组实施常规治疗,包括调节水电解质、抗血小板、降颅内压、营养神经、脱水降脂等,例如拜阿司匹林(拜耳医药保健有限公司;国药准字HJ20160685;100 mg),首 次 给 药300 mg/次,1次/d,第2 d开 始100 mg/次,1次/d,口服;阿托伐他汀(福建东瑞制药有限公司;国药准字H20193043;10 mg),40 mg/次,1次/d,口服;氯吡格雷(南京正大天晴制药有限公司;国药准字H20203269;75 mg),首次给药300 mg/次,1次/d,第2 d开始75 mg/次,1次/d,口服。
研究组基于对照组上,应用阿替普酶早期静脉溶栓,阿替普酶(Boehringer Ingelheim Pharma GmbH & Co. KG,S20020035,50 mg),按0.9 mg/(kg·d)剂 量 进行 溶 栓,其 中10%静 推,1 min之 内;余 下90%静滴,1 h之内。2~4 h后确定无脑出血后,给予拜阿司匹林100 mg/次,1次/d,口服;阿托伐他汀钙片40 mg/次,1次/d,口服;氯吡格雷75 mg/次,1次/d,口服。
两组持续服药21 d。
1.3 观察指标
(1)服药21 d后评价治疗有效率,显效:体征恢复,可正常生活及工作,神经功能缺损(NIHSS)评分改善75%以上;好转:体征基本恢复,基本可独立生活,NIHSS评分改善55~75%;无效:未达到上述结果。治疗有效率=(显效例数+好转例数)/总例数×100%[8]。
(2)服药前后清晨抽取患者空腹静脉血(3 mL),按3000 r/min速度离心,10 min后取血浆,选择全自动血凝仪,严格遵照凝固法测定凝血酶时间(TT)、凝血酶原时间(PT)、部分凝血酶时间(APTT)。
(3)服药前后清晨抽取患者空腹静脉血(3 mL),按3000 r/min速度离心,10 min后分离血清,按酶联免疫吸附法检测超敏C反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、内皮素(ET)、一氧化氮(NO)。
(4)统计两组不良反应(皮下出血、消化道出血、泌尿系统出血、牙龈出血)。
(5)服药前后评价神经功能缺损(NIHSS)评分,0~15分轻度神经缺损;16~30分中度;31~45分严重[9],同时测量甘油三酯(TG)、胆固醇(TC)。
(6)服药前后选择全自动血液流变仪检测纤维蛋白原、血浆黏度、低切与高切黏度。
1.4 统计学处理
全文数据选择SPSS 20.0系统计算,x±s为计量数据,选择t检验;%为计数数据,选择χ2检验,P<0.05为数据存在统计学差异。
2 结 果
2.1 两组治疗有效率比较
研究组治疗有效率(88.57%)大于对照组(68.57%),差异有统计学意义(P<0.05)。见表1。
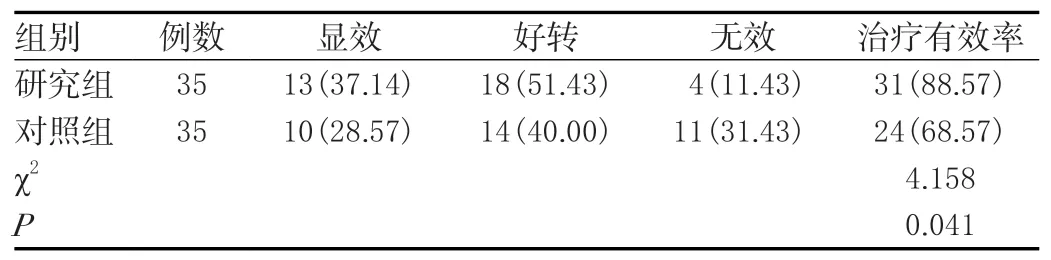
表1 两组治疗有效率比较[n(%)]
2.2 两组凝血功能变化比较
两组服药前凝血功能差异无统计学意义(P>0.05),服药后研究组TT、PT、APTT均大于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组凝血功能变化比较(±s)单位:s
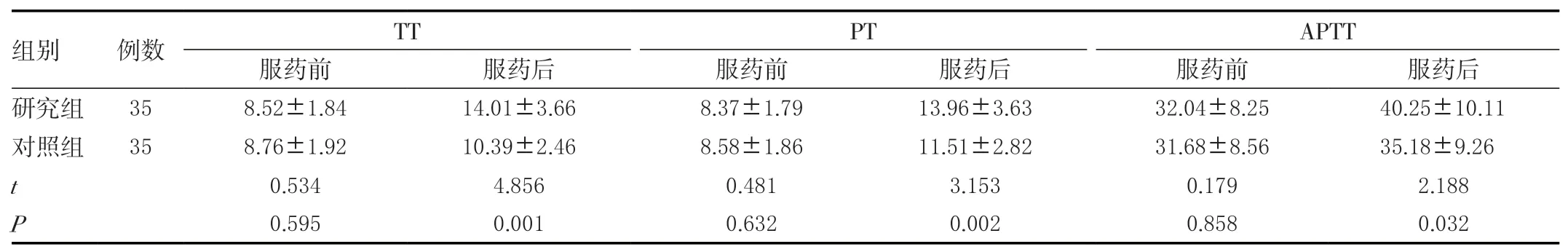
表2 两组凝血功能变化比较(±s)单位:s
组别 例数 TT PT APTT服药前 服药后 服药前 服药后 服药前 服药后研究组 358.52±1.8414.01±3.668.37±1.7913.96±3.6332.04±8.2540.25±10.11对照组 358.76±1.9210.39±2.468.58±1.8611.51±2.8231.68±8.5635.18±9.26 t 0.5344.8560.4813.1530.1792.188 P 0.5950.0010.6320.0020.8580.032
2.3 两组炎性指标变化比较
两组服药前炎性指标差异无统计学意义(P>0.05),服药后研究组hs-CRP、TNF-α、IL-1β均小于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组炎性指标变化比较(±s)
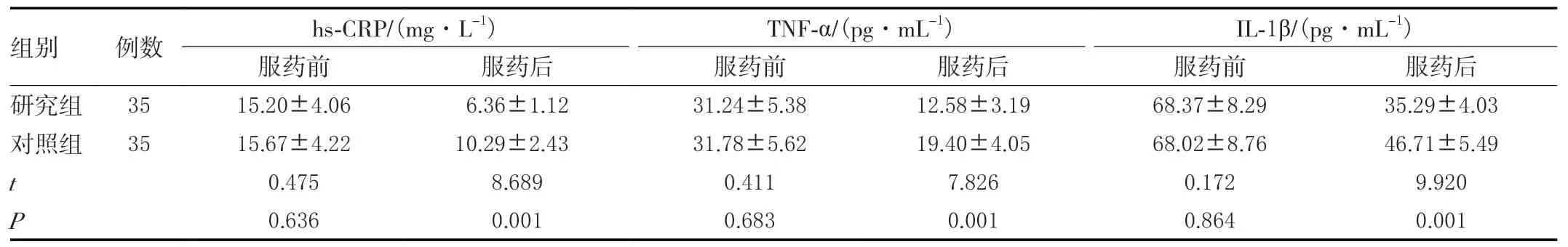
表3 两组炎性指标变化比较(±s)
组别 例数 hs-CRP/(mg·L-1) TNF-α/(pg·mL-1) IL-1β/(pg·mL-1)服药前 服药后 服药前 服药后 服药前 服药后研究组 3515.20±4.066.36±1.1231.24±5.3812.58±3.1968.37±8.2935.29±4.03对照组 3515.67±4.2210.29±2.4331.78±5.6219.40±4.0568.02±8.7646.71±5.49 t 0.4758.6890.4117.8260.1729.920 P 0.6360.0010.6830.0010.8640.001
2.4 两组不良反应比较
研究组不良反应(11.43%)与对照组(28.57%)相比,差异无统计学意义(P>0.05)。见表4。
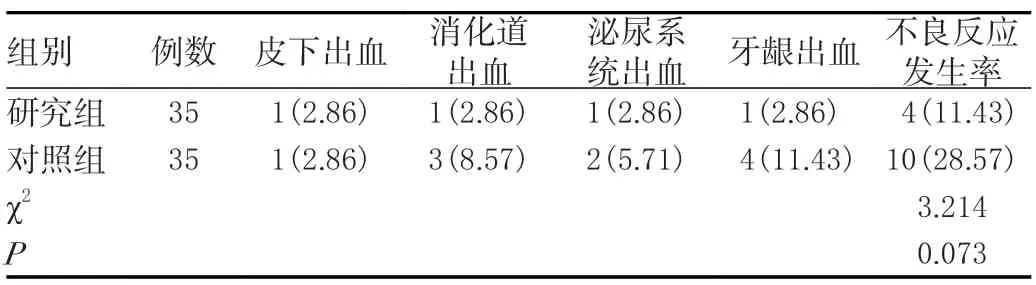
表4 两组不良反应比较[n(%)]
2.5 两组NIHSS评分及血脂变化比较
两组服药前NIHSS评分及血脂差异无统计学意义(P>0.05),服药后研究组NIHSS、TG、TC均小于对照组,差异有统计学意义(P<0.05)。见表5。
表5 两组NIHSS评分及血脂变化比较(±s)
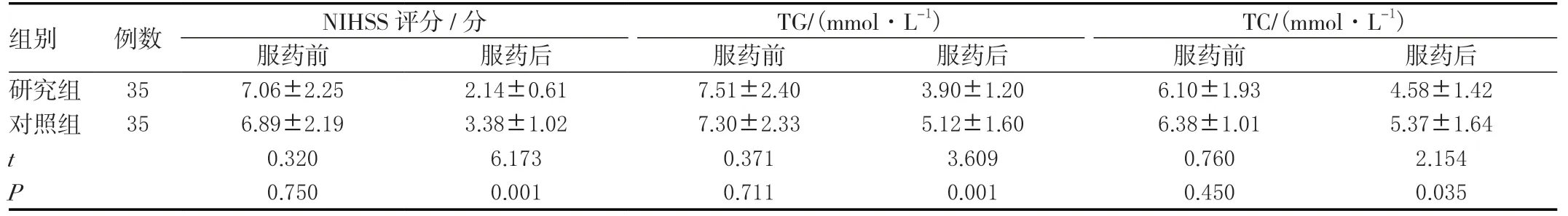
表5 两组NIHSS评分及血脂变化比较(±s)
组别 例数 NIHSS评分/分 TG/(mmol·L-1) TC/(mmol·L-1)服药前 服药后 服药前 服药后 服药前 服药后研究组 357.06±2.252.14±0.617.51±2.403.90±1.206.10±1.934.58±1.42对照组 356.89±2.193.38±1.027.30±2.335.12±1.606.38±1.015.37±1.64 t 0.3206.1730.3713.6090.7602.154 P 0.7500.0010.7110.0010.4500.035
2.6 两组血管内皮功能变化比较
两组服药前血管内皮功能差异无统计学意义(P>0.05),服药后研究组ET小于对照组,但NO大于对照组,差异有统计学意义(P<0.05)。见表6。
表6 两组血管内皮功能变化比较(±s)

表6 两组血管内皮功能变化比较(±s)
组别 例数 ET/(ng·L-1) NO/(μmol·L-1)服药前 服药后 服药前 服药后研究组 3581.26±7.3561.54±4.2340.79±6.3455.81±9.06对照组 3581.80±7.1470.91±5.1141.20±6.2849.34±7.22 t 0.3128.3560.2723.304 P 0.7560.0010.7870.002
2.7 两组血液流变学变化比较
两组服药前血液流变学指标差异无统计学意义(P>0.05),服药后研究组纤维蛋白原、血浆黏度、低切与高切黏度均小于对照组,差异有统计学意义(P<0.05)。见表7。
表7 两组血液流变学变化比较(±s)
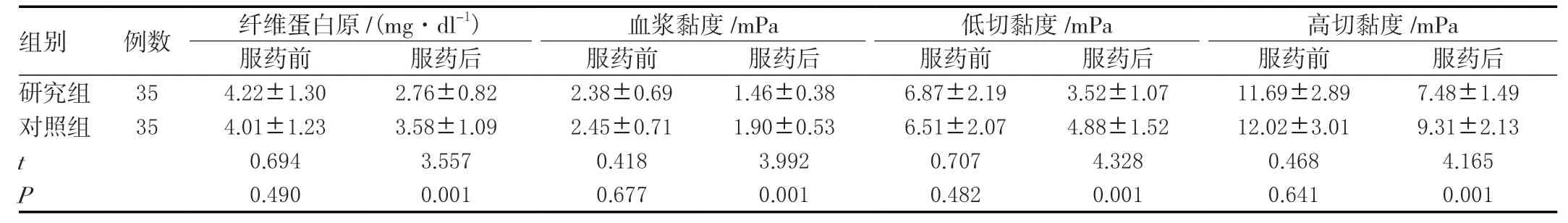
表7 两组血液流变学变化比较(±s)
组别 例数 纤维蛋白原/(mg·dl-1) 血浆黏度/mPa 低切黏度/mPa 高切黏度/mPa服药前 服药后 服药前 服药后 服药前 服药后 服药前 服药后研究组 354.22±1.302.76±0.822.38±0.691.46±0.386.87±2.193.52±1.0711.69±2.897.48±1.49对照组 354.01±1.233.58±1.092.45±0.711.90±0.536.51±2.074.88±1.5212.02±3.019.31±2.13 t 0.6943.5570.4183.9920.7074.3280.4684.165 P 0.4900.0010.6770.0010.4820.0010.6410.001
3 讨 论
据有关数据显示[10],脑梗塞的发生率占据全部脑卒中的80%左右,且病死率较高,患者预后较差,成为危及生命的常见病。急性脑梗塞通常表示患者脑部血液供应受阻,从而使脑组织因缺血缺氧后坏死[11]。该病的患病率逐年升高,一旦发生后,可造成局部缺血组织坏死,导致神经胶质细胞、神经元细胞破裂,甚至使缺血组织周边出现缺血半暗带,给患者神经功能造成一定伤害[12]。针对此,应尽快选择合适的救治方式,以此挽救患者生命,促进其神经功能恢复,同时提高生活质量,保障预后[13]。
既往,临床多选择常规治疗如调节水电解质、抗血小板、降颅内压、营养神经、脱水降脂等治疗急性脑梗塞,虽然取得过一定的应用效果,但效果不佳,无法快速改善脑组织血流灌注状态,甚至延长治疗周期,不利于病情尽快稳定[14-15]。随着临床研究的不断深入,发现除了上述常规治疗之外,采取阿替普酶早期静脉溶栓的效果更好,可弥补常规治疗的局限性,进一步提升整体疗效,但部分学者对其疗效及安全性存在较大争议[16]。本文结果显示:研究组治疗有效率大于对照组,差异有统计学意义(P<0.05);但两组不良反应差异无统计学意义(P>0.05);两组服药前凝血功能、炎性指标、NIHSS、血脂、血管内皮功能、血液流变学指标差异无统计学意义(P>0.05),服药后研究组各指标均优于对照组,差异有统计学意义(P<0.05),上述结果说明研究组疗效更好,可减轻炎性反应,增强神经功能,不良反应少,还可降低患者血脂及血液流变指标,促进血管内皮功能以及凝血功能改善,安全性更高。经分析发现静脉溶栓主要是利用静滴或者静注的途径给药,能够改善患者脑部组织的血流灌注以及缺血情况。此外阿替普酶作为重组组织型纤溶酶原激活剂,也属于转基因技术合成的药物,进入机体后能够与血栓内纤维蛋白组成复合体,从而使患者神经功能好转,最大程度地救治半暗带区域脑组织,使其血流恢复,同时可发挥溶解血栓的功能[17-19]。加上急性脑梗塞发展期间,患者通常伴有不同程度的神经功能缺损情况,经阿替普酶溶栓后,可有效改善患者因缺血缺氧导致的神经缺损状况,使得脑损伤尽快好转[20]。此外,由动脉粥样斑块破裂引起的凝血途径激活在产生血栓上意义重大,其中凝血途径激活期间可能受到各类凝血因子的干扰,加上凝血因子的作用,血栓可被激活,从而使机体中凝血功能亢进,有效缩短了凝血时长[21]。但通过阿替普酶的静脉溶栓治疗,可改善患者凝血功能,防止凝血因子被激活,有效延长凝血时间,最终导致凝血功能指标改善。除此之外,患者脑组织受损后,分析其神经胶质细胞与神经元细胞受损的原因,还可与炎性反应以及氧化反应存在密切关系,例如氧化反应中,因局部缺氧可导致氧自由基出现,并引起神经功能受损[22-23]。此时阿替普酶作为纤维蛋白特性溶栓药物,其中赖氨酸残基能够和血栓内纤维蛋白发生结合反应,并构成纤溶酶原,从而溶解血栓,有效减轻炎性反应,达到快速控制病情的作用[24-25]。TT、PT、APTT属于评价机体凝血机制平衡的主要指标,本文结果中看到研究组服药后的TT、PT、APTT均较对照组延长,这说明阿替普酶早期静脉溶栓在调节患者凝血功能上的效果明显。另外,局部缺氧可导致大量氧自由基出现,而氧自由基又可分泌多种炎性细胞,使得hs-CRP、TNF-α、IL-1β等炎性介质产生,造成炎症性损害。但上述结果看到,研究组服药后的hs-CRP、TNF-α、IL-1β均较对照组更低,进一步证实了阿替普酶早期静脉溶栓能够减轻炎性反应。由此看出,阿替普酶早期静脉溶栓的疗效更好,值得应用。综上所述,阿替普酶早期静脉溶栓的效果更为理想,能够调节患者凝血功能,清除炎性反应,不良反应少,还可改善患者神经功能,增强血管内皮功能,控制血脂,促进血液流变学指标改善。

