不同调理剂作用下的污泥生物干化有机质降解研究
王新雨 ,王 侃 ,郑国砥 ,陈 颖 ,蔡 璐,4*
(1.宁波大学 土木工程与地理环境学院,浙江 宁波 315211;2.中国科学院地理科学与资源研究所 环境修复中心,北京 100101;3.中国科学院大学 资源与环境学院,北京 100049;4.宁波市应急管理局,浙江 宁波 315042)
近年来,我国市政污泥产量急剧增加,市政污泥含水率和有机质含量高、易腐、含有大量病原微生物,未经处理的污泥随意堆放易造成二次污染,影响环境且危害人体健康[1].目前生物干化是处理和利用污泥的有效办法,其特点是不需外加能源,利用有机物降解产生的生物热促进水分蒸发,快速去除水分[2].生物干化过程与好氧堆肥相似,都是基于好氧发酵原理的生物处理方式,前者旨在快速实现脱水减量,产物可作为生物质燃料、土壤改良剂等实现资源化利用[3-4],后者侧重于堆肥产品的稳定性和成熟度,用于生产满足施用标准的有机肥[5].因此,生物干化被认为是实现污泥减量化及资源可持续利用的理想选择[6].
由于污泥含水率高、碳氮比低,生物干化中常添加调理剂调节堆体间隙率和物料含水率,并优化碳氮比,从而提升干化效果[7].近年来,有研究使用有机调理剂如锯末、秸秆、稻草等取得较好效果[8-10],然而此类有机调理剂在生物干化过程中会逐渐降解,难以有效筛分,增加成本,在收集、运输方面存在困难以及安全隐患,故其应用受到限制[11].因此,可重复使用的调理剂逐渐受到关注,有研究使用浮石、可回收塑料、陶粒等作为调理剂对污泥进行好氧堆肥,均达到较好的效果[12-14].近年来,TiO2由于其低毒性、高化学稳定性被广泛应用于环境有机污染物的降解、水污染中蛋白质的光降解[15-16].基于此,本研究采用硅酸盐基可循环调理剂(T1 组)、负载TiO2的可循环调理剂(T2 组)、陶粒(T3 组)对污泥进行生物干化.
有机质组分含量变化可反映生物干化效率,表征干化进程,而生物干化堆体物料中有机质的降解受微生物分泌的各类特定功能酶的调控[17].特定酶活性的变化可以反映特定物质代谢速度和与之相关的微生物活动的强弱,也可以在一定程度上反映产物的腐熟程度[18-19].
本研究将污泥、餐厨垃圾协同进行生物干化,分别使用可循环调理剂、负载TiO2的可循环调理剂、陶粒调理剂,测定理化参数、酶活性指标、有机质各组分含量,评价生物干化效果,总结生物干化过程中不同阶段的酶活性以及有机质含量变化影响,明确相关酶活性与有机物含量降解变化规律,为进一步优化生物干化工艺提供酶活调控参数[20].
1 材料与方法
1.1 试验材料
研究所用堆肥物料包括污泥、餐厨垃圾、锯末、陶粒、可循环调理剂、负载TiO2的可循环调理剂.实验在宁波大学实验室进行,研究所用污泥为宁波市某污水处理厂离心脱水污泥;餐厨垃圾取自宁波大学食堂,为1 cm 的碎料,以便获得均匀的粒度在反应器中进行充分混合;锯末直径为0.2 cm,陶粒直径为1.5 cm,均购于江苏省镇江市.所用的可循环调理剂为实验室自行研制,为边长3 cm 的立方体,由硅酸盐、火山岩、沙子、偏高岭土和生物炭组成(负载TiO2的可循环调理剂是将锐钛矿晶型纳米TiO2与去离子水经超声分散混合为乳浊液涂刷在调理剂表面,烘干后进行反复涂刷、自然风干、碰撞测试操作,直至调理剂表面形成牢固附着的TiO2涂层).所用原料的理化性质见表1.
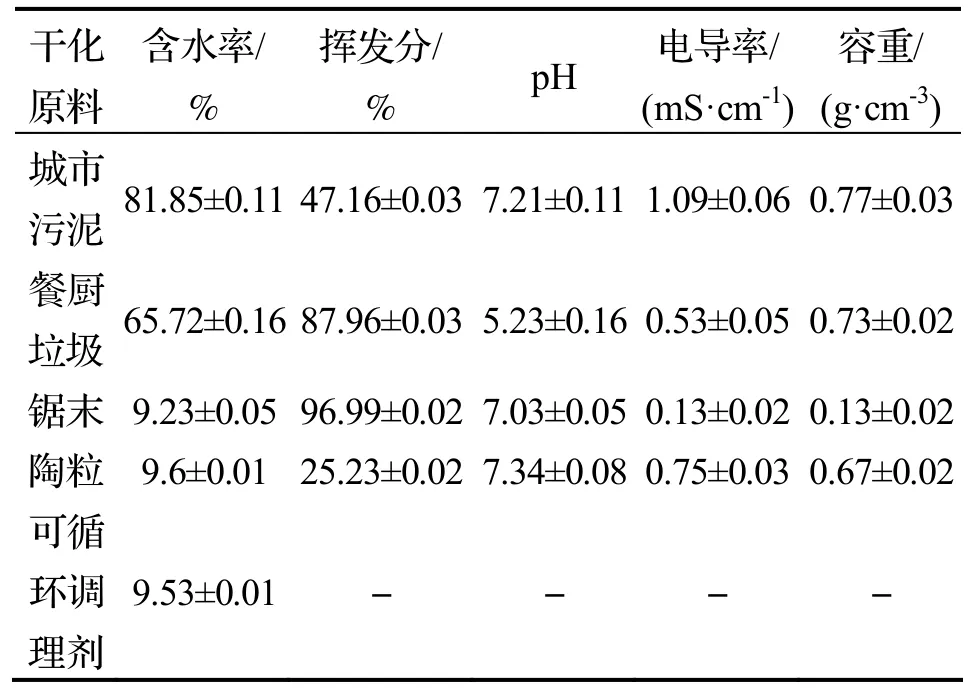
表1 堆体物料的理化性质
1.2 试验设计
分别在3 个发酵桶中建立3 组堆体(T1、T2、T3),发酵桶为圆柱状高密度聚乙烯材料反应器,有效容积50 L,底部为开孔率20%的不锈钢隔板.T1 原料为污泥、餐厨垃圾、锯末、可循环调理剂;T2原料为污泥、餐厨垃圾、锯末、负载TiO2可循环调理剂;T3 原料为污泥、餐厨垃圾、锯末、陶粒.均以3:1:1:1 混合质量比组成.T1、T2、T3 初始含水率分别为64.31%、65.81%、65.32%.在21 d 的生物干化周期内,每3 d 进行一次翻抛和取样,采用鼓风机间歇性曝气,通风量为0.15 m3·(min·m3)-1,通风周期为通风开启15 min,关闭45 min,21 d 内重复循环.
1.3 分析方法
在生物干化过程中,每3 d 从堆体的上、中、下层取料混匀后测其理化性质(使用温度计每天测定两次温度,多点测定取平均值).测定参数均设置3 个重复样.试验中理化指标、酶活性、有机质组分含量测定方式见表2.

表2 试验各参数测定方式
2 结果与讨论
2.1 常规指标
2.1.1 温度
生物干化过程中各堆体温度变化如图1 所示.3 个堆体在生物干化过程中温度均呈先升高后降低的趋势,生物干化初期,微生物逐渐分解有机物,释放大量热量使堆体迅速升温,T1、T2、T3 分别在第3、3、2 d 到达了高温期(50 ℃以上),峰值分别为59.7、61.2、62.2 ℃.3 组堆体维持在高温期的时间分别为6、6、5 d,且最高温度达到60 ℃左右,有利于杀灭病原菌和寄生虫卵[25].生物干化经历高温期后逐渐趋于室温.

图1 生物干化过程中温度变化
2.1.2 含水率
在生物干化过程中,高温及通风操作使堆体水分蒸发,堆体含水率总体呈下降趋势(图2),T1、T2、T3 的含水率由64.3%、65.8%、65.3%分别降至最终的52.9%、51.2%、53.3%,水分去除率分别为17.8%、22.2%、18.5%.结果表明,T1、T2、T3的水分去除效果相近,T2 使用添加TiO2的调理剂对堆体含水率的降低略有优势.

图2 生物干化过程中含水率变化
2.1.3 pH
在生物干化中pH 可影响微生物生命活动,进而影响有机物分解,也会影响酶活性及有机质降解性能[26].一般认为,适宜好氧发酵的pH 值应控制在5.2~8.8 之间,利于微生物的生长和繁殖[27].如图3 所示,各组堆体在生物干化前期呈中性,进入高温期后堆体pH 值激增,降温期逐渐下降.生物干化初期,有机酸被微生物分解,物料pH 升高,T1、T2、T3 分别在第6、3、3 d 达到最高pH 值8.18、8.47、8.43,随着高温期嗜热菌生命活动变得旺盛,微生物代谢产生的有机酸逐渐积累导致pH下降,生物干化结束时各堆体pH 值分别为6.32、6.52、7.03,均在适宜范围内.

图3 生物干化过程中pH 变化
2.1.4 电导率
电导率(EC)反映了浸提液中盐基离子的浓度,即可溶性盐的含量,是表明样品含盐成分、含离子成分、含杂质成分等的重要指标[28].堆体EC 均呈先上升后下降的趋势(图4),随着生物干化的进行,微生物分解有机质释放无机盐,堆体电导率升高,T1、T2、T3 均在第6 d 达到最高值,分别为0.67、0.96、0.92 mS·cm-1.微生物在高温期利用物料中可溶性盐维持自身生命活动,EC逐渐下降.生物干化产物EC 均小于3 mS·cm-1,表明产物中的可溶性盐对植物没有毒害作用[29].
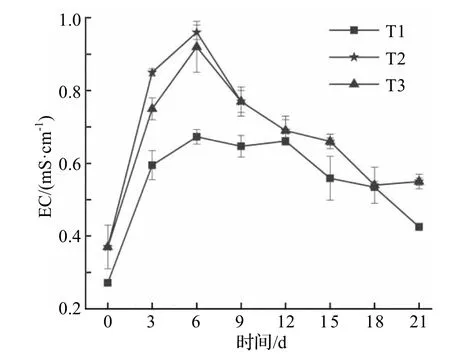
图4 生物干化过程中电导率变化
2.1.5E4/E6
腐殖化系数E4/E6 为腐殖酸溶解离子在465 和665 nm 的光密度比,是生物干化稳定性和产品成熟度的重要指标[30],E4/E6 愈小,腐殖质的缩合度和芳构化程度愈高.3 组堆体的E4/E6 均随着生物干化的进行逐渐下降(图5),表明小分子腐殖酸开始转化成大分子腐殖酸,分子量增加,缩合度增大,干化产品得到腐熟[31].干化结束后E4/E6值分别为2.4、2.61、2.82,产品E4/E6 值在1.5~1.9 时表明成熟[32],本研究各干化产品的值均大于1.9,表明生物干化的周期过短导致产品腐殖化程度不够高.
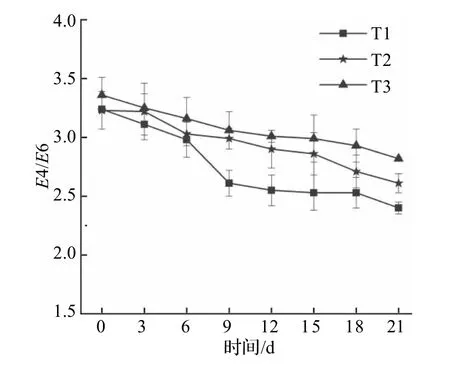
图5 生物干化过程中E4/E6 变化
2.1.6 挥发分
图6 所示为生物干化中挥发分固体(VS)含量变化.3组堆体的VS随着生物干化的进行持续下降,且VS 的下降速率在升温期和高温期相较于降温期更快.T1、T2、T3 在生物干化后有机质含量分别下降了13.9%、12.4%、6.7%,其中T3 组VS 下降最少,即陶粒和锯末以1:1 混合作为调理剂时,VS降解率最低.
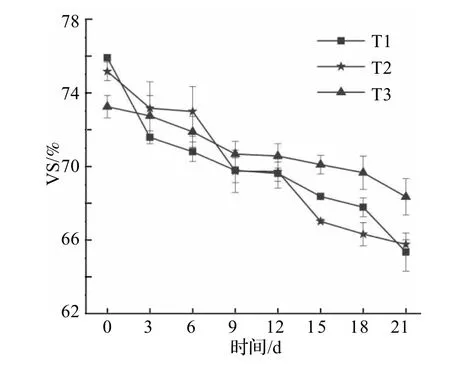
图6 生物干化过程中挥发性固体含量变化
2.2 生物干化中酶活性变化
好氧发酵过程中所产生的酶大部分都属于基质诱导型,即在堆体中某种酶的产生是由于出现了具有与该种酶相对应的底物种类[33].参与生物干化过程的酶主要有水解酶和氧化还原酶两种.分析它们在生物干化各过程的活性变化有助于探究干化物料有机质成分转化的内在生化机理.
2.2.1 水解酶活性变化
本研究选取的水解酶有中性蛋白酶、脂肪酶、α-淀粉酶、纤维素酶,由图7(a)和图7(b)可以看出,3 组堆体的蛋白酶和脂肪酶活性在21 d内均呈先上升后降低的趋势,T1、T2、T3 的蛋白酶活性均在高温期第3 d 达到最高,分别为0.76、0.83、0.69 μmol·(min·g)-1,其中T2 蛋白酶活性始终极显著高于T1、T3 (P<0.01).T1、T2、T3 的脂肪酶活性同样在第3 d 达到峰值,分别为28.95、24.95、31.72 μmol·(min·g)-1,T3 的脂肪酶活性一直极显著维持在较高水平(P<0.01),表明T3 中脂肪酶促进堆体中脂肪降解的能力强,干化后期各组脂肪酶活性降低并逐渐趋于稳定.
α-淀粉酶是一种液化型、内切型淀粉酶,它从淀粉的非还原末端水解底物的α-葡萄糖苷键,能够作用于淀粉,将其水解成长短不一的糊精及少量的低分子糖类、葡萄糖和麦芽糖[34].根据图7(c),T1、T2、T3 的α-淀粉酶活性变化趋势各不相同.T1的α-淀粉酶活性先上升至第3 d 的峰值28.19 μmol·(min·g)-1后降低,第15 d 活性降至最低值25.47 μmol·(min·g)-1后有小幅上升;T2 的α-淀粉酶活性随干化时间呈先上升后下降变化,在第3 d 达到最高值20.67 μmol·(min·g)-1;而T3 酶活性在初始时最大值18.88 μmol·(min·g)-1后小幅下降;T1 中α-淀粉酶活性始终极显著高于T2、T3 (P<0.01),可见T1 中微生物对淀粉进行降解的生化反应剧烈.
纤维素酶是参与纤维素水解的关键酶,从图7(d)可以看出,3 组堆体纤维素酶活性都呈先上升后降低的趋势,虽上升速率各有不同,但均在第15 d 达到最高酶活性,分别为182.27、187.49、166.79 μmol·(min·g)-1,但从高温期开始各组纤维素酶活性已经开始增强且始终处于较高水平,生物干化结束时仍在150 μmol·(min·g)-1以上,其中T2 组纤维素酶活性一直显著高于T1、T3 (P<0.05).
2.2.2 氧化还原酶活性变化
在生物干化后期腐殖化过程中,氧化还原酶起主要作用.本研究选取了氧化还原酶中的木质素过氧化物酶,它可以降解结构复杂且不规则的大分子难降解有机物木质素,同时其活性也可表明生物干化的进程[35].从图7(e)可以看出,T1、T2、T3 木质素过氧化物酶活性均呈逐渐上升趋势,在生物干化后期达到最高值,分别为28.19、19.29、18.88 μmol·(min·g)-1,其中,T2、T3 的木质素过氧化物酶活性无显著差异(P>0.05),T1 酶活性极显著高于T2、T3 (P<0.01),表明T1 堆体加入可循环调理剂进行生物干化有助于提高木质素过氧化物酶活性,从而加快木质素的降解速率.
由图7 各组酶活性变化情况可以得出,蛋白酶、脂肪酶、α-淀粉酶活性均在各堆体进入高温期后达到峰值,经历高温期后酶活性逐渐降低,纤维素酶活性从各组堆体进入高温期开始到降温期一直保持较高活性,木质素过氧化物酶在生物干化降温期逐渐发挥作用.生物干化过程中,T1 组α-淀粉酶、木质素过氧化物酶活性最高,T2 组蛋白酶、纤维素酶活性最高,T3 组脂肪酶活性最高.
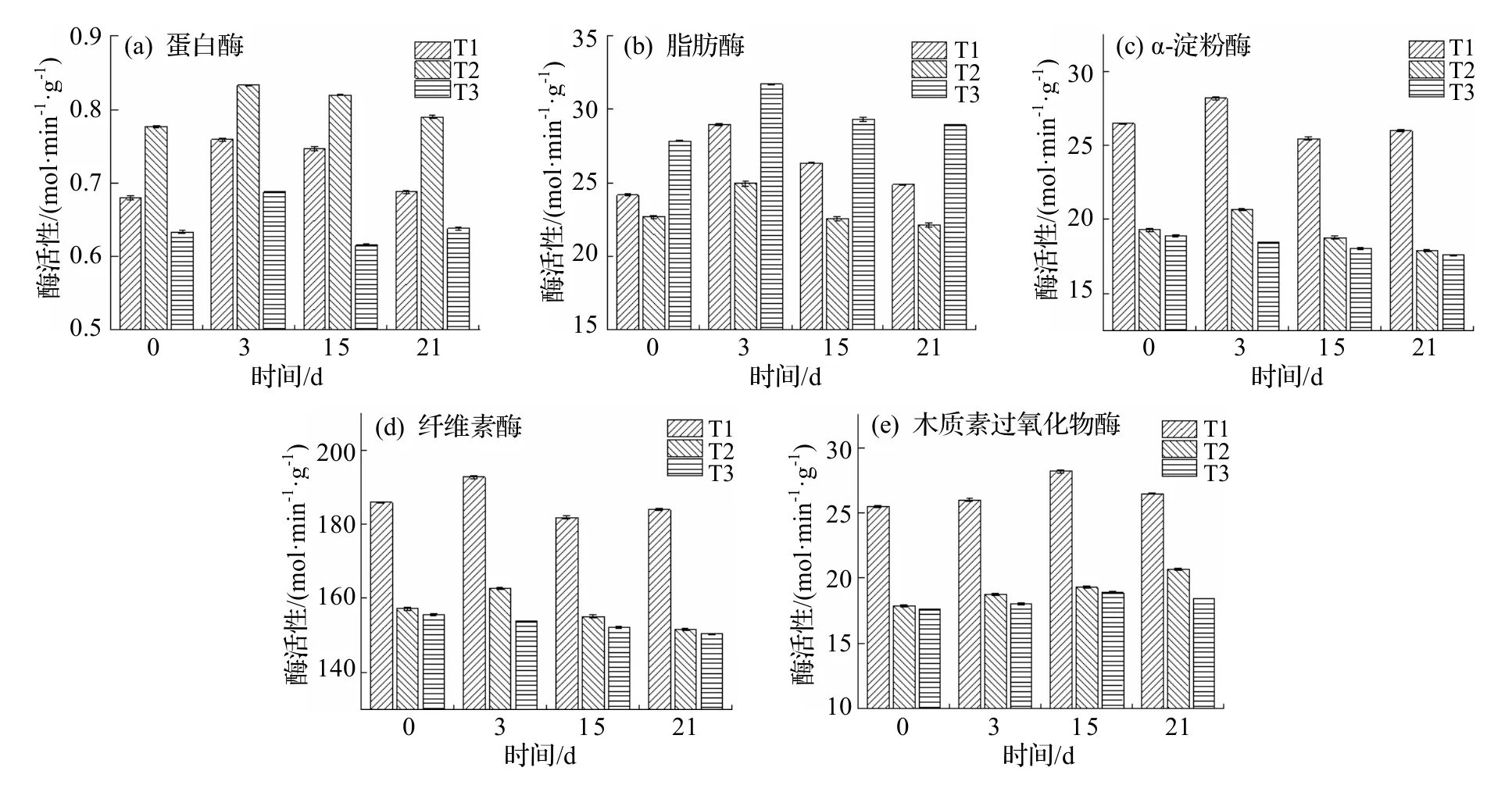
图7 生物干化中各阶段关键性酶活性变化
2.3 有机质及其组分含量变化
2.3.1 蛋白质含量变化
在生物干化期间,微生物分泌的蛋白酶将蛋白质降解为氨基酸,通过脱氨作用进一步产生氨和有机酸[36].蛋白质含量呈缓慢下降趋势(图8(a)),T1、T2、T3 堆体的初始蛋白质含量分别为6.61、6.28、5.80 mg·g-1,在生物干化结束后蛋白质含量为6.26、5.90、5.52 mg·g-1,T1、T2、T3 经21 d 的生物干化后蛋白质分别降解了5.30%、6.05%、4.83%,其中T2 组蛋白质降解率最高.
2.3.2 脂肪含量变化
脂肪由脂肪酶分解为甘油和脂肪酸,甘油和脂肪酸在组织内经一系列反应被氧化成CO2及H2O,所释放的化学能供微生物生命活动[37].如图8(b)所示,T1、T2、T3 的脂肪含量分别从初始的22.13、27.86、25.81 mg·g-1下降至18.31、25.07、21.10 mg·g-1,降解率分别为 17.26%、10.00%、18.25%,且降解规律基本一致,其中T3 组脂肪降解率最高.
2.3.3 纤维素、木质素含量变化
木质纤维素主要由纤维素、半纤维素、木质素组成,其中纤维素占40%~60%,半纤维素占20%~35%,木质素占15%~30%,生物干化周期内纤维素和木质素这类难降解大分子有机物的分解和转化对促进干化进程,合成腐殖质有一定作用[37-38].纤维素是堆肥微生物的能源物质和碳源[39],如图8(c)所示,T1 纤维素含量的主要下降区间在生物干化后期第15~21 d,T2 在第0~3 d纤维素含量快速下降,后期逐渐趋于平稳直至干化结束,T3 在第3~15 d 纤维素含量快速下降,T1、T2、T3 分别降解了10.40%、12.70%、9.90%,T2 组纤维素含量降解率最高,表明生物干化耦合TiO2光催化能够在堆体进入高温期后开始促进堆体中纤维素的降解.
生物干化中结构复杂的木质素降解缓慢,是极难分解的物质之一,研究木质素的降解规律有利于提高生物干化过程中木质纤维素的降解性能.如图8(d)所示,T2、T3 木质素降解缓慢,生物干化前T1、T2、T3 的木质素含量分别为8.23、10.49、9.84 mg·g-1,干化结束后含量分别为6.12、9.44、9.17 mg·g-1,T1 木质素含量降解率高达25.60%,结合木质素过氧化物酶活性,T1 堆体木质素过氧化物酶活性最高,其木质素降解率最高,干化结束后含量最低.
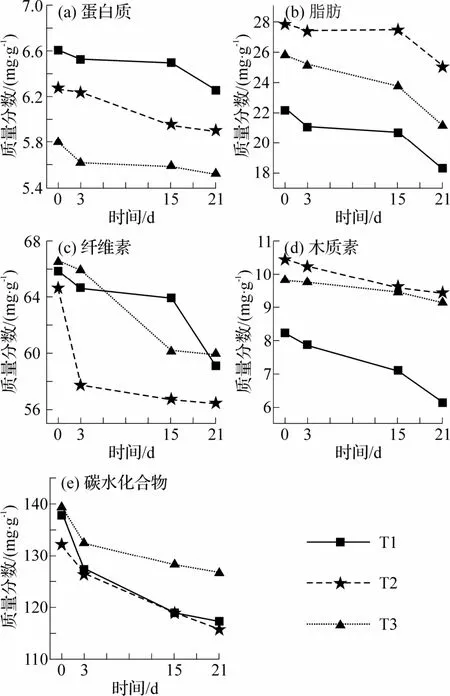
图8 生物干化中各阶段有机质组分含量变化
2.3.4 碳水化合物含量变化
碳水化合物作为生物干化过程中的主要碳源,为微生物的生命活动提供能量.由图8(e)可以看出,各组堆体的碳水化合物含量在生物干化过程中均呈下降趋势,T1、T3 的碳水化合物含量始终比T2高,T1、T2、T3 碳水化合物含量由初始值137.80、132.30、139.50 mg·g-1分别降至生物干化结束值117.30、115.70、126.60 mg·g-1,生物干化周期内碳水化合物降解率分别为14.90%、12.50%、10.00%,T1 中碳水化合物降解最快.
在生物干化前期,堆体物料中含有充足的养分,微生物逐渐繁殖,蛋白质、脂肪、淀粉等易降解的有机物先被降解,进入高温期后微生物生命活动逐渐旺盛,纤维素、木质素这类难降解物质开始逐渐被降解.可循环调理剂参与的T1、T2 组,其蛋白质、纤维素、木质素、碳水化合物的降解均优于陶粒组,可能是由于生物炭的加入增强了微生物的活性,从而促进了相关有机质的降解[40].其中负载TiO2的可循环调理剂组蛋白质和纤维素降解率高,表明生物干化耦合TiO2光催化能够促进堆体中蛋白质和纤维素的降解.结合各组分酶活性变化趋势可知,有机质的各组分酶活性越高,相对应的底物降解率越高,故各堆体生物干化过程中酶活性与底物降解率呈正相关.
3 结论
本文使用硅酸盐基可循环调理剂、负载TiO2的硅酸盐基可循环调理剂和陶粒调理剂分别对污泥进行生物干化,结果表明: 生物干化后,可循环调理剂作用下堆体的木质素、碳水化合物降解率最高,负载TiO2的可循环调理剂作用下堆体的蛋白质、纤维素降解率最高,而以陶粒作为调理剂堆体的脂肪降解率最高,表明添加可循环调理剂比添加陶粒更适宜生物干化的进行,有机物各组分的降解相对彻底,能促进堆体减量化,提高干化效果;各堆体生物干化过程中有机质的各组分酶活性越高,相对应的底物降解率越高;生物干化升温期和高温期水解酶活性较高,木质素过氧化物酶活性在高温期后开始逐渐增强,促进难降解有机物木质素的降解.研究结果有助于明确生物干化各阶段酶活性变化和有机质降解规律,为生物干化进程与有机质降解的深入研究提供相应基础.

