团头鲂SOCS家族基因的分子特征及其对嗜水气单胞菌胁迫的响应
翟文娅,李博,王济秀,王焕岭,刘红
华中农业大学水产学院/农业农村部淡水生物繁育重点实验室/长江经济带大宗水生生物产业绿色发展教育部工程研究中心,武汉 430070
细胞因子信号转导抑制因子(suppressor of cyto⁃kine signaling,SOCS)家族成员是重要的细胞因子受体信号反馈抑制因子[1],可以通过对细胞因子诱导的信号通路进行负调控从而防止过多的信号干扰免疫系统发育及其功能调控[2]。细胞因子诱导的含SH2结构域蛋白(cytokine-inducible SRC homology 2 do⁃main protein,CISH)在1995 年被发现,它是SOCS 家族中第一个被发现的成员[3];随后在1997 年,人们发现了SOCS1[4];至今,人们在哺乳动物中共发现了8个SOCS 家族成员,分别为SOCS1~SOCS7 与CISH[5];在鱼类中,还发现了SOCS3b、SOCS5b、SOCS8以及SOCS9[6-7]等鱼类特有的成员。
目前,在哺乳动物中对SOCS 家族基因功能已有深入研究,已有大量研究探究了SOCS 家族基因的主要功能[8-10]。但是在鱼类中,有关SOCS 家族基因的研究有限,目前仅在半滑舌鳎(Cynoglossus semi⁃laevis)[11]、牙鲆(Paralichthys olivaceus)[12]、斑点叉尾鮰(Ictalurus punctatus)[13]等部分水产动物中验证了其在免疫应答方面发挥着至关重要的作用。
团头鲂(Megalobrama amblycephala)属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲌亚科(Culteri⁃nae)、鲂属(Megalobrama),因其具有肉质较嫩、个体规格适于中国家庭消费、生长速度较快、易于养殖且养殖成本不高等优点而备受广大养殖户的青睐。但是近年来,不合理的养殖结构和布局及滥用药物等,严重阻碍了其养殖业的持续健康发展。其中由嗜水气单胞菌(Aeromonas hydrophila)引发的细菌性败血症每年都会导致大量的团头鲂死亡,造成巨大经济损失。团头鲂抗嗜水气单胞菌感染的相关基因的研究已有很多[14-16],本研究一方面通过对团头鲂SOCS 家族基因进行生物信息学分析来确定其分子特征;另一方面探究SOCS 家族基因在健康团头鲂各组织与嗜水气单胞菌感染后的表达模式,旨在为进一步探究团头鲂SOCS 家族在抵抗嗜水气单胞菌感染中发挥的免疫功能提供研究基础。
1 材料与方法
1.1 试验材料
试验所用团头鲂均采集于湖北省洪湖市洪湖水产鱼种养殖场,幼鱼体质量为(50±10)g,成鱼体质量为(500±20)g。将试验鱼转移到华中农业大学水产学院实验基地中暂养,水温为25~28 ℃,24 h 不间断充氧,早晚各换水1 次,换水量为总体积的1/4,暂养14 d后开始试验。
1.2 团头鲂SOCS的生物信息学分析
首先检索NCBI 数据库(www.ncbi.nlm.nih.gov)获得团头鲂socs1、socs3a、socs3b基因(GenBank 登录号:MK101316.1,MH107241.1,MH107242.1)与斑马鱼(Danio rerio)socs2、socs4、socs5a、socs5b、socs6、socs7、socs9基因(登录号:NM_001114550.1,NM_001111225.1,NM_001113758.2,NM_001113797.1,EF195764.1,NM_001287077.1,NM_001113801.1)的cDNA 序列,并利用斑马鱼socs基因的cDNA 序列通过本地Blast 从团头鲂转录组(登录号:PRJ⁃NA716731)中获取对应的团头鲂序列。
通 过ORF Finder(www.ncbi.nlm.nih.gov/orf⁃finder)预测10个团头鲂socs基因的ORF 及氨基酸序列;利 用ExPASy(http://web. expasy. org/com⁃pute_pi/)预测其蛋白质的理论分子质量(MWs)与理论等电点(pI);使用SMART(http://smart.embl.de/)预测其蛋白质结构域,并使用IBS 1.0.3 进行绘图;从GenBank 数据库获取斑马鱼、青鳉(Oryzias latipes)、小鼠(Mus musculus)和人(Homo sapiens)等脊椎动物物种已有的SOCS蛋白序列,利用MEGA 6使用邻接法(Neighbour-Joining,NJ法)构建进化树。
1.3 试验样品采集
为了确定团头鲂socs基因的组织表达模式,分别取3 尾健康团头鲂成鱼的心脏、肝脏、脾脏、体肾、头肾、脑、血液、肠道、肌肉和鳃10个组织(器官)。
为了探究嗜水气单胞菌感染后团头鲂socs基因的组织表达模式,以团头鲂幼鱼为试验对象,随机设置对照组与感染组2 个处理组,每一处理设置3 个生物学重复(每个生物学重复取3尾鱼)。感染试验中,对感染组团头鲂每尾腹腔注射0.1 mL 浓度为6.7×106CFU/mL 的嗜水气单胞菌,对照组腹腔注射等量PBS 缓冲液。在注射后的0、4、12、24、72 h 分别采集感染组和对照组的脾脏、体肾和头肾组织[17]。
上述样品快速分离后置于液氮中,冻存24 h 后转入−80 ℃冰箱中保存备用。
1.4 总RNA的提取及cDNA合成
组织总RNA 提取采用Trizol 法,具体步骤参照Trizol试剂(Invitrogen)说明书。提取的RNA 浓度通过紫外分光光度计(Nanodrop 2000,美国)进行测定,RNA 的完整度与纯度通过琼脂糖凝胶电泳法测定。使用PrimeScript™RT reagent Kit(TaKaRa,日本)试剂盒按照说明书对提取的RNA 进行反转录,将获得的cDNA保存于−20 ℃冰箱。
1.5 半定量PCR及荧光定量PCR(qRT-PCR)
通过半定量PCR 方法检测socs基因在健康团头鲂不同组织的表达量。PCR 反应体系为10.0 μL,包括cDNA 模板1.0 μL、ddH2O 7.1 μL、10×TaqPCR Buffer 1.0 μL、上下游引物各0.3 μL、dNTP 0.15 μL、TaqDNA 酶0.15 μL。反应程序:94 ℃预变性5 min后,94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸20 s,30个循环,最后72 ℃延伸5 min。扩增后,取5.5 μL PCR产物进行琼脂糖胶电泳检测。
通过荧光定量PCR(qRT-PCR)评估团头鲂SOCS家族基因在嗜水气单胞菌刺激后脾脏、体肾与头肾中的表达。qRT-PCR反应总体系为20.0 μL,包括SYBR 混合试剂10.0 μL、ddH2O 7.4 μL、cDNA 模板1.0 μL、上下游引物各0.8 μL。反应程序:95 ℃预变性5 min 后,95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸15 s,进行40个循环。
选择18S rRNA为内参基因,使用primer pre⁃mier 5.0 软件对团头鲂socs设计特异性上下游引物(表1),并由武汉擎科生物科技有限公司合成。
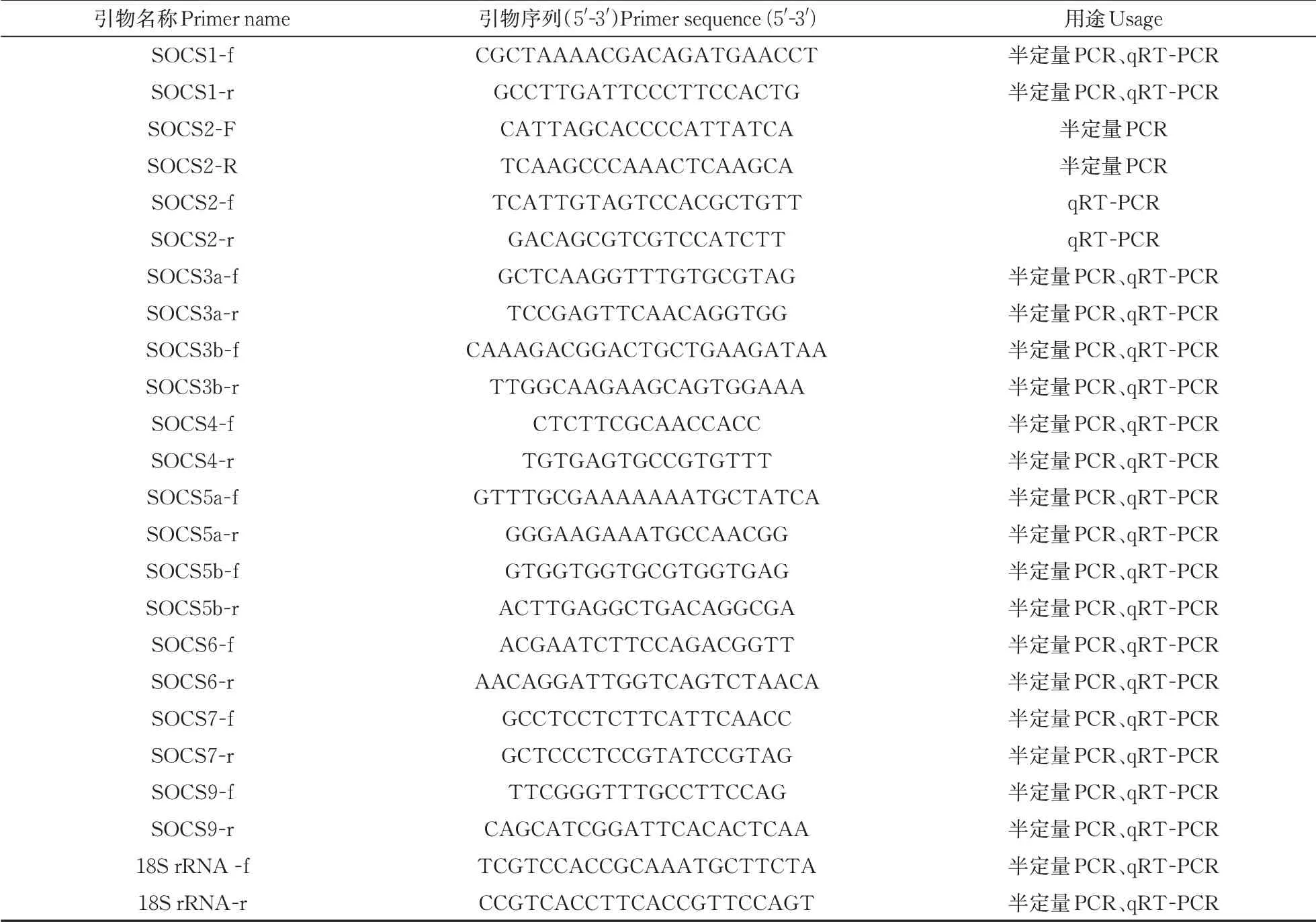
表1 本研究用到的引物Table 1 Primers used in this study
1.6 数据处理
基因的表达量采用2−ΔΔCt法计算,使用SPSS Statistics 24.0 软件对数据进行分析,采用Duncan’s进行多重比较,数值均采用“平均值±标准误”(mean±SE)表示,P<0.05 为统计学差异显著,P<0.01 为统计学差异极显著。
2 结果与分析
2.1 团头鲂10个socs基因序列分析
通过本地Blast 比对NCBI 中获得的斑马鱼SOCS 家族基因与检索NCBI 中团头鲂SOCS 家族基 因,共 获 得socs1、socs2、socs3a、socs3b、socs4、socs5a、socs5b、socs6、socs7、socs9共10 个团头鲂socs基因序列,分别编码201、197、209、216、378、526、557、530、744、494 个氨基酸,等电点(pI)分布在5.69~9.37,平均等电点为7.85,蛋白分子质量为22.3~80.97 ku,具体信息见表2。
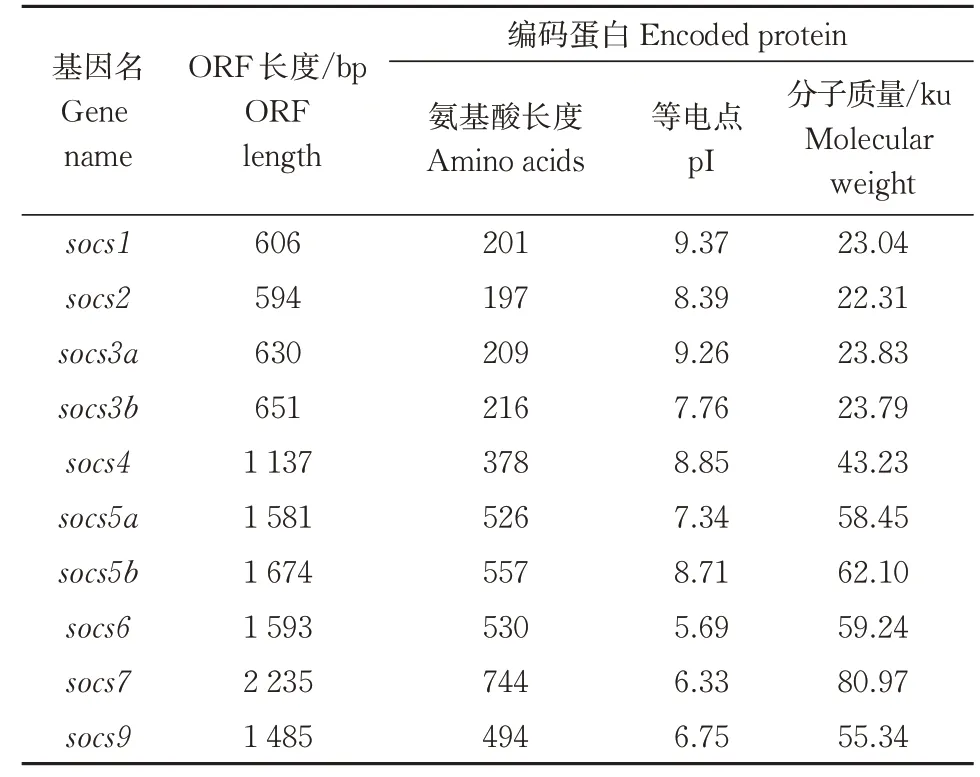
表2 团头鲂SOCS家族基因特征Table 2 Features of SOCS family genes identified in M.amblycephala
预测团头鲂10 个socs基因结构,结果如图1 所示:团头鲂SOCS 家族基因具有1~8 个外显子,其中大部分socs基因仅具有1 个外显子,但socs7具有7 个外显子。对其蛋白结构域进行预测,结果如图2 所示,显示其均含有2 个保守结构域,分别是SOCS BOX 特异性蛋白结构域与SH2 中心结构域。

图1 团头鲂socs基因结构图Fig.1 Gene structure of socs in M.amblycephala
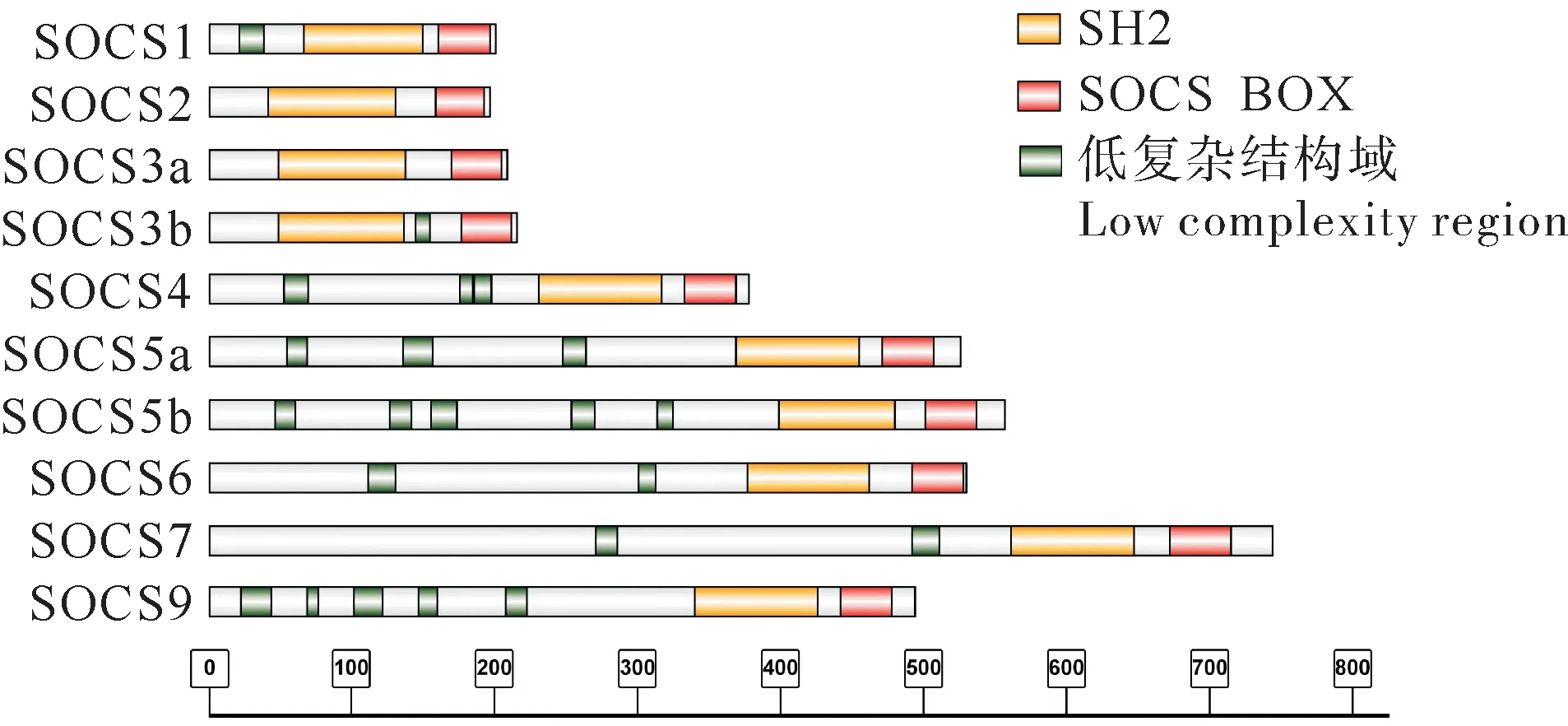
图2 团头鲂SOCS家族蛋白结构域Fig.2 Protein domains of SOCS family in M.amblycephala
2.2 SOCS的系统进化分析
通过MEGA构建SOCS系统进化树,结果如图3所示。团头鲂与草鱼(Ctenopharyngodon idella)、斑马鱼亲缘关系较近,然后与其他硬骨鱼类聚为一支,与哺乳动物亲缘关系较远,这与传统形态学上的物种分类地位一致。进化树分为2 个主要分支:一支(Ⅰ型)包括SOCS4、SOCS5a、SOCS5b、SOCS6、SOCS7 与SOCS9,另一支(Ⅱ型)包括SOCS1、SOCS2、SOCS3a与SOCS3b。
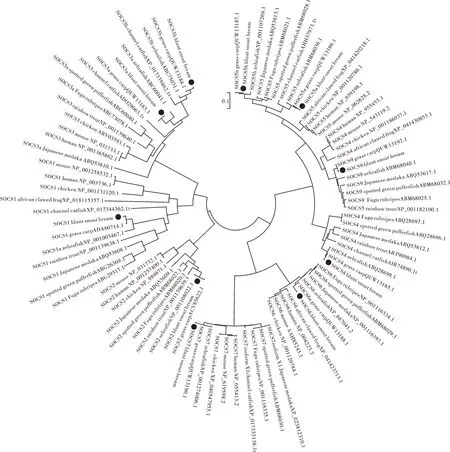
图3 脊椎动物SOCS系统进化树Fig.3 Phylogenetic analysis of SOCS in vertebrates
2.3 SOCS家族基因在健康团头鲂组织中的表达
半定量PCR 结果(图4)显示在健康团头鲂成鱼中,socs1基因在脑组织中的表达量最高,其次在血液和心脏表达量较高,在肠、体肾、脾脏、头肾组织中也有不同程度表达,在其余组织的表达量较低或未表达;socs2基因在体肾与血液中的表达量最高,其次为心脏、鳃、肝脏、脾脏与肠;socs3a基因在脑中的表达量最高,其次为血液和脾脏,在肝脏和体肾中也有一定程度的表达;socs3b、socs4、socs5a、socs5b基因在团头鲂各组织中表达量均不高;socs6与socs7在脾脏、体肾、头肾、脑与血液中表达量均较高;socs9在脾脏中表达量最高,其次为心脏,在除肌肉与鳃以外的组织中也有一定量的表达。总体而言,10个团头鲂socs基因在体表组织(鳃、肠)表达量较低,在脾脏、体肾、脑与血液中表达量较高;团头鲂socs1、socs2、socs3a、socs6、socs7与socs9表达量相对其他4个基因较高。

图4 SOCS家族基因在团头鲂不同组织中的表达Fig.4 Expressions of 10 SOCS family genes in various tissues of M.amblycephala
2.4 嗜水气单胞菌感染后SOCS家族基因的表达
通过qRT-PCR 结果可知,嗜水气单胞菌感染后,团头鲂脾脏中sosc5a、sosc5b、sosc6、sosc9表达量无明显差异,sosc1、sosc3a、sosc3b表达量在嗜水气单胞菌感染后呈现先上升后下降的趋势,且均在12 h达到峰值;sosc2、sosc7表达量在嗜水气单胞菌感染后4 h 均出现显著下调,sosc2表达量在12 h 出现短暂回升并于感染后24 h 再次显著下调,sosc7表达量则是在24 h 出现上调表达后于72 h 恢复至初始水平;sosc4表达量在嗜水气单胞菌感染后先显著下调后逐渐回升至初始水平(图5A)。
嗜水气单胞菌感染后,团头鲂体肾中sosc4、sosc5b、sosc9表达量无明显差异,sosc1、sosc3a、sosc3b表达量变化趋势与脾脏中一致,其中sosc1与sosc3a在感染后12 h达到峰值,sosc3b在感染后24 h达到峰值;sosc6、sosc7表达量呈现先上升后下降的趋势;sosc2在4 h表达显著上调,在12 h出现短暂回落并于感染后24 h 再次显著上调,在72 h 恢复至初始水平;sosc5a表达量在在嗜水气单胞菌感染后出现下调,24 h出现短暂轻微上调后再次下调(图5B)。
嗜水气单胞菌感染后,团头鲂头肾中sosc2、sosc5a表达量无明显差异,sosc1、sosc3a、sosc3b、sosc6表达量仍呈现先上升后下降的趋势,均在感染后12 h时达到峰值;sosc4、sosc5b、sosc9、sosc7表达量在嗜水气单胞菌感染后出现下调现象,其中sosc4在感染后24 h出现短暂回升但未恢复至初始水平,72 h再次出现下调趋势;sosc7在短暂下调后24 h 出现回升,72 h后恢复至初始水平(图5C)。

图5 嗜水气单胞菌感染后SOCS家族基因在团头鲂脾脏(A)、体肾(B)和头肾(C)中的表达量Fig.5 Relative expression of SOCS family gene in spleen(A),kidney(B)and head kidney(C)of M.amblycephala after infection by Aeromonas hydrophila
3 讨 论
细胞因子具有多效性,它在免疫调节、细胞增殖以及受损组织修复等多个过程中发挥着重要作用[18]。SOCS 蛋白可通过多种机制减弱细胞因子信号转导,对细胞因子发挥负调控作用[13]。已有研究发现,SH2 中心结构域可与N 区协同,通过结合特定细胞因子受体识别目标蛋白,从而调节细胞因子信号转导[19],SOCS BOX 特异性蛋白结构域可以结合泛素蛋白对其降解。因此,在信号传递过程中,SOCS 蛋白主要是由SH2 中心结构域特异性识别目标蛋白后通过SOCS BOX 特异性蛋白结构域使其降解。此外,在草鱼、梭鱼(Liza haematocheila)等鱼类中,SOCS 家族基因蛋白具有高度保守的SH2 中心结构域和SOCS BOX 特异性蛋白结构域[20-21],本研究中的团头鲂SOCS 蛋白均含有这2 个特征蛋白结构域,此结果与已有研究相同,表明这10 个SOCS 蛋白结构相对保守。
系统进化分析表明,10 个SOCS 可分为2 个亚族:Ⅰ型家族中包括SOCS4、SOCS5a、SOCS5b、SOCS6、SOCS7 与SOCS9,Ⅱ型家族包括SOCS1、SOCS2、SOCS3a 与SOCS3b,这与梭鱼等物种中已有研究结果一致[21-22]。在果蝇中只存在Ⅰ型亚族的类似基因[23],因此可推测在进化过程中,Ⅱ型亚族成员可能是由Ⅰ型亚族成员基因复制产生,硬骨鱼类中特有的几种socs基因也表明类似的基因复制也发生在鱼类进化的过程中[18]。
健康团头鲂半定量PCR 结果显示,socs1和socs9在心脏中表达量较高;socs3a、socs6与socs3b在肝脏中表达量较高,细胞因子在葡萄糖代谢、脂肪代谢以及蛋白质代谢过程中均有参与,那么SOCS 作为细胞因子信号抑制蛋白的1种,在团头鲂重要代谢器官肝脏中具有高表达可能与此有一定关系。脾脏与体肾是鱼体重要的免疫器官[24],在本研究中,socs1、socs3a与socs9在脾脏中表达量较高,socs1与socs2在体肾中表达量较高,这表明其可能在免疫应答中发挥着重要作用。在脑中,socs1和socs3a高表达,暗示其可能在血脑屏障的建立中起着一定作用[21];socs2具有调节神经祖细胞分化的功能,同时也可以影响神经元与中间神经元间的信息传递[25],符合其在脑中有一定表达量的研究结果;socs7基因缺失小鼠相较于野生型小鼠体质量轻,同时约有50%的小鼠在出生后2 周头盖骨会出现畸形,大脑皮层变薄并最终死亡[10],这意味着它在大脑发育过程中发挥着不可或缺的作用,与其在脑中高表达结果相一致。
在鱼类中,Poly(I:C)、LPS 和细菌已被证明能够影响socs基因的表达[26-27]。本研究中,团头鲂在嗜水气单胞菌感染后的4 h 内,部分socs基因出现差异表达现象,表明在急性反应期间SOCS 家族基因会发挥一定作用。在嗜水气单胞菌感染后,socs2在头肾中无显著性变化,在脾脏中显著下调,而在体肾中显著上调,推测这与socs2在不同组织中发挥作用不同有关;socs1、socs3a与socs3b在团头鲂头肾、脾脏、体肾中的总体变化趋势相同,均为显著上调。据报道,溶藻弧菌(Vibrio alginolyticus)感染卵形鲳鲹(Trachinotus ovatus)后在3 个免疫组织(头肾、肝脏、脾脏)中socs1、socs3的表达量均显著升高[13];爱德华氏菌(Edwardsiella ictaluri)感染3 h 后,斑点叉尾鮰肠道中socs1表达量显著上调;迟缓爱德华菌(Ed⁃wardsiella tarda)感染后,半滑舌鳎肝脏、体肾与脾脏中socs1表达量在所检测时间点均出现显著上调[11],这些研究结果与本试验研究结果均表明socs1、socs3a与socs3b在细菌感染后机体免疫过程中发挥了重要功能。socs4在感染后表达量小幅度降低但仍有统计学差异,这意味着其可能以低表达量协同参与调控过程。socs5a、socs5b表达量在感染前后几乎无显著差异,这暗示了它们可能不参与机体免疫防御过程。socs6在头肾中表达量出现了显著上调,socs7在3 个组织中同样出现了显著上调,这意味着其可能在抵抗嗜水气单胞菌感染过程中也发挥了一定的功能。
综上所述,本研究初步探究了团头鲂10 个SOCS分子特征,分析了其在健康团头鲂中的组织分布及嗜水气单胞菌胁迫下的表达模式,可为进一步研究团头鲂SOCS家族基因功能奠定基础。

