大口黑鲈弹状病毒的分离与鉴定
章文言,张玉军,李陈,石和荣,刘学芹
1.华中农业大学水产学院/湖北省水生动物病害防控工程技术研究中心,武汉 430070;2.东莞市银华生物科技有限公司,东莞 523000
大口黑鲈(Micropterus salmoides),又名加州鲈,是北美洲重要的游钓性鱼类,于1983 年被引进中国广东[1]。大口黑鲈作为一种优质的淡水鱼,具有肉质细腻、蛋白质含量高、繁殖周期短、耐受性好等优点[2],现已成为我国重要的淡水养殖鱼类之一。根据《2021 中国渔业统计年鉴》,大口黑鲈的养殖产量在中国水产养殖市场中逐年攀升。然而随着养殖规模的不断扩大,大口黑鲈病毒病、细菌病、真菌病、寄生虫病等一系列病害[3-5]日益严重,尤其病毒病因传染快、病程短、死亡率高,防控难度大,且无有效的治疗手段等[6],严重危害大口黑鲈养殖业的发展。近年来由弹状病毒(micropterus salmoides rhabdovirus,MS⁃RV)引起的大口黑鲈死亡事件时有发生,其高传染性可导致大量幼鱼死亡[7],死亡率最高可达90%[8]。
2021 年广东省韶关市某大口黑鲈养殖场出现大口黑鲈幼鱼大量死亡的现象。患病的大口黑鲈主要表现为体色发白、身体失衡、螺旋打转、聚游水面。为了弄清病因,本研究对患病大口黑鲈进行临床观察,从细菌学、寄生虫学、病毒学三方面进行了检测,并通过分子生物学分析、透射电镜观察等方法,鉴定其病原为大口黑鲈弹状病毒,命名为大口黑鲈弹状病毒韶关株(MSRV-SG01)。现报道如下。
1 材料与方法
1.1 病料和试验动物
病鱼来源于广东韶关某大口黑鲈养殖场。试验用鱼购自广东佛山某大口黑鲈鱼种繁育场,鱼体质量为(0.5±0.1)g,体长为(3±0.5)cm。试验开始前,随机抽取3 尾鱼进行RT-PCR 检测,确定无病毒携带后,暂养2 周,每天早晚各投喂1 次,利用加热棒将水温控制在26 ℃左右,使用增氧装置将溶氧控制在5 mg/L左右。
1.2 细胞及主要试剂
鲤上皮瘤细胞(epithelioma papillosum cyprini cells,EPC)、胖头鱥肌肉细胞(fathead minnow mus⁃cle cells,FHM)、斑点叉尾鮰卵巢细胞系(channel catfish ovary cells,CCO)细胞来源于笔者所在实验室细胞库;石斑鱼脾脏细胞(grouper spleen cells,GS)由华南农业大学秦启伟教授惠赠;总DNA 提取试剂盒、Trizol 和凝胶小量DNA 胶回收试剂盒购自Magen;反转录试剂盒购自ABclonal;M199细胞培养基购自Cytiva;胎牛血清、0.25%EDTANa2的胰酶购自Hyclone;PBS 缓 冲 液购 自Bio-Channel;2×M5 HiPer plus Taq HiFi PCR Mix、DNA Marker、核酸染料和琼脂糖购于北京百奥莱博科技有限公司。
1.3 细菌及寄生虫检测
取病鱼体表黏液制备涂片和压片,在光学显微镜下观察有无寄生虫感染。随机取3 尾病鱼用酒精棉擦拭鱼体后,在无菌条件下整尾鱼匀浆,PBS 稀释后1 000 r/min 离心2 min 去沉淀,LB 平板上划线培养24 h后,观察菌落的生长状况。
1.4 病毒检测
随机取4尾病鱼用酒精棉球擦拭鱼体后,在无菌条件下整尾鱼匀浆,加入300 μL 无菌PBS 缓冲液稀释后平均分成3 份,1 份冻存于−80 ℃用于后续病毒的分离鉴定,另外2 份用于鱼类病毒检测。将2 份中的1 份置于Trizol 中提取总RNA,另1 份用DNA试剂盒提取DNA,采用特异性引物进行PCR 检测(引物信息见表1),PCR 反应体系为25 μL:模板3 μL;上下游引物各1 μL;2×M5 HiPer plus Taq HiFi PCR Mix 12.5 μL;ddH2O 7.5 μL。RT-PCR 反应程序:95 ℃3 min;94 ℃25 s;55 ℃25 s;72 ℃15 s,35 个循环;72 ℃10 min。PCR 产物经2%琼脂糖凝胶电泳鉴定,切胶回收送至公司测序,测序结果在NCBI 中进行Blast 分析,进一步确定分离到的病毒。引物合成及测序由武汉擎科有限公司完成。

表1 引物碱基序列Table 1 Nucleotide sequences of primers
1.5 病毒细胞培养
从−80 ℃冰箱取出病料匀浆液,无菌条件下取20 μL,用无菌PBS 缓冲液将匀浆液稀释10 倍,然后取20 μL 稀释后的匀浆液加到5 mL 无血清M199 培养液中,存于−80 ℃冰箱反复冻融3 次,充分裂解释放病毒。4 ℃条件下将冻融后的匀浆液1 000 r/min离心10 min 去除组织碎片,再经0.22 μm 微孔过滤器除菌后,分别接种于已长满单层的EPC、FHM、CCO、GS 细胞,28 ℃孵育吸附1 h后更换成相应的细胞维持培养基,并设置未接毒阴性对照,每天观察细胞病理变化,并拍照记录。待90%的细胞出现细胞病变时,收集上清及细胞,反复冻融3 次,1 000 r/min离心10 min,然后将病毒悬液继续接种细胞,传代3次。
1.6 病毒滴度测定及生长动力学曲线的绘制
以无血清M199 培养基10 倍梯度稀释病毒(10−2~10−5),接种到铺满单层EPC 细胞的12 孔板中,每孔500 μL,在28 ℃培养箱中孵育1 h,吸弃病毒液,每孔加入1 mL 含5% FBS 的DMEM-CMC 半固体培养基,培养60 h 后进行固定、染色处理及空斑计数。取病毒悬液,用无血清M199 培养基稀释后,分别以0.1 MOI(感染复数:multiplicity of infection,MOI)和0.01 MOI 的病毒液接种单层EPC 细胞密度90%的12 孔板,1 h 后换成5%FBS 的细胞维持培养基。分别在感染后的6、12、24、36、48 h 取细胞培养液上清,用空斑试验测定各时间点病毒滴度,并利用GraphPad Prism 8.0绘制病毒生长动力学曲线。
1.7 病毒电镜样品的制备
取1 瓶单层细胞密度90%的EPC 细胞,于无菌环境下加入5 mL 的病毒悬液,28 ℃吸附1 h,然后更换含5%FBS 的M199 维持培养基,28 ℃培养15 h 后吸弃维持液,将细胞用无菌PBS洗涤1次,弃之,再加入1 mL 胰酶消化30 s,用枪头把细胞吹下来,转移至2 mL无菌EP管中,1 000 r/min离心3 min(细胞团绿豆大小)。弃上清,缓慢加入1 mL 常温戊二醛(2.5%),将细胞团轻轻挑起,悬浮于固定液中,先室温避光固定30 min,再转移到4 ℃冰箱保存,交于武汉赛维尔生物科技有限公司进行包埋、制片、拍照。
1.8 人工感染试验
将试验鱼随机分为A、B、C 3 组,每组30 尾鱼。A、B 组分别腹腔注射10 μL 的105PFU/mL、106PFU/mL 的病毒液,C 组注射等量无血清M199 培养基作为阴性对照,每天观察鱼体死亡情况并记录。
1.9 组织病理学观察
分别取攻毒鱼的肝、脾、肠组织,4%多聚甲醛固定24 h,各组织分别经70%、80%、95%、100%乙醇脱水,二甲苯透明、石蜡包埋切片(5~7 μm)、H&E染色,最后在显微镜下观察、拍照。
1.1 0 系统发育树分析
采用设计的覆盖MSRV-G基因全长序列的保守性引物对MSRV-F/MSRV-R 进行PCR 扩增,经1%琼脂糖凝胶电泳鉴定后,切胶回收送至武汉擎科有限公司测序,在NCBI 将测序结果进行Blast 分析。在GenBank 中下载常见的几种弹状病毒G 蛋白氨基酸序列,利用MEGA7.0 软件绘制该毒株与大口黑鲈弹状病毒(MSRV-FJ985;GenBank:MT818233.1、MSRV-YH01;GenBank:mk397811.2)、鳜弹状病毒(Sinipercachuatsirhabdovirus, SCRV; GenBank:NC_008514.1)、水疱性口炎病毒(vesicular stomatitis Indiana virus,VSV;GenBank:MW373779)、梭子鱼苗弹状病毒(pike fry rhabdovirus,PFRV;GenBank:NC_025356.1)、鲤春病毒血症病毒(spring viremia of carp virus,SVCV;GenBank:AJ318079.1)、牙鲆弹状 病 毒(hirame rhabdovirus,HIRRV;GenBank:AF104985.2)、传染性造血器官坏死病毒(infectious hematopoietic necrosis virus, IHNV; GenBank:X89213.1)、乌鳢弹状病毒(snakehead rhabdovirus,SHRV;GenBank:NC_000903.1)、病毒性出血性败血 症 病 毒(viral hemorrhagic septicemia,VHSV;GenBank:KP866927.1)的系统发育树。
2 结果与分析
2.1 患病鱼的临床观察
自然发病鱼池的水温为26 ℃,病鱼全长0.8~1.0 cm,发病前期在水面聚集、停止摄食,发病后期身体失衡、螺旋打转、并出现死亡。健康大口黑鲈幼鱼背部为青灰色、腹部灰白色(图1A),而发病大口黑鲈体色发白(图1B)。

图1 患病鱼的临床症状Fig.1 Clinical symptoms of diseased fish
2.2 病原检测结果
取组织匀浆液划线分离未见致病菌,体表黏液在显微镜下未观察到寄生虫。通过几种特异性检测引 物 对MSRV-F1/MSRV-R1、ISKNV-F/ISKNVR、LMBV-F/LMBV-R、NNV-F/NNV-R 对病料进行PCR 检测,结果如图2所示,针对MSRV 的检测引物扩增出1条大小约为217 bp的特异性条带,其他检测引物均未扩增出条带。
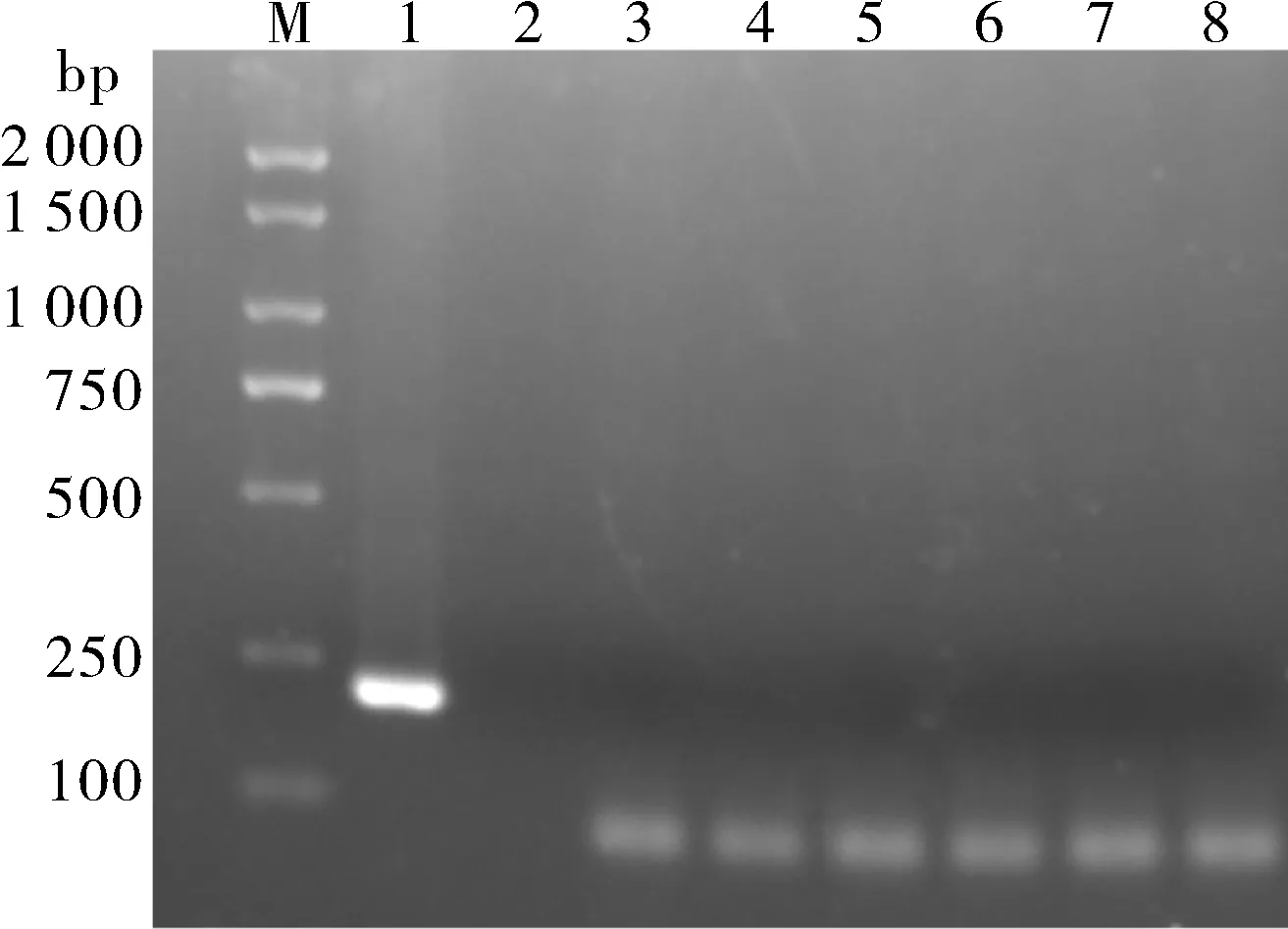
图2 不同鱼类病毒的RT-PCR检测的结果Fig.2 Results of RT-PCR detection of different fish viruses
2.3 病毒分离培养结果
将无菌处理后的病料悬液分别接种EPC、FHM、CCO、GS细胞,24 h后进行拍照观察。结果显示EPC、FHM、CCO 均出现不同程度的病变(箭头指示),主要表现为细胞皱缩、聚团,病变严重部位大面积死亡并脱落,阴性对照组细胞表现正常。MSRV 对这3 种细胞的敏感度从高到低依次为:EPC>FHM>CCO,而接毒后的GS 细胞与阴性对照组相比无明显差异,表明MSRV 对该细胞不敏感(图3)。
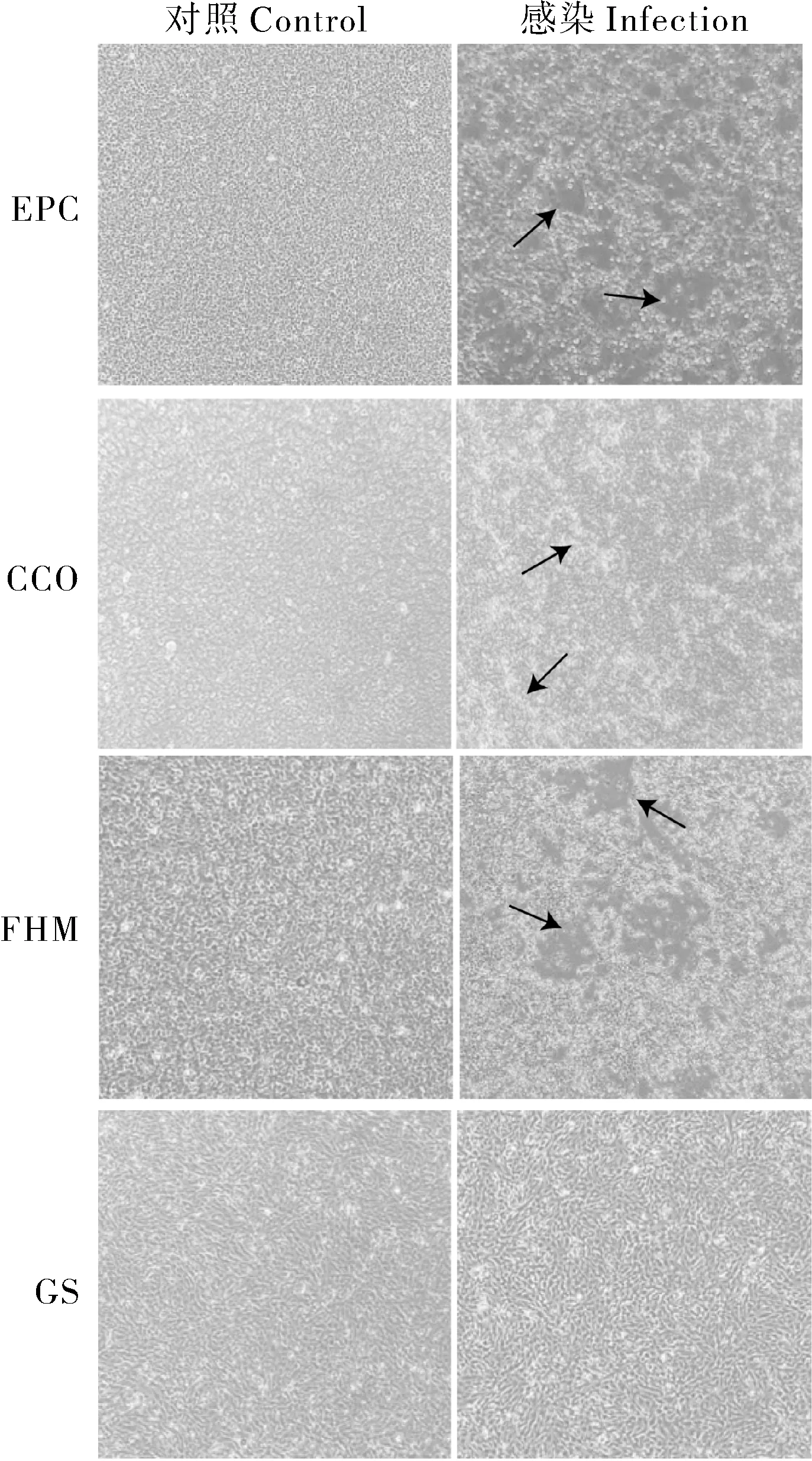
图3 病料接种不同细胞系24 h后的病变结果(40×)Fig.3 Lesion results after 24 hours of inoculation with different cell lines(40×)
2.4 病毒滴度及生长曲线测定结果
病毒在EPC 细胞上最敏感,后续将病毒在EPC 细胞上盲传3 代,收取接毒24 h 的上清进行病毒效价测定,空斑测定结果显示,病毒效价为106.5PFU/mL。生长动力学曲线显示该毒株在0.01 MOI 和0.1 MOI 感染剂量下的增殖曲线总体趋势一致:6~24 h,病毒快速复制、增殖,进入对数生长期;24~48 h,病毒增殖缓慢,进入平台期,滴度相差不大,在36 h的滴度相对最高(图4)。
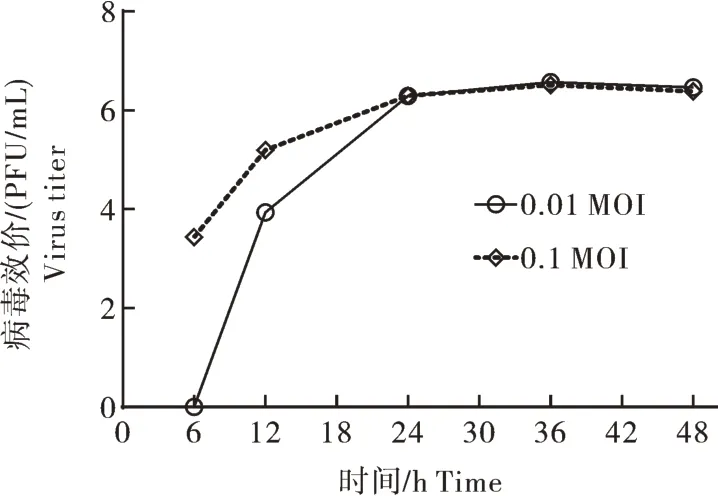
图4 病毒在EPC细胞中的生长动力学曲线Fig.4 Growth kinetics of virus in EPC cells
2.5 病毒粒子形态
用2.5%戊二醛固定接毒15 h的EPC 细胞,然后在HITACHI HT7700 透射电镜下观察,发现大量具有子弹状特征的病毒粒子,病毒纵切面呈现圆形或椭圆形,长度为120~170 nm,直径为50~65 nm(图5)。
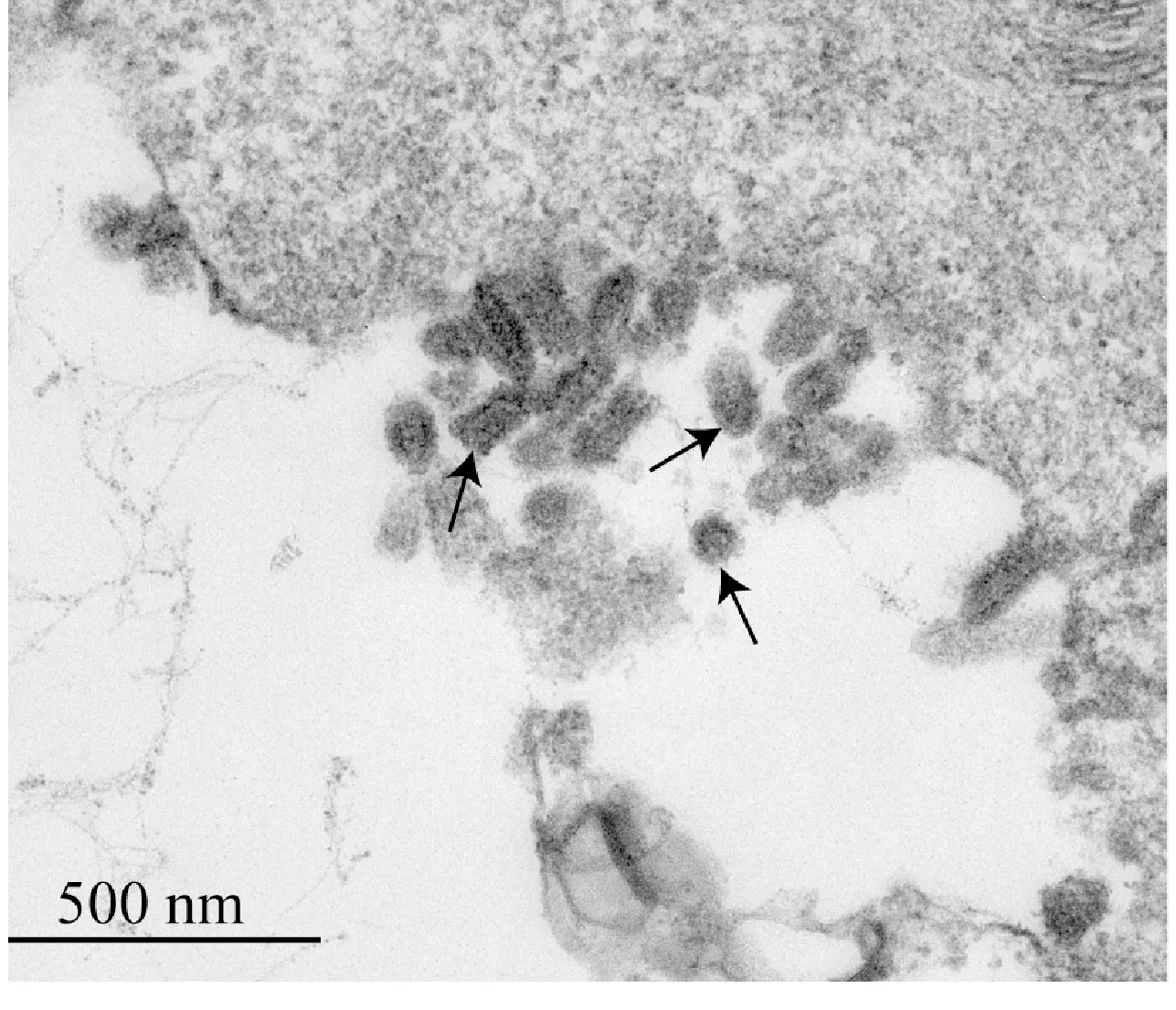
图5 透射电镜下观察病变细胞中的病毒粒子的形态大小Fig.5 Observation of the shape and size of virus particles in diseased cells under a transmission electron microscope
2.6 回感试验结果
攻毒试验结果显示,A 组、B 组大口黑鲈均于接毒后的第2 天开始死亡。攻毒后第3 天,观察到攻毒组大部分试验鱼游动缓慢、浮游池边,有个体出现身体失衡、打转、身体弯曲的现象。肉眼观察,对照组(C 组)试验鱼体表完整,健康有光泽(图6A),攻毒组试验鱼表现为身体弯曲、体表出血(图6B)、拖便(图6C)、烂尾(图6C、D)等临床症状,解剖后可以看到病鱼肝、脾器官肿大发红(图6D)。A 组在第5 天达到死亡高峰期,B 组的死亡高峰期为第2 天和第3 天。7 d 后,A、B 组试验鱼全部死亡,死亡率100%,而注射M199 的对照组鱼并未出现死亡(图7)。

图6 人工感染后大口黑鲈的临床症状Fig.6 Clinical symptoms of Micropterus salmoides after artificial infection
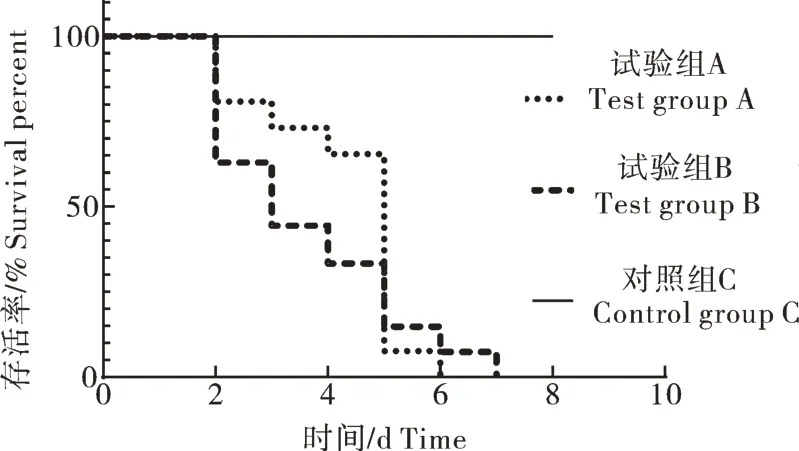
图7 攻毒模型生存曲线Fig.7 The survival curve of the challenge model
2.7 病理组织切片观察
H&E 染色结果显示,与对照组(图8A)相比,病鱼的肝实质细胞呈拉网状坏死、细胞边界模糊,连成一片、胞浆空泡化严重(图8B,箭头指示)。与对照组(图8C)相比,病鱼脾淋巴组织疏散,含铁血黄素大量沉积(图8D,箭头指示)。与健康大口黑鲈的肠组织(图8E)相比,患病大口黑鲈的肠组织(图8F)没有明显的病理变化。
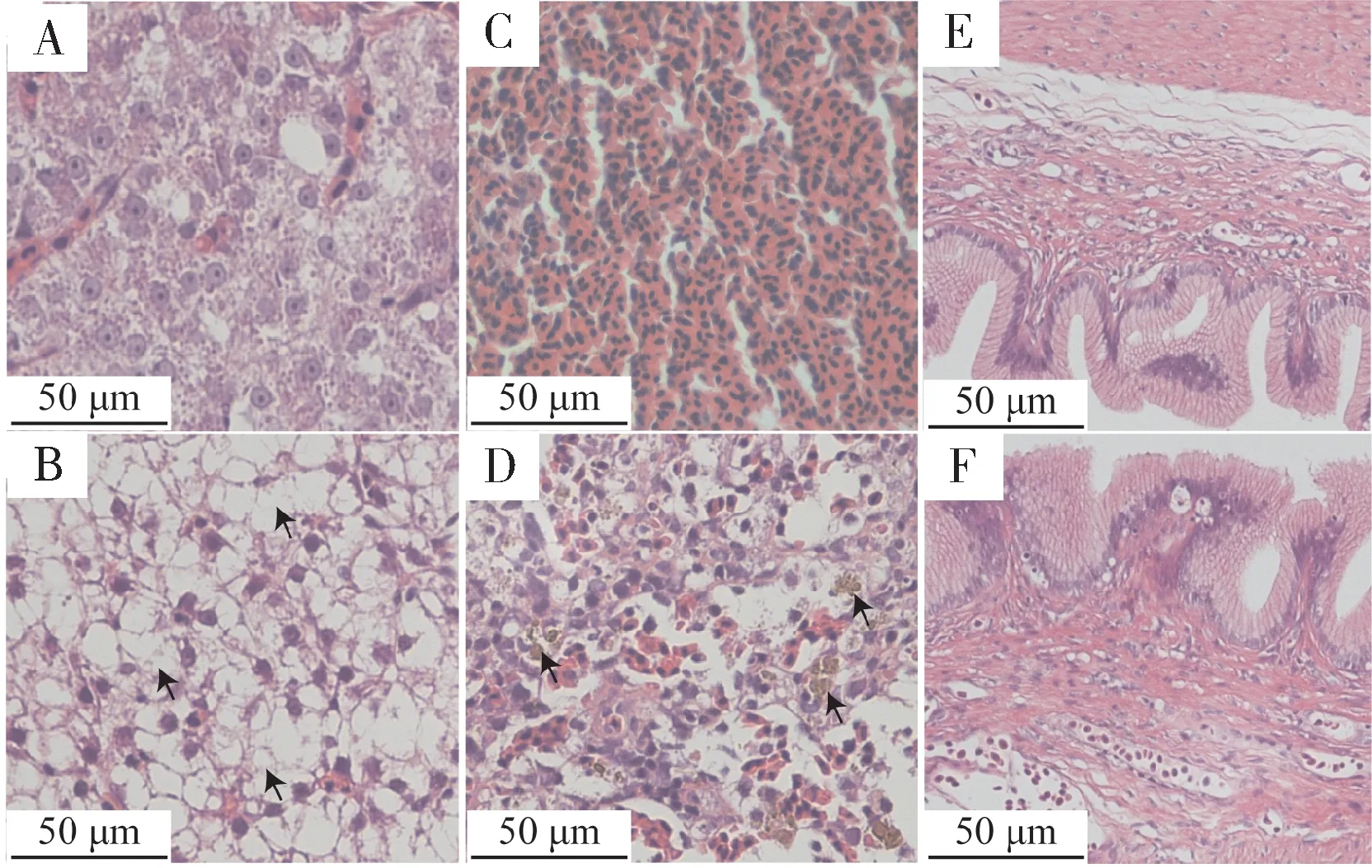
图8 MSRV感染大口黑鲈的组织病理变化Fig.8 Histopathological changes of MSRV-infected Micropterus salmoides
2.8 系统进化树分析结果
以接种病毒悬液24 h 的EPC 细胞为样品,经RNA 提取、反转录后得到模板cDNA,采用特异性引物MSRV-F/MSRV-R 扩增G 基因全长序列,得到1 条与预期结果一致的大约位于1 500 bp 的特异性条带,测序结果显示,G 基因ORF 为1 541 bp。通过Blast 比对MSRV-SG01 与其他弹状病毒的同源性,发 现MSRV-SG01 与MSRV-FJ985、MSRVYH01 这2 株大口黑鲈弹状病毒的核苷酸同源性分别为99.36%、98.19%,氨基酸同源性分别为99%、97%。利用MEGA7.0 聚类分析MSRV-SG01 G 蛋白氨基酸序列与MSRV-FJ985、MSRV-YH01、SCRV、VSV、PFRV、SVCV、HIRRV、IHNV、SHRV、VHSV 的G 蛋白氨基酸序列,结果显示MS⁃RV-SG01 毒 株 与 MSRV-FJ985、MSRV-YH01、SCRV 聚为同一分支,并与MSRV-FJ985 毒株的亲缘关系最近,但与诺拉弹状病毒属的VHSV亲缘关系较远(图9)。确定分离得到1 株大口黑鲈弹状病毒,根据病料来源地,将该毒株命名为MSRV-SG01。
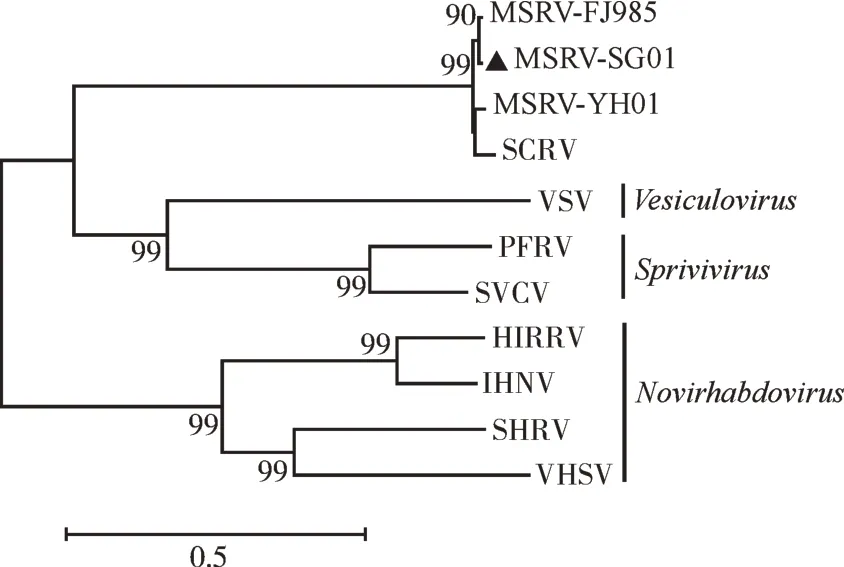
图9 MSRV-SG01 G蛋白氨基酸序列系统发育树Fig.9 Phylogenetic tree of MSRV-SG01 G protein amino acid sequence
3 讨 论
弹状病毒(rhabdovirus)是单股负链RNA 病毒,基因组大小为10.08~16.1 kb[9],宿主广泛,哺乳动物、鸟类、爬行动物、植物和鱼类等均可被感染。作为全球野生及养殖鱼类的重要病原体,弹状病毒严重危害鱼类养殖业的健康发展[10]。MSRV 与大多数水生弹状病毒不同,其具有年龄特异性,主要危害2~4 cm 的幼鱼,在25~28 ℃水温条件下,致死率较高[11-12]。MSRV 与大多数鱼类弹状病毒的基因组大小、蛋白结构相似,全基因组长度为11 kb 左右,主要编码核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)和聚合酶(L)5 种结构蛋白[11,14]。
根据以往的研究报道,自然感染MSRV 的大口黑鲈体长为2.5~4.5 cm[11-12],而本研究采集的患病大口黑鲈为全长0.8~1.0 cm 的幼鱼,规格相对较小。由于患病大口黑鲈携带卵黄囊,并未从外界摄入营养,推测MSRV 极有可能是通过垂直传播途径由亲鱼传播给苗种。在鱼类养殖过程中,养殖水体污染而导致的病毒感染也有报道[14],不排除幼鱼也有可能通过受病毒污染的水体而被感染。
本研究发现MSRV-SG01 毒株对EPC、FHM、CCO 均敏感,都可以产生明显细胞病变现象,该毒株能在不同科的鱼类细胞中复制,说明其具有较强的感染性[15],这提示我们在MSRV 的防控中要注意病毒的种间传播,避免造成更大的经济损失。将接毒后病变的EPC 细胞制作成超薄切片,在透射电镜下观察到大量具有子弹状特征的病毒粒子,长度为120~170 nm,直径为50~65 nm,与SCRV(长76~18 nm,宽29~52 nm)相比要大一些[16],但是比诺拉弹状病毒属的SHRV(180~200 nm,60~80 nm)要小一些[17]。已有研究表明,浸泡和腹腔注射2 种方式均能够使大口黑鲈幼鱼感染MSRV[7]。本试验采用腹腔注射的方式感染幼鱼,7 d 内死亡率达100%,显示该毒株具有较强毒力,已有研究建立的大口黑鲈弹状病毒攻毒模型死亡率为20%~80%,人工感染死亡率的差异性,可能主要与攻毒剂量有关[7,18-19]。人工感染大口黑鲈后,病鱼2 d 内出现死亡,呈出血、鱼体弯曲,不规则状游泳、烂尾、拖便等临床症状,这符合大口黑鲈弹状病毒感染病例[8]。组织病理切片结果显示,患病大口黑鲈的肝组织大量坏死,肝细胞空泡化严重,脾淋巴组织呈弥散性坏死,含铁血黄素大量沉积,与病变症状一致,为本研究结果提供了更加有力的证据。
为进一步确定MSRV-SG01 毒株的分类地位,本研究在GenBank 中下载了MSRV-FJ985、MSRV
YH01、SCRV、VSV、PFRV、SVCV、HIRRV、IH⁃NV、SHRV、VHSV 这几种常见弹状病毒的G 蛋白氨基酸序列。根据系统发育树结果,本试验分离得到 的MSRV-SG01 毒 株 与MSRV-FJ985、MSRVYH01、SCRV 聚为一类,且与已报道的MSRVFJ985 毒株、MSRV-YH01 毒株的核苷酸同源性分别高达99.36%、98.19%,氨基酸同源性分别高达99%、97%,同源性较高,但仍具有一定差异,这可能是MSRV-SG01 毒株在本研究建立的攻毒模型中导致较高死亡率的原因之一。
综上,本研究从携带卵黄囊的大口黑鲈幼鱼上分离出1 株MSRV-SG01 毒株,可为MSRV 的垂直传播提供参考依据,建议从源头防控水生动物疾病,以促进大口黑鲈的健康养殖。

