暴马桑黄倍半萜合酶基因SbTps2 克隆及其响应茉莉酸甲酯的表达分析
乌木提·巴合提别克,李亚伟,佟鑫宇,朱丽颖,邹莉
(东北林业大学 林学院,黑龙江 哈尔滨 150040)
桑黄Sanghuangporus spp.是一种珍稀大型药用真菌[1]。据文献资料报道,桑黄具有抗氧化、抗病毒、降血压和抗肿瘤等多种药效[2],其药效来源于桑黄含有的活性成分,其中多糖和萜类是主要的药效成分[3]。
暴马桑黄S.baumii是生长在暴马丁香树上的一种桑黄。目前,关于暴马桑黄的研究主要集中在暴马桑黄的药理作用方面,人们逐渐认识到暴马桑黄是抗癌效果最好的药用菌之一,但是由于市场需求量大,加上人们不断地采摘,同时还不能大量人工栽培,使得暴马桑黄资源匮乏,这严重限制了其发挥药理作用。因此通过外源因子诱导暴马桑黄倍半萜合成途径中的关键基因来促进倍半萜合成,将是一种可靠的技术手段。
倍半萜是暴马桑黄次生代谢物,具有很好的抗炎、抗寄生虫和抗癌活性[4]。倍半萜合酶作为倍半萜生物合成途径的关键酶,负责把法尼焦磷酸环化为多个具有不同生物活性的结构多样的化合物,主要负责催化法尼基二磷酸(FPP)的释放,然后引导碳正离子沿着异戊烯链迁移,进而诱导一系列环化和重排反应,暴马桑黄倍半萜合成代谢途径如图1。目前,青蒿等几种植物中对倍半萜合酶的研究已经取得了一些进展[5-6],但在真菌中的研究相对较少,仅在灰盖鬼伞、灵芝、紫芝、牛樟芝等[7-10]少数真菌中有所报道。
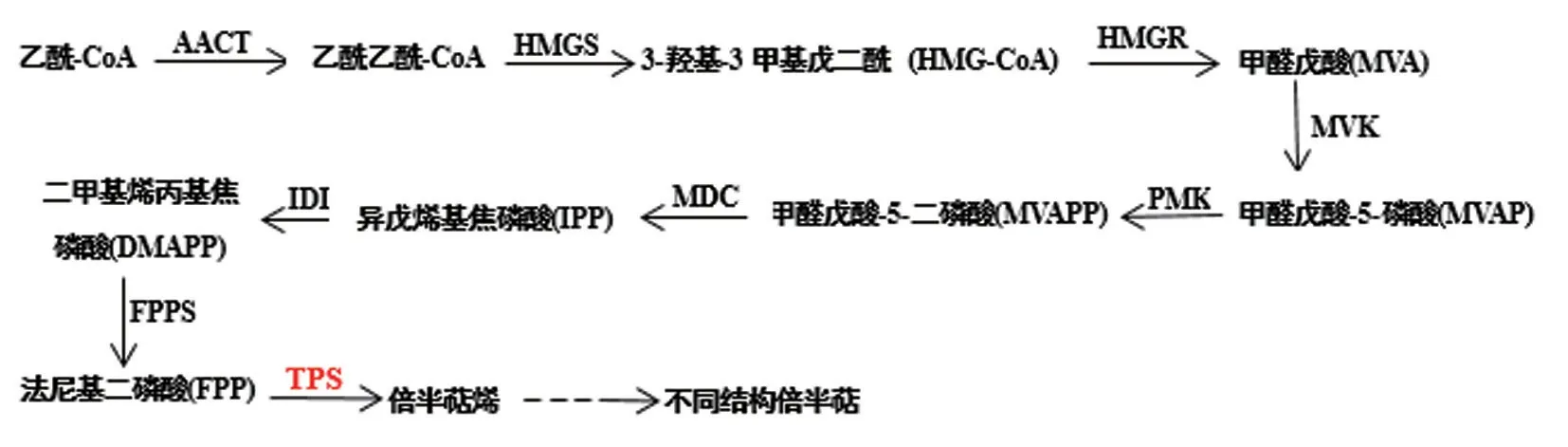
图1 暴马桑黄倍半萜合成途径(MVA 途径)Fig.1 Biosynthesis pathway of sesquiterpenes in S.baumii (MVA pathway)
茉莉酸甲酯(Methyl Jasmonate,MeJA)作为次生代谢途径中重要的信号转导分子,可激活或抑制相应转录因子的活性,影响启动子与转录因子的结合,进而调控与植物次生代谢相关的关键酶基因的表达,影响酶的活性,最终调控次生代谢产物的合成[11-12]。研究表明,MeJA 可以诱导植物中倍半萜类物质的生物合成。徐艳红等[13]外施MeJA 处理白木香树发现产生3 种倍半萜物质。苏闪闪[14]用MeJA 对洋甘菊叶片进行处理后,MrβFS(一种倍半萜合成相关基因)表达量增加。其中,在处理24 h后Mr-βFS表达水平是对照组的11.5 倍。GC—MS 分析表明,MeJA 诱导后叶片中几种挥发性萜类物质含量与对照相比均存在显著差异。邓文静等[15]研究MeJA 对广藿香JA 信号转导途径及倍半萜合成途径关键基因表达的影响发现,JAZ2是JA 信号转导途径里响应MeJA 诱导的主要基因,可激活倍半萜合成途径FPPS基因的协同表达,进而影响广藿香醇等倍半萜的合成。而MeJA 诱导真菌倍半萜类物质合成的研究相对较少。张国权[16]用MeJA 对鲍姆纤孔菌进行诱导,提高了Unigene1790等倍半萜合酶基因的表达量。
1 材料与方法
1.1 试验菌株与载体
本试验所用的暴马桑黄菌种经ITS(Internal transcribed spacer)鉴定为暴马桑黄(NCBI 登录号为KP974834),命名为暴马桑黄DL101,于东北林业大学森林保护学科实验室保藏。大肠杆菌Escherichia coli克隆菌株Top10、表达菌株BL21(DE3)和载体pMD18-T vector 购自大连Takara生物公司。
1.2 试验试剂
Premix Taq 酶、TB GreenTM Premix Ex TaqTMⅡ(TliRNaseH Plus)、Prime Script Ⅱ1ST、Strand cDNA Synthesis Kit 和Prime ScriptTM RT reagent Kit with gDNA Eraser 均购于大连Takara 公司。植物总RNA 提取试剂盒、植物基因组DNA提取试剂盒和琼脂糖凝胶DNA 回收试剂盒均购于北京天根生化公司。MeJA 购自Sigma 公司。其余所用药物为国产分析纯。
1.3 试验引物
用于SbTps2基因克隆、启动子克隆、检测、荧光定量的引物序列如表1 所示。
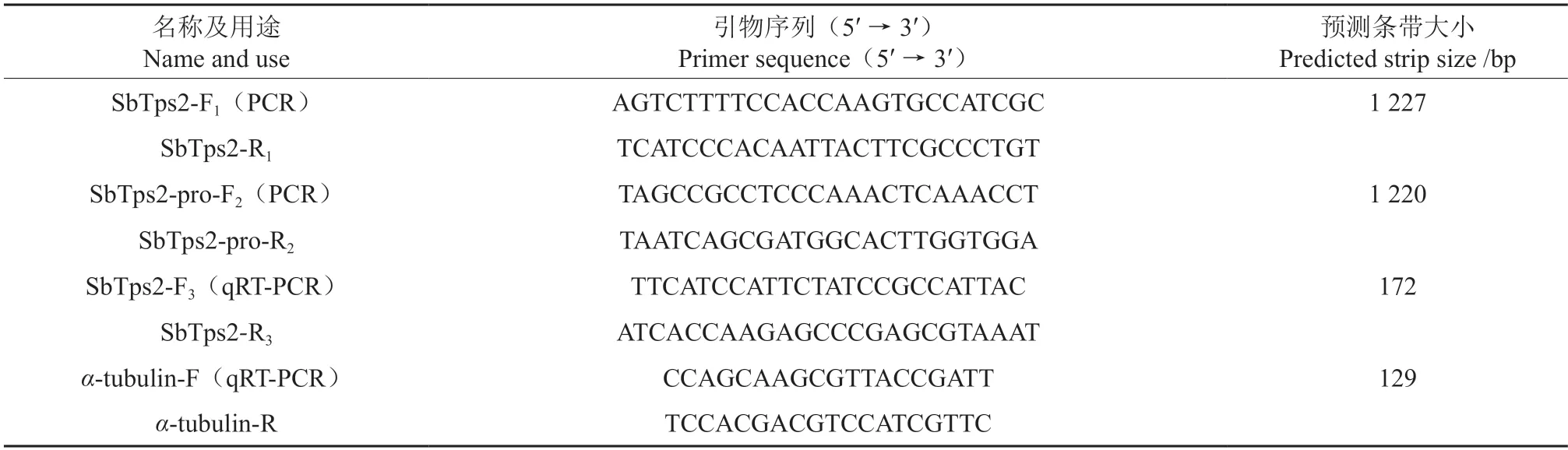
表1 引物信息Table 1 Primer information
1.4 SbTps2 基因克隆
用植物总RNA 提取试剂盒提取暴马桑黄总RNA,以反转录的cDNA 为模板,SbTps2-F1、SbTps2-R1为引物进行PCR 扩增,PCR 产物用琼脂糖凝胶DNA 回收试剂盒进行纯化回收,并检测回收产物浓度。回收产物送至哈尔滨擎科生物公司测序。
1.5 SbTps2 基因启动子克隆
用DNA 提取试剂盒提取暴马桑黄基因组DNA,以得到的DNA 为模板,以SbTps2-pro-F2、SbTps2-pro-R2为引物进行PCR 扩增。PCR 产物经1%琼脂糖凝胶电泳检测正确后,用琼脂糖凝胶DNA 回收试剂盒进行纯化回收,核酸分析仪检测回收产物浓度。
1.6 SbTps2 基因与启动子序列生物信息学分析
将序列提交至NCBI,用Open reading frame,ORF 预测SbTps2基因开放阅读框;再用NCBI里 的Conserved Domains(https://www.ncbi.nlm.nih.gov/)预测SbTps2 蛋白的保守结构域;用在线软件http://gsds.gao-lab.org/ 对基因DNA 序列进行内含子、外显子分布分析。分别用在线软件ProtParam、TMHMM、SignalP-3.0、SOPMA、SWISS-MODEL 预测蛋白理化特性、跨膜结构、信号肽、蛋白二级结构、蛋白质三级结构。用Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子结构,并用在线软件http://gsds.gao-lab.org/制图。用MEGA 5.2进行系统发育预测和分析[18-20]。
1.7 MeJA对SbTps2 基因转录水平的影响
用PD 液体培养基培养暴马桑黄菌丝体,在摇菌培养14 d 后,匀质仪打碎,以4%(V/V)接种量接入250 mL PD 培养基中,25℃、180 rpm 下培养8 d。在8 d 时加入以吐温20 为助剂配制的MeJA,使MeJA 终浓度分别为100,150,200,250 和300 μM 的PD 液体培养基为试验组培养菌丝体,只加入无菌水的PD 液体培养基为对照组CK,诱导48 h,收集菌丝,分别提取总RNA,将提取到的总RNA 用Prime Script ™ RT reagent Kit with gDNA Eraser 试剂盒分别反转录成cDNA。利用实时荧光定量PCR(Quantitative real-time PCR)技术,将α-tubulin 作为内参基因(表1),每组样品设置3 个重复。据不同Ct 值,按公式2-△△Ct计算不同处理中的基因相对表达量[21-22]。
2 结果与分析
2.1 SbTps2 基因及启动子克隆
用暴马桑黄菌丝总RNA 反转录得到的cDNA为模板,SbTps2-F1和SbTps2-R1为引物扩增得到PCR 产物。琼脂糖凝胶电泳检测显示,在1 000~1 500 bp 之间出现特异性条带(图2),与预测目的片段大小(1 227 bp)一致。纯化回收产物送至哈尔滨擎科生物公司测序。以SbTps2-pro-F2、SbTps2-pro-R2为引物,克隆SbTps2 基因启动子。与预期大小1 220 bp 一致,结果如图2所示。
小蝉气的怔怔的,瞅着冷笑道:“我可拿什么比你们,又有人进贡,又有人作干奴才,溜你们好上好儿,帮衬着说句话儿。”(第六十回)
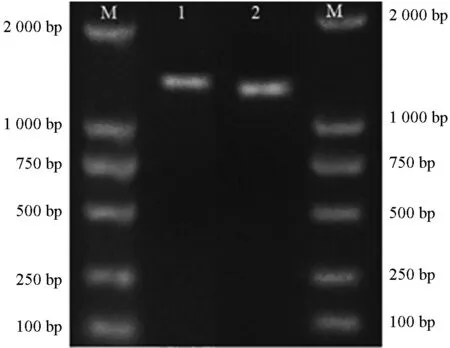
图2 SbTps2 基因cDNA、启动子PCR 扩增产物Fig.2 PCR products of the cDNA and promoter of SbTps2
2.2 SbTps2 基因生物信息学分析
基于转录组基因序列信息,以暴马桑黄菌丝cDNA 为模板,利用PCR 技术获得SbTps2基因cDNA 全长序列。该序列全长1 227 bp(图3),其中开放阅读框(ORF)为1 227 bp,编码407 个氨基酸,SbTps2基因cDNA 序列及对应的氨基酸序列见图3。根据暴马桑黄基因组已知的序列,并结合SbTps2基因 cDNA 测序结果,用在线软件(http://gsds.gao-lab.org/)对SbTps2基因的外显子和内含子进行预测。分析表明,SbTps2基因包含3个外显子(核苷酸0~527、592~898 和953~1 348 bp)和两个内含子(528~591 和899~952 bp,如图4)。

图3 SbTps2 基因cDNA 序列及推测的氨基酸序列Fig.3 The cDNA of SbTps2 and its predicted amino acid sequence
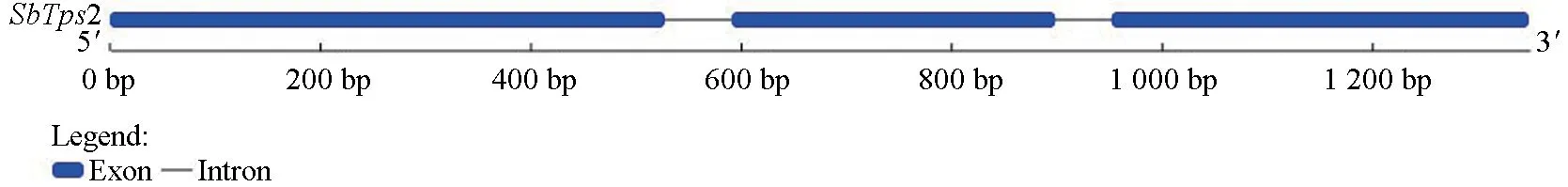
图4 SbTps2 基因的外显子和内含子预测结果Fig.4 Exon and intron prediction of SbTps2
2.3 启动子序列生物信息学分析
2.3.1 作用元件预测及分析
利用在线软件Gene promoter miner 和Plantcare 预测该启动子作用元件,结果发现其含有典型启动子的作用元件(图5):5 个TATAbox(核心启动子元件)、9 个CAAT-box(启动子和增强子区域的共同顺式作用元件)。除了具有典型特征的保守序列外,该序列中还含有参与光响应的顺式作用调控元件G-box、I-box,参与MeJA 响应的顺式作用调节元件TGACG-motif,参与干旱诱导的MYB 结合位点MBS 以及参与厌氧诱导所必需的顺式作用调节元件ARE 等其他元件。
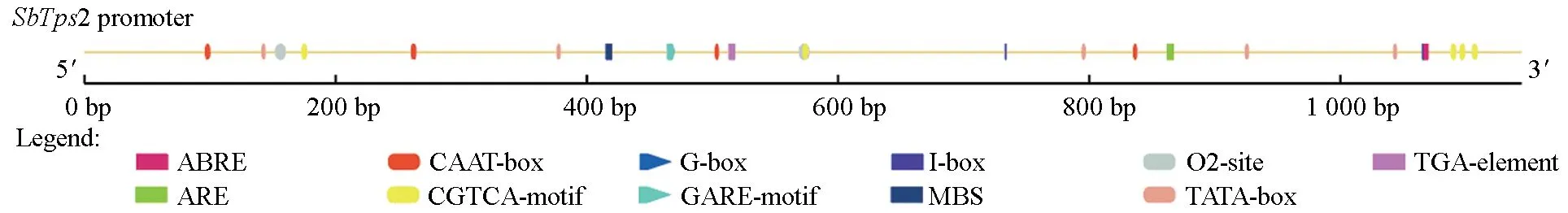
图5 SbTps2 启动子的主要作用元件及位置Fig.5 The main cis-acting elements in the SbTps2 promoter
2.3.2 核心启动区预测及分析
核心启动子区是转录因子和RNA 聚合酶结合的区域,对启动子的活性有较大的影响。Neural network promoter prediction 预测结果发现:SbTps2基因启动子序列中含有2 处核心启动子区(表2),其中367~467 bp之间是核心启动子区的概率最高。

表2 SbTps2 基因启动子核心启动子区†Table 2 The core promoter region of SbTps2
2.4 SbTps2 蛋白生物信息学分析
2.4.1 SbTps2 蛋白理化性质分析
用在线软件分析结果表明,SbTps2基因cDNA 序列长1 227 bp,编码407 个氨基酸,蛋白分子量为45.73 kDa,理论等电点5.89,氨基酸含量最高的为亮氨酸Leu(12.7%),含量最低的为组氨酸His(1.2%);疏水性指标为-0.224,疏水性指标为负值,说明SbTps2 蛋白为亲水性蛋白;不稳定指数63.89,大于40,因此该蛋白是一种不稳定蛋白[23]。
2.4.2 SbTps2 蛋白保守序列预测分析
保守结构域是判断一个蛋白是否属于倍半萜合酶的基本依据,其基序的突变会导致酶的催化活性降低或者产生异常的产物[24]。通过NCBI 网站上的Conserved domains 程序比对结果如图6 所示,得出序列与Isoprenoid Biosynthesis enzymes Class1 和Superfamily of trans-isoprenyl diphosphate synthases 最为相似,含有1 个超家族Isoprenoid-Biosyn-C1 保守区,E-value 仅为8.16e-13,具有类异戊二烯生物合成酶和反式异戊二烯二磷酸合成酶超家族的保守序列。

图6 SbTps2 蛋白保守序列预测Fig.6 Prediction of the conserved sequences of SbTps2 protein
2.4.3 SbTps2 蛋白跨膜区预测
跨膜区是氨基酸序列中跨越细胞膜的区域,能预测1 个蛋白是否具有传递物质及信号的功能,使用TMHMM 预测SbTps2 蛋白跨膜区结果如图7所示,该蛋白所有的氨基酸序列(1~400 位)都位于细胞膜外部。说明该蛋白不具有跨膜结构,是非跨膜蛋白。
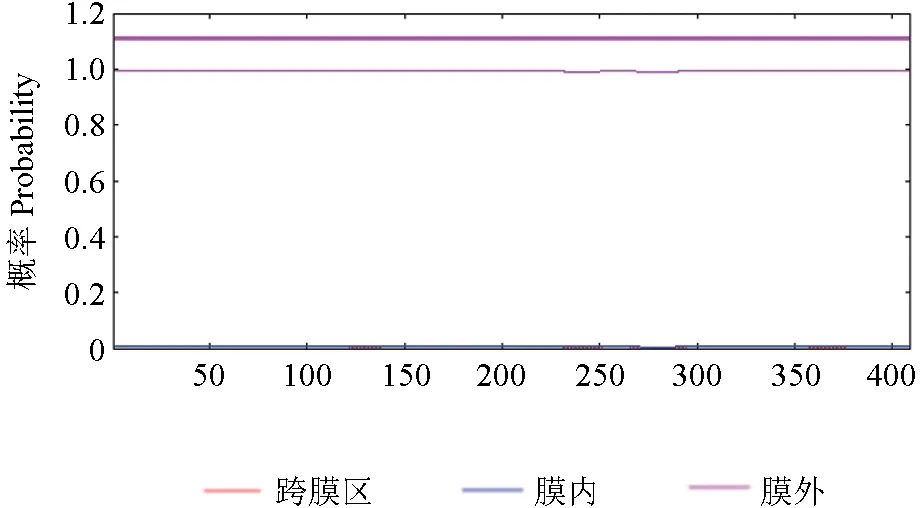
图7 SbTps2 蛋白跨膜区预测Fig.7 Prediction of the transmembrane region of SbTps2
2.4.4 SbTps2 蛋白信号肽预测
信号肽序列负责将蛋白质引导到具有不同膜结构的细胞亚细胞器中去发挥功能,用SignalP对SbTps2 蛋白信号肽进行预测,结果表明该蛋白中不存在信号肽剪切位点(图8)。
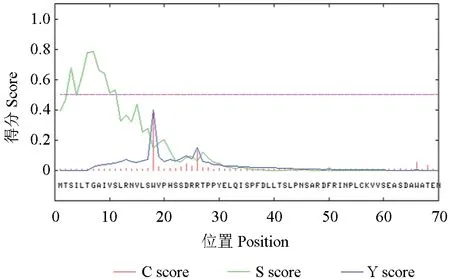
图8 SbTps2 蛋白信号肽预测Fig.8 Signal peptide prediction of SbTps2
2.4.5 SbTps2 蛋白高级结构预测
使用SPOMA 对SbTps2 蛋白二维结构预测分析,结果显示该蛋白含有213个α螺旋,占52.08%,其中8.31%处于延伸链、2.20%处于β转弯、2.73%处于弯曲区域、37.41%处于无规则卷曲状态,说明该蛋白大部分氨基酸序列都处于螺旋卷曲状态,二级结构分析如图9 所示。使用Swiss model 预测SbTps2 蛋白的三级结构,结果显示SbTps2 蛋白三级结构是以Terpene synthase metal-binding domain-containing protein 蛋白结构(4okm.1.A)为模板构建的(图10),建模残基范围是第33 位氨基酸到第388 位氨基酸。
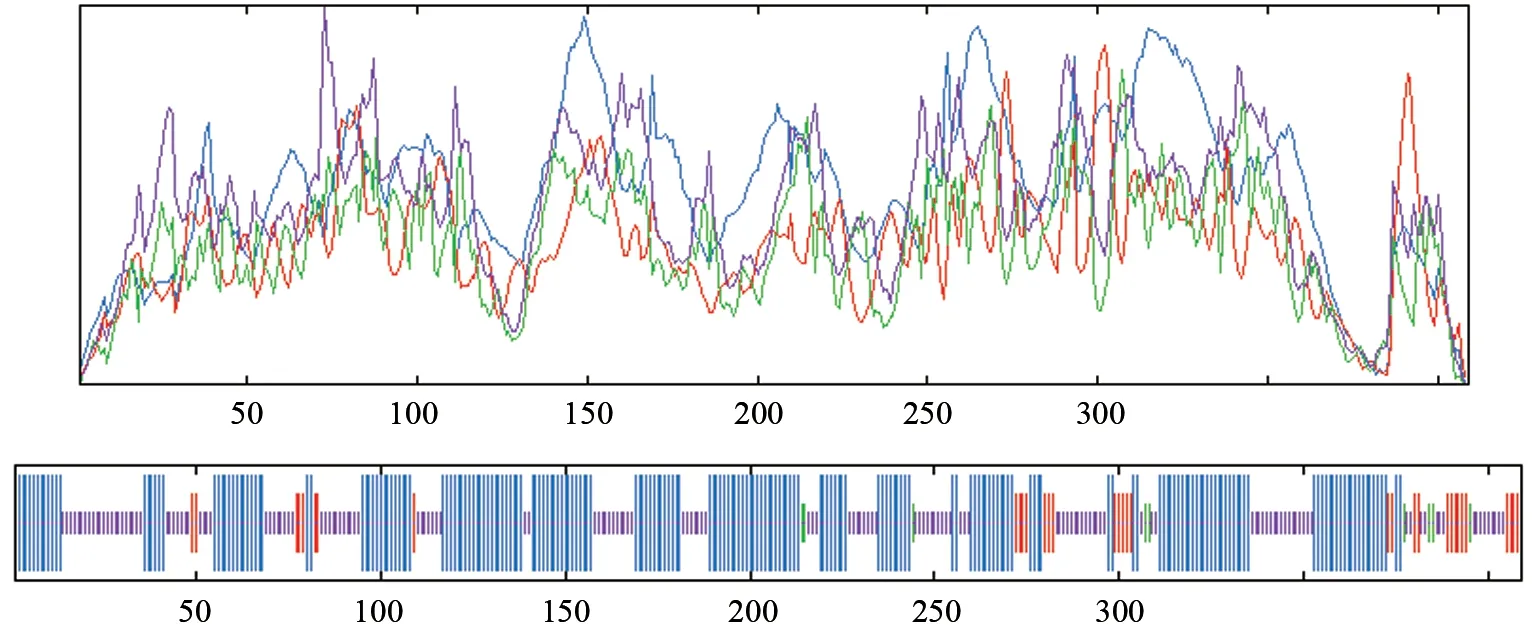
图9 SbTps2 蛋白的二级结构预测Fig.9 Prediction of the secondary structure of SbTps2 protein
2.4.6 SbTps2 蛋白多序列比对
SbTps2 蛋白与其他真菌类倍半萜合酶蛋白的多序列比对分析如图11 所示,使用DNA MAN 软件将SbTps2 蛋白与硬柄小皮伞、茶树菇和灰盖鬼伞的倍半萜合酶基因氨基酸序列进行多重序列比对(图11),比对结果表明,不同真菌的倍半萜结构域的组成上有个别差异,但是大部分残基十分保守。

图11 SbTps2 蛋白与其他真菌类倍半萜合酶蛋白的多序列比对结果Fig.11 Multiple alignment analysis of SbTps2 proteins among different fungi
2.4.7 SbTps2 系统发育分析
暴马桑黄倍半萜合酶蛋白与其他已经鉴定的物种倍半萜合酶[7]和NCBI 上相近的倍半萜合酶的系统进化分析如图12 所示,根据系统进化树聚类,可以看出SbTps2 蛋白与不同种物质的倍半萜合酶基因聚为一类,因此可以推断该基因为倍半萜合酶基因。

图12 SbTps2 蛋白NJ 系统发育进化树Fig.12 Neighbor-joining phylogenetic tree of SbTps2 proteins
2.5 MeJA对SbTps2 基因转录水平的影响
为了了解不同浓度MeJA 处理条件下,SbTps2基因在转录水平上的表达特征,以SbTps2-F3、SbTps2-R3为引物(表1),利用实时荧光定量PCR 技术分析了SbTps2基因的相对表达量。不同浓度MeJA 处理对SbTps2基因相对表达量影响结果如图13 所示。无菌水对基因的表达不产生影响,吐温抑制基因的表达(是无菌水的0.496 倍),茉莉酸甲酯浓度100 μM 至200 μM时,基因表达量呈上升趋势,并在MeJA 浓度为200 μM 时,基因表达量达到峰值(是无菌水的1.50倍)。之后随着MeJA 浓度的提高,基因表达量降低,MeJA 浓度为300 μM 时,基因表达量达到最低值。说明添加适宜浓度的MeJA 能促进基因的表达。
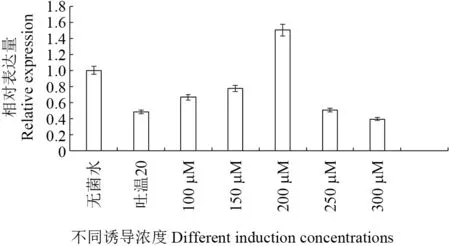
图13 不同浓度MeJA 诱导下SbTps2 基因转录水平Fig.13 The transcription level of SbTps2 under different concentrations of MeJA
3 结论与讨论
3.1 讨论
暴马桑黄是一种著名的药用真菌,其产生的倍半萜具有抗氧化和抗病毒活性,但是暴马桑黄中倍半萜的含量较低。通过对暴马桑黄倍半萜合酶基因进行诱导,可以达到增加倍半萜化合物产量的目的。
本研究克隆了暴马桑黄倍半萜合酶基因SbTps2的全长序列,其基因全长1 227 bp,编码407 个氨基酸。生物信息学分析结果表明,SbTps2蛋白无跨膜蛋白与信号肽,该结果与灵芝、鲍姆纤孔菌中报道的倍半萜合酶基因以及与SbTps1 蛋白结果一致[16-17,25];SbTps2 蛋白为不稳定蛋白,该结果与灵芝、紫芝里报道的倍半萜合酶蛋白以及与SbTps1 蛋白[9,17,25]结果一致,但是与鲍姆纤孔菌[16]中的结果不符;SbTps2 蛋白为亲水性蛋白,该结果与鲍姆纤孔菌中报道的倍半萜合酶蛋白以及与SbTps1 蛋白结果一致[16-17];预测保守结构域发现SbTps2 蛋白序列含有与SbTps1 蛋白一样的保守区,但是SbTps2 与SbTps1 蛋白的具有不同的功能[17];根据系统进化树的聚类,可以看出SbTps2 蛋白与不同种物质的倍半萜合酶基因聚为一类,其中SbTps2 蛋白与紫芝倍半萜合酶蛋白聚为一支,因为紫芝与暴马桑黄均属于担子菌,在进化关系上具有相似性。
此外,本研究克隆了SbTps2启动子,发现其含有2 处核心启动子区,且存在MeJA 响应元件CGTCA-motif,暗示该启动子能够响应MeJA 诱导表达。
暴马桑黄倍半萜含量的多少受基因的调控,而基因的表达受外界环境的影响。MeJA 是一种重要的信号分子,具有广谱的生理效应,以往的研究表明MeJA 不仅可以调节植物的生长发育、刺激植物次生代谢产物的合成,而且能够激活植物的防御反应以及防御基因的表达。然而关于MeJA诱导暴马桑黄菌体内倍半萜的合成以及关键酶基因表达的研究鲜见报道。本研究利用实时荧光定量PCR 技术分析SbTps2基因的相对表达量发现,当MeJA 浓度为200 μM时SbTps2基因的相对表达量与无菌水比提高了1.50 倍,这一结果表明,适宜浓度的MeJA 可以促进SbTps2基因的表达。在鲍姆纤孔菌中,用MeJA 进行诱导,提高了Unigene1790等基因的表达量[16];在灵芝中,MeJA 处理显著提高了HMGR、SQS和OSC基因的转录水平[26],与本结果相符。
综上,荧光定量结果在一定程度上说明适宜浓度的MeJA 可促进SbTps2基因的表达。研究结果为从分子水平上调控SbTps2基因表达量,同时为揭示暴马桑黄倍半萜合成机制的研究提供理论基础。然而,SbTps2基因究竟在倍半萜形成的过程起着怎样的作用,与信号通路中其他的基因如何相互作用共同调控响应MeJA 信号途径相关基因的表达有待深入的研究。
3.2 结论
本研究克隆了暴马桑黄倍半萜合酶基因SbTps2的全长序列,该基因全长为1 227 bp,编码407 个氨基酸,生物信息学分析结果表明,SbTps2蛋白无跨膜蛋白与信号肽;同时,本研究克隆了SbTps2启动子序列,启动子长度为1 220 bp,生物信息学分析发现其含有2 处核心启动子区,且存在MeJA 响应元件CGTCA-motif;利用实时荧光定量PCR 技术分析不同MeJA 浓度诱导下SbTps2基因的相对表达量,发现当MeJA 浓度为200 μM时SbTps2基因的相对表达量与无菌水比提高了1.50 倍,与鲍姆纤孔菌中MeJA 诱导倍半萜合酶基因Unigene1790的结论一致。结果表明,适宜浓度的MeJA 可以促进SbTps2基因的表达。
——青蒿素

