基于核糖体工程技术的泰乐菌素高产菌株的选育研究
牛 春,丁亚莲, 张 萍
(宁夏泰瑞制药股份有限公司,银川 750101)
泰乐菌素是一类大环类酯类抗生素,在弗氏链霉菌中发现[1]。泰乐菌素主要由泰乐菌素A、B、C、D 四个组分组成,其中泰乐菌素A为主要组分,并且生物活性最强[2]。泰乐菌素A的主体结构上有三个脱氧糖苷配基性质决定了这类药物的药学动力特性[3]。泰乐菌素是一种用于畜禽的抗菌药物,其抑菌机制是阻止肽酰基tRNA从mRNA的移位,使氨酰基tRNA不能结合到原位点,使细菌蛋白质合成受阻[4]。泰乐菌素对畜禽有明显的促生长作用,又不与人类产生交叉耐药性,在养殖业市场中需求较大,因此应用空间较为广阔[5]。在抗生素发酵产业中,有三项重要工艺,即菌种选育、发酵工艺与产品提纯工艺,其中菌种选育是源头工作,最为主要。核糖体工程育种技术主要作用于细胞的核糖体与RNA聚合酶,微生物次级代谢产物开始产生时,反应中ppGpp(鸟苷-5′-二磷酸-3′-二磷酸)才有明显积累,抗生素的抗性突变可激活依赖ppGpp积累来启动的菌体产生抗生素能力[6-7]。
核糖体对微生物次级代谢产物的合成有重要的调控作用,使用核糖体工程技术筛选高产突变株,其原理是利用作用于核糖体上的抗生素为药物标记,使核糖体蛋白或rRNA发生定向突变导致蛋白质合成能力的改变[8-9]。这种靶向核糖体或RNA聚合酶的自发抗药性突变改变了菌落形态而引起发酵产量的改变[10]。刘华华等利用核糖体工程技术将阿维拉霉素的产量提高了1.8倍[11]。Wang等用了7或8种药物的耐药性获得产生了大量的聚酮类放线菌素抗生素,比野生型产生的水平高出180倍[12]。本文使用核糖体工程技术筛选泰乐菌素高产突变株,在泰乐菌素高产菌的选育过程中,采用递推的方式,从单一抗性突变株到多重抗性突变株,使泰乐菌的产素能力有了很大的提高。
1 材料与方法
1.1 材料
1.1.1 菌种来源 泰乐菌素产生菌株T19-805,由宁夏泰瑞制药股份有限公司技术中心提供。
1.1.2 试剂 链霉素、庆大霉素、夫西地酸、硫链丝菌素、林可霉素、遗传霉素、巴龙霉素,以上抗生素均购于Sigma公司。
1.1.3 培养基及培养条件 斜面和分离平板培养基(g/L):淀粉2.5、蛋白胨2.0、氯化镁0.5、硫酸亚铁0.1、硫酸锌0.1、琼脂2。调节pH值为7.0~7.2, 培养温度28±1 ℃,培养湿度35%~45%,培养周期9~15 d。
种子培养基(g/L):黄豆饼粉4、酵母抽提粉2.5、玉米浆3、碳酸钙4、豆油4。调节pH值为7.6~7.8, 培养温度28±1 ℃,培养湿度35%~45%,摇床转速220 r/min,培养周期46~48 h。
发酵培养基(g/L):玉米淀粉15、玉米蛋白粉15、棉籽蛋白粉13、甜菜碱盐酸盐0.62、磷酸氢二铵0.5、氯化钾1.2、氯化钠1.1、碳酸钙20、豆油45。调节pH值为7.6~7.8,培养温度28±1 ℃,培养湿度为35%~45%,摇床转速220 r/min条件下,培养周期6~7 d。
1.2 方法
1.2.1 单孢子悬液的制备 取出发菌株T19-805新鲜斜面孢子,放入带有玻璃珠的三角瓶中,加适量的生理盐水,于28 ℃,150 r/min振荡15~20 min,使孢子充分分散,经脱脂棉过滤,制得单孢子悬液,用血球计数板计数,控制孢子浓度为108~1010cfu/mL备用。
1.2.2 抗生素最小抑制浓度(MIC)的确定 取1.2.1项制备好的单孢子悬浮液0.1 mL分别涂布于含有不同浓度的7种抗生素(链霉素、庆大霉素、夫西地酸、硫链丝菌素、林可霉素、遗传霉素、巴龙霉素)分离平板上,以不含抗生素的培养基平板为对照,28±1 ℃培养15~18 d。观察并记录不同平板上的菌落生长状况,未长菌落的抗生素最小浓度即为抗生素对该菌的最小抑制浓度(Minimum inhibition concentration, MIC)。并统计致死率与正突变率。
致死率(%)=(对照组菌落数-抗生素处理后的菌落数)/对照组菌落数×100%,正突变率(%)=效价高于对照的正突变菌株数/所测菌株总数×100%。
1.2.3 单重抗药性突变株的选育 挑取临界MIC的抗生素平板上长出的单菌落30株,划在含同等剂量抗生素的试管斜面中,28±1 ℃培养9~15 d。将生长起来的斜面孢子用无菌接种铲刮取适量接种于种子培养基,28±1 ℃培养46~48 h,以15%的接种量转入发酵培养基(500 mL的三角瓶,装量为45 mL),28±1 ℃培养周期6~7 d,放瓶提取发酵产物检测效价,筛选高产突变株保藏备用。
1.2.4 双重抗药性突变株的筛选 以1.2.3项获得的单重抗性高产突变菌株为出发菌株,按1.2.2项制备成孢子菌悬液,稀释后涂布在含两种临界浓度抗生素平板上,28±1 ℃培养9~15 d,生长出的菌落即为双重抗性突变株。待菌落长成后挑取划在含同等剂量的双重抗生素斜面上。发酵摇瓶验证筛选高产突变株保藏备用。
1.2.5 多重抗药性突变株的筛选 以1.2.4项获得的双重抗性高产突变菌株为出发菌株,按1.2.1项制备成孢子菌悬液,稀释后涂布在含四重临界浓度抗生素平板上,28±1 ℃培养9~15 d,生长出的菌落即为四重抗性突变株。待菌落长成后挑取划在含同等剂量的四重抗生素斜面上。发酵摇瓶验证筛选高产突变株保藏备用。
1.2.6 高产菌株遗传稳定性试验:将泰乐菌素高产菌株连续培养5代,摇瓶发酵后测定泰乐菌素的化学效价,验证其是否具有遗传稳定性。
2 结果与分析
2.1 抗生素最小抑制浓度的确定 以不含抗生素的空白平板上菌落数和菌落外观为对照,与含不同抗生素浓度平板菌落进行对比,不同抗生素浓度对出发菌株T19-805孢子最小抑制浓度的测定,结果见表1。

表1 不同抗生素的致死率和正突变率
由表1结果可知,几种抗生素对泰乐菌株都有一定的抑制作用,不同抗生素对其抑制的最小浓度不同。随着抗生素浓度的不断增加,菌株在筛选平板上的单菌落数逐渐减少,菌落外观也逐渐变化,在抗生素浓度较小时对菌落形态影响较小,菌落大、边缘整齐、孢子白润丰富;第二次增加一个梯度的抗生素浓度平板上的菌落稍小、孢子较干、菌落成典型的馒头型、边缘整齐;第三次增加一个梯度的抗生素浓度菌落较小,挑取时发现是一层不易划碎的结皮;第四次加大抗生素浓度,平板上的菌落很少,而且都是基质,没有白孢子形成。第五次与第六次加大抗生素浓度时,平板上都没有单菌落形成,全部死亡。所以链霉素、庆大霉素、夫西地酸、硫链丝菌素、林可霉素、遗传霉素与巴龙霉素的最小抑制浓度分别为2.6、2.8、2.7、0.35、4.0、0.25、0.5 μg/mL。正突变率分别约为27.3%、23.6%、24.2%、28.3%、28.5%、26.1%与24.6%。从正突变率分析不同抗生素对泰乐菌株产生效果由高到弱的顺序依次为林可霉素、硫链丝菌素、链霉素、遗传霉素、巴龙霉素、夫西地酸与庆大霉素。
2.2 单重抗性突变株筛选结果 在临近最小抑制浓度的每种抗生素平板上挑取单菌落划在含同等浓度的抗生素试管斜面上,7种抗生素每种挑取30株,共210株,斜面孢子培养至成熟。经发酵摇瓶验证,结果见图1。

图1 不同抗生素突变株的筛选结果
由图1可知,210株中有3株菌的效价达到13000 μg/mL以上,分别是林可霉素、硫链丝菌素与链霉素的单重抗性突变株,菌株号及效价分别为Tlin-30(13256 μg/mL)、Ttsp-24(13118 μg/mL)、Tstr-15(13077 μg/mL)。其中Tlin-30(13256 μg/mL)效价最高,将出发菌株T19-805(12000 μg/mL)提高了10.5%。以Tlin-30为菌源进行双重抗生素选育。
2.3 双重抗生素突变株筛选结果 以Tlin-30为出发菌株,分离在含林可霉素与硫链丝菌素最小抑制浓度的双重抗生素平板上,等菌落长成后挑取单菌落30株进行验证,结果见图2。
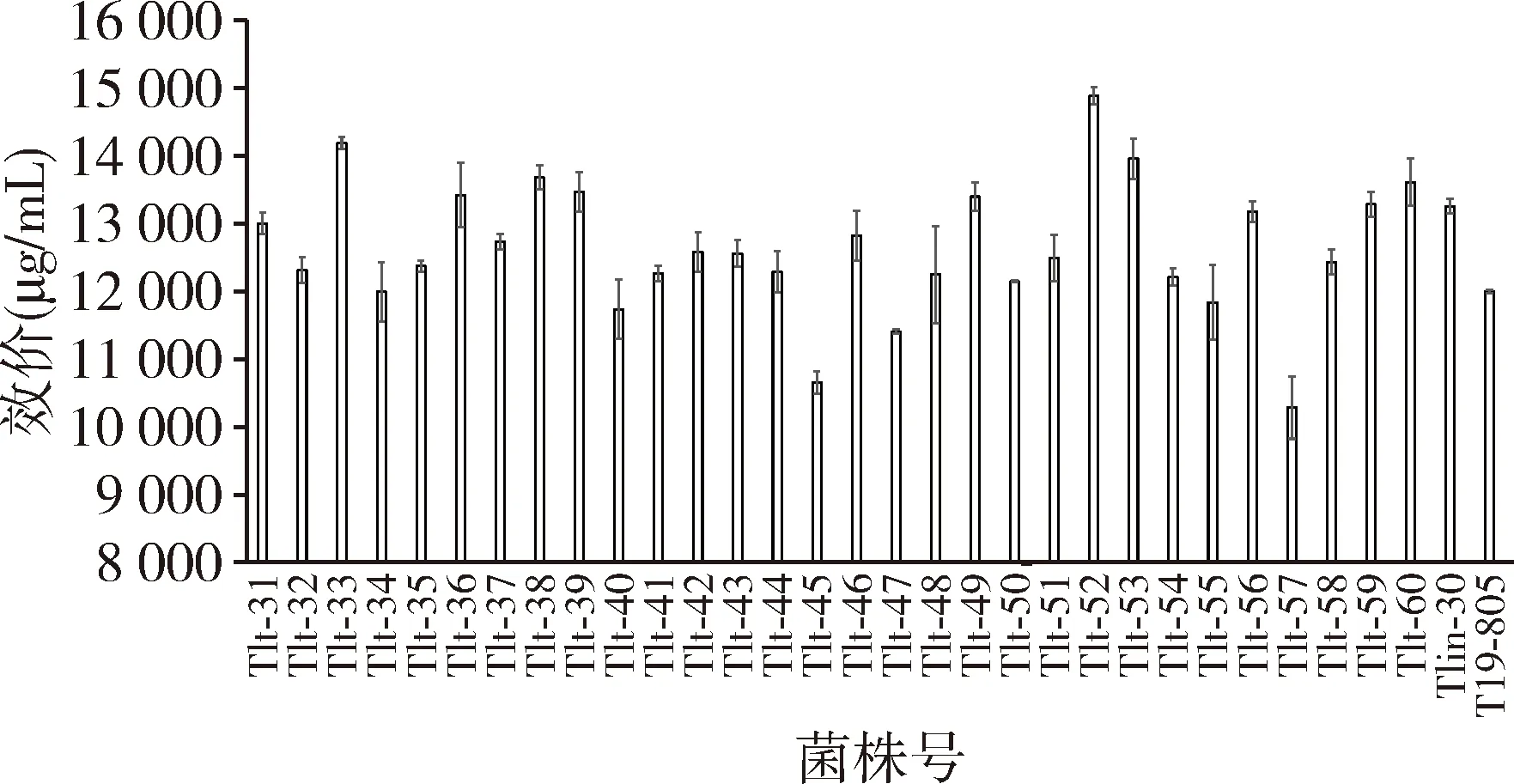
图2 双重抗生素突变株的筛选结果
由图2可知,含林可霉素与硫链丝菌素双重抗生素突变株中有3株菌的效价达到14000 μg/mL以上,其中Tlt-52(14885 μg/mL)效价最高,将单重抗生素标记菌株Tlin-30(13256 μg/mL)提高了12.3%,将原始出发菌株T19-805(12000 μg/mL)提高了24.0%。所以选菌株Tlt-52进行多重抗生素突变株的筛选。
2.4 多重抗生素抗性突变株的筛选 随着抗生素种类不断增加,筛选获得的突变株耐药性逐渐增强,所以本轮筛选同时多增加了两种抗生素,按正突变率由高到低顺序选用链霉素与遗传霉素两种抗生素,结果见图3。随着不同抗生素的逐级添加,抗性突变株的效价也逐步增高,结果见图4。

图3 四重抗生素突变株的筛选结果
由图3可知,在含四种抗生素的突变株中有1株菌的效价明显高于其他菌株,菌种号为Tltsg-69,效价达到16185 μg/mL。由图4可知,原始出发菌株T19-805经林可霉素单重抗生素突变,逐级增加硫链丝菌素、链霉素与遗传霉素,高产突变株的效价不断增加。突变株Tltsg-69(16185 μg/mL)将单重抗生素标记菌株Tlin-30(13256 μg/mL)提高了22.1%,将双重抗生素标记菌株Tlt-52(14885 μg/mL)提高了8.7%,将原始出发菌株T19-805(12000 μg/mL)提高了34.9%。

图4 出发菌株T19-805逐级增加抗生素时泰乐菌素产量不断增长
2.5 高产突变株的遗传稳定性分析 将筛选到的高产菌株在斜面上连续培养4代,各代菌种经行摇瓶发酵培养测其化学效价,结果见表2。

表2 Tltsg-69菌株遗传稳定性实验
由表2结果可知,突变株Tlpsg-69前四代的化学效价基本稳定,具有较好的遗传稳定性,第五代开始稳定性较差,为了保证生产质量,一般选取前两代斜面使用。
2.6 高产突变株与出发菌株的菌丝形态比较 种子液的菌丝用美兰染色,用光学显微镜,在100倍的油镜下观察,结果见图5。

图5 出发菌株T19-805与四重抗性突变株Tlpsg-69在种子液中指数增长时期的菌丝形态特征
由图5可知,将突变株与出发菌株同时培养,观察指数生长期种子液(发酵罐所需的最佳种子液)的菌丝形态,四重抗性突变株Tltsg-69的菌丝较粗、圆润、着色深、舒展,网织稍疏松但不紧密,末端菌丝伸展有力,芽枝较长连成网织,菌丝网成大垛生长。出发菌株T19-805的菌丝较弯曲、稍细,末端菌丝舒展程度差,菌丝芽多较短。所以,四重抗性突变株的菌丝特征明显优于原始出发菌株的菌丝,菌丝形态的改善是发酵产量明显提高的有力保障。
2.7 豆油加量对泰乐菌素发酵产量的影响 在实验过程中,发现高产稳定突变株Tltsg-69的发酵液中豆油的利用率较差,发酵结束后发酵液中含有较多的油脂,而原始菌株发酵液对豆油利用较充分。所以,推断突变株对豆油的消耗较低(图6)。

图6 豆油加量对泰乐菌素发酵产量的影响
由图6可知,豆油加量对发酵产量影响较为明显,随着豆油加量不断增大,发酵产量先升高后降低。豆油的加量为30 g/L时突变株Tltsg-69的产量最高为16507 μg/mL,而豆油的加量为45 g/L时出发菌株T19-805的产量最高为12000 μg/mL。所以突变株Tltsg-69的发酵液中豆油最适加量为30 g/L,对豆油消耗减少了33.3%,这样就降低了原材料的成本。最终突变株Tltsg-69产量达到16507 μg/mL,将原始出发菌株T19-805(12000 μg/mL)提高了37.6%,具有很好的工业化生产价值。
3 小结与讨论
本研究共选用了7种已报道对链霉菌突变有效的抗生素,分别是链霉素、庆大霉素、夫西地酸、硫链丝菌素、林可霉素、遗传霉素与巴龙霉素。这7种抗生素对泰乐菌株都有一定的抑制作用。最小抑制浓度分别为2.6、2.8、2.7、0.35、4.0、0.25、0.5 μg/mL。正突变率分别约为27.3%、23.6%、24.2%、28.3%、28.5%、26.1%、24.6%。从正突变率分析对泰乐菌株产量有明显提高作用的抗生素有4种,分别为林可霉素、硫链丝菌素、链霉素、遗传霉素。
在单重抗生素突变株中共挑选了210株菌,以其中1株高产突变株Tlin-30(13256 μg/mL)为出发菌株进行双重抗生素抗性突变株的筛选,获得双重抗生素高产突变株Tlt-52(14885 μg/mL),再以其进行四重抗生素突变株的筛选,在含四种抗生素的突变株筛选中获得1株高产突变株Tltsg-69,效价达到16185 μg/mL,将单重抗生素标记菌株Tlin-30(13256 μg/mL)提高了22.1%,将双重抗生素标记菌株Tlts-52(14885 μg/mL)提高了8.7%,将原始出发菌株T19-805(12000 μg/mL)提高了34.9%。突变株Tltsg-69前四代的化学效价基本稳定,具有较好的遗传稳定性。从种子液指数生长期的菌丝形态特征分析,四重抗性突变株Tltsg-69的菌丝明显好于原始出发菌株的菌丝,种子液菌丝形态的改善是发酵产量明显提高的有力保障。
豆油加量对发酵产量影响较为明显,随着豆油加量不断增大,发酵产量先升高后降低。豆油的加量为30 g/L时突变株Tltsg-69的产量最高为16507 μg/mL,而豆油的加量为45 g/L时出发菌株T19-805的产量最高为12000 μg/mL。所以突变株Tltsg-69的发酵液中豆油最适加量为30 g/L,对豆油消耗降低了33.3%,这样就降低了原材料的成本。最终突变株Tltsg-69产量达到16507 μg/mL,将原始出发菌株T19-805(12000 μg/mL)提高了37.6%,所以利用核糖体工程育种方法有效的提高泰乐素产量。
微生物次级代谢的调控基因可能被激活,提高次级代谢产物的合成能力,是一种遗传性改变[13]。研究发现,抗性突变是由于编码核糖体蛋白S12的rpsL基因或其它基因发生突变导致核糖体或核糖体蛋白发生改变而产生[14]。井冈霉素[15],去甲基万古霉素[16]利用带链霉素抗性标记均筛到产素较高的菌株。核糖体工程育种技术需要的时间、成本较少,在菌株改良方面应用较为简便。虽然本文应用核糖体工程技术选用了几种抗生素处理泰乐菌素产生菌株,经过大量发酵摇瓶筛选出高产突变菌株,但对于编码核糖体蛋白的基因、突变位点的研究较少,有关的诱导机制需继续加强学习研究。

