siRNA-HIF1α对结直肠癌SW480细胞转录水平的调节作用
朱梓维,白宇新,李云霞,孙冶,刘光焱,杨彪*
(1.沈阳医学院基础医学院2018级临床医学专业本科生,辽宁 沈阳 110034;2.沈阳医学院基础医学院病原生物学教研室;3.沈阳医学院附属中心医院呼吸内科)
中国国家癌症中心发布的数据显示,我国2018年有393万人被确诊患有癌症,其中死亡率前五位的癌症分别为肺癌、胃癌、结直肠癌、肝癌和乳腺癌[1]。我国结直肠癌的发病率和死亡率均保持上升趋势[2-3]。因此,探索结直肠癌的发生、发展机制,寻找特异性的早期诊断标志物及潜在的治疗靶点对于提高患者健康,提升患者生活质量具有重要意义。
结直肠癌的发生发展是一个多因素、多阶段、多环节参与的复杂过程,在此过程中肿瘤微环境(tumor microenvironment,TME)中各种成分之间的相互作用起重要作用。缺氧微环境是肿瘤生长所必需的,这个过程中缺氧诱导因子(hypoxia inducible factor,HIF)发挥了关键作用。研究发现,HIF-1α与VEGF表达呈正相关,而且在结直肠癌中的表达差异有统计学意义[4]。在低氧条件下,癌症相关成纤维细胞通过HIF-1α和转化生长因子β的协同作用,可诱导结直肠癌化疗耐药[5]。
肿瘤耐药的发生机制非常复杂,是当前临床治疗所面临的最主要问题之一。本研究通过沉默转录应激转录因子HIF1α的表达,转录组分析差异表达基因,预测可能的肿瘤耐药分子机制,为全面了解和应对癌症的耐药提供线索。
1 材料与方法
1.1 细胞培养 人结直肠癌细胞系SW480购置于中国科学院,RPMI 1640培养基(含10%FBS,1%青霉素和链霉素)5 ml,吹匀后转入25 cm2螺口培养瓶,37℃,5%CO2孵箱培养。
1.2 细胞转染 细胞计数,1×106/孔,接种到6孔细胞培养板(康宁公司),当细胞密度达75%时进行转染。实验所用的siRNA-HIF1α引物从上海吉玛公司购得。RNA Oligo序列如下:siRNA-HIF1α-830:上游引物:5′-GGAAAUGAGAGAAAUGCUU TT-3′;下游引物:5′-AAGCAUUUCUCUCAUUUC CTT-3′。siRNA-HIF1α-934:上游引物:5′-GGAA AUGAGAGAAAUGCUUTT-3′;下游引物:5′-AAGC AUUUCUCUCAUUUCCTT-3′。siRNA-HIF1α-1067:上游引物:5′-GCUGAUUUGUGAACCCAUUTT-3′;下游引物:5′-AAUGGGUUCACAAAUCAGCTT-3′。阴性对照:上游引物:5′-UUCUCCGAACGUGUCAC GUTT-3′;下游引物:5′-ACGUGACACGUUCGGA GAATT-3′。siRNA细胞转染步骤如下:(1)将GPtransfect-Mate转染试剂5μl与195μl的RPMI 1640无血清培养基混匀于1.5 ml的离心管中,静置5 min。(2)将10μl siRNA与190μl RPMI 1640无血清培养基混匀于1.5 ml的离心管中,静置5 min。(3)将上述(1)步骤混匀静置的转染试剂和(2)步骤混匀静置的siRNA再次混匀,静置20 min。(4)将6孔板培养的细胞更换RPMI 1640无血清培养基1.8 ml。(5)将各组的孵育试剂加入到更换无血清培养基的细胞中,37℃,5%CO2孵箱培养6 h,更换完全培养基。(6)48 h后提取总RNA。
1.3 总RNA提取,电泳质检,逆转录cDNA及Real-time PCR(qPCR)验证转染siRNA结果。
1.3.1 Trizol法提取总RNA 采用Trizol Reagent试剂盒(美国Thermo Fisher Scientific公司)提取细胞总RNA。(1)消化收集约有100μl体积的SW480细胞株,加入1ml Trizol反复吹匀,室温静置5 min;(2)加五分之一体积氯仿进行分离,混匀15 s,室温5 min。4℃,12 000×g离心15 min;(3)转水相到EP管,加入等体积异丙醇,混匀10 min,进行RNA沉淀。4℃,12 000×g离心10 min;(4)弃上清,加1 ml冰预冷75%乙醇(DEPC水配制)。4℃,7 500×g,5 min(2次)。弃上清,室温干燥5~10 min;(5)DEPC水50μl在55~60℃水中溶解RNA。
1.3.2 RNA质量鉴定(1)2%琼脂糖凝胶配制:称取琼脂粉1 g,倒入锥形瓶中,加50 ml 1×TAE电泳缓冲液,摇匀后微波炉加热1 min取出放凉至约50℃,加入2.5μl核酸染料,充分混匀,倒入电泳槽中,胶完全凝固后备用。(2)将凝胶放入电泳槽中,加入足量1×TAE电泳缓冲液,没过凝胶,取一定量RNA与10×Loading buffer按10∶1比例混匀后加入凝胶孔。(3)电压80 V,电泳约15 min,于凝胶成像仪紫外光下成像,观察条带边缘情况、28S和18S条带亮度以及有无DNA污染。
1.3.3 逆转录cDNA 将提取的2μl总RNA逆转录为cDNA,使用逆转录试剂盒。应用GoScript Reverse Transcription System试剂盒(Promega),获得cDNA。
1.3.4 qPCR验证siRNA-HIF1α转染结果 通过ABI 7500 real time PCR扩增仪检测验证测序得到的筛选基因。qPCR引物序列如下:HIF1α,上游引物:5′-CCACAGAAACTACCTTCAACTCC-3′,下游引物:5′-GTGATCTCCTTCTGCATCCTGT-3′;GAPDH,上游引物:5′-GAAGGTGAAGGTCGGAGTC-3′,下游引 物:5′-GAAGATGGTGATGGGATTTC-3′。通过ΔΔCT法进行样品间相对量的比较。
1.4 细胞形态观察 在普通光学显微镜下观察细胞的形态特征改变。
1.5 RNA-Seq 转录组高通量测序由华大基因公司完成。DNBSEQ平台一共测了6个样品(siRNA干扰实验组3个样品重复,对照组3个样品重复)。测序文库构建、簇生成、上机测序、数据分析。依据结果对siRNA-HIF1α-934干扰的结直肠癌SW480细胞株的差异表达基因的GO(Gene ontology)聚类、KEGG(Kyoto Encyclopedia of Genes and Genomes)等Pathway分析,获得筛选基因。
1.6 qPCR验证筛选基因 在转录水平对RNA-Seq结果的Pathway分析及筛选基因进行实验验证。通过ABI 7500 real time PCR扩增仪检测,验证测序得到的筛选基因,6个上调基因(H2AC19、SULT1A4、GALNT4、H3C14、EIF3CL和CT45A6)和3个下调基因(OR2A4、CSNK2A3和MIOX)。引物序列见表1。

表1 qPCR的引物序列
1.7 统计学方法 使用GraphPad Prism 6(GraphPad Software,CA,USA)对实验数据进行分析。数据报告为3个独立实验的均数±标准差。使用2组的非配对双尾Student′st检验进行统计比较。P<0.05为差异有统计学意义。
2 结果
2.1 qPCR验证siRNA-HIF1α的敲除结果 将siRNA-HIF1α-830、siRNA-HIF1α-934、siRNAHIF1α-1067分别转染人结直肠癌细胞系SW480,提取siRNA-HIF1α和对照组细胞株的4种细胞的总RNA,逆转录为cDNA,通过qPCR验证3种siRNAHIF1α的敲除结果。通过分析HIF1α的基因表达水平,发现siRNA-HIF1α-934敲除效果最为显著,即mRNA的表达水平下调1倍以上,见图1。

图1 qPCR检测3种siRNA-HIF1α的敲除结果
2.2 转染后细胞形态 与转染阴性对照引物相比较,转染siRNA-HIF1α-934组细胞,其形态与对照组基本无太大的变化,但是通过计数发现SW480细胞的伪足较对照组有所减少,但细胞的体积无显著改变,见图2。

图2 siRNA-HIF1α转染SW480细胞的形态观察(100×)
2.3 RNA-Seq结果
2.3.1 差异表达基因分析 通过对6个样品(siRNA干扰实验组3个样品重复,对照组3个样品重复)RNA-Seq结果分析,每个样品平均产出7.25 G数据,一共检测到17 230个基因。如图3,得到了差异表达基因共计3 900个,其中上调表达1 292个,下调表达1 608个。为了验证差异表达基因的mRNA表达水平,从RNA-Seq的结果中随机选择9个显著差异基因进行qPCR检测,包括6个上调基因(H2AC19、SULT1A4、GALNT4、H3C14、EIF3CL和CT45A6)和3个下调基因(OR2A4、CSNK2A3和MIOX)。通过实验证实了RNA-Seq的分析结果,且趋势与高通量测序数据一致,见表2。

图3 RNA-Seq分析的差异表达基因火山图

表2 siRNA-HIF1α-934干扰SW480细胞后的差异基因表达情况
2.3.2 差异基因表达富集分析 通过Pathway分析表明,20种通路受这些差异表达基因的调控影响,主要包括内质网蛋白加工通路、肌动蛋白细胞骨架及黏附调节通路和叉头状转录因子(FoxO)信号通路等通路(图4A)。差异表达基因的功能如图4B所示,这些差异基因的转录物最常见的功能是调控细胞内液、细胞质、黏附作用、核糖体、细胞骨架和线粒体基质等。
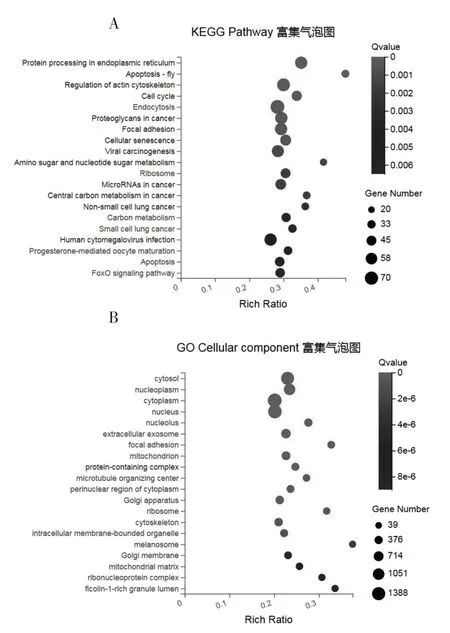
图4 差异基因表达富集分析图
3 讨论
结直肠癌在全球最常见癌症中排名第三,每年报告的新病例超过100万,约有600 000例患者死于该病[6]。患者耐药性的产生仍然是结直肠癌患者生存率低的重要原因。由于耐药的发生及多重耐药的出现,经常导致化疗的失败,从而导致肿瘤的复发和转移,严重影响人民群众的健康。肿瘤耐药机制是一个复杂的过程,其影响因素较多,主要包括个体遗传差异、肿瘤微环境、肿瘤干细胞、药物失活、药物吸收减少、抗肿瘤药物代谢改变等。恶性肿瘤的重要特征就是缺氧微环境,在缺氧环境下HIF-1α起到了重要的作用,与肿瘤的生长情况以及侵袭能力密切相关。因此,HIF-1α在结直肠癌中参与了多种与肿瘤相关的途径的调节,促进了肿瘤的发生发展以及侵袭迁移过程,导致了患者的不良预后[7]。
缺氧微环境是恶性肿瘤的重要特征,实体瘤中的肿瘤细胞会表达HIF-1转录因子,而HIF-1在缺氧环境下起到了重要的作用,与肿瘤的生长以及侵袭能力密切相关。研究证明,肿瘤的发生和转移与多种机制有关,包括血管生成、糖酵解、细胞侵袭和细胞存活等,肿瘤细胞内的低氧环境促进了这些环节的发展[8-10]。本研究中,我们使用siRNA技术获得了HIF1α低表达的细胞株,以期研究肿瘤细胞在引发HIF-1α这类治疗药物耐药后,肿瘤发展的调控通路改变情况,解析其可能的肿瘤耐药分子机制。研究发现,与对照组相比,siRNA-HIF1α-934组细胞的伪足明显减少,同时肿瘤细胞在面对HIF1α低表达调整了其部分的调控通路,如上调了内质网加工蛋白通路、激动蛋白细胞骨架及黏附调节通路和叉头状转录因子信号通路等通路基因的表达。所以,通过本研究了解和应对癌症的耐药,能够有效提高患者健康、提升患者生活质量,对于癌症患者和所属家庭来说意义重大。
低表达HIF1α后,内质网蛋白质加工通路调控活性增强。细胞合成的蛋白质经过内质网的修饰后,参与细胞功能和命运的调控过程。当内质网无法完成功能蛋白的修饰时,细胞就会受到内质网应激[11]。引发范围广泛的细胞紊乱,破坏内质网中蛋白质修饰的效率,并导致错误折叠蛋白质的积累,从而触发未折叠蛋白质反应(unfolded protein response,UPR)。内质网应激发生的同时,UPR最初发出适应性输出,减少负荷并增加内质网分泌途径的能力,以恢复内质网稳态。面对更为强烈的内质网压力,UPR会发出促炎和死亡信号,导致细胞死亡[12]。肿瘤块内的恶劣微环境条件,如营养缺乏、氧限制、高代谢需求和氧化应激,会干扰内质网的蛋白质折叠能力,这些条件可以促进内质网中错误折叠蛋白的积累从而引发“内质网应激”的状态[13]。内质网应激传感器的持续激活赋予恶性细胞更大的致瘤性、转移性和耐药性。研究中我们发现,siRNA-HIF1α-934组细胞的KEGG分析,分值最高就是内质网蛋白通路的改变。说明当SW480细胞面对低HIF1α表达的情况,将启动新一轮的蛋白修饰程序,通过加强对内质网的调控,编辑新的修饰蛋白,从而在转录水平实现新的微环境的适应。
低表达HIF1α后,肌动蛋白细胞骨架及黏附调节通路发生显著的改变。上皮-间质转化(epithelial-mesenchymal transition,EMT)是癌症进展过程中重要的细胞程序。肌动蛋白调控细胞骨架介导了细胞形状和极性所必需的结构框架等生物学功能。研究表明,肌动蛋白重塑是转移性癌细胞中EMT的加速剂[14]。当敲低HIF1α表达使得肌动蛋白细胞骨架发生重塑,说明抑制HIF1α表达可以增加肌动蛋白细胞骨架的动力调控的异常,同时肿瘤细胞通过相应转录通路调节肌动蛋白细胞骨架,导致了恶性肿瘤的迁移能力增强。转移的早期步骤涉及细胞内信号和微环境的协调,通过细胞形态的变化,以允许细胞从原发部位分离。黏着斑在细胞成熟过程中通过黏附作用及改变分子组合来产生牵引并转换信号驱动细胞迁移,细胞的黏附能力下降是肿瘤转移的重要因素之一[15]。实验中,我们敲低了HIF1α表达,同时发现该组细胞的定植能力减弱,即细胞间彼此交流的伪足开始减少,说明细胞已经开启了一种新的迁移模式。恶性肿瘤细胞利用这种低的迁移阻力侵入邻近组织和血管系统,并最终转移。
低表达HIF1α后,FoxO信号通路活性上调。Fox蛋白家族是一大类在化疗耐药和EMT中起重要作用的转录因子。当细胞发生氧化应激时,FoxO转录因子可大量激活,能够控制多种特定的基因表达程序。FoxO可通过磷酸化、乙酰化、泛素化和甲基化等多种修饰方式,同时参与PI3K/Akt、Wnt/β-catenin等信号通路的作用,调控肿瘤细胞的增殖、凋亡、EMT及能量代谢等多种生物学行为。研究发现FOXC1和FOXQ1通过调节关键EMT相关分子促进肝细胞癌转移[16-17]。FOXD1在包括胃癌在内的几种实体瘤中被发现失调,并抑制NF-κB活化,特别是p65亚单位的活化。据报道,FOXM1可调节卵巢癌的EMT、细胞干性和化疗耐药性[18]。FOXL2是FOX蛋白家族的另一成员,FOXL2在对常规化疗耐药的进行性和复发性颗粒细胞肿瘤中也被发现上调[19-20]。本研究沉默转录应激转录因子HIF1α的表达,发现肿瘤细胞开启了FOX的调控,通过激活FOX转录因子调控的信号通路,使得肿瘤细胞发生增殖和转移,从而发展成为新一轮的耐药细胞株。所以,在肿瘤药物的研发过程中应加入伴侣药物的协同作用的研究,预测抗肿瘤药物耐药株的出现,同时加入另外一种协同成分,以期更好地抑制肿瘤的增殖和转移。
肿瘤耐药的发生机制非常复杂,其仍然是当前临床治疗所面临的最主要问题之一。通过生物信息学分析发现,沉默转录因子HIF1α的表达,可通过激活FoxO转录因子等信号通路,促进肿瘤细胞发生增殖和转移。我们接下来将针对HIF-1α这类治疗药物进行肿瘤耐药性分析,解释其可能的肿瘤耐药分子机制,以全面了解和应对癌症的耐药,此途径将有效提高患者健康、提升患者生活质量,是新的治疗选择和生存希望,具有广泛而深远的社会意义。
——疾病防治的新靶标

