分枝杆菌液体培养和微孔板法分枝杆菌药敏实验在结核感染中的应用*
刘金花 罗一钧 彭海英 刘平庆
(江西省赣州市第五人民医院检验科 赣州 341000)
作为临床常见感染性疾病,结核分枝杆菌潜伏感染(结核感染)主要指的是机体受到结核分枝杆菌感染所致的一系列临床综合征,为进一步明确是否存在结核病,需要配合细菌学、影像学检查等[1]。临床强调对于合并结核感染患者应积极进行药物治疗,促进症状缓解。近年来随着结核分枝杆菌耐药的增加,为结核感染防治也增加了一定的难度[2]。痰培养是临床诊断结核感染的金标准,但传统固体罗氏培养及药敏试验周期长,不利于早期诊断与治疗,因此寻找一种快捷、有效的诊断方式尤为重要。分枝杆菌液体培养较传统固体罗氏培养所用时间短,且无须进行磨菌可直接对接药敏试验,具有较高的安全性[3~4]。微孔板法即微量肉汤稀释法能够测定药物最低抑菌浓度(MIC),为治疗药物选择及剂量确定提供参考[5]。为探究其在结核感染中的应用价值,本研究收集60 例我院结核感染患者痰标本病例进行研究。现报道如下:
1 资料与方法
1.1 一般资料 选取我院2021 年6~8 月收治的60例肺结核门诊疑似和确诊后复发结核感染患者为研究对象,采集患者痰标本,其中34 例为疑似新发患者,26 例为已经确诊后复诊患者,性别分布男33例、女 27 例;年龄 18~79 岁,平均年龄 51.6 岁;体质量指数(BMI)18~27 kg/m2,平均 BMI(23.36±3.24)kg/m2。入组标准:结核感染诊断参照《WS196-2017 结核病分类》标准[6]者;年龄≥18 岁者;均在医院接受痰培养等相关检测者;患者交流无障碍,可配合本研究者。
1.2 方法
1.2.1 试剂与仪器 痰消化缓冲液(2%NaOH,0.05 M 柠檬酸钠)100 ml/瓶,2 瓶;N-乙酰 -L-半胱氨酸(NALC)0.5 g/管,2 管。每管 NALC 溶于一瓶痰消化缓冲液,完全溶解后使用(溶解后24~36 h 内使用)。10 倍磷酸盐缓冲液浓缩液pH 6.8,50 ml 10 倍磷酸盐缓冲液浓缩液与450 ml 0.9%无菌生理盐水混合后使用。恒温培养箱;生物安全柜;高压消毒锅;带滤芯灭菌洗头;移液器;BD BACTEC MGIT960;50 ml 离心管离心机;96 孔带盖 U 型板;OADC;7H9肉汤;阿米卡星;利福平;异烟肼;左氧氟沙星;液体培养管;固体罗氏培养基药敏管;酸性固体罗氏培养基。
1.2.2 标本处理与检测 指导患者分别于清晨、晚间以及即时接受痰标本采集,将3 次获得的痰标本进行涂片染色处理,根据痰标本的黏稠程度,加不同体积的2%NALC-NaOH 消化液入前处理管中,脓痰、浑浊的痰需加3 倍体积的消化液,稀薄痰则加等量消化液。旋紧容器螺旋盖。接通涡旋振荡器电源,在生物安全柜内,将处理管在涡旋振荡器上振荡50 s 左右,直至标本充分液化。将前处理管置于试管架内,室温静置15 min,偶尔用手轻轻地摇动,加入pH 6.8 的 PBS(0.067 mol/L)缓冲液至 40 ml 标记的刻度,混匀。设定制冷温度,3 000×g离心15 min,将上清液倒入防喷溅的、含有消毒剂的容器中,用20 ml注射器向每一个处理试管中的沉淀物加入磷酸缓冲液1.0 ml,形成混悬液。
1.2.3 传统固体罗氏培养 吸取处理后的标本混悬液接种时,第一滴液体接种至固体培养基斜面中部,第二滴接种到培养基上部,每支培养基接种0.10~0.15 ml(约2 滴),轻轻转动并放低培养管底部,使菌液均匀铺于斜面,斜面水平向上放36±1℃恒温培养箱内培养。每一标本同时接种2 支。接种后第3、7 天各观察1 次菌落生长情况。发现菌落生长者,经抗酸染色证实后,可报告快速生长分枝杆菌阳性。此后每周观察1 次,记录菌落生长及污染情况。阳性生长物经抗酸染色证实后,可报告分枝杆菌生长。满8 周后未见菌落生长者方可报告培养阴性结果,必要时可延长。
1.2.4 分枝杆菌液体培养 采用MGITBD960 全自动仪器法,将0.5 ml 消化离心后沉淀物加入分枝杆菌液体培养专用管中,并加入0.8 ml 杂菌抑菌剂,放入BD960 全自动培养仪,仪器根据荧光值自动判读结果,仪器报阳后,进行手工抗酸染色涂片显微镜检查,抗酸杆菌显红色,背景显蓝色。
1.2.5 微孔板法液体培养 菌株准备:液体培养阳性物(要求经抗酸染色确定为抗酸阳性杆菌同时无杂菌合并,且经抗原检测为MPT64 抗原阳性的培养物),于37℃环境下培养1~7 d 增菌(菌量足够药敏检测即可不可超过7 d,超过7 d 仍然达不到要求菌量,则应转种新的液体培养管)。接种液的制备:使用一次性无菌滴管从液体培养管底部吸取0.5 ml 含菌量较大的菌液,置于含有1.5 ml 盐水的磨菌管中,拧紧螺口,用玻璃珠进行旋涡震荡磨菌分散(磨成均匀的细沙状)。根据比浊仪给出菌悬液浊度及参考加入生理盐水量将菌液调整至0.5 McFarland。接种:吸取100 μl 菌悬液至自配或者商品化的含有OADC的7H9 药敏接种培养液中,涡旋振荡混匀30 s。得到约1×105 CFU/ml 的接种液。采用适合的多通道移液器,向96 孔U 型版板的每个孔中添加100 μl接种液。务必在30 min 内将接种液接种至96 孔U型板中。药物浓度准备:将四种药敏分别调至原始浓度的8 倍,在进行倍比稀释8 个梯度,MIC 依次为16.000、8.000、4.000、2.000、1.000、0.500、0.250、0.125。再将调配好的对应的药敏浓度10 μl 添加至微孔板中,最后一孔第12 排第12 孔不添加任何药敏,只添加菌悬液,作为对照孔。一株菌做四种药物8 个浓度,由此得出一块96 孔板可做3 株菌。最后使用密封膜和通明胶带以正确的方式覆盖96 孔板,避免褶皱或者歪斜,确保所有孔完全被覆盖,随后采用刮板或者滚轮压实密封膜,以保证足够的密封性,防止渗漏或者蒸发导致实验失败或者实验室污染。孵育:接种好的药敏板置于35~37℃有氧环境下孵育10 d。在7~10 d 检查对照孔生长情况,如果10 d 后生长情况不好,再放入孵箱,继续孵育11 d。生长表现:U 型孔底部出现混浊或者菌落沉积。可采用系统判读或者肉眼观察读取结果。首先观察阳性生长对照孔是否有菌生长表现,如未见生长,则结果无效。当阳性生长对照孔菌生长良好时,读取每种药物的MIC值,MIC 值为生长明显抑制的最低抗生素浓度。当受试菌株对某种药物的MIC 值大于临界浓度,则判断为该受试菌株对该药物耐药;当受试菌株对某种药物的MIC 值小于临界浓度,则判断为该受试菌株对该药物敏感。各抗结核药物可接受的MIC 范围见表1。

表1 各抗结核药物可接受的MIC 范围(μg/ml)
1.2.6 比例浓度法固体培养 准备废弃物容器及消毒液。将一次性使用的含0.5%有效氯或75.0%酒精的消毒纸垫铺在生物安全柜的台面上,临床分离分枝杆菌的新鲜培养物无须传代即可做药敏试验。取上述培养物放无菌玻璃磨菌器底部,震荡磨菌,加入少量0.9%生理盐水,静置15 min,用比浊仪比浊配成1 mg/ml 的菌悬液。在无菌痰瓶中加入生理盐水, 用接种枪取500 μl 1 mg/ml 的菌悬液稀释至10~2 mg/ml,接种培养用接种枪分别取100 μl 10~2 mg/ml 菌液,分别接种至含药和对照培养基的表面,置于37℃环境下孵育4 周观察结果。采用接种环提取新鲜菌落,保存于磨菌瓶,与麦氏比浊管进行比浊处理,将其制作为浓度为1 mg/ml 的菌悬液,经过稀释处理(100 倍),获得浓度为10~2 mg/ml 的菌液,并进行稀释,使其成为10~4 mg/ml 溶液,得到两种不同浓度的工作菌液,然后在对应的含药培养基斜面接种。
1.3 观察指标 所有标本分别予以分枝杆菌液体培养与传统固体罗氏培养法,并采用微孔板法进行分枝杆菌药敏实验,对比分枝杆菌培养报阳时间、阳性符合率,并分析微孔板法药敏结果检测效能。
1.4 统计学方法 将研究获得的计数资料、计量资料应用SPSS22.0 软件进行统计学处理,表示方法分别为%、(),同一批患者标本用不同方法处理,采用配对设计方法。P<0.05 表示差异有统计学意义。
2 结果
2.1 不同培养方法对分枝杆菌培养报阳时间比较在34 例疑似新发患者中,采用液体培养法报阳时间为 4~21 d,平均(13.26±5.23)d;传统固体罗氏培养法报阳时间为 15~36 d,平均(22.73±7.42)d,差异有统计学意义(t=6.083,P<0.05)。26 例已经确诊后复诊患者,液体培养法报阳时间为10~31 d,平均(21.35±5.17)d,传统固体罗氏培养法报阳时间为15~41 d,平均(28.72±8.42)d,差异有统计学意义(t=3.803,P<0.05)。
2.2 不同培养法对分枝杆菌阳性检出率比较 采集60 例患者痰标本,分别进行不同培养法检测,结果显示液体培养法阳性检出率为31.67%(19/60);传统固体罗氏培养法检测阳性率为15.00%(9/60)。不同培养法总阳性检出率比较,差异有统计学意义(χ2=4.658,P<0.05)。见表 2。
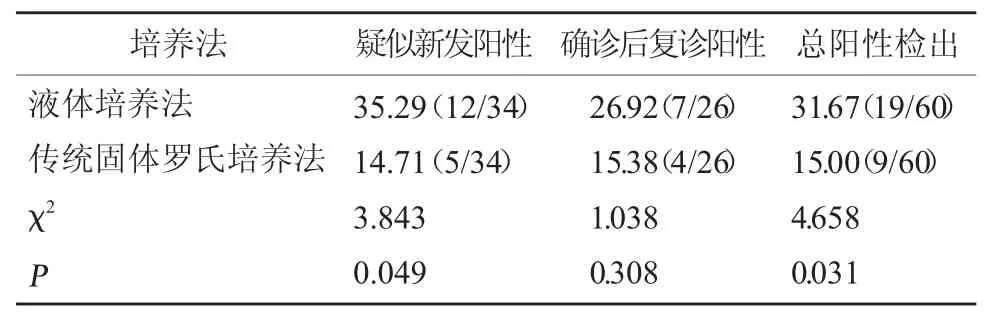
表2 不同培养法对分枝杆菌阳性检出率比较[%(例/ 例)]
2.3 微孔板法药敏法对抗结核药物耐药性检测结果 微孔板法药敏法结果显示,利福平耐药16 个,异烟肼耐药14 个,阿米卡星耐药1 个,左氧沙星耐药2 个。传统比例法药敏法利福平耐药12 个,异烟肼耐药12 个,阿米卡星耐药1 个,左氧氟沙星耐药1 个。微孔板法药敏法对阿米卡星耐药检测特异性高于传统比例法药敏法,差异显著(P<0.05),其他检测效能比较差异无统计学意义(P>0.05)。见表3~表5。
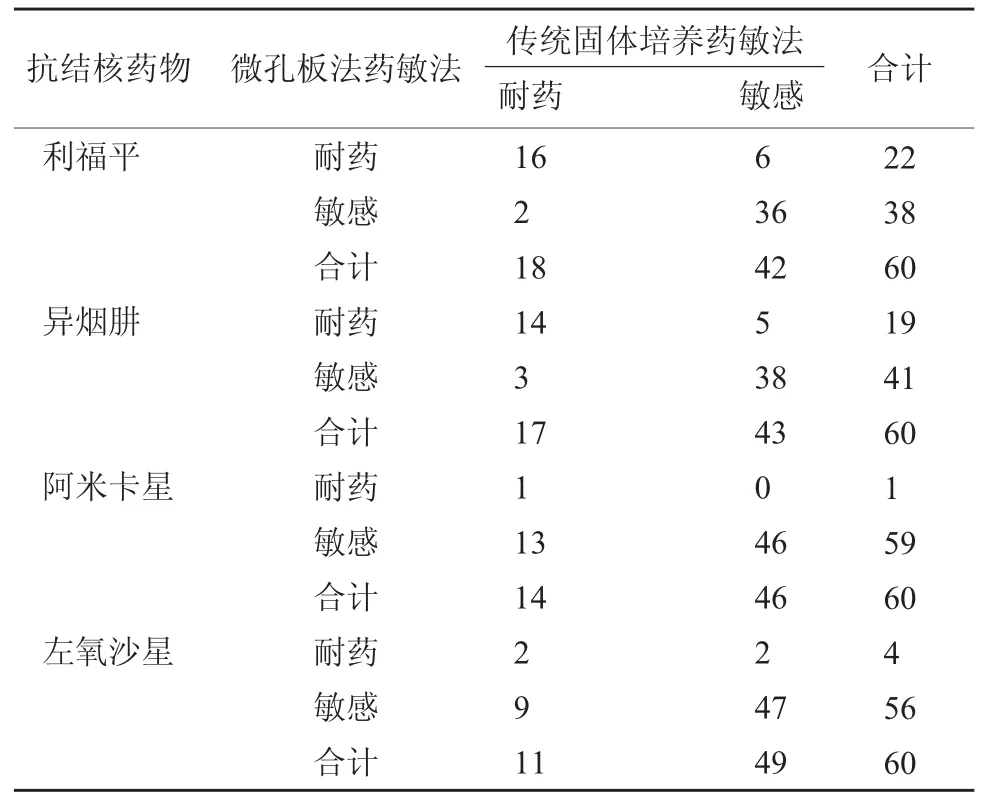
表3 微孔板法药敏法对抗结核药物耐药性检测结果(个)
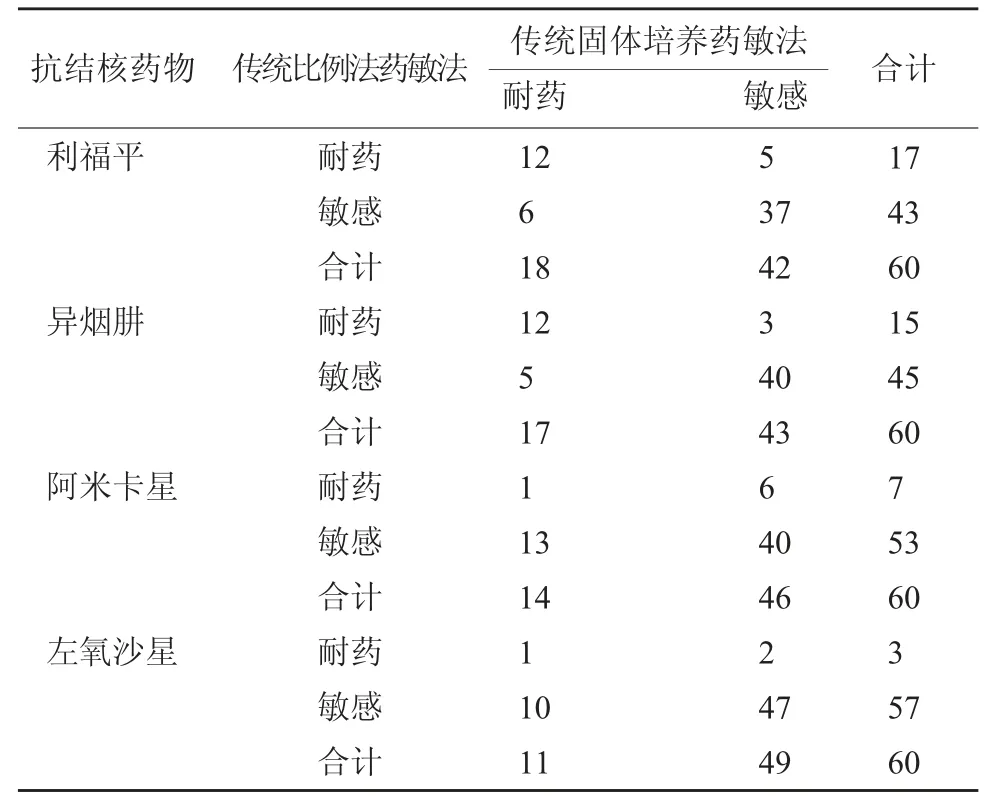
表4 传统比例法药敏法对抗结核药品耐药性检测结果(个)
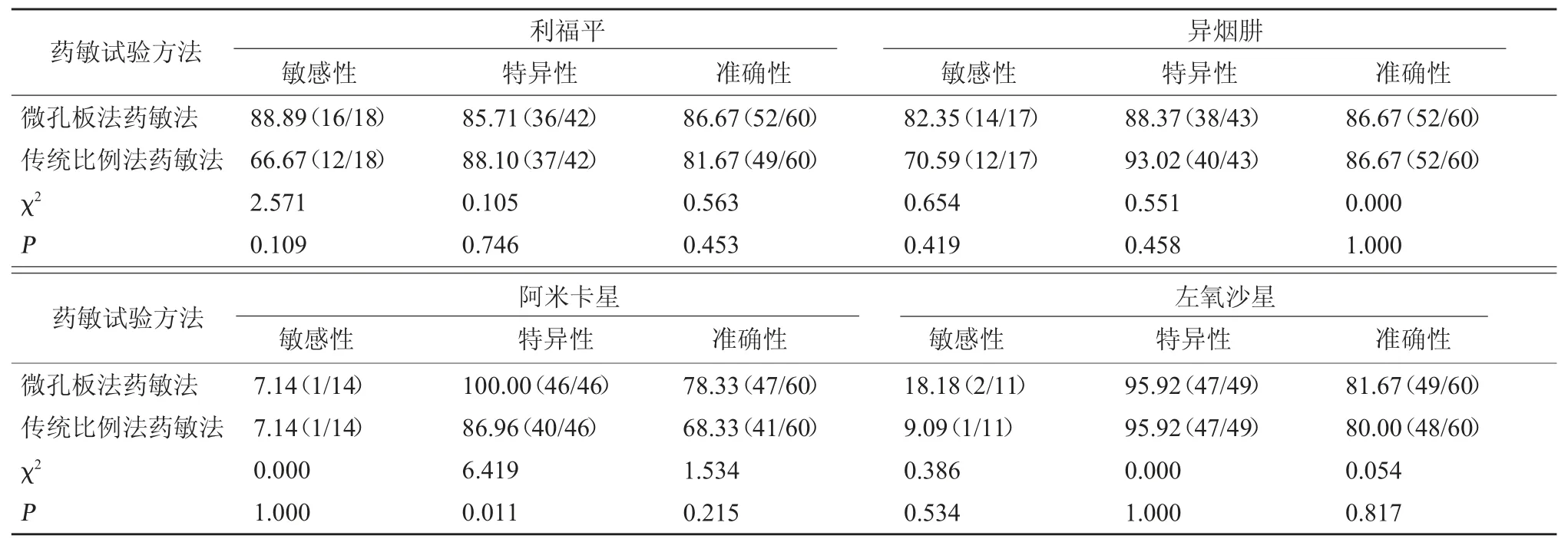
表5 微孔板法药敏法、传统比例法药敏法对抗结核药品耐药性检测效能分析[%(例/ 例)]
3 讨论
作为临床常见病,结核感染常见致病菌为结核分枝杆菌,发病率、死亡率高,目前仍是威胁人类健康的公共卫生疾病。现有资料显示全球在结核感染控制方面仍存在诸多问题,疾病预防与控制措施相关资料较缺乏[7~9]。以往研究报道,机体感染结核杆菌后是否发病很大程度上取决于患者抵抗力、结核杆菌数量及毒力等[10~11]。随着卡介苗的接种普及,各种有效抗结核药的问世、结核病的严格管理和隔离,很大程度上控制了结核的传染,控制了结核病的传染率。及时发现、及时隔离处理、并进行有效抗结核治疗,是抗结核防治工作的重中之重[12~14]。
目前,多数医疗机构未具备开展结核分枝杆菌培养的条件,无法进行药敏试验,部分甚至不能够满足结核分枝杆菌的抗酸染色检查,在对结核感染患者予以治疗时多依赖临床表现、影像学特点等,常用药物包括利福平、异烟肼、阿米卡星等,基于当前严峻的结核耐药形势,依据经验性治疗方案已经无法满足结核感染的治疗需要[15]。且多数患者由于初治失败或再次复发导致耐药增加,因此寻找一种准确、快速的药敏试验迫在眉睫[16]。传统固体罗氏培养法在培养结核分枝杆菌时耗时长,由于细菌生长速度慢,往往需要1 个月左右才能够判断是否存在细菌集落,且阳性率低,考虑是因为结核分枝杆菌多在低氧环境下产生,肉芽组织细菌量少,部分手术患者术前需行强化抗结核治疗,导致细菌量减少[17]。比例浓度法是目前应用最为广泛且受临床信赖的方法,但等待时间长。近年来分枝杆菌液体培养法在临床得以应用,其主要原理如下:MGIT 底部包埋了荧光物质,当管内氧含量变化后,荧光物质也会随之发生反应,分枝杆菌在MGIT 内生长过程中会对氧有一定的消耗,导致管内荧光物质被激活,从而释放荧光,经过MGIT 荧光读数仪能够直接对结果进行判读,具有操作简单、可行性强等优势[18~20]。本研究分枝杆菌液体培养法对疑似新发病例、复诊患者报阳天数均短于传统固体罗氏培养法,且对分枝杆菌总阳性检出率高于传统固体罗氏培养法,差异有统计学意义(P<0.05),体现了液体培养法的优势。不仅如此,液体培养法利用MIC 能够对药物的杀菌、抑菌作用进行评估,MIC 值越小提示药效越强。
作为药敏试验的有效检测方法,微孔板法在早期耐药筛查中有着一定的应用,其在96 孔板中提前加入被检测药物,在板中接种定量菌悬液,不仅操作简单,而且降低了污染风险,能够实现对包含4 种一线、12 种二线在内的抗结核药物进行药敏检测,为结核感染患者早期耐药筛查提供可靠的参考[21~22]。本研究将比例法固体培养药敏结果作为金标准,可以发现微孔板法药敏法对阿米卡星耐药检测特异性高于传统比例法药敏法,差异显著(P<0.05),体现了微孔板法在药敏实验中的应用优势。以往研究发现,微孔板法能够检出低浓度耐药情况,可为药物使用剂量的确定提供依据[23~24]。在检查过程中存在检测结果不一致的情况,考虑与菌株活性有关。较弱的菌株活性会减慢代谢速度,细菌生长不充分,对判断结果准确性产生影响[25]。分枝杆菌药敏阅读仪的应用则能够促进分辨率的提升。
本研究就分枝杆菌液体培养和微孔板法在药敏实验中的价值进行了汇报,但病例少、随访时间有限,可能有所偏倚,且对于不符合标准未能进一步进行基因测序,后续仍需大样本研究,挖掘其临床价值,更好地服务于临床。综上所述,分枝杆菌液体培养对结核感染患者分枝杆菌检测时间短,阳性检出率高,利用微孔板法能够提升分枝杆菌药敏试验灵敏度、特异性,且可检测到最小抑菌浓度,为药物疗效监测以及精准治疗提供可靠的参考依据。

