龙眼PIFs家族全基因组鉴定及其表达分析
李小芳,林晓艺,苏炳茜,张城瑜,罗彬彬,陈裕坤,杜迎刚,2 ,赖钟雄
(1.福建农林大学园艺植物生物工程研究所,福建 福州 350002;2.潍坊科技学院山东省高校设施园艺实验室,山东 潍坊 261000)
0 引言
【研究意义】龙眼(Dimocarpus longanLour.)是无患子科(Sapindaceae)龙眼属(DimocarpusLour)的热带亚热带常绿经济果树,别称桂圆和三尺农味等,具有降血脂、补脑益智、免疫调节、抗肿瘤等功效,是一种重要的经济水果。龙眼胚胎的发育对龙眼坐果率及其果实品质有重要影响,因此对龙眼胚胎发育的深入研究对龙眼产业的发展具有重大意义。【前人研究进展】光信号在植物生长发育过程中发挥着重要的调节作用,植物对光信号的感知主要是通过光感受器来进行,而光敏色素(Phytochromes,phy)作为一种可以感知红光/远红光的植物色素蛋白,以吸收红光的非活性形式Pr和吸收远红光的活性形式Pfr存在[1],在植物的生长发育中发挥重要作用[2]。光敏色素互作基因PIFs(Phytochrome interacting factors,PIFs)作为光敏色素极为重要的一种互作基因和重要的信号整合因子参与调节植物的众多生理过程[3]。在光照下,光敏色素通过快速磷酸化、泛素化和蛋白酶体介导的降解促进PIF的周转,从而抑制PIF功能诱导转录重编程,导致光形态发育[4]。PIFs属于basic helix-loop-helix(bHLH)转录因子家族的第15亚族,植物PIFs转录因子具有bHLH结构域,大部分还具有保守的APB(Active phytochrome B-binding domain)结构域,APB结构域是PIFs与具有生物活性光敏色素相结合的不可或缺的元件[5]。PIF3是第一个被鉴定出来的与phyB、phyA互作的bHLH 转录因子,其他PIFs成员同样能够与Pfr形式的phyB发生互作[6]。PIFs 蛋白序列中保守的 bHLH 结构域能特异性地与启动子中的G-box元件结合从而调控靶基因的表达[7]。通过ChIP-seq(染色质免疫共沉淀技术)和RNA-seq(转录组测序技术) 分析发现,PIF1、PIF3、PIF4和PIF5 都有各自直接的调控基因,但同时也发现有139个基因能同时被这4个PIF蛋白调控。这些结果表明 PIF蛋白具有相同和各自不同的DNA结合特性,从而表现出功能重叠及各自特定功能[8]。研究表明,PIFs可以协调光和激素信号传递[9-10],参与种子萌发[11]、避荫反应[12]、开花[13]等生理活动,可以负调控花青素、叶绿素的生物合成和光合作用相关基因的表达[14-16],还能响应光、荫、温度和昼夜条件[17-20]。在非生物胁迫调控方面,PIFs可以调控植物对低温、高温的耐性[21-24],对干旱和盐胁迫也有响应[25]。总之,PIFs对植物的生长发育具有极为重要的作用。【本研究切入点】龙眼体胚发生系统是研究木本植物胚胎发生的优良体系,可以替代合子胚的发生系统,为研究龙眼体胚发生的分子调控机制和龙眼分子育种奠定基础[26]。目前国内外缺少对龙眼中PIFs家族的研究,更缺乏PIFs家族在龙眼体胚和不同组织器官发育过程中所发挥功能的了解。【拟解决的关键问题】基于龙眼基因组数据对DlPIFs家族进行鉴定及相关生物信息学分析,通过龙眼不同组织部位转录组、不同光质和不同温度处理下的转录组对DlPIFs家族的FPKM(Reads per kilobase per million mapped reads)值进行分析,并且利用qRT-PCR分析DlPIFs在龙眼体胚发生早期的表达模式及不同生长调节剂处理下的表达模式,为DlPIFs在龙眼体胚发生过程中的功能研究奠定基础。
1 材料与方法
1.1 材料
龙眼体胚发生早期3个阶段包括EC、ICpEC和GE,参照赖钟雄等[27]的方法培养获得。二代龙眼基因组数据库(NCBI登录号:BioProject PRJNA 3053370)和三代龙眼基因组和不同温度处理下EC转录组数据库(另文发表)、龙眼体胚发生早期转录组数据库、龙眼不同组织部位转录组、不同光质处理下龙眼EC转录组数据库(GenBank登录号:SRA050205)为本实验室保存。
1.2 方法
1.2.1DlPIFs基因家族成员的鉴定 拟南芥(Arabidopsis thaliana)PIF基因家族序列从拟南芥TAIR数据库下载(https://www.arabidopsis.org/),采用clustalX2软件进行序列比对并转换成Stockholm模式的HMM文件,利用HMMER 3.0的HMMbuild建立PIFs隐马尔科夫模型,利用HMMER 3.0的HMMsearch从龙眼三代基因组数据中鉴定出DlPIFs家族成员;使用龙眼蛋白序列构建本地Blast数据库,以拟南芥PIF蛋白序列进行Blast搜索,进一步筛选DlPIFs家族成员,再 通 过CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对DlPIFs家族成员数量进行最终确认,并利用以上方法从龙眼二代基因组数据中筛选并确定家族成员,最后对确定的家族成员进行命名。
1.2.2 DlPIFs蛋白序列的基本理化性质、二级结构、亚细胞定位分析 分别利用在线软件ProtParam(http://web.expasy.org/protparam/)、SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl)和 Plant-mPLoc server(sjtu.edu.cn)对DlPIF蛋白序列的基本理化性质、二级结构及亚细胞定位进行分析。
1.2.3DlPIFs家族基因结构和保守基序分析 使用GSDS(http://gsds.cbi.pku.edu.cn/)在线网站对DlPIFs的基因结构进行分析,运用MEME在线软件(http://meme-suite.org/tools/meme)分析DlPIFs编码蛋白的保守基序,再使用TBtools进行基因结构和保守基序图的绘制。
1.2.4DlPIFs染色体定位分析 使用TBtools软件对龙眼PIFs染色体定位图进行绘制分析,再通过Artificial Intelligence 2020软件对绘制的染色体定位图进行美化。
1.2.5 植物PIFs 系统进化树分析 使用 MEGA 5对龙眼、拟南芥、水稻(Oryza sativa)、甜橙[Citrus sinensis(L.) Osbeck]的PIFs蛋白序列的多重序列进行比对,使用邻接法(Neighbor-joining,NJ)构建进化树,执行参数为Poission模式、完全删除和1 000次重复[28]。水稻蛋白序列下载于https://ricedata.cn/gene/,甜橙蛋白序列下载于http://citrus.hzau.edu.cn/orange/。
1.2.6DlPIFs家族启动子顺式作用元件分析 利用获得的PIFs基因家族各成员起始密码子ATG上游的2 000 bp 的启动子序列,通过PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子顺式作用元件,并通过PlantTFDB(http://planttfdb.gao-lab.org/)对转录因子结合位点进行分析。
1.2.7DlPIFs家族成员在龙眼体胚发生早期、不同组织器官、不同光质和不同温度处理下的FPKM值分析 参照龙眼不同组织器官(供试红核子龙眼的根、茎、叶、雄花、雌花、幼果、果肉、果皮和果核等不同组织器官的材料均采自福建农林大学创业园)、不同光质[将龙眼EC置于均光培养箱内,以黑暗处理作为对照,分别对其进行黑暗、蓝光、红光和白光处理,湿度55%~60%,温度为(25±2) ℃][29]及不同温度[将龙眼EC材料在25 ℃条件下培养两天后,再放入不同温度(15 ℃、25 ℃和35 ℃)培养箱中处理24 h]处理下转录组数据库中DlPIFs的基因表达水平,对各成员的表达趋势进行分析,使用TBtools绘制热图。
1.2.8DlPIFs家族成员在体胚发生早期和不同生长调节剂处理下的表达模式分析 首先采用TransZol Up试剂盒提取龙眼体胚发生过程中3个阶段的龙眼愈伤和5种生长调节剂处理的龙眼EC的RNA,参照 PrimeScript™ IV 1st Strand cDNA Synthesis Mix 试剂盒进行cDNA合成。
再使用DNAMAN 7.0软件对DlPIF家族成员序列进行qRT-PCR引物设计(表1),以FSD-Q作为内参基因[30],对DlPIFs在龙眼体胚发生早期不同阶段和龙眼EC在不同生长调节剂处理下的表达水平进行qRT-PCR检测,采用2-△△Ct法进行相对表达量的计算,每个处理3个重复。利用Excel软件对试验数据进行分析,利用Graphpad prism软件进行折线图和柱状图的绘制,并使用SPSS 26软件中单因素ANOVA的邓肯法对数据进行差异显著性分析(P<0.05)。

表1 DlGRF基因家族qRT-PCR引物Table 1 qRT-PCR primers of DlPIFs
2 结果与分析
2.1 DlPIFs家族成员的鉴定
基于龙眼基因组三代测序数据,共鉴定出8个DlPIFs基 因 家 族 成 员(Dlo12584、Dlo015892、Dlo034359、Dlo028134 、Dlo014068 、Dlo011892、Dlo31044、Dlo012986),它们都具有bHLH保守结构域(图1),根据与拟南芥PIFs序列比对的分析结果,将DlPIFs各成员分别命名为DlPIF1-1、DlPIF1-2、DlPIF3、DlPIF4、DlPIF5、DlPIF6、DlPIF7、DlPIF8。经DNAMAN7.0软件分析发现,其CDS序列长度依次为 1 605、1 197、2 298、1 617、975、1 695、1 362 和1 431 bp(表2)。基于龙眼基因组二代测序数据,共鉴定出6个DlPIFs基因家族成员(Dlo_000274.1、Dlo_031800.1、Dlo_000977.1、Dlo_018063.1、Dlo_012166.1、Dlo_028817.1)。利用 DNAMAN 7.0进行序列比对,发现龙眼基因组二代测序数据中所确定成员均与龙眼基因组三代测序数据中所确定成员一致。

图1 龙眼PIFs保守结构域Fig.1 Conserved domain of DlPIFs
2.2 DlPIFs蛋白序列的基本理化性质、二级结构及亚细胞定位分析
理化性质分析表明DlPIF1~DlPIF8编码的氨基酸残基数分别为534、398、765、538、324、540、453和476个,分子量分别为59 036.32、43 473.33、82 158.84、58 258.97、35 089.75、62 892.14、49 786.89和50 818.37 Da,等电点(pI)分别为6.39、5.44、6.10、6.73、5.48、9.21、8.39 和 8.55,DlPIFs均为不稳定、亲水性蛋白(表2)。
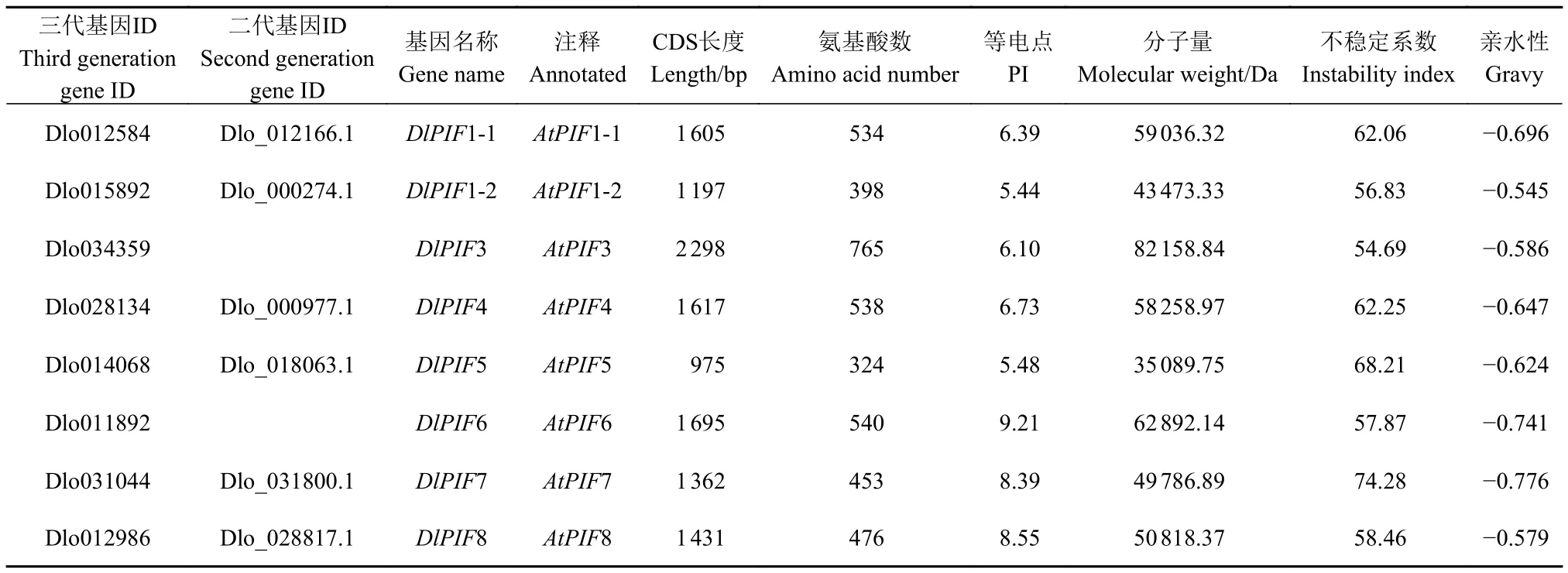
表2 龙眼PIFs成员基本理化性质Table 2 Basic physicochemical properties of DlPIFs
亚细胞定位预测结果表明DlPIFs定位于细胞核。二级结构分析发现无规卷曲所占比例最高,α-螺旋次之,延伸链较低,β-转角最低(表3)。
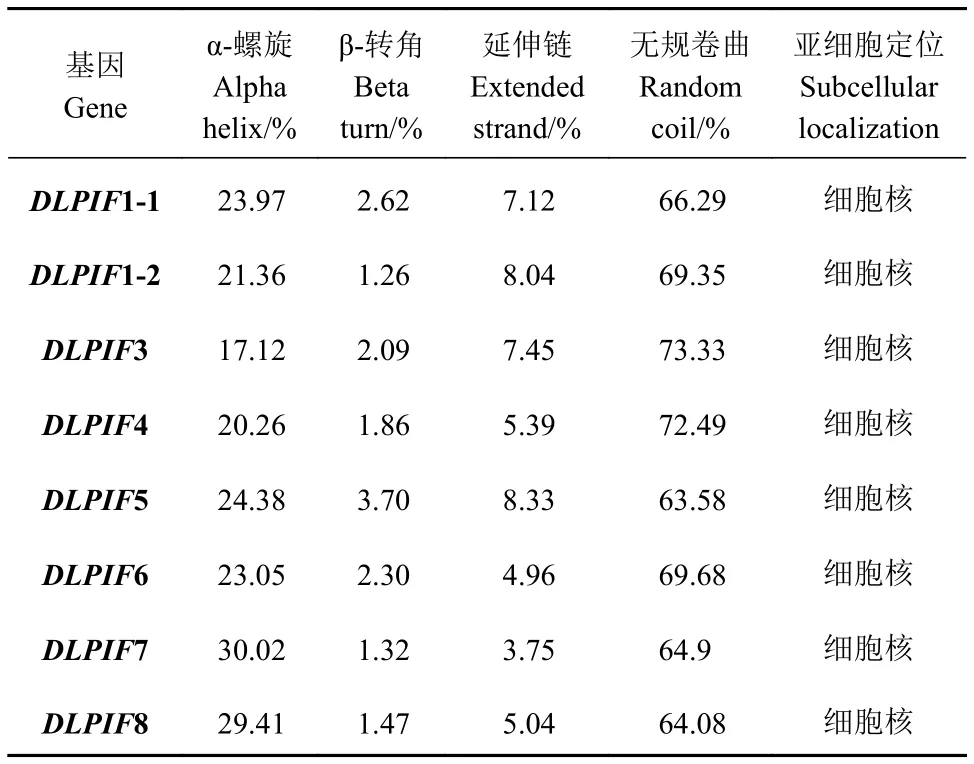
表3 龙眼PIFs家族二级结构及亚细胞定位Table 3 Secondary structure and subcellular localization of DlPIFs
2.3 DlPIFs家族基因结构、保守基序及染色体定位分析
通过对DlPIFs家族成员的基因结构进行分析发现,DlPIF1-1和DlPIF5有4个内含子和5个外显子;DlPIF1-2和DlPIF4有6个内含子和7个外显子;DlPIF3、DlPIF6和DlPIF7有5个内含子和6个外显子;DlPIF8有7个内含子和8个外显子(图2)。

图2 龙眼PIFs家族基因结构和蛋白质保守基序分布Fig.2 Gene structure and protein conserved motifs of DlPIFs
使用MEME对DlPIFs的蛋白序列进行保守基序分析,共获得6个保守基序,8个DlPIF家族成员均含有这6个保守基序。
DlPIFs染色体定位结果见图3,结果表明7个家族成员定位在染色体上。其中DlPIF1-1、DlPIF6和DlPIF8均定位在chr5染色体上,DlPIF5、DlPIF1-2、DlPIF4和DlPIF7分别定位在chr6、chr7、chr13和chr15上。DlPIF3并未定位在染色体上,推测其为叶绿体或线粒体基因。
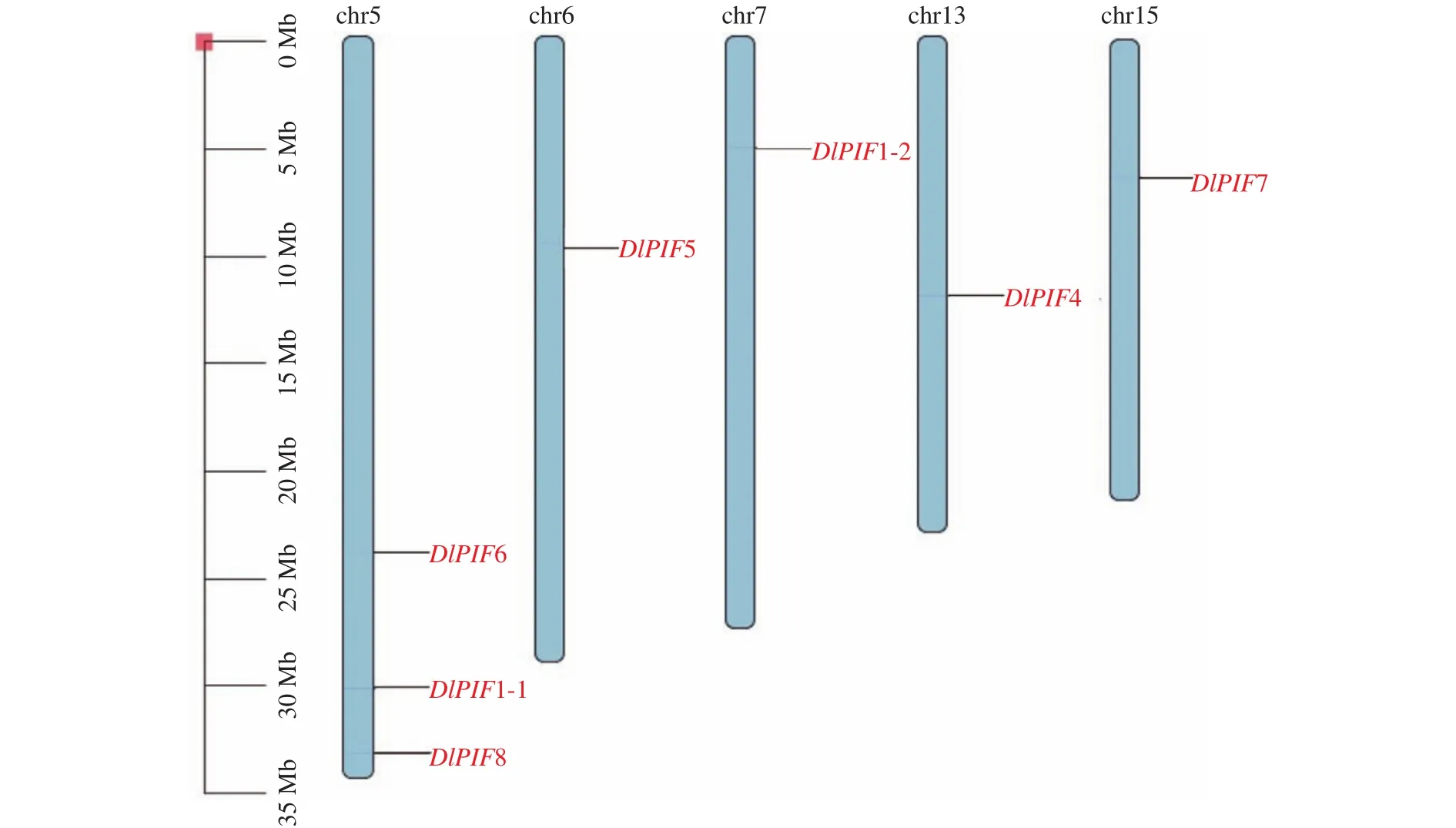
图3 DlPIFs染色体定位Fig.3 Chromosome distribution of DlPIFs
2.4 DlPIFs家族启动子顺式作用元件分析
利用PlantCARE在线预测分析DlPIF基因家族的启动子顺式作用元件发现,DlPIFs家族成员启动子区均包含TATA-box和CAAT-box两个核心元件(图4)。DlPIFs家族的启动子区还包含多种作用元件,且家族成员间的作用元件的数量和种类存在一定差异。
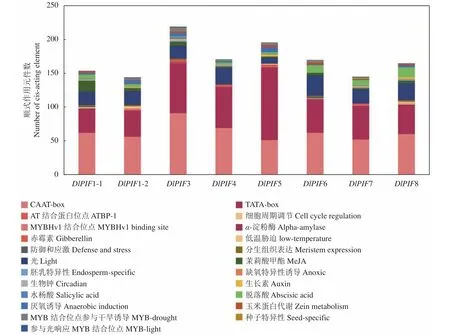
图4 DlPIFs家族启动子顺式作用元件分析Fig.4 Cis-acting elements of DlPIFs
DlPIFs基因家族成员均包含光响应相关的作用元件,数量相似,DlPIF1-2、DlPIF3和DlPIF7还含有MYB结合位点参与光反应(MRE)相关的作用元件。DlPIF基因家族启动子区包含5种激素响应相关的作用元件。DlPIFs家族成员均包含茉莉酸甲酯(CGTCA-motif、TGACG-motif)响应元件和脱落酸(ABRE)响应元件;DlPIF1-1、DlPIF1-2、DlPIF3、DlPIF5、DlPIF7和DlPIF8含有生长素(TGA-element、AuxRR-core)响应元件;DlPIF1-1、DlPIF3、DlPIF5和DlPIF7含有水杨酸(TCA-element)响应元件;DlPIF3、DlPIF4、DlPIF5、DlPIF7还含有赤霉素(GARE-motif、P-box、TATC-box)响应元件。
DlPIFs基因家族还含有种子特异性(RY-element)、胚乳特异性(GCN4_motif)、生物钟(Circadian)、分生组织表达(CAT-box)、玉米蛋白代谢(O2-site)、α-淀粉酶等相关的作用元件和低温胁迫(MBS)、防御和应激(TC-rich repeats)、MYB转录因子结合位点相关的作用元件,并含有参与干旱诱导(MBS)、厌氧诱导(ARE)、缺氧特异性诱导(GC-motif)等与非生物胁迫相关的作用元件。
由上述结果推测,DlPIFs家族最主要的功能为光响应功能,同时在激素响应、生物钟调控和非生物胁迫等方面起重要作用。
2.5 DlPIFs家族的系统进化树分析
使用龙眼、拟南芥、水稻和甜橙4个物种的PIF蛋白序列构建系统进化树(图5)。根据其进化亲缘关系的远近,将PIFs家族初步分为6大类(Class Ⅰ~VI),DlPIF6属于 Class Ⅱ,DlPIF7和DlPIF8属于 Class Ⅲ,DlPIF1-1和DlPIF4属于Class V,DlPIF1-2、DlPIF3和DlPIF5属于Class VI。DlPIFs家族与拟南芥和甜橙亲缘关系较近。
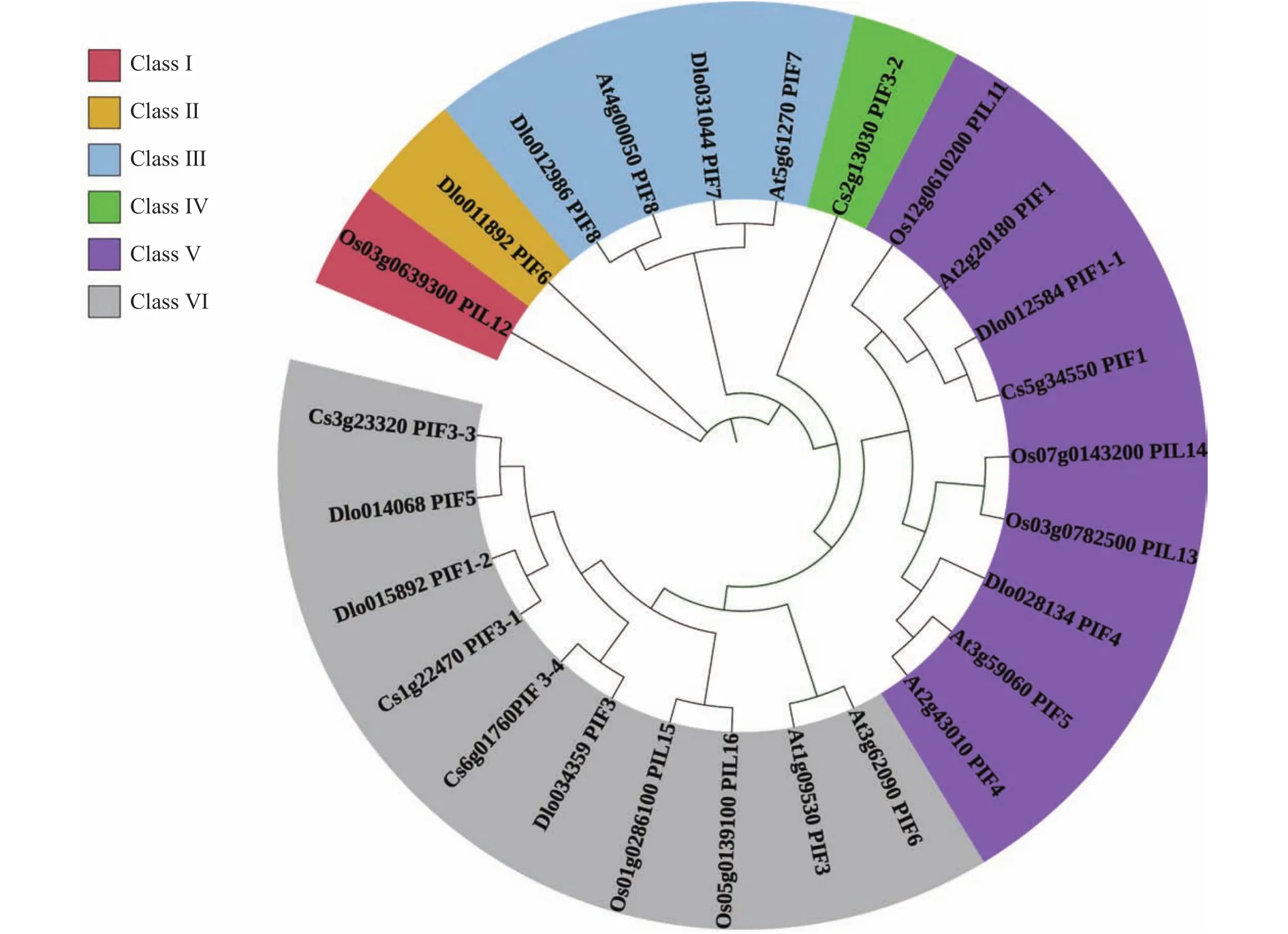
图5 龙眼、拟南芥、水稻、甜橙PIFs家族系统进化树Fig.5 Phylogenetic tree of PIF families in Arabidopsis thaliana, Oryza sativa L., Citrus sinensis, and D.longan
2.6 DlPIFs家族在不同组织器官的转录组基因表达水平分析
转录组基因表达水平结果(图6)显示,从整体上看DlPIFs在不同组织器官的表达水平在龙眼叶中最高,远高于茎、花蕾、果肉、果皮、种子、幼果和花,在根中最低。DlPIF1-1的表达量在种子中最高,推测DlPIF1-1对种子的发育过程具有重要作用;DlPIF1-2的表达量在果肉中最高,推测DlPIF1-2对果肉的发育过程具有重要作用;DlPIF4的表达量在茎中最高,推测DlPIF4对茎的发育具有重要作用;DlPIF5的表达量在花蕾中最高,推测DlPIF5对花蕾的发育具有重要作用;DlPIF7和DlPIF8的表达量在叶中最高,推测DlPIF7和DlPIF8对叶的发育均具有重要作用。由上述结果可知,DlPIFs家族成员与龙眼不同组织器官的生长发育过程有着重要的联系,在其中发挥着重要的功能。

图6 DlPIFs家族在非胚性和胚性培养物和不同组织器官的表达量热图Fig.6 Heat map of expressions of DlPIFs in non-embryogenic and embryogenic cultures and various tissues and organs
2.7 DlPIFs家族在不同光质和不同温度处理下的转录组基因表达水平分析
不同光质处理下的转录组数据分析得出(图7),除DlPIF7以外,其他DlPIFs家族成员均在不同光质处理下有不同程度的表达;DlPIF1-1、DlPIF5和DlPIF8在蓝光处理下的表达量明显高于对照,推测DlPIF1-1、DlPIF5和DlPIF8能够响应蓝光的调控;DlPIF4在白光和蓝光处理下的表达量均明显高于对照,推测DlPIF4能够响应蓝光和白光的调控;DlPIF1-2在3种光质处理下的表达量差别不明显,推断DlPIF1-2对不同光质的响应程度差别不明显。DlPIFs成员在不同光质处理下呈现不同的表达模式,推测DlPIFs成员能响应光信号。
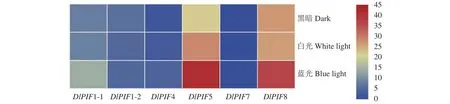
图7 DlPIFs家族在不同光质条件下的表达量热图Fig.7 Heat map of expressions of DlPIFs exposed to varied light
不同温度处理下的转录组数据分析得出(图8),相对高温(35 ℃)促进DlPIF4和DlPIF6的表达,抑制DlPIF1-1、DlPIF1-2、DlPIF3和DlPIF8的表达;相对低温(15 ℃)促进DlPIF1-1、DlPIF3和DlPIF5的表达,抑制DlPIF1-2、DlPIF4、DlPIF6和DlPIF8的表达。综上所述,DlPIFs成员在不同温度处理下有着不同的表达模式,说明DlPIFs大多数成员可能参与温度的调控,并且对温度的调控存在不同的作用。
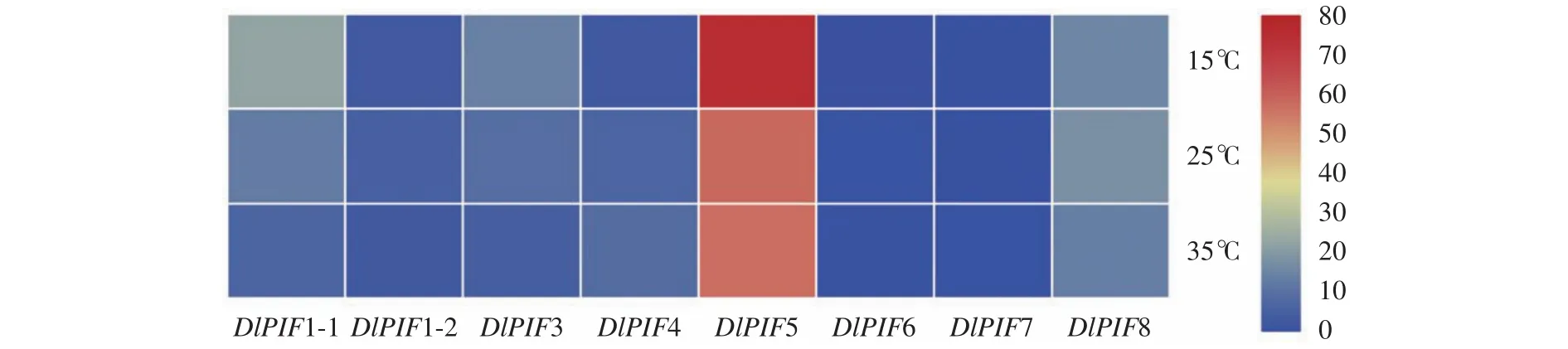
图8 DlPIFs家族在不同温度条件下的表达量热图Fig.8 Heat map of expressions of DlPIFs under different temperatures
2.8 DlPIFs家族在龙眼体胚发生早期的表达分析
龙眼体胚发生早期的qRT-PCR结果(图9)显示,DlPIF1-1、DlPIF5、DlPIF6和DlPIF8的表达量随着龙眼体胚早期的发育不断下降,推测DlPIF5、DlPIF6和DlPIF8DlPIF1-1、DlPIF5、DlPIF6和DlPIF8在龙眼体胚发育进程中具有相似的功能。DlPIF1-2和DlPIF3的表达量在EC到ICpEC阶段下降,在ICpEC到GE阶段上升,DlPIF4和DlPIF7的表达模式与之相反,推测DlPIF1-2和DlPIF3与DPIF4和DlPIF7对龙眼体胚发育进程具有相反的作用。综上所述,DlPIFs家族不同成员在龙眼体胚发生早期具有不同的表达模式,可能通过相同或者不同的分子调控机制调节龙眼体胚的早期发育过程。
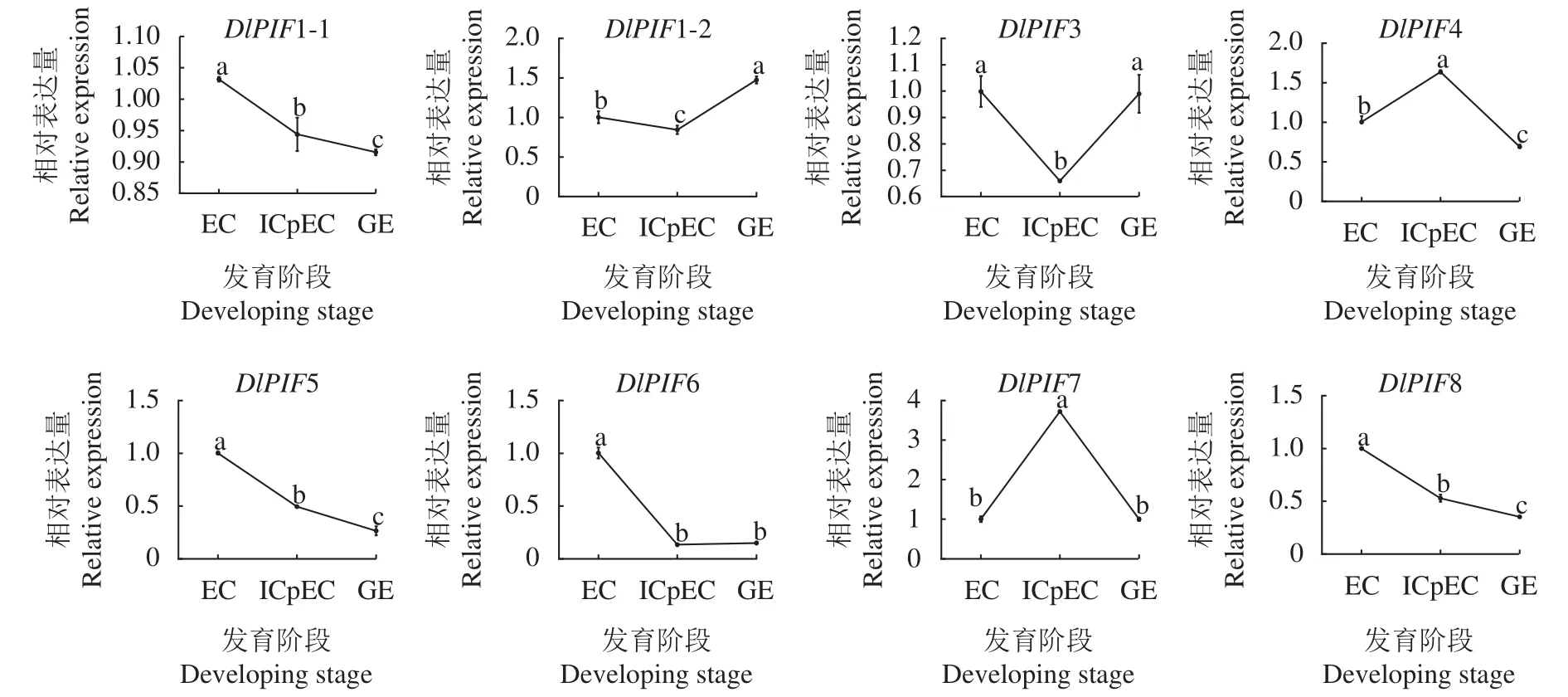
图9 龙眼PIFs家族体胚发生阶段表达分析Fig.9 Expressions of DlPIFs during somatic embryogenesis
2.9 DlPIFs家族在不同生长调节剂处理下的表达分析
利用qRT-PCR技术对不同生长调节剂处理下的龙眼愈伤组织中DlPIFs基因的表达水平进行分析(图10),结果显示,在GA3和ABA处理下,DlPIF3、DlPIF5和DlPIF7的表达量与对照相比有明显提高,推测DlPIF3、DlPIF5和DlPIF7能响应GA3和ABA的调控;2,4-D和SA处理下,DlPIF5和DlPIF7的表达量与对照相比有明显提高,推测DlPIF5和DlPIF7能响应2,4-D和SA的调控;在MeJA处理下,DlPIF1-2、DlPIF5和DlPIF7的表达量与对照相比有明显提高,推测DlPIF1-2、DlPIF5和DlPIF7能响应MeJA的调控。综上所述,DlPIF5和DlPIF7的表达量在5种生长调节剂处理下都具有明显变化,推测DlPIF5和DlPIF7是响应激素调控的主要成员。

图10 生长调节剂处理下DlPIFs基因的相对表达量Fig.10 Expressions of DlPIFs in response to exogenous hormones
显著性差异分析发现,在5种生长调节剂处理下,DlPIFs家族的大多数成员在不同时间处理下的表达量具有显著性差异。
3 讨论
3.1 DlPIFs家族的鉴定和功能的多样性
近几年,随着对PIF基因家族研究的不断深入,发现PIFs基因家族转录因子不仅在光信号中具有重要作用,在植物生长发育的多个方面都起到关键信号节点作用。目前研究发现,拟南芥(Arabidopsis thaliana)中有7个PIFs家族成员(PIF1,PIF3~PIF8);水稻中有6个PIFs家族成员(OsPIL11~OsPIL16);玉米(Zea maysL.)中有7个PIFs家族成员(ZmPIF1~ZmPIF7)[31-32];香蕉(Musa nanaLour.)中有7个PIFs家族成员(MaPIF1、MaPIF1-1、MaPIF3、MaPIF3-1、MaPIF4、MaPIF4-1、MaPIF)[33];马铃薯(Solanum tuberosumL.)中有7个PIFs家族成员(St PIF1a、St PIF1b、StPIF3、St PIF4、St PIF7a、St PIF7b、St PIF8)[34];白菜(Brassica rapa)中有10个PIFs家族成员(BrPIF1-BrPIF10)[34]。本研究鉴定出龙眼PIFs家族8个具有bHLH结构域的成员。基因结构和保守基序分析发现,部分成员之间具有相似的基因结构和保守基序,推测成员的功能存在一定的保守性。亚细胞定位发现DlPIFs成员均位于细胞核,这与袁凌云等[35]在白菜和吴广霞[36]在玉米中的研究一致。植物细胞内拥有3套独立的基因组,即细胞核基因组、线粒体基因组和叶绿体基因组。除去拥有巨大遗传信息的细胞核之外,线粒体和叶绿体是植物细胞中具有双膜系统的细胞器,它们的发育和增殖是受细胞核基因组及其自身基因两套遗传系统的控制,称为半自主性细胞器[37]。染色体定位发现,大部分DlPIFs成员定位于染色体上,而DlPIF3未定位于染色体,推测该基因为叶绿体或线粒体基因。启动子顺式作用元件分析有助于预测基因潜在的功能,进化树和启动子顺式作用元件分析发现,亲缘关系较近的成员所含有的顺式作用元件种类相似,不同成员之前包含的顺式作用元件数量和种类有所差别,说明DlPIFs成员之间具有相同或者不同的生物学功能。
PIFs通过介导光信号,参与植物的光形态建成[38]。在拟南芥中PIF3负调控或者正调控植物幼苗的光反应[6,39-40],PIF1、PIF4和PIF5可以负调控幼苗的各种光反应[11,15,41],PIF7是红光下幼苗去黄化的负调控因子[42],PIF6是植物光反应的正调控因子[43]。与前人研究相同,本研究对DlPIFs家族进行顺式作用元件分析得出DlPIFs家族各成员均含有与光响应有关的作用元件且对不同光质处理下DlPIFs转录组基因表达水平进行分析,发现DlPIFs成员普遍在蓝光下表达量最高,在白光和黑暗处理下表达量较低。
PIFs不仅能够响应光信号,影响植物的光形态建成,还响应非生物胁迫。前人研究表明光敏色素在参与调控植物对干旱胁迫的耐受性的过程中,phyB是主要的调控因子,在拟南芥中,PIF3和PIF4可能在phyB下游调控气孔的开合中起作用[44];在玉米中,ZmPIFs均受到干旱胁迫的诱导,而且其中起主要作用的是ZmPIF1和ZmPIF3[45]。本研究对DlPIFs家族进行顺式作用元件分析得出PIF1-1、PIF1-2、PIF3、PIF4、PIF5、PIF6和PIF8含有与干旱响应相关作用元件。有研究发现在高温条件下,PIF4 能通过激活生长素的合成基因YUC8和TAA1促进生长素应答基因IAA19和IAA29的表达来调节植物下胚轴和叶柄伸长[46],并有研究发现高温下phyB可以促进HMR(phyB的互作蛋白)的积累,HMR进一步与PIF4相互作用,从而促进高温响应基因的表达[47]。低温条件下,植物低温胁迫响应路径的调控因子EBF1和 EBF2蛋白(能够通过26S蛋白酶体直接靶向降解PIF3)降解使PIF3蛋白更加稳定从而 抑制CBFs及其下游低温响应基因表达。此外,拟南芥PIF4和PIF7也能通过光周期依赖方式下调CBFs基因的表达来降低植物抵抗低温的能力[48]。本研究发现DlPIFs家族中PIF1-1、PIF1-2、PIF5、PIF6和PIF8含有与低温响应相关的作用元件,并且对温度处理的转录组数据进行分析得出,相对高温(35 ℃)促进DlPIF4和DlPIF6的表达,抑制DlPIF1-1、DlPIF1-2、DlPIF3和DlPIF8的表达;相对低温(15 ℃)促进DlPIF1-1、DlPIF3和DlPIF5的表达,抑制DlPIF1-2、DlPIF4、DlPIF6和DlPIF8的表达,此研究结果与前人研究相符。还有研究发现CCA1/LHY属于MYB家族转录因子,是生物钟的核心组件,PIFs能够结合CCA1/LHY启动子的G-box区域,参与生物钟的调控[49]。本研究结果表明DlPIF1-1、DlPIF3和DlPIF4存在与生物钟响应相关的作用元件,与前人研究相符。
3.2 DlPIFs家族可能参与龙眼激素信号途径
植物激素能以微小的含量调控植物的生命活动,是植物感受外部环境变化、调节自身生长状态、抵御不良环境及维持生存必不可或缺的信号分子。在拟南芥中,脱落酸(ABA)激活PIF3和PIF6的表达,但抑制PIF1的表达,生长素(IAA)和茉莉酸甲酯(MeJA)分别抑制PIF5、PIF4和PIF8[8]。在玉米中,外源施加GA能显著诱导ZmPIF5和ZmPIF6表达,与在ABA胁迫下的反应相反,两者可能作为ABA与GA信号的连结点[44]。有研究表明,在番茄(Lycopersicon esculentum)植株中,PIF4可以通过诱导JA和ABA合成基因的表达,从而促进JA和ABA积累,抑制GA合成基因的表达,降低GA含量[50]。本研究发现,PIFs具有多种激素响应元件,如生长素、赤霉素、脱落酸、水杨酸、茉莉酸甲酯,且对不同生长调节剂下表达量水平进行分析发现,DlPIF5和DlPIF7的表达量在5种生长调节剂处理下都具有明显变化,与前人研究相符。因此,推测DlPIFs参与龙眼激素信号途径。
3.3 DlPIFs家族可能参与龙眼不同组织部位生长发育的调控
PIFs家族在不同植物的不同组织部位存在不同水平的表达。在拟南芥中,PIF1、PIF3和PIF4在幼苗和叶片中的表达量较高,PIF6在花和果实中的表达量较高,在嫩芽中,PIF5的表达量高于其他成员,PIF3在不同器官中的表达水平相似,而PIF8在所有地上器官中的表达水平相对较高[8]。在杨树中,PtPIF1、PtPIF3和PtPIF8a在成熟叶中的表达水平较高,PtPIF3、PtPIF8a和PtPIF9b在幼叶中表达水平较高,PtPIF3b、PtPIF4、PtPIF5a、PtPIF9a和PtPIF10在各组织中的表达水平较低,PtPIF4和PtPIF5b只在成熟叶中表达[23]。与上述研究相似,DlPIFs成员在龙眼不同组织部位具有不同程度的表达水平,其中,DlPIF1-1在龙眼不同组织部位均具有较高的表达量,DlPIF4、DlPIF7和DlPIF8 在茎和叶中高表达,DlPIF5和DlPIF8 在花中高表达,在花蕾中6个DlPIFs成员的表达量均具有较高表达,DlPIF4和DlPIF8 在幼果和果皮中高表达,DlPIF1-2在果肉中高表达,DlPIF1-2在种子中有较高的表达。整体来看,在叶中的表达水平最高,在根中的表达水平最低,这与Gao等[32]在玉米中的发现一致。因此,表明DlPIFs是龙眼生长发育过程不可或缺的调控因子。
3.4 DlPIFs家族可能参与龙眼胚胎早期发育的调控
温度和光照时间是影响棉花离体胚成苗的关键因素,适宜温度和光照时间有利于离体胚的成苗和根系发育,温度30 ℃、光照时间24 h的培养条件下,离体胚的水培成苗效果好,可作为早熟陆地棉离体胚成苗培养的适宜条件[51]。蜜瓜外植体培养中,在不同的光质条件下愈伤组织的形成率有明显的差异,其中,蓝光对愈伤组织的形成有明显的促进作用[52]。还有研究发现,温度对山核桃体胚发生具有一定影响,当培养温度在30 ℃时诱导率最高,当培养温度高于30 ℃或低于24 ℃时,诱导率均较低,并且出现较多畸形胚[53]。本研究得出,DlPIFs家族对温度和光照等条件均有不同程度的表达,可能参与光照和温度的调控,并且DlPIFs家族不同成员在龙眼体胚发生早期具有不同的表达模式。所以,推测DlPIFs家族可能通过不同的分子调控机制调节龙眼体胚的早期发育过程。

