柿叶水提物对高脂诱导的糖尿病小鼠心肌损伤的改善作用及可能机制▲
姚姿羽 时 洁 陈子雯 王常清 覃鸿恩 周 辉
(恩施土家族苗族自治州中心医院1 西药房,2 中药房,3 制剂室,湖北省恩施市 445000; 4 湖北民族大学附属民大医院西药房,湖北省恩施市 445000)
随着经济的发展,人们的饮食结构发生巨大的变化,糖尿病的患病率也随之升高[1]。目前,我国大约有1.14亿糖尿病患者,防控形势严峻[2]。随着糖尿病病情的发展,肾脏及其他相关脏器的功能将会受到损伤,多组织器官的代谢发生异常[3-4]。柿叶含有黄酮类化合物、有机酸、维生素等多种成分,具有降低血脂与血糖、增强免疫功能、增加冠状动脉血流量、扩张血管等功效。有研究表明,柿叶提取物对糖尿病大鼠具有良好的降糖作用[5]。黄永洪等[6]的研究结果显示,柿叶提取物可明显减少心肌梗死大鼠的心肌细胞凋亡,改善心室重塑。但柿叶水提物是否可改善糖尿病相关性心肌损伤尚不清楚。本文旨在探讨柿叶水提物对高脂诱导的糖尿病小鼠心肌损伤的改善作用,并初步分析其作用机制,以期为糖尿病患者的治疗提供一定的理论基础。
1 材料和方法
1.1 实验动物 75只无病原体级雄性昆明小鼠,6~8周龄,体重(30±2)g,由湖北省实验动物研究中心提供,动物生产许可证号为SCXK(鄂)2015—0018,动物使用许可证号为SCXK(鄂)2017—0002。饲养条件:温度为23 ℃~25 ℃,相对湿度为40%~60%,每12 h昼夜交替,自由摄取食物及饮水。本实验经过动物伦理委员会批准。
1.2 主要试剂与仪器 柿叶水提取物购自华中科技大学同济医学院;常规饲料及D12492i高脂饲料购自Research Diets,Inc.(批号:1905647);HbA1c检测试剂盒、空腹胰岛素(fasting insulin,FINS)检测试剂盒均购自南京建成生物工程研究所有限公司(批号:20190584、20191073);肌酸激酶同工酶(creatine kinase MB isoenzyme,CK-MB)、肌钙蛋白I(cardiac troponin I,cTnI)、肌酸激酶(creatine kinase,CK)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、白细胞介素(interleukin,IL)-4、IL-10 ELISA试剂盒购自上海恒远生物科技有限公司(批号:2020021545、2020050237、2019120172、2020031582、2019110653、2020010922、2020031472);苏木素、伊红、中性福尔马林、酒精均购自天津市科密欧化学试剂有限公司(批号:191005、200430、190801、200122);iNOS、IL-10、GAPDH一抗购自沈阳万类生物科技有限公司(批号:WL00992a、WL03088、WL01114);山羊抗兔/鼠蛋白二抗购自上海碧云天生物技术有限公司(批号:A0208、A0216)。Sysmex Chemix-180型全自动生化分析仪购自Furuno Electric公司;高精度型ONETOUCHⅡ血糖仪购自强生公司;Mini-PROTEAN®Tetra蛋白电泳仪、Trans-Blot SD转膜仪购自Bio-Rad公司;C150凝胶成像系统购于Azure Biosystems, Inc.。
1.3 建模及干预方法
1.3.1 分组及建模:将75只昆明小鼠适应性饲养7 d后,采用随机数字表法分为健康对照组、模型组,以及低、中、高剂量柿叶水提物组,每组15只。除健康对照组外,其他各组小鼠采用D12492i高脂饲料持续喂养12周以建立糖尿病模型[7]。建模结束后,采集小鼠餐后2 h尾尖血用于检测血糖,如血糖水平≥16.7 mmol/L,则可认为成功建立糖尿病模型。健康对照组小鼠给予常规饲料喂养。
1.3.2 药物干预:建模成功后,分别按10 g/kg、20 g/kg、40 g/kg给予低、中、高剂量柿叶水提物组小鼠柿叶水提物灌胃,给予健康对照组和模型组小鼠等量生理盐水灌胃,1次/d,连续给药10 d。
1.4 观察指标

1.4.2 空腹血糖、HbA1c和FINS水平:完成体重、体长测量后采集小鼠尾静脉血1 mL。取0.3 mL静脉血,采用ONETOUCHⅡ血糖仪检测空腹血糖水平。将0.7 mL静脉血以3 000 r/min离心10 min,获取血清,采用全自动生化分析仪检测HbA1c水平,采用125I-胰岛素放射免疫法检测FINS水平,计算稳态模型胰岛素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)指数,HOMA-IR指数=空腹血糖(mmol/L)×FINS(μU/mL)/22.5。
1.4.3 心肌酶和炎症因子水平:完成尾静脉采血后麻醉小鼠,取腹主动脉血1 mL,以3 000 r/min离心10 min后获取血清,按照ELISA试剂盒的说明书检测血清CK-MB、cTnI、CK、TNF-α、iNOS、IL-4及IL-10水平。
1.4.4 Western blot检测小鼠心肌组织的iNOS和IL-10蛋白表达水平:完成腹主动脉取血后处死小鼠,立即分离心肌组织。取一部分心肌组织用剪刀剪碎后,加入RIPA裂解液匀浆,提取总蛋白,采用二喹啉甲酸法测定蛋白浓度,取50 μg变性后的蛋白进行SDS-PAGE,切割目的蛋白凝胶后采用湿转法进行电转印,将蛋白转至PVDF膜后,将PVDF膜浸于5%脱脂牛奶中,室温下封闭2 h,接着浸于一抗工作液中(iNOS、IL-10稀释比为1 ∶500,GAPDH稀释比为1 ∶1 000),4 ℃孵育过夜,然后浸于稀释比为1 ∶5 000的二抗工作液中,37 ℃孵育1 h,最后采用ECL发光显影。以GAPDH为内参,以目的蛋白灰度值和内参蛋白灰度值比值作为目的蛋白的相对表达水平。
1.4.5 HE染色法观察心肌组织的病理学变化: 取部分心肌组织,经4%甲醛溶液固定后,行石蜡包埋、切片,脱蜡后用梯度乙醇脱水,随后依次行苏木精染色、伊红染色,最后用二甲苯透明10 min,适量中性树胶封片,在400倍的光学显微镜下观察小鼠心肌组织的病理学变化。
1.4.6 TUNEL染色法观察心肌细胞凋亡情况:取剩余心肌组织,石蜡包埋并切片后,放入二甲苯中脱蜡,然后水化、PBS洗涤,加入TUNEL染色试剂,避光孵育45 min,加入DAPI染细胞核,置于400倍的光学显微镜下随机挑选5个视野,每个视野计数100个细胞中的凋亡细胞数(细胞核呈棕色),细胞凋亡率(%)=(凋亡细胞/总细胞)×100%。
1.5 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t法。以P<0.05为差异具有统计学意义。
2 结 果
2.1 5组小鼠肥胖指数的比较 5组小鼠的肥胖指数比较,差异具有统计学意义(P<0.05)。其中,与健康对照组相比,模型组、低剂量柿叶水提物组、中剂量柿叶水提物组小鼠的肥胖指数均升高(均P<0.05);与模型组及低剂量柿叶水提物组比较,中、高剂量柿叶水提物组小鼠的肥胖指数均降低,且肥胖指数的变化呈剂量依赖性(均P<0.05)。见表1。

表1 5组小鼠肥胖指数的比较(x±s)
2.2 5组小鼠空腹血糖水平、HbA1c水平及HOMA-IR指数的比较 5组小鼠的空腹血糖水平、HbA1c水平及HOMA-IR指数比较,差异均有统计学意义(均P<0.05)。其中,与健康对照组相比,模型组、低剂量柿叶水提物组、中剂量柿叶水提物组小鼠的空腹血糖水平、HbA1c水平及HOMA-IR指数均升高,高剂量柿叶水提物组小鼠HbA1c水平及HOMA-IR指数亦均升高(均P<0.05);与模型组及低剂量柿叶水提物组相比,中、高剂量柿叶水提物组小鼠的空腹血糖水平、HbA1c水平及HOMA-IR指数均降低,且空腹血糖、HbA1c水平的变化呈剂量依赖性(均P<0.05)。见表2。

表2 5组小鼠空腹血糖水平、HbA1c水平及HOMA-IR指数的比较(x±s)
2.3 5组小鼠血清TNF-α、iNOS、IL-4及IL-10水平的比较 5组小鼠的血清TNF-α、iNOS、IL-4及IL-10水平比较,差异均有统计学意义(均P<0.05)。其中,与健康对照组相比,模型组及3个剂量柿叶水提物组小鼠的血清TNF-α、iNOS、IL-4及IL-10水平均升高(均P<0.05);与模型组及低剂量柿叶水提物组相比,中、高剂量柿叶水提物组小鼠的血清TNF-α、iNOS水平均降低,血清IL-4及IL-10水平均升高,且上述指标的变化呈剂量依赖性(均P<0.05)。见表3。
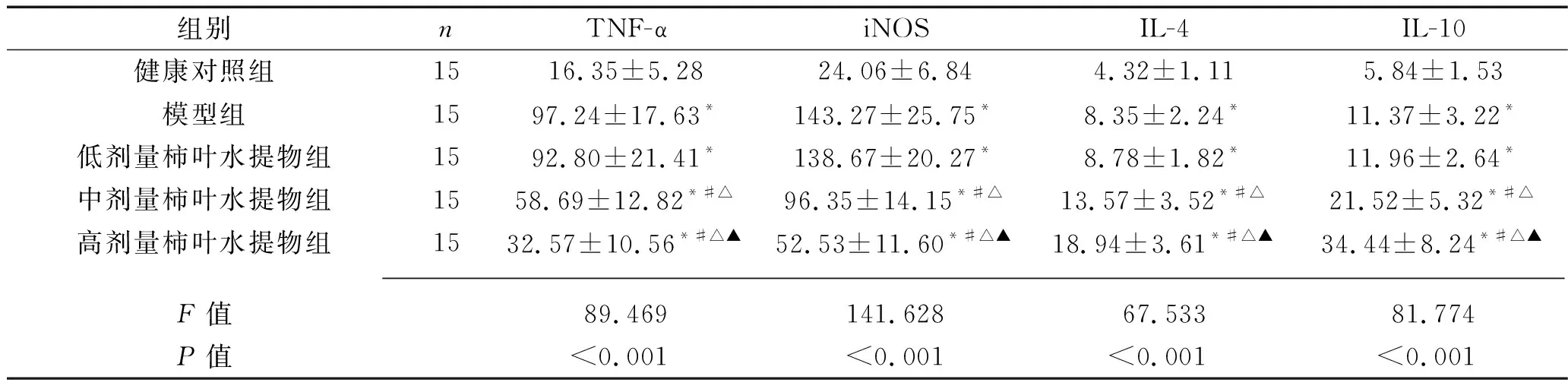
表3 5组小鼠血清TNF-α、iNOS、IL-4及IL-10水平的比较(x±s,pg/mL)
2.4 5组小鼠心肌组织iNOS和IL-10蛋白表达水平的比较 5组小鼠心肌组织的iNOS和IL-10蛋白表达水平比较,差异均有统计学意义(均P<0.05)。其中,与健康对照组相比,模型组及3个剂量柿叶水提物组小鼠心肌组织的iNOS和IL-10蛋白表达水平均升高(均P<0.05);与模型组及低剂量柿叶水提物组相比,中、高剂量柿叶水提物组小鼠心肌组织的iNOS蛋白表达水平均降低,IL-10蛋白表达水平均升高,且上述指标的变化呈剂量依赖性(均P<0.05)。见图1、表4。
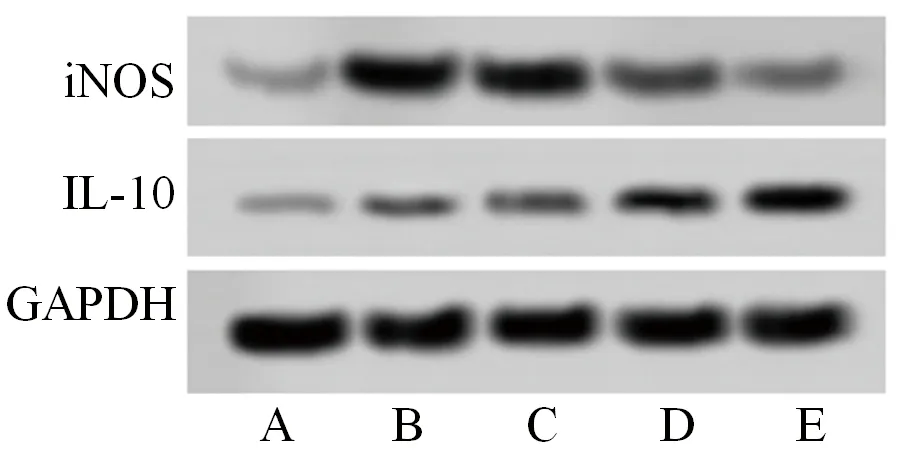
图1 5组小鼠心肌组织的iNOS和IL-10蛋白表达情况
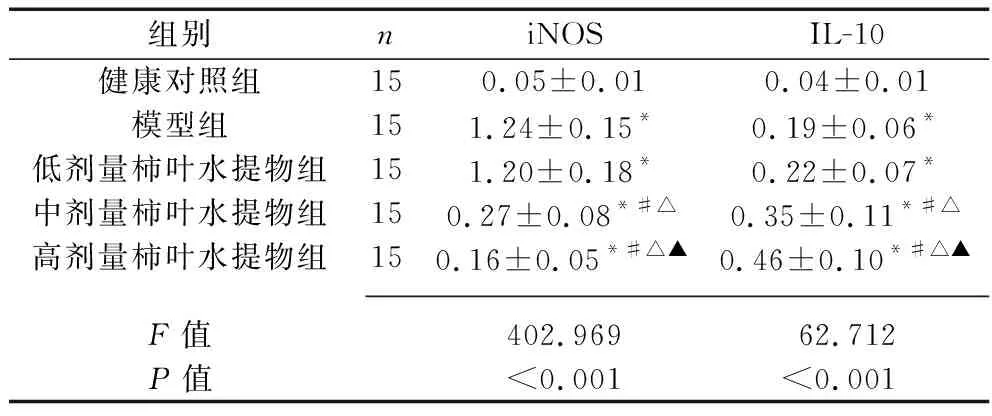
表4 5组小鼠心肌组织iNOS和IL-10蛋白相对表达水平的比较(x±s)
2.5 5组小鼠血清cTnI、CK、CK-MB水平的比较 5组小鼠的血清cTnI、CK、CK-MB水平比较,差异均有统计学意义(均P<0.05)。其中,与健康对照组相比,模型组、低剂量柿叶水提物组、中剂量柿叶水提物组小鼠血清cTnI、CK、CK-MB水平均升高,高剂量柿叶水提物组cTnI、CK水平亦均升高(均P<0.05);与模型组及低剂量柿叶水提物组相比,中、高剂量柿叶水提物组小鼠血清cTnI、CK、CK-MB水平均降低,且上述指标的变化呈剂量依赖性(均P<0.05)。见表5。

表5 5组小鼠血清cTnI、CK、CK-MB水平的比较(x±s)
2.6 5组小鼠心肌组织的病理学变化 健康对照组小鼠心肌组织的肌外膜、心肌纤维均正常完整,且排列较为整齐;模型组小鼠心肌组织的肌红蛋白溶解,心肌细胞核固缩、溶解,肌束膜破裂、心肌纤维弯曲,细胞排列杂乱无章;低剂量柿叶水提物组小鼠的心肌组织病理变化情况与模型组相似;中、高剂量柿叶水提物组小鼠心肌组织中有少量肌纤维断裂溶解弯曲,以及少量心肌细胞核固缩,但上述病理损伤较模型组及低剂量柿叶水提物组减轻。见图2。

图2 5组小鼠心肌组织的病理学变化(HE染色,×400)
2.7 5组小鼠心肌细胞凋亡情况的比较 5组小鼠的心肌细胞凋亡率比较,差异有统计学意义(P<0.05)。其中,与健康对照组相比,模型组及3个剂量柿叶水提物组小鼠的心肌细胞凋亡率均升高(均P<0.05);与模型组及低剂量柿叶水提物组相比,中、高剂量柿叶水提物组小鼠的心肌细胞凋亡率均降低,且心肌细胞凋亡率的变化呈剂量依赖性(均P<0.05)。见图3、表6。
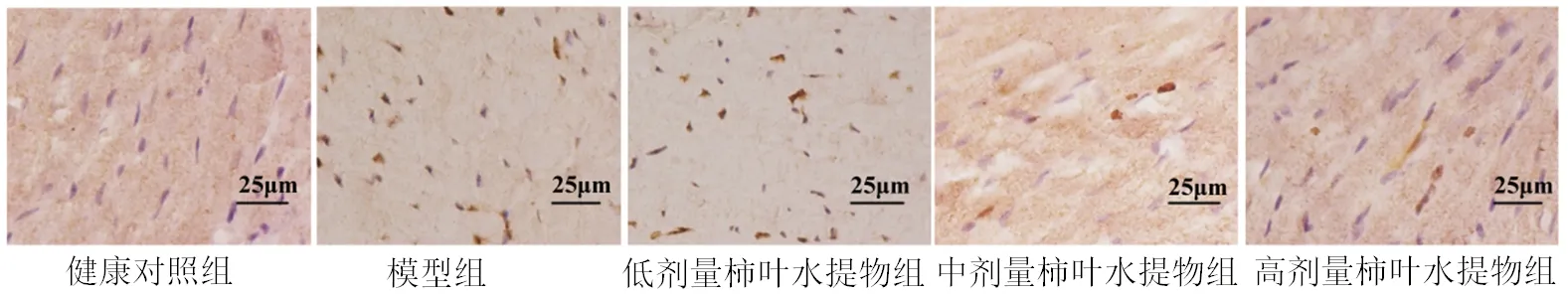
图3 5组小鼠心肌细胞凋亡情况(TUNEL染色,×400)
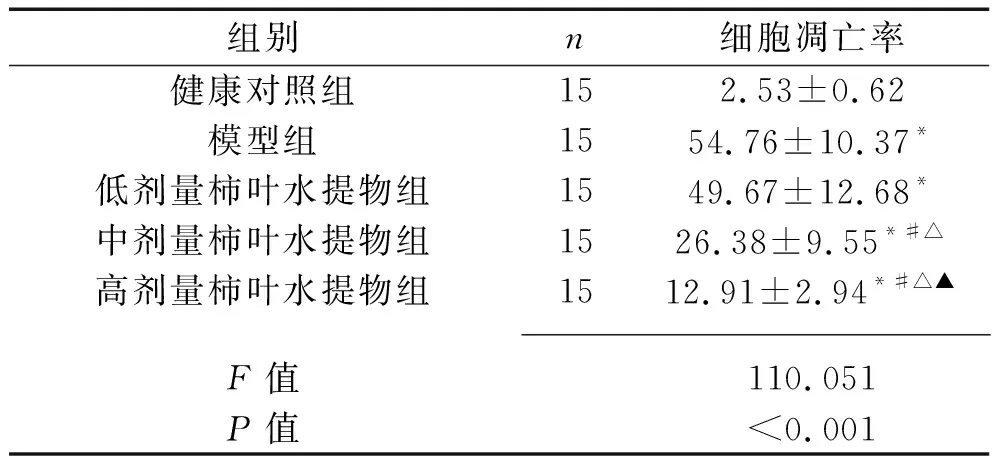
表6 5组小鼠心肌细胞凋亡率的比较(x±s,%)
3 讨 论
研究表明,高脂饮食诱导的肥胖可以上调内脏脂肪组织中血管紧张素原基因的表达,并可以通过磷脂酰肌醇-3-激酶信号通路加重胰岛素抵抗,从而导致脂代谢和糖代谢紊乱[8]。张丽萍[9]的研究结果显示,内脏脂肪功能失常或胰岛素抵抗与脂代谢紊乱、高血压、高血糖和炎症均密切相关。胰岛素水平和胰岛素抵抗是评估糖尿病病情的重要指标[10]。胰岛细胞受损会导致胰岛素抵抗,使机体对胰岛素的敏感性下降,最终导致组织器官的代谢异常[11]。除胰岛素水平外,HbA1c也是诊断糖尿病的指标之一,HbA1c是红细胞中的血红蛋白与血液中的葡萄糖经过缓慢而不可逆的非酶促反应结合而形成的产物,其水平升高表明胰岛细胞受损[12]。本研究采用D12492i高脂饲料喂养小鼠建立糖尿病模型,结果显示,与健康对照组比较,模型组小鼠肥胖指数、空腹血糖水平、HbA1c水平及HOMA-IR指数均升高(均P<0.05),这提示高脂饲料喂养建立的糖尿病小鼠模型可以模拟临床糖尿病患者的疾病特征。柿叶的生物学效用丰富,可用于咳嗽、冠心病、动脉硬化等多种疾病的预防与治疗,其提取物的效果更好。曹旭等[13]的研究表明,柿叶中的二氯甲烷萃取物可以有效调节糖尿病大鼠的血糖和血脂水平。曹芬等[14]研究发现,柿叶提取物可以减轻糖尿病小鼠的胰岛素抵抗。本研究结果显示,中、高剂量柿叶水提物组小鼠的空腹血糖水平、HbA1c水平、HOMA-IR指数及肥胖指数均低于模型组(均P<0.05),这提示柿叶水提物可以有效调节糖尿病小鼠的糖代谢和脂代谢,并改善糖尿病小鼠的肥胖症状。这可能是因为柿叶水提物中含有黄酮类化合物和酚性化合物,这两类化合物具有抗脂质氧化、增强免疫的功能,可调节小鼠的血脂水平;黄酮类化合物还可以阻断肾上腺素受体对血管的收缩作用,并通过增加抗氧化酶的活性来减轻胰岛细胞的过氧化损伤,使机体胰岛素水平趋于正常,达到调节糖代谢、降低血糖的作用[15-16]。
有研究显示,糖尿病小鼠发生脂代谢紊乱后,其脂肪组织内存在大量的巨噬细胞浸润,同时脂肪储存信号的过度反馈使机体慢性炎症反应被激活[17]。目前研究较多的炎症因子有TNF-α、IL-1β、IL-6等促炎症因子和IL-2、IL-12、IL-4、IL-10等抑炎症因子[18-19]。此外,iNOS作为炎症相关信号通路下游因子,在炎症反应中也具有重要作用。成芳梅等[20]的研究结果显示,柿叶水提物可以有效降低小鼠体内的炎症因子水平。本研究结果显示,与健康对照组相比,模型组小鼠血清TNF-α、iNOS、IL-4及IL-10水平均升高,心肌组织的iNOS和IL-10蛋白表达水平上调(均P<0.05),这提示在糖尿病小鼠中慢性炎症反应的激活可上调TNF-α等促炎症因子表达,同时可刺激机体释放一定的抑炎症因子,但抑炎症因子不足以降低整体炎症反应水平。与模型组相比,中、高剂量柿叶水提物组小鼠的血清TNF-α、iNOS水平降低,血清IL-4、IL-10水平升高,心肌组织的IL-10蛋白表达水平升高,而iNOS蛋白表达水平降低,且高剂量柿叶水提物组上述指标的改善优于中剂量柿叶水提物组(均P<0.05)。这提示柿叶水提物可以抑制糖尿病小鼠机体炎症反应,且40 g/kg柿叶水提物的干预效果更优。
糖尿病可导致组织器官的代谢异常从而影响各组织器官的正常功能,心脏是糖尿病常见的受累器官之一[21]。糖尿病导致的心肌损伤可使心肌细胞肥大、纤维化及凋亡。黄永洪等[7]的研究表明,柿叶水提物可以有效减轻心肌梗死大鼠心肌细胞的凋亡。本研究结果显示,模型组小鼠心肌组织的肌红蛋白溶解,心肌细胞核固缩、溶解,肌束膜破裂、心肌纤维弯曲,细胞排列杂乱无章,且血清cTnI、CK、CK-MB水平均高于健康对照组(均P<0.05),这提示糖尿病小鼠存在心肌受损;而中、高剂量柿叶水提物组小鼠心肌组织病理损伤较模型组减轻,血清cTnI、CK、CK-MB水平和心肌细胞凋亡率均低于模型组,且高剂量柿叶水提物组上述指标的改善优于中剂量柿叶水提物组(均P<0.05)。这提示柿叶水提物可以改善糖尿病小鼠的心肌损伤,且40 g/kg柿叶水提物的干预效果更优。这可能是因为柿叶水提物中含有三菇类化合物,后者可有效抑制氧化反应从而保护心肌细胞,同时柿叶水提物中的黄酮类化合物可以抑制炎症反应,这两类物质的协同作用可以抑制心肌细胞的凋亡,保护心肌细胞功能。但本研究结果显示,低剂量柿叶水提物组小鼠的各项观察指标与模型组比较,差异均无统计学意义(均P>0.05),这提示柿叶水提物剂量<20 g/kg时作用效果并不明显,其原因可能与有效成分含量偏少有关。
综上所述,柿叶水提物可改善高脂诱导的糖尿病小鼠的心肌损伤,其可能是通过调节胰岛素抵抗、炎症因子及免疫因子水平来发挥作用,且部分效果具有一定的剂量依赖性。

