丁酸梭菌MY-Z 高密度发酵培养基及发酵工艺的优化
朱 曦,李英俊,梅余霞,查 宇,王朝瑞,梁运祥*
1.华中农业大学农业微生物学国家重点实验室,武汉 430070;2.湖北蓝谷中微生物技术有限公司,湖北 宜昌 443100
丁酸梭状芽孢杆菌(Clostridium butyricum),又名丁酸菌、宫入菌、酪酸菌,在自然界中多分布在肠道、酒窖、奶酪中。1933 年,由日本千叶医科大学宫入近治博士首次发现[1]。丁酸梭菌属于严格厌氧的革兰氏阳性内生芽孢杆菌,细胞直径(0.6~1.2)μm×(3.0~7.0)μm;在梭菌增菌培养基(RCM)平板上和高层琼脂柱内菌落呈奶白色,边缘不整齐;显微视野中菌体呈杆状或梭状,多数单个,少数呈短链,部分菌株在对数生长初期菌体会呈现长丝状[2]。
近几年来,丁酸梭菌作为微生态制剂被广泛应用于食品、医药、饲料与养殖等领域[3]。2009 年7 月,原农业部批准了丁酸梭菌为新饲料添加剂[4]。丁酸梭菌作为微生态制剂饲料添加剂,具有较强的抗生素耐受性,对氨苄西林、强力霉素、甲硝唑等抗生素均不敏感,相对于乳酸菌、枯草芽孢杆菌等常规菌剂,与抗生素联用时受限度较小[5]。因丁酸梭菌是肠道原生有益菌,作为口服的丁酸梭菌制剂较其他益生菌类更能适应肠道生存环境,增强本菌株在肠道中的菌群优势;同时,其与双歧杆菌、乳酸菌、粪肠球菌等有益菌不仅共生还可促进增殖,维护肠道良性微生态平衡[6];其产生的以丁酸、乙酸为主的短链脂肪酸可抑制有害菌,大量动物试验和人体临床试验表明,丁酸不仅可以修复肠道黏膜,还是肠道上皮细胞生长的直接能量来源,促进肠道绒毛发育,增强肠道对有害物质的屏障能力,常用于治疗肠道疾病[7],在抑制动物腹泻、提高动物免疫力等方面具有积极的效果。丁酸梭菌产生的胞外活性酶如淀粉酶、蛋白酶、纤维素酶等,可帮助机体分解多糖、纤维素、脂肪、蛋白质等,利于机体消化吸收[8]。虽然丁酸梭菌是严格厌氧菌,因其是产芽孢杆菌,芽孢不仅具有耐热、耐胃酸、胆酸还耐氧,使其具有一定的抗逆性,便于工业规模化生产、运输、保存和在常规环境下使用。
自丁酸梭菌被发现以来,国内外很多生物、医药等领域的学者对丁酸梭菌进行了深入的研究,重点在菌株分离鉴定及其应用机理,而在丁酸梭菌规模化发酵生产工艺及菌数检测等方面的基础研究还不够深入,生产发酵水平偏低。目前在国内,1 t 以上的发酵罐产出的发酵液芽孢数普遍只在2×108~109CFU/mL。少数企业在后处理时经离心浓缩、喷雾干燥后有效活菌数才能达到1×1010CFU/g,市场上现有的丁酸梭菌相关产品普遍存在有效活菌数低、货架期短、价格偏贵等问题[9]。随着相关专业人员和普通大众“减抗、禁抗”意识的增强及对益生菌剂认知的提高,现有的生产发酵水平已难以满足食品、医药、养殖及饲料加工等行业对丁酸梭菌需求量大、有效活菌数高、货架期长且价格低廉等要求,严重制约了丁酸梭菌的推广和应用,各生产和使用厂家急切需要解决发酵工艺中的限制问题,突破现有发酵水平,降低发酵成本。本试验通过探究丁酸梭菌的营养条件及其发酵工艺优化,以期能在实际生产及应用等方面提供解决思路和策略,实现丁酸梭菌的高密度发酵,从而大幅度提高有效活菌数和芽孢转化率及降低规模化生产成本。
1 材料与方法
1.1 菌种来源
丁酸梭状芽孢杆菌C.butyricumMY-Z,由华中农业大学农业微生物学国家重点实验室提供。
1.2 试验仪器
DL-CJ-2ND1 洁净工作台(北京东联哈尔仪器制造有限公司);显微镜GC-8860 气相色谱仪(安捷伦科技有限公司);GI54DWS 型高压灭菌锅;AOE INSTRUMENTS UV-1500 分光光度计;P70D20TLD4 格兰仕微波炉;UPR-II-5/10T 超纯水仪;C22-IH960D 苏泊尔电磁炉。
1.3 培养基
梭菌增殖培养基(RCM 培养基):酵母粉3 g,牛肉浸膏10 g,胰蛋白胨10 g,葡萄糖5 g,可溶性淀粉1 g,氯化钠5 g,三水合乙酸钠3 g,半胱氨酸盐酸盐0.5 g,0.5%美蓝0.2 mL,蒸馏水1 000 mL,调节pH 至7.0±0.2。
发酵基础培养基:葡萄糖10.0 g、蛋白胨10.0 g、酵母粉5.0 g、牛肉粉10.0 g、可溶性淀粉2.0 g、K2HPO41.05 g、MgSO4·7H2O 1.21 g、NaCl 0.3 g、CaCO31.5 g、MnSO4·H2O 0.012 g、促生长因子0.2 g、蒸馏水1 000 mL,调节pH 至7.0±0.2。
计数培养基:梭菌增殖培养基(RCM 培养基)加0.4%~0.8%的琼脂,分装试管,上封液体石蜡,制成高层半固体培养基。
计数稀释液:0.85%的生理盐水加0.03%的吐温80。
上述培养基均115 ℃灭菌30 min。
1.4 培养方法
1)种子活化及培养方法:取超低温保存的甘油管菌种100 μL,接种到含有15 mL 的已除氧溶化冷却至40 ℃的RCM 半固体培养基的试管中,培养基表面覆盖高2~3 cm 液体石蜡以隔绝空气,37 ℃恒温培养箱中静止培养12~18 h。再取此菌液100 μL 接种到已除氧RCM 培养基中,37 ℃静置培养至对数期作为种子液备用。
2)丁酸梭菌发酵培养:采用液体深层静止培养,250 mL 试剂瓶,装液量150 mL,表面覆盖高2~3 cm 液体石蜡以隔绝氧气,于37 ℃恒温培养箱中静止培养24 h 后计数。
1.5 检测方法
1)丁酸梭菌芽孢计数方法(试管高层半固体琼脂法)。取菌液于80 ℃水浴加热10 min,取经处理后的待测菌液10 mL 加到90 mL 去氧液封稀释液内,并用移液管搅打均匀,不形成气泡,制成1∶10 的均匀稀释液,取此菌悬液1 mL 注入到9 mL 去氧液封稀释液内,同上,制成1∶100 均匀稀释液,按上述操作依次进行10 倍递增稀释,选择1~3 个合适的稀释度,取1 mL 注入到10~15 mL 已除氧高层半固体培养基内,每个梯度做3 管平行,置(36±1)℃培养16~24 h,计数。
2)还原糖的检测方法。采用3,5 二硝基水杨酸法(DNS 法)。
3)气相色谱测定丁酸产量。取发酵液10 mL,用50%硫酸和乙醚提取丁酸,以丁酸标准品为内标进行气相色谱仪测定。色谱条件:柱流量为1 mL/min,FID 检测器,检测器温度为250 ℃,进样量为1 μL;升温程序如下:60 ℃保持4 min,以6 ℃/min 的速度升温至180 ℃,再以20 ℃/min 的速度升温至200 ℃,保持5 min。
1.6 单因素试验
1)最佳接种量及初始pH 的确定。分别以1%、2%、3%、4%、5%、10%的接种量接种到基础培养基中,另将基础培养基初始pH 分别用0.5 mol/L 的盐酸溶液和饱和碳酸氢钠溶液调制成pH 5.5、6.0、6.5、7.0、7.5,其他培养条件不变,以确定最佳接种量及初始pH。
2)碳源的筛选。分别以1.0%的量添加红糖、糖蜜、甘油、麸皮、玉米粉、可溶性淀粉、乙酸钠等原料替换初始培养基中的碳源,其他营养组分不变,以初始培养基为对照,探究不同碳源对丁酸梭菌增菌的影响。3%的接种量,37 ℃培养24 h 后,取样测定菌落数。
3)优势碳源添加量的确定。筛选出优势碳源后,再分别以2.0%、2.5%、3.0%、3.5%、4.0%、5.0%的量替代初始发酵培养基中的碳源,以确定最佳添加量。接种量及培养方法同1.6 2)。
4)氮源的筛选。在1.6 3)的基础上,分别以2.0%的肽、玉米浆、鱼粉、花生粕、酵母粉、豆粕、酶解羽毛粉、硫酸铵等量替代初始发酵培养基中胰蛋白胨和蛋白胨2 种主要的氮源,考察不同的氮源对丁酸梭菌增菌的影响,接种量及培养方法同1.6 2)。
5)最佳氮源添加量的筛选。在1.6 4)的基础上,本试验采用增菌明显的酵母粉、肽粉和鱼粉分别以2.5%、3.0%、4.0%、5.0%的量替代初始培养基中的胰蛋白胨和蛋白胨,以确定最佳添加量,接种量及培养方法同1.6 2)。
1.7 发酵工艺的研究
以下试验培养基均以2.5%的葡萄糖、3.5%鱼粉和0.5%的酵母粉,其他营养成分与比例同初始培养基。
1)发酵过程中间歇调控pH 对增菌的影响。在单因素试验基础上,三角瓶发酵静置培养至10 h,10、15 h 时分别用浓度为20%的NaOH 溶液调节发酵液pH 至6.0,并检测葡萄糖,接种量及培养方法同1.6 2)。
2)在发酵过程中补料对增菌的影响。本试验在1.7 1)的基础上,培养至10、15 h 时分别按1.0%、2.0%、2.5%、3.0%、3.5%、4.0%、5.0%的量向发酵液中补充初始培养基营养液,接种量及培养方法同本文1.6 2)。
3)发酵过程中在线控制pH 并补料对增菌的影响。50 L 自控发酵罐,配制优化后的培养基,装液系数60%,上覆2~3 cm 厚的液体石蜡或连续通入氮气以保证相对厌氧环境,低速搅拌,接种量3%,培养温度37 ℃,培养至10 h 开始变量流加补充培养基营养液,总流加量为5%,同时用中和剂维持培养液pH 在6.0。发酵过程中分时段取样检测葡萄糖、丁酸及芽孢数。
2 结果与分析
2.1 不同的接种量和初始pH 值对菌数的影响
从图1 可以看出,接种量为3%的发酵液生物量最高,随着接种量的增加,生物量略有下降。分析原因:由于接种量大,生长速率快,营养消耗快,且接种量过大,种液中的代谢物特别是酸性物质降低了培养基的初始pH 值,缩短了菌体的生长对数期。由此可见,在实际应用中并不是接种量越大越好,应根据实际的试验和生产情况确定相应的接种量。另外,在本试验中发现接种量越小,相对启动耗时越长,接种量越大,发酵启动越快,接种量为10%的发酵液启动时间比1%组提前了约1.5 h,接种量过低启动时间过长,增加了动力消耗和发酵液污染的风险。本研究后面试验均采用3%的接种量。
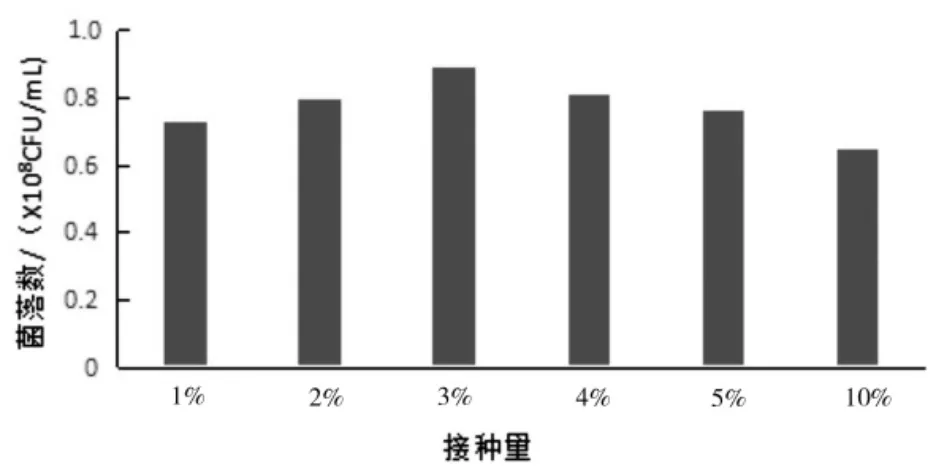
图1 不同的接种量对菌落数的影响
由图2 可知,初始pH 为5.5 时,丁酸梭菌的启动很慢,生长很弱,随着pH 值的升高菌数增加,pH值为6.0 时菌数最高,pH 6.5 时菌数略低,2 组差异不明显。此后,随着pH 升高,菌数开始下降,由此表明初始pH 在偏酸范围内较好。后面试验确定初始pH 值为6.0。

图2 不同的初始pH 值对菌落数的影响
2.2 不同碳源筛选
碳源是微生物培养基的主要营养成分,为微生物的生长繁殖、构成菌体细胞和代谢活动提供能源。丁酸梭菌可以利用多种碳源,包括单糖和多糖。本试验所选的8 种碳源中包括单糖、多糖及乙酸钠。由图3 可知,葡萄糖作为碳源时芽孢数最高,达到0.98×108CFU/mL,明显高于其他碳源组(P>0.05),因此优选葡萄糖作为本次后续试验碳源。红糖和糖蜜仅次于葡萄糖,从原料来源和生产成本考虑,建议在工业化生产中选这2 种作为主要碳源。

图3 不同碳源对丁酸梭菌菌落数的影响
2.3 最佳碳源添加量的确定
微生物在生长过程中对营养物质的需求有一定的限量范围,营养物质过低或过高都会对菌体的生长造成很大的影响,因此确定适当的量,对微生物生长尤为重要。本试验在确定最佳碳源的基础上,优化其最佳添加量,结果见图4。从图4 可以看出,葡萄糖添加量为3.0%的发酵液菌数最高,达到2.33×108CFU/mL,明显高于1.0%组,与2.5%组差异不显著,与4.0%、5.0%组差异显著。由表1 可知,发酵结束后1.0%、2.0%组的培养液所含还原糖分别为0.18%和0.23%,表明糖几乎消耗殆尽,2.5%添加量的培养液内还原糖为0.48%,3.0%及以上各组培养液里还原糖均高于2.5%组,5.0%组还原糖值最高,达到了2.21%。随着糖量的增加,培养液还原糖值越高,培养基内的残糖越多,并且从发酵液的pH值可以看出,所添加的糖并没有被利用转化,由此确定葡萄糖的最适添加量为2.5%。
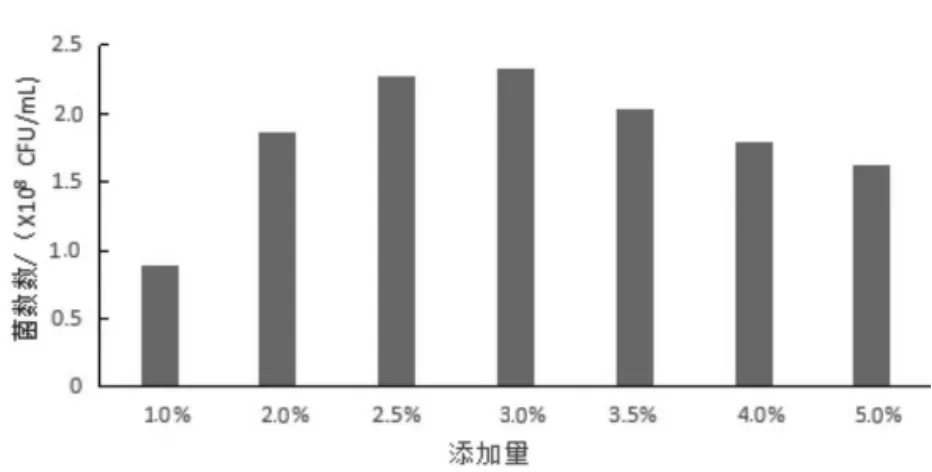
图4 优势碳源不同添加量对丁酸梭菌菌落数的影响

表1 各组发酵液中还原糖及pH 的检测结果
2.4 优势氮源添加量的确定
氮是构成生命重要物质蛋白质和核酸等的主要元素,与碳源相同,氮源也是微生物的主要营养物质,通常分为有机氮源和无机氮源。本试验以市场上常见的包含有机氮和无机氮的8 种氮源,以部分替代基础培养基中原有氮源的方式,考查不同氮源对丁酸梭菌生长的影响,结果见图5。其中,肽粉、鱼粉和酵母粉3 组间菌数差异不显著,但优于对照组,且显著高于其他氮源。
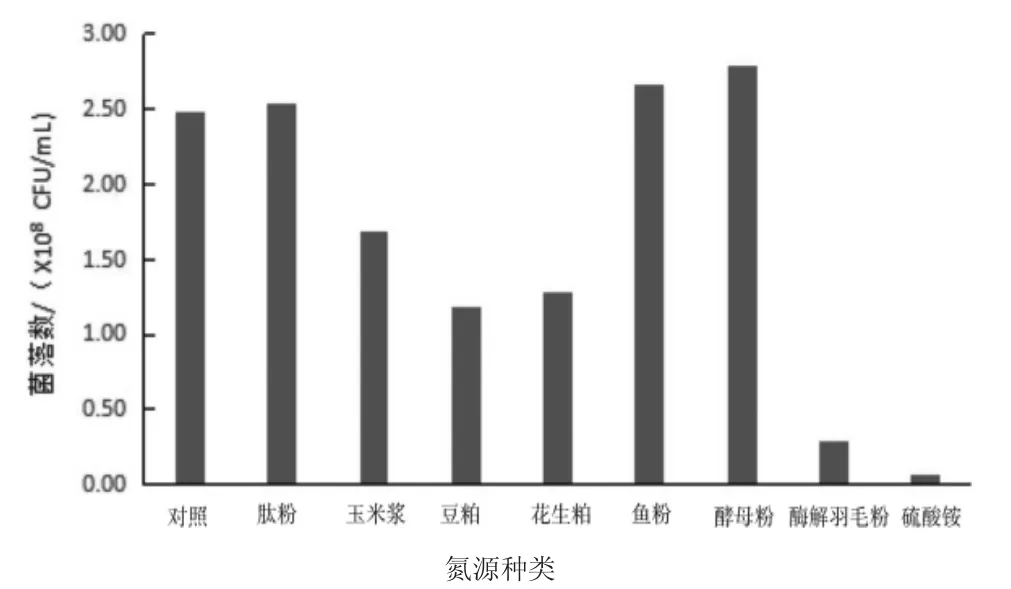
图5 不同氮源对丁酸梭菌菌落数的影响
本试验选择菌落数相对较高的酵母粉、鱼粉和肽粉作为优势氮源,在一定范围内以确定最佳添加量,结果见图6,酵母粉在2.5%时菌数为3.12×108CFU/mL。肽粉和鱼粉分别在3%菌数最高,分别达到2.95×108、3.05×108CFU/mL。各组添加比例间菌落数没有随着添加量的增加而显著提升,且各组最高菌数间差异不显著。3 种优势氮源中,酵母粉不仅是微生物生长的优质氮源,还含有多种生长因子,但价格相对来说要高出很多。在发酵生产中,为保证营养互补多采用复合氮源的方式。因此,本试验确定酵母粉为0.5%与3.0%的肽粉或3.0%的鱼粉组合成复合氮源。

图6 3 种优势氮源不同的添加量对丁酸梭菌菌落数的影响
2.5 发酵过程中间歇调控pH 对增菌的影响
1.6 1)试验结果显示,初始pH 在5.5 时菌体生长缓慢,表明过低的pH 值对丁酸梭菌生长会形成抑制。1.6 3)试验结果可知,发酵结束时培养液的pH 值显示为4.7 左右,且除1.0%组外,其他各组培养液内均有不等量的残留葡萄糖,表明菌体可能是由于受到酸性代谢物的抑制,糖没有被完全利用。为了解除酸抑制,本试验在培养至10 h 和培养至10、15 h 分别调节pH 至6.0,培养结果见图7。由图7 可知,在培养过程中调节pH 可以明显提高丁酸梭菌的生物量,在10 h 和10、15 h 分别调节pH 至6.0 的试验组菌落数比对照组分别提高了21.02%和39.66%。检测培养液内剩余葡萄糖,由表2 可知,1次补碱组剩余葡萄糖为0.31%、2 次补碱组剩余葡萄糖为0.06%。经2 次补碱后,葡萄糖基本被利用完全。表明解除酸抑制,不仅延长了菌体的生长对数期,还可提高糖的利用率,同时也大幅度提高了生物量。
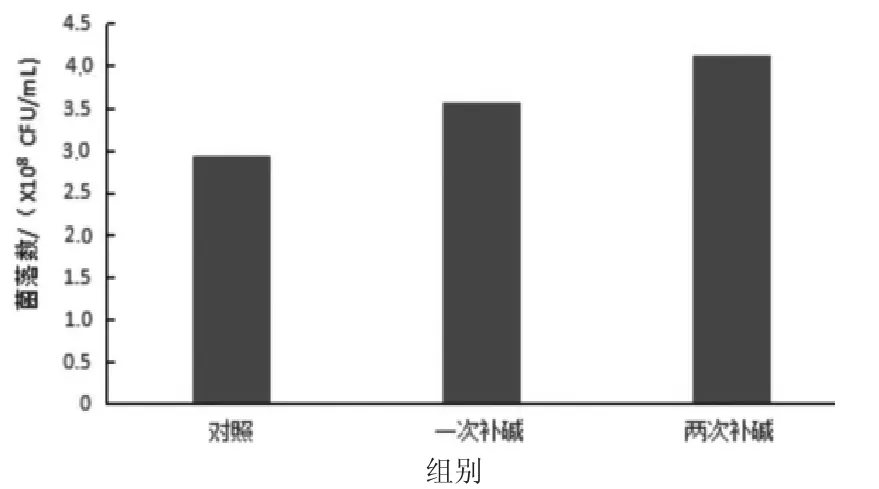
图7 不同补碱次数对丁酸梭菌菌落数的影响

表2 间歇控酸发酵液残糖量检测结果
2.6 发酵过程中补料对增菌的影响
从1.7 1)试验可知解除酸抑制后,培养液里的糖基本利用完全,培养基内的碳量偏低,表明对数期菌体生长快,培养基中的营养物质消耗也快,可能会造成后期发酵动力不足。本试验通过培养至10、15 h 在2 次补碱的同时分别按总量为1%、2%、3%、5%补充初始培养基营养液,结果见图8。2%的补料量菌数最高,但与1%组差异不显著。3%、5%补料组的菌落数没升反而有所下降,可能是因菌体生长快,产酸量大,调节酸碱的间隔时间过长,发酵液的营养过于丰富,影响了转孢率。由于本试验所用的检测方法为丁酸梭菌芽孢计数法,所计菌数实际为芽孢数,使得菌数低于前2 组。试验结果表明,适量的补料可为菌体持续性的生长繁殖提供充足的动力,延长对数期。
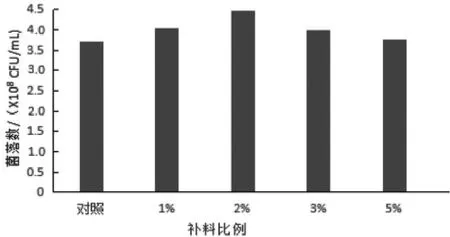
图8 梯度补充营养液对丁酸梭菌菌落数的影响
2.7 发酵过程中在线控制pH 并补料对增菌的影响
由图9 和表3 可知,随着发酵的启动,在发酵至10 h 测得发酵液中葡萄糖的含量为0.18%,而发酵液中的丁酸含量呈持续性增加。补料泵开启后,菌数保持快速生长的状态,发酵至24 h 左右丁酸的含量增加缓慢,此时停止补料,此后菌落数仍然在增长,表明发酵液中菌体萌发芽孢,此后芽孢大量的形成和成熟,发酵至32 h,菌落数为2.28×109CFU/mL,镜检发酵液芽孢率已达90%以上。
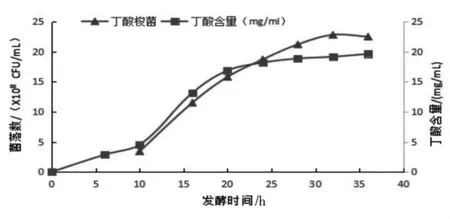
图9 发酵罐中丁酸含量与丁酸梭菌生长之间的关系

表3 补料前发液中葡萄糖的含量
3 讨 论
本试验通过优化调整培养基中主要碳、氮源,对常见的8 种碳源和氮源筛选比较,确定葡萄糖为最佳碳源,这与杜孟思等[11]、戚薇等[12]及耿正颖[13]的研究结果相一致。在试验结果中可见红糖、糖蜜的菌落数与葡萄糖的差异不大,糖蜜为制糖下角料,相对于葡萄糖价格低廉,在规模化生产中因量大原料成本间的差异突出显现,可考虑采用糖蜜作为唯一碳源或补充碳源。氮源的筛选结果是酵母粉为最佳氮源,其次是鱼粉和肽粉,二者差异不显著,与夏会丽等[14]研究结果大致相同(酵母粉为最佳氮源)。与目前丁酸梭菌常用的牛肉粉和各种蛋白胨及戚薇等[15]采用水解3 h 的豆粕作为最佳氮源不同的是,本试验选择鱼粉和肽粉作为备选原料,主要是考虑到牛肉粉和胰蛋白胨价格昂贵,水解豆粕工艺相对复杂,对于生产丁酸梭菌的厂家来说自己处理比较繁琐,市场来源相对较少。且目前由于本菌发酵水平和后期处理工艺不成熟,利润空间有限,生产厂家急需相对廉价且易得的生产原料。本试验考虑到鱼粉是饲料行业常用原料,不仅含优质蛋白还含有丰富的维生素及矿物质元素;而肽粉是近些年来饲料行业新兴原料,富含小分子物质,宜于机体吸收利用,广泛用于饲料及食品行业,生产工艺成熟,市场来源广泛,易于采购且质量有保障。试验结果表明,酵母粉、鱼粉、肽粉3 种优势氮源可完全替代常用的牛肉粉和胰蛋白胨。经优化,2.5%葡萄糖和复合氮源(3.0%肽粉与0.5%酵母粉或3.0%鱼粉与0.5%酵母粉)、无机盐及其他组分同初始培养基,为最佳营养条件,初始pH 6.0,接种量3%,在此条件下三角瓶静置培养芽孢数可达3.35×108CFU/mL。
在1.6 3)的试验中发现,发酵过程中随着发酵时间的延长,菌体代谢产生的如丁酸、乙酸、乳酸等有机酸的积累[16],发酵液的pH 快速降低并对菌体的生长形成抑制,出现“酸胁迫”现象,菌体生长对数期只有短短的3~5 h。1.7 1)试验采用在发酵过程中补碱来解除“酸胁迫”。在试验中发现,1 次补碱可延长生长对数期1~3 h,培养液中葡萄糖的量明显降低,二次调节后培养液中所剩葡萄糖的量微乎其微。本试验在调节pH 时没有采用邹孟琳等[17]使用饱和碳酸氢钠溶液作为中和剂,而是用质量分数为20% NaOH 溶液作为中和剂,避免了在发酵过程中由于本菌产酸量高,需消耗的碳酸氢钠溶液的量大,不仅稀释了培养基,还使得发酵液的终体积大幅增加,影响发酵器具的初装量。
通过1.7 1)试验发现,在间隔2 次调pH 试验过程中,对数期的丁酸梭菌对营养需求量比较大,初始糖很快消耗殆尽,远不能满足菌体快速生长的需要,菌体生长过程中出现“碳饥饿”。1.7 2)试验通过一定量的补料延长了菌体生长的对数期,大幅度提高了生物量。
在50 L 发酵罐发酵过程中,由于可在线调控恒定发酵液的酸碱度,菌体处于持续性良好的生长环境,生长繁殖速度快,培养基内的营养消耗相应也快,在发酵10 h 左右取样检测培养基里葡萄糖的量已不到0.2%,这说明从发酵10 h 开始,发酵液中的营养已不能满足丁酸梭菌快速生长的需要,这与夏会丽等[14]研究的发酵至12 h 检测发酵液中的糖近乎为0 的结果相近。由于丁酸梭菌存在“碳溢流”现象[18],并且高浓度培养基的高渗透压会给菌体细胞膜带来压力和损伤,为避免此类影响,发酵初始培养基通常只提供基本生长的营养。为了提高生物量,在菌体快速生长时期需要增补充足的营养。本试验在发酵过程中及时进行在线连续补料,不仅使菌体在快速生长时得到充足的营养,延长菌体生长对数期,还可以避免因营养不足出现菌体因“饥饿”而急速衰亡。培养至28 h,芽孢数为2.12×109CFU/mL,取样镜检芽孢率达90%以上,4 h 后测得发酵液菌数达2.28×109CFU/mL,再延时培养至36 h,菌落数并没有显著增加,芽孢数趋于平稳,由此建议在实际生产中发酵至32 h 即可下罐。
4 结 论
通过单因素试验,得到优化的培养基和培养条件:葡萄糖25 g/L、酵母粉5 g/L、肽粉30 g/L 或(酵母粉5 g/L、鱼粉30 g/L)、K2HPO41.05 g/L、MgSO4·7H2O 1.21 g/L、NaCL 0.3 g/L、CaCO31.5 g/L、MnSO4·H2O 0.012 g/L、促生长因子0.2 g/L,接种量3%,37 ℃培养30~36 h,发酵过程中在线恒定pH为6.0,并在发酵10 h 左右进行培养基营养液总量为5.0%的连续补料。丁酸梭菌MY-Z 在此发酵工艺条件下,芽孢数可达2.28×109CFU/mL。

