质量管理小组活动在规范中成药生产企业药品不良反应中医术语MedDRA编码中的实践与探索
吴 颖 何桂英 刘雪梅 龙 平 彭良帅
太极集团四川绵阳制药有限公司质管部,四川绵阳 621000
药品不良反应(adverse drug reaction,ADR),是指合格药品在正常用法用量下出现的与用药目的无关的有害反应。《监管活动医学词典》(medical dictionary for regulatory activities,MedDRA) 是 在“人用药品技术要求国际协调理事会”(International council for harmonisation of technical requirements for pharmaceuticals for human use,ICH)的主办下编制的国际医学术语集。MedDRA术语集是生物制药监管领域被国际认可的医学术语集,是药事管理机构和医药行业数据互换和共享的标准化术语集。国家实行药品不良反应报告制度,药品生产企业(包括进口药品的境外制药厂商)、药品经营企业、医疗机构应当按照规定报告所发现的药品不良反应[1-3]。药品不良反应报告涉及的MedDRA编码就是将不良反应中的原始用语转化为MedDRA术语集中统一的术语,编码后不仅有助于监管机构及行业内各组织的交流沟通,还能提高不良反应数据分析的时效性和可用性。
MedDRA术语集的层级结构为五级结构[4],见图1。层级结构提供了上下级别,上级术语是范围较广的一组术语,适用于其下级的每个术语。层级结构的各层级则代表本术语集内的各种纵向联系。层级结构是实现灵活的数据检索和清晰的数据表达的重要机制。五级结构为数据检索提供了多种选择,根据检索特异度的要求可通过特异的或宽泛的组来检索。低位语(lowest level term,LLT)的特异性最高。首选语(preferred term,PT)是对某种症状、体征、疾病、诊断、适应证、检查、外科和内科操作、疾病史、社会史或家族史等单一医学概念进行独特表达的专用术语,PT必须定义明确,无歧义,特异性和描述性强且符合国际标准。
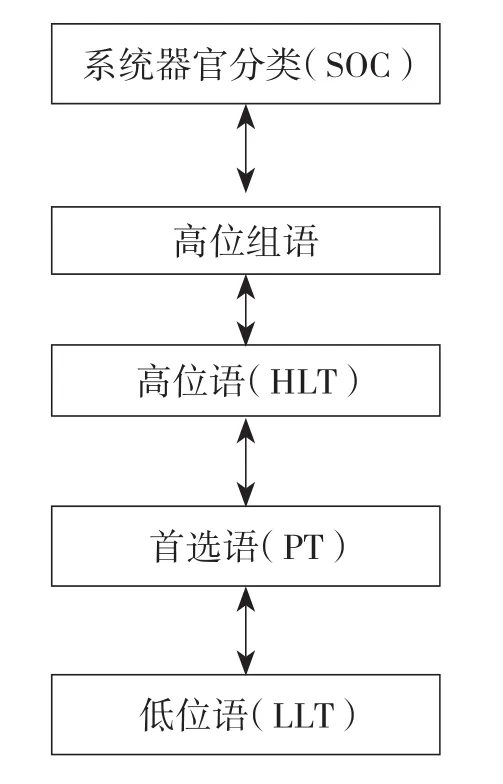
图1 MedDRA术语集层级结构
国家药品监督管理局要求药品上市许可持有人自2022年7月1日起,在提交上市后药品不良反应报告中使用MedDRA编码[5]。然而,MedDRA术语集是基于西医学体系构建而成,作为中成药生产企业,在使用MedDRA术语对收集到的不良反应原始数据进行编码时发现,不良反应原始数据中患者的“用药原因”多是中医术语,如“上火”“肝胆湿热”“舒筋活血”“腰膝酸软”“养血安神”“胸闷”“胸胁苦满”等,在MedDRA术语集中无法找到对应的术语,无法进行编码。编码人员往往根据主观理解在MedDRA术语集中选择相近的术语进行编码。然而,不同人员或同一人员在不同时间编码的结果很容易不一致,甚至与患者原始的用药原因偏差过大,导致公司不良反应数据编码不规整、不统一,最终影响数据的分析和统计,甚至失去了药品不良反应报告的意义[6]。例如“反胃”,有报告编码为“恶心”(图2),有报告编码为“呕吐”(图3);如“纳差”,有报告编码为“食欲减退”(图4),有报告编码为“摄食量减少”(图5)。

图2 “反胃”MedDRA编码1

图3 “反胃”MedDRA编码2

图4 “纳差”MedDRA编码1

图5 “纳差”MedDRA编码2
为使公司不良反应中医术语MedDRA编码更规整、统一,组建了融智创新质量管理小组(QC小组),通过开展QC创新活动,探索如何规范公司不良反应中医术语MedDRA编码。
1 设定目标及目标论证
1.1 设定目标
探索如何规范不良反应中医术语MedDRA编码,使编码统一、规范,利于不良反应数据的统计和分析。
1.2 目标可行性分析
公司配备了具有丰富药物警戒经验的专业技术人才,人力资源充沛;购买安装了药物警戒系统,内嵌MedDRA编码程序,并获得了MedDRA的使用授权,信息化工具或系统均满足条件;QC小组活动的开展促进了内生动力,提高了人员积极性,助于课题推动及目标达成。
2 提出方案并确定最佳方案
为达到设定目标,小组制订出三种方案,见表1。经过调研、考察、讨论,最终决定建立《中医术语MedDRA编码对照表》。

表1 方案对比及最佳方案确定表
3 对策制定
小组经过讨论,按照5W1H原则制定了对策表。见表2。

表2 对策表
4 对策实施
4.1 数据规整及编码
将每一例不良反应数据中患者的“用药原因”(原始数据)进行规整,规整为意思相近的西医术语,使用该术语在MedDRA术语集中检索,选择恰当的低位语(LLT)和首选语(PT),完成编码。
4.2 建立对照表并对照编码
建立《中医术语MedDRA编码对照表》,将已编码的原始数据和首选语(PT)纳入对照表中,随着不良反应数据逐渐增多,按照4.1编码后增加至对照表中,后续相同的“用药原因”直接搜索对照表进行编码。
4.3 《中医术语MedDRA编码对照表》
QC小组活动开展一年以来,《中医术语MedDRA编码对照表》共纳入321条“用药原因”MedDRA编码对照信息,见表3。

表3 中医术语MedDRA编码对照表(部分)
5 效果检查
5.1 目标完成情况
建立了《中医术语MedDRA编码对照表》,达到了使中医术语MedDRA编码统一、规范的目的,利于不良反应数据的统计和分析。对本次QC小组活动开展前后,部分不良反应“用药原因”的MedDRA编码结果进行了比较,结果见表4。
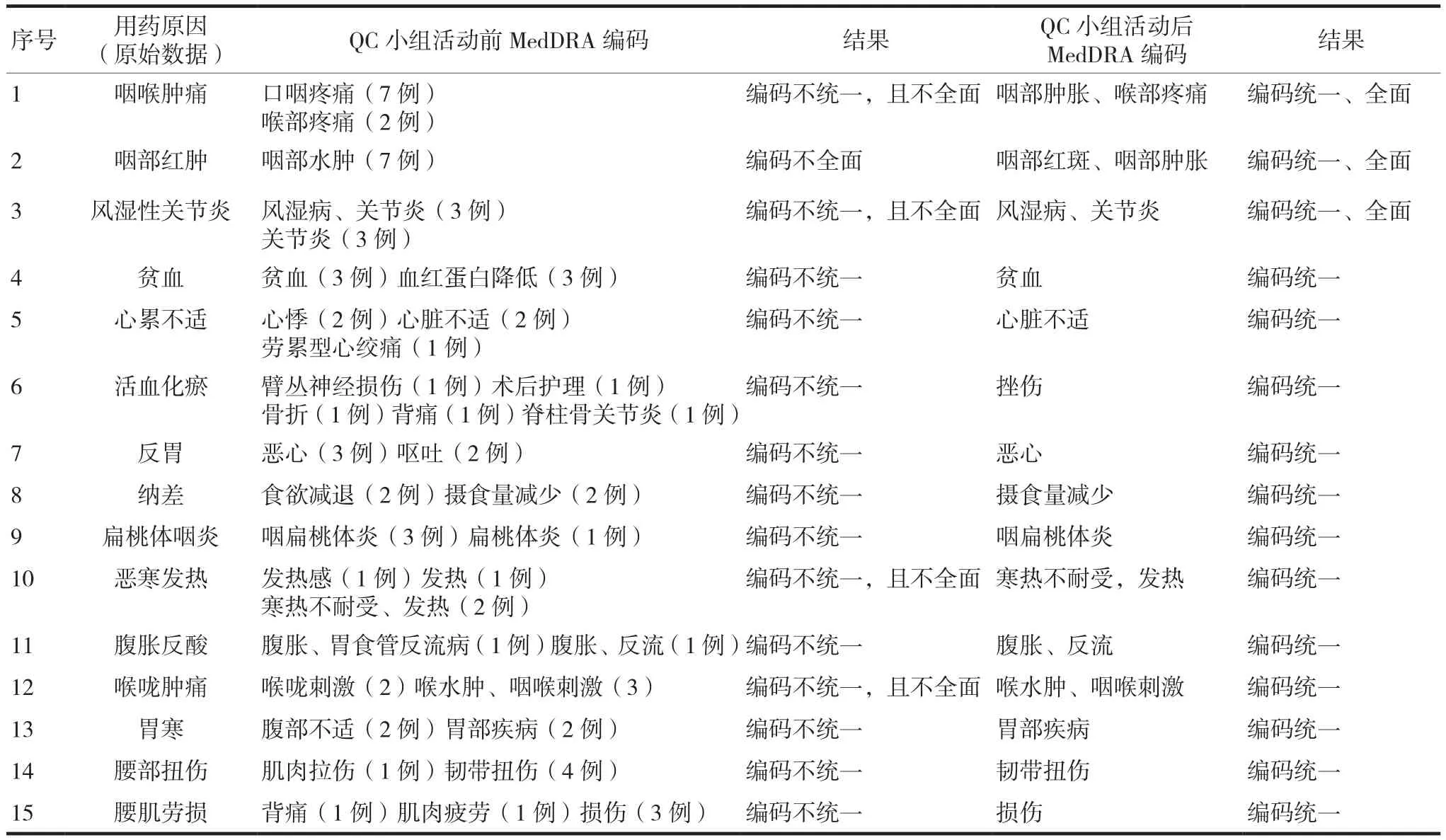
表4 QC小组活动开展前后MedDRA编码结果比较
5.2 效益
通过本次QC小组活动的开展,公司不良反应中医术语MedDRA编码更统一、规范,此外,还明显提高了编码人员的编码效率,降低了对固定人员MedDRA编码能力的依赖性,同时还能加快新人对该业务的上手速度,即使未曾学过MedDRA编码规则的人员,在编码过程中使用《中医术语MedDRA编码对照表》进行搜索,选择匹配的术语,可快速完成编码。因此,本活动的实践还间接降低了企业人力资源管理的成本。
6 讨论
6.1 QC小组活动成效
经过小组人员的共同努力,成功实现了使不良反应中医术语MedDRA编码统一、规范的目标,未来将持续更新《中医术语MedDRA编码对照表》的内容。通过本次QC小组活动,将QC工具运用到日常工作中,工作质量和效率有所提高,创新能力得到了提升。
6.2 标准化
本次活动建立的对照表是针对每一例药品不良反应的用药原因,一例不良反应的用药原因可能是一种,也可能是多种。后续计划开展标准化工作,针对每一种用药原因来统计数据,建立更专业、精准的中医术语MedDRA编码数据库。
6.3 建议
MedDRA术语集目前已被各国广泛应用,有数据统计截至2020年,MedDRA用户已经覆盖126个国家,MedDRA的语言版本就有14种[7]。陆续有国家开始强制使用MedDRA,如我国,在前期做了大量工作以促进MedDRA在我国的应用[8-9],但其只适用于西医术语编码使用,无法适用于中医术语。在中国知网等数据库以多种检索词检索药品不良反应中医术语MedDRA编码相关内容,搜索到的相关研究寥寥无几,发表时间最近的为2018年,未搜到近三年发表的相关研究。有研究[10]探讨构建基于MedDRA术语的中医药临床试验编码术语集,通过确定主次系统器官分类(System Organ Class,SOC)来解决SOC中医与现有SOC中同义词条的编码表达和后期检索问题,从而有利于中医药临床试验数据的交换、共享、检索和再分析。有研究[11]提出成立研究指导组和课题组,拟定中医术语范围,维护符合MedDRA规则的中医学编码术语,确定术语英文翻译,建立国际公认的中医学不良反应术语集,并持续维护和更新,以促进中医学不良反应的规范编码、分析、监管和数据共享。有研究[12]以MedDRA术语集为参照和基础,根据中医标准用语与差异性研究的结果所得出的类名词分别加入术语集,将术语集进行扩充,加入有中医含义及中医特有的中医名词,初步建立新的编码数据库。
《中华人民共和国药品管理法》[13]于2019年12月1日正式施行,提出“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制。”《药物警戒质量管理规范》[14]已经于2021年12月1日开始施行,规范要求药品上市许可持有人开展符合法律法规要求的药品不良反应报告与处置活动。《药品上市许可持有人MedDRA编码指南》[15]也于2022年5月6日发布并实施,该指南只适用西药学体系的不良反应编码。自2022年7月1日起药品上市许可持有人的不良反应报告强制使用MedDRA编码。从目前监管形式看,国家对药品上市许可持有人合规报告不良反应的质量要求越来越高,监管力度越来越大。建议国家药品不良反应监测中心考虑与MSSO合作,召集中医和西医术语专家,从中医的特色和特点出发,开展专项研究,研制专门的中医学不良反应编码术语集,或者在MedDRA术语集中新增中医术语,以规范中医学不良反应编码,便于药品上市许可持有人规范开展不良反应监测和上报工作,同时促进监管机构及行业内各组织的交流沟通,更利于中医药走上国际化。

