室内环境嗜松青霉的MVOCs释放特征及影响因素
温胜超,刘兆荣
室内环境嗜松青霉的MVOCs释放特征及影响因素
温胜超,刘兆荣*
(北京大学环境科学与工程学院,北京 100871)
以嗜松青霉为例,用顶空-固相微萃取-气相色谱-质谱联用仪(HS-SPME-GC-MS)采集分析其代谢挥发性有机物(MVOCs),考察了生长时间、温度、光照、氧含量(通气流量)对MVOCs释放特征的作用,探讨了其对室内VOCs的源贡献.结果表明,共发现6类14种MVOCs,包括浓度较高的乙醇、丙酮、乙酸、乙酸乙酯、异戊醇、苯甲醚,浓度较低的异丁醇、2-甲基丁醇、糠醇、甲苯、间二甲苯、1-辛烯-3-醇、3-辛醇和柠檬烯.氧含量和生长时间对MVOCs影响最明显,氧含量主要影响乙醇和丙酮的竞争代谢,乙酸、乙酸乙酯也在缺氧时产量更多;嗜松青霉在不同的生长阶段的代谢产物种类和产量均不同,总MVOCs量在接种第4~6d达到最大值,除乙酸、柠檬烯外,其他物质均受生长时间的影响;在25℃时能产生最多的MVOCs量,在35℃时产生的MVOCs最少,不同温度下各MVOCs组分也不同;光照对嗜松青霉的MVOCs代谢影响不明显.在有氧有光的3种实验温度下,总MVOCs排放强度在5031~7650ng/(m2×d)之间,各物质室内浓度贡献区间为0.0256~444.0380ng/m3.
嗜松青霉;MVOCs;HS-SPME-GC-MS;影响因素;排放强度
室内空气污染物包含颗粒物和气态污染物两大类,挥发性有机物是气态污染物的一部分.微生物源挥发性有机物(MVOCs)是由微生物代谢产生的一类挥发性有机物.潮湿建筑内常常伴随着微生物的污染,带来不愉悦气味[1],主要是具有霉味、泥土味、蘑菇味和水果味的气体[2],这些是室内空气中有气味的挥发性有机物的重要组成部分[3].室内微生物很大部分来自室外源,其中曲霉菌和青霉菌属占室内真菌的绝大多数[4-6],霉菌产生的MVOCs主要包括醇、苯、醛、烯烃、酸、酯、酮类物质[3,7].MVOCs可能造成病态建筑综合征如咳嗽、嗓子痛、鼻塞等[8-10],在敏感的气喘人群和超敏感的肺炎易感染人群中的上呼吸道症状和哮喘症状与霉菌的生长相关,MVOCs暴露也与嗜睡、头痛以及对眼睛和鼻子、喉咙的刺激有关[11-13],霉菌还能引起一些儿童的下呼吸道疾病[14].
最近30a的相关研究主要采用顶空被动吸附和主动吸附、顶空流动进样的方式采集MVOCs,而MVOCs的分离鉴定手段包括PTR-TOF-MS、GC-MS、GC-FID、IMS等,最常用的是顶空-固相微萃取-气相质谱联仪(HS-SPME-GC-MS).微生物在不同条件下产生的MVOCs的种类和量都不相同,温度、湿度、光照、氧含量、pH值、盐度、培养基类型、菌种、呼吸强度、生长周期等[15]对其组分和排放量有影响.通过MVOCs的排放物特征能快速鉴定室内微生物污染,而目前微生物MVOCs谱极其不完整,需要更准确的MVOCs指纹和更多菌种的MVOCs研究才有可能实现室内微生物MVOCs示踪物的建立,同时确定微生物的室内VOCs贡献.由于室内环境的多样性,室内微生物在不同条件下的MVOCs有不同的VOCs贡献.
嗜松青霉()是一种好氧青霉属菌,最适生长温度约为30℃,除了室内,嗜松青霉还在土壤和植物中存在,是一种土传植物病原真菌[16-17].嗜松青霉被研究用于生产内切β-1,4-葡聚糖酶来降解纤维素,以及研究对聚乙烯的降解效果[18-19].Zhao等[20]用固相微萃取分析了其MVOCs组分及对果蝇的毒性,发现在青霉属中的毒性为中等水平,Fang等[4]发现其在青霉属中占比较高.为了更好地理解室内环境条件对霉菌的MVOCs影响,本研究用顶空固相微萃取采样、气相色谱-质谱联用仪分析该霉菌的MVOCs排放特征,考察温度、光照、氧含量、生长时间对MVOCs种类和排放量的影响,进一步计算了排放强度以及对室内VOCs的贡献.
1 材料和方法
1.1 菌株培养
将封于玻璃管内的冷冻干粉嗜松青霉(GIM3.610,北纳创联)菌株接种于6个斜面培养基上活化,在25℃恒温培养箱中培养7d产生孢子.把一份霉菌孢子用无菌水(SERVA)稀释至6×106个/mL,其余部分活化的菌株置于4℃冰箱保存.取2mL稀释的孢子悬浮液置于装有100mL培养基的250mL锥形瓶中培养.上述培养基均为MEA培养基( Solarbio),以4.8g/100mL水配制而成.
1.2 实验设计
如图1,实验装置基于Nilsson的设备根据现有实验室条件搭建[21],用固相微萃取顶空吸附锥形瓶中霉菌产生的MVOCs.锥形瓶用钻有2个孔的硅橡胶塞封闭,其中一个孔用于进气,另一个用于固相微萃取采样.装有霉菌的锥形瓶在恒温水浴箱中培养7d,在培养第3d开始采集MVOCs,一共采集5d.
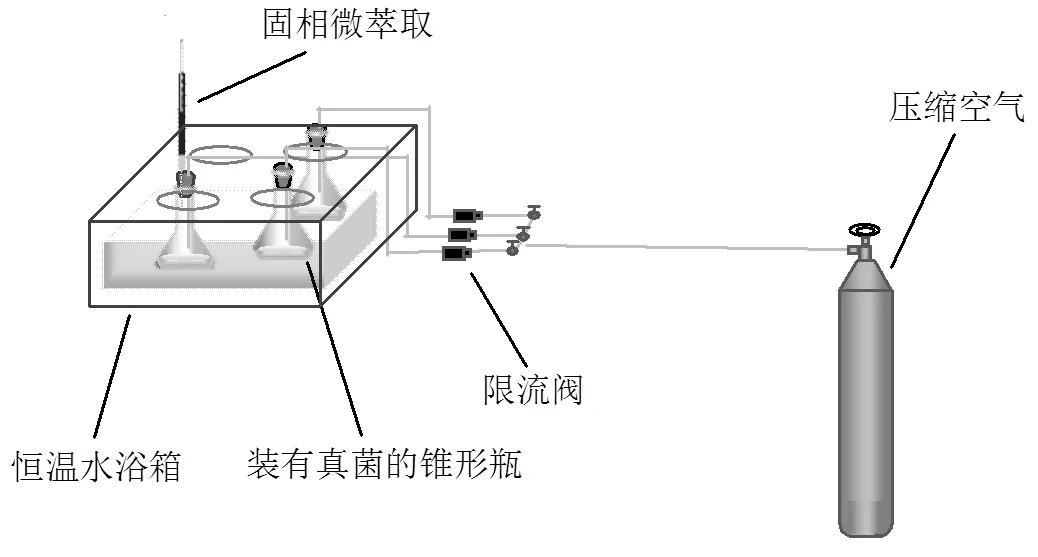
图1 实验装置示意
实验设置3种条件研究其对实验菌的MVOCs影响,分别为光照、氧含量(实际为通气流量)和温度.光照强度用照度表示,照度为0表示无光(遮光组),否则为有光(光照组);氧含量用通气流量控制,通气流量为0称为缺氧,通气流量为6mL/min称为有氧;温度分别设置25,30,35℃.3种条件相互交叉,共12组.
固相微萃取用手动采样组件( Supelco,57330-U, SPME HOLDER, MANUAL)和二乙烯基苯/羧基/聚二甲基硅氧烷纤维组件(Supelco,57348-U, Divinylbenzene/Carboxen/Pol-ydimethylsiloxane,DVB/CAR/PDMS,50/30μm)组装使用.
岛津GC-MS QP2010SE色谱进样口温度为230℃,分流比1:20,质谱离子温度200℃,接口温度230℃,载气为氦气(流速1mL/min),色谱柱为J&W DB-1(60m×0.25mm×1μm).色谱升温程序:30℃保持5min,以10℃/min的速度升温至260℃,在260℃保持5min,后以20℃/min升温至220℃.
分离的物质通过和NIST数据库进行比对,选择相似度在80%以上的判定为目标物质.将样品物质的参考离子比例及保留时间与标准物质的对应参数进行比较完成物质定性.标准物质用甲醇或环己烷为溶剂配制为标准溶液,岛津AOC-20i自动进样器进样(液体),建立标准曲线.
1.3 质量保证和质量控制(QA&QC)
检测限(LOD)为3倍信噪比(/),定量限(LOQ)为10倍信噪比(/).标准曲线的每个点采集3次以上,RSD均小于10%,每做完一组实验将存储于冰箱储备液通过GC-MS分析,回收率基本在95%以上.
每个实验组设有3个平行样,采集分析的数据RSD基本小于30%.每组实验设有空白样,分析数据前先用Python3.6进行Shapiro-Wilk检验平行数据是否服从正态分布,然后用成对数据的检验验证实验组和空白组有重合的物质是否存在差异,当存在差异时扣除空白,不存在即表示微生物未产生该种物质.
2 结果与讨论
2.1 总MVOCs释放特征
表1为3种温度下,不同光照、通气量条件下检出物质种类最多的MVOCs浓度,检出物质包含6类,分别为醇、酮、酸、酯、芳香族化合物、烯烃,共14种.
检出醇类占比最大,共检出有7种醇,其中量最大的是乙醇和异戊醇,乙醇占绝大部分.其次是酮类,只检出丙酮一种,在一些条件下丙酮的浓度与乙醇浓度相当.已有研究发现碳链长为2~4的醇类和酮类如乙醇、丙酮分别由糖酵解和三羧酸循环产生[22],事实上醇类和酮类分别由脂肪酸的氧化和脂肪酸衍生物的去碳脱羧产生[23].而碳链长为8的醇类如1-辛烯-3-醇和3-辛醇则可能是通过亚油酸和亚麻酸的分解形成[23].
检出乙酸和乙酸乙酯.低分子量的乙酸可能是由微生物对MEA培养基的酒精发酵的厌氧代谢产生[23].乙酸乙酯伴随着乙酸出现,可能是霉菌产生的乙酸和乙醇在加热条件下非生物合成,或者是嗜松青霉自身合成,比如Oro发现几种酵母菌会产生乙酸乙酯[24].
检出的芳香族化合物有2类即苯系物和含氧芳烃,苯系物包括甲苯和间二甲苯,含氧芳烃为苯甲醚.2种苯系物浓度均非常低,苯甲醚的浓度比苯系物高.芳香族可能是由芳香族氨基酸的脱羧以及单萜烯的加氧氧化形成[22].
检出的烯烃为柠檬烯,其他研究者在一种镰刀霉菌和曲霉菌产生的MVOCs中也发现了柠檬烯的存在[25-26],可能是同样的产生机制.
本实验菌的所有MVOCs在其他微生物的代谢产物中均有检出,凭单一物质难以实现对嗜松青霉的鉴定,只有从MVOCs的指纹构成着手.

表1 MVOCs总检出
2.2 全生长曲线MVOCs 变化特征
在一定封闭区域内固定量培养基中培养微生物的生长数量由生长曲线表示,分成4个阶段,即延迟期、对数生长期、停滞期和衰亡期,反映了4个不同时期微生物群落生长状态.嗜松青霉在3种温度下在接种第3d开始出现肉眼可见的菌落,在第3~5d保持着基本不变的白色菌落形态,第6d相继出现菌落变黄、变干卷曲甚至脱离培养基表面的特征.从上述现象可以了解在本实验中霉菌的生长状态.由图2可见,总MVOCs浓度从第3d开始增加到第4d,这与Pitt的霉菌在接种前5d为对数生长期的结论一致[27],而后迅速下降.糠醇、乙酸乙酯、乙醇、异戊醇的浓度变化情况与总MVOCs类似,同样在第4d达到最高浓度后下降.浓度最高的MVOC是乙醇,第3~4d迅速增加,第4~5d迅速下降,然后缓慢下降.推测是由于氧气和营养源的限制,导致指数生长期结束,从而代谢模式改变所致[28].在第3d开始可以观察到菌落从单个菌落逐渐增大到铺满整个培养基面,菌数增加需要更多的氧气来进行代谢,而菌数增加、供氧量不变的情况下就造成了氧气的相对缺乏,这可能是这一时间段乙醇大量产生的原因.

图2 30℃有氧无光MVOCs随时间的变化
苯甲醚和柠檬烯除了第7d有所回升,其他时间一直下降.异丁醇、2-甲基丁醇、间二甲苯在第5d达到最大浓度后下降,丙酮在第4d下降后同样在第5d达到最大浓度.丙酮是三羧酸循环的代表性产物,而前3种物质与丙酮的变化相似(除了丙酮第4d有所下降),推测这3种物质的产生与三羧酸循环相关.不同生长阶段嗜松青霉的MVOCs排放浓度差别非常大,这主要是由菌数、代谢类型的变化导致.这一结果表明微生物的MVOCs排放特征不仅受到不同理化条件的影响,其生长时间也是重要因素.
2.3 各因素对MVOCs释放的影响
2.3.1 光照 光照主要影响真菌孢子的形成、色素的合成、能进行光合作用的真菌生长等[29-31].本研究嗜松青霉在两种光照强度下培养,二者照度相差114.1lux.如图3所示,除了第5d外,光照对MVOCs总量的影响不明显,2个条件下的总量相差不大.主要区别在于乙醇,有光组在接种第5d的乙醇明显多于无光组.而在第4d,有光组无乙醇产生,第6d无光组无乙醇产生,有光组和无光组都只有连续2d产生乙醇,且无光组先于有光组.同时,因为有光组第5d产生大量乙醇的代谢作用与产生丙酮的代谢竞争,导致丙酮的产量远低于无光组.值得注意的是乙酸乙酯总是伴随着乙醇和乙酸的同时存在而检出,这说明在该条件下乙酸乙酯很有可能并不是由霉菌自身合成,而是由乙酸和乙醇在加热条件下非生物脱水酯化形成,这一现象在图2中也有体现.
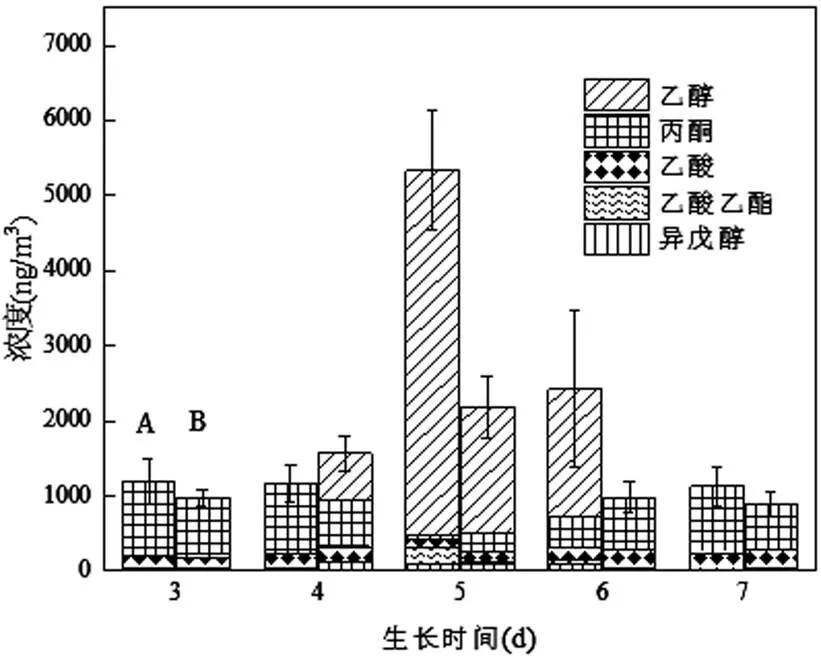
图3 35℃有氧时光照对MVOCs的影响
A:有光条件的MVOCs;B:无光条件的MVOCs
光照对其他物质包括乙酸、异戊醇、苯甲醚的产量几乎无影响,两组的物质不论是绝对量还是百分比都非常接近.这一结果与Verena等[32]用约300lux的LED灯研究深绿木霉的MVOCs释放影响相似.
114.1lux的光照差异除了对乙醇的产生有快慢和量的影响外,其他影响不明显,推测嗜松青霉的MVOCs代谢可能不受光照影响或者一定的光照差异不改变其代谢方式.基于此,在室内真菌控制方面,光照这一因素不应放在突出地位,在其他条件一致的前提下利用MVOCs特征鉴定时在光照充足或阴暗的房间均可共用一套特征谱.
2.3.2 氧含量 CO2和O2对真菌的生长都有重要影响,一定低浓度CO2有利于其正常生长发育[33],而高浓度如体积分数10%的CO2则会明显抑制真菌的生长和孢子产生[34],在高浓度CO2、低浓度O2的环境中能产生更多的MVOCs[33].以往的研究多保证了微生物生长时的O2量,通气流量主要集中在1~ 10mL/min[15,21,31],而微生物生长的环境会有厌氧的情况,不同含氧量会造成微生物代谢变化.
由图4可见,除了第4d有氧组产出乙醇量和缺氧组相当外,其他时间均未产生乙醇.因为乙醇是糖酵解产生,推测有氧组尽管已经充了一定量的空气,但随着指数生长期菌数不断增长,现有的氧含量不能满足其需氧量而进行了厌氧代谢.随着菌数稳定或减少,氧气量又能满足其好氧代谢,而不再产生乙醇,这与检测结果一致.缺氧组每天都有乙醇产生,但无丙酮产生.反观有氧组每天有丙酮产生,且第4d有乙醇产生的情况下丙酮量较其他无乙醇产生的情况明显更少.嗜松青霉糖酵解和三羧酸循环的两个代谢过程极有可能是相互竞争的,即在厌氧情况下,倾向于进行糖酵解,好氧情况倾向于三羧酸循环,这一特征证明嗜松青霉为兼性菌,而非好氧菌(与生物信息库不一致),对之后不同氧含量的真菌鉴定有一定参考.

图4 30℃无光时氧含量对MVOCs的影响
α:缺氧条件的MVOCs;β:有氧条件的MVOCs
氧含量对乙酸也有明显影响,氧含量低时,乙酸随着乙醇的增多而增加,与Boots推测乙酸是由酒精厌氧发酵产生相符[23],有氧组的乙酸在没有乙醇的情况下仍能产生,这证明有氧时其产乙酸机制有所不同.从MVOCs总量来看,霉菌缺氧能产生更多量的MVOCs,说明霉菌在缺氧时活性更低,代谢物质用于自身干重增长更少[35].氧含量对嗜松青霉的MVOCs影响非常显著,尤其是乙醇、丙酮、乙酸、乙酸乙酯的差异最大.

图5 3种温度下各MVOCs的相对含量和总浓度
2.3.3 温度 温度会影响生物细胞内酶的活性,从而影响生化反应和代谢产物.由图5可见,3个温度条件浓度最高的都是乙醇,其中25℃时最多,是35℃的近2倍.乙醇、乙酸乙酯和柠檬烯的相对占比类似.可知霉菌在25℃产生乙醇、乙酸乙酯和柠檬烯的代谢过程最强.其次是异戊醇、丙酮、乙酸,35℃时的占比最高,30℃时除异戊醇较低,丙酮和乙酸的量都和25℃时接近.2-甲基丁醇和异丁醇的占比类似,35℃时产量最多,25℃时其次,最少的是30℃时.甲苯和糠醇只在2种温度下产生,在30和35℃时产生甲苯,在25和30℃时产生糠醇.温度对甲苯和糠醇的影响最明显,在温度差异较大情况下,该两种物质无法产生.同时,一些物种在高温下产量更高,如2-甲基丁醇、甲苯、异丁醇、异戊醇、丙酮.霉菌适宜低温条件产生乙醇、柠檬烯、糠醇、乙酸乙酯.温度对丙酮和乙酸的影响较小,不同温度的产量相差不大.
嗜松青霉的最适生长温度为30℃,本研究中25℃总MVOCs最高,其次是30℃,最低的是35℃.Calvo的研究发现微生物在适宜的生长条件下产生的MVOCs更少[35],而Polizzi等[36]研究温度影响时,发现 MVOCs排放量与真菌生长状态一致.可见,微生物的生长状态和代谢MVOCs总量之间的相关性尚存在争议,还需要深入研究.
2.4 对室内MVOCs浓度贡献
由固相微萃取分配系数[37]:
fg=f/g=(f/f)/(g/g) (1)
式中:fg为萃取涂层/样品分配系数;f为萃取涂层上吸附样品的浓度单位,ng/m3;g为样品顶空浓度单位,ng/m3;f为样品涂层上的质量,ng;g为顶空样品质量,ng;f为萃取涂层的体积,m3;g为采样容器顶空体积,m3.
通过GC-MS获得固相微萃取头上的样品浓度和该物质的分配系数,即可求得培养容器中样品的浓度.分配系数和温度、萃取涂料等因素相关,与浓度无关[37].通过文献可直接得到丙酮、甲苯、间二甲苯、1-辛烯-3-醇、3-辛醇、柠檬烯的分配系数[21].线性程序升温保留指数(LTPRI)是在一种色谱柱中化合物的保留时间和直链烷烃保留时间之间的关系,可在NIST Chemistry WebBook按照相同的色谱柱获得.LTPRI和fg之间具有线性关系[38]:
lgfg=·LTPRI+(2)
式中:,与色谱柱涂层材料相关,聚二甲基硅氧烷(PDMS)的色谱柱其关系式为[38]:
lgfg=0.00415LTPRI-0.188 (3)
霉菌的排放强度:
MVOCs=g/(·) (4)
式中:为霉菌落面积:m2;为生长时间:d.
由表5可见5d的MVOCs的平均排放强度.嗜松青霉的总MVOCs排放强度为5031~7650ng/ (m2d),各种物质的排放强度差异很大,最多相差6个量级.单个物质排放强度最大的是乙醇,占总排放强度的57%~76%,其次是丙酮、乙酸、乙酸乙酯、异戊醇.其他物质的排放量极少,在0.003~17.165ng/ (m2d)不等.

表3 有氧有光3种温度的MVOCs排放强度
以一间50m3的房间中有50.77cm2的菌落生长为例(本研究实验条件),控制室内温度为25℃,室内MVOCs的浓度可由如下方法计算:
=MVOCs (1-e-nt) /(r) (5)
式中:为MVOCs浓度,ng/m3;r房间体积,m3;MVOCs排放强度,ng/(m2h);为常见室内换气次数,0.1,0.2,0.5次/h[39].
由表4可见,不同的换气次数室内MVOCs浓度相差10倍以上,按照0.1次/h换气次数,如果采用U.S. EPA TO11A的检测限为1000ng/m3,即使浓度最高的乙醇444.0380ng/m3,仍无法检出,故采用传统的SUMMA罐采集室内MVOCs是不合适的.

表4 不同换气次数室内MVOCs浓度(ng/m3)
3 结论
3.1 嗜松青霉生长过程释放6类14种MVOCs,涵盖醇、酮、酸、酯、芳香族化合物和烯烃,分别是乙醇、丙酮、乙酸、乙酸乙酯、异丁醇、异戊醇、2-甲基丁醇、甲苯、糠醇、间二甲苯、苯甲醚、1-辛烯-3-醇、3-辛醇、柠檬烯.
3.2 释放MVOCs的影响因素中氧含量和生长时间影响最明显,温度影响其次,光照影响最弱.氧含量的影响主要体现在营养代谢类型的改变,缺氧时进行厌氧代谢,氧气充足时进行好氧代谢,厌氧和好氧代谢的标志物分别为乙醇和丙酮.生长时间的影响主要集中在乙醇、丙酮、乙酸、乙酸乙酯、异戊醇等高浓度的MVOCs排放量.温度影响具体物质的生成,1-辛烯-3-醇只在25℃产生,而糠醇在35℃不会产生.
3.3 在有氧有光的3种实验温度下,MVOCs总排放强度在5031~7650ng/(m2d)之间,相应MVOCs排放贡献为0.0256~444.0380ng/m3.
[1] Lonnblad P, Kokotti H, Kujanpaa L, et al. Occurrence of microbes in non-ventilated outer walls and health effects [C]//Proceedings of the 10th International Conference on Indoor Air Quality and Climate, 2005:4-9.
[2] Ruth J H. Odor thresholds and irritation levels of several chemical substances: A review [J]. American Industrial Hygiene Association journal, 1986,47(3):142-151.
[3] Morath S U, Hung R, Bennett J W. Fungal volatile organic compounds: A review with emphasis on their biotechnological potential [J]. Fungal Biology Reviews, 2012,26(2/3):73-83.
[4] Fang Z, Tang Q, Gong C, et al. Profile and distribution characteristics of culturable airborne fungi in residential homes with children in Beijing, China [J]. Indoor and Built Environment, 2015,26(9):1232- 1242.
[5] Odebode A, Adekunle A, Stajich J, et al. Airborne fungi spores distribution in various locations in Lagos, Nigeria [J]. Environmental Monitoring and Assessment, 2020,192(2):87-101.
[6] Sautour M, Sixt N, Dalle F, et al. Profiles and seasonal distribution of airborne fungi in indoor and outdoor environments at a French hospital [J].Science of The Total Environment, 2009,407(12):3766-3771.
[7] Korpi A, Jarnberg J, Pasanen A L. Microbial volatile organic compounds [J]. Critical Reviews in Toxicology, 2009,39(2):139-193.
[8] Mølhave L, Liu Z, Jørgensen A H, et al. Sensory and physiological effects on humans of combined exposures to air temperatures and volatile organic compounds [J]. Indoor Air, 1993,3(3):155-169.
[9] Mølhave L. Volatile organic compounds and sick building syndrome [M]. Environmental Toxicants Hoboken, NJ, USA: John Wiley & Sons, Inc, 2009:241-256.
[10] Araki A, Kawai T, Eitaki Y, et al. Relationship between selected indoor volatile organic compounds, so-called microbial VOC, and the prevalence of mucous membrane symptoms in single family homes [J]. Science of The Total Environment, 2010,408(10):2208-2215.
[11] Mendell M J, Mirer A G. Dampness, mould, and health-a review of epidemiologic evidence for the upcoming WHO guidelines for indoor air quality [J]. Epidemiology, 2008,19(6):S136-S137.
[12] Arthur R. Damp indoor spaces and health [M]. Oxford: Oxford University Press, 2005:234-234.
[13] Choi H, Schmidbauer N, Bornehag C G. Volatile organic compounds of possible microbial origin and their risks on childhood asthma and allergies within damp homes [J]. Environment International, 2017,98: 143-151.
[14] Adan C G, Samson R A. Fundamentals of mold growth in indoor environments and strategies for healthy living [C]//Wageningen, Wageningen Academic Publishers, 2011:277-302.
[15] Misztal P K, Lymperopoulou D S, Adams R I, et al. Emission factors of microbial volatile organic compounds from environmental bacteria and fungi [J]. Environmental Science & Technology, 2018,52(15): 8272-8282.
[16] Stefano S, Nicoletti R, Zambardino S, et al. Structure elucidation of a novel funicone-like compound produced by Penicillium pinophilum [J].Natural Product Letters, 2002,16(3):207-211.
[17] Qing S W. Identification and Biocontrol of Latent Pathogenic Fungi in Blueberry Fruits [J]. Northern Horticulture, 2017,18:41-48.
[18] VolkeSepulveda T, SaucedoCastaneda G, GutierrezRojas M, et al. Thermally treated low density polyethylene biodegradation by Penicillium pinophilum and Aspergillus niger [J]. Journal of Applied Polymer Science, 2002,83(2):305-314.
[19] Jeya M, Joo A R, Lee K M, et al. Characterization of endo-beta-1, 4-glucanase from a novel strain of Penicillium pinophilum KMJ601 [J]. Applied Microbiology and Biotechnology, 2010,85(4):1005-1014.
[20] Zhao G, Yin G, Inamdar A, et al. Volatile organic compounds emitted by filamentous fungi isolated from flooded homes after hurricane Sandy show toxicity in a Drosophila bioassay [J]. Indoor Air, 2017, 27(3):518-528.
[21] Nilsson T, Larsen T, Montanarella L, et al. Application of head-space solid-phase microextraction for the analysis of volatile metabolites emitted by Penicillium species [J]. Journal of Microbiological Methods, 1996,25(3):245-255.
[22] Wilkins K, Larsen K, Simkus M. Volatile metabolites from mold growth on building materials and synthetic media [J]. Chemosphere, 2000,41(3):437-446.
[23] Boots A W, Smolinska A, van Berkel J, et al. Identification of microorganisms based on headspace analysis of volatile organic compounds by gas chromatography-mass spectrometry [J]. Journal of Breath Research, 2014,8(2):027106.
[24] Oro L, Feliziani E, Ciani M, et al. Volatile organic compounds from,andinhibit growth of decay causing fungi and control postharvest diseases of strawberries [J]. International Journal of Food Microbiology, 2018,265:18-22.
[25] Pasanen A L, Lappalainen S, Pasanen P. Volatile organic metabolites associated with some toxic fungi and their mycotoxins [J]. Analyst, 1996,121(12):1949-1953.
[26] Cheng Z, Li M, Marriott P J, et al. Chemometric analysis of the volatile compounds generated by Aspergillus carbonarius strains isolated from grapes and dried vine fruits [J]. Toxins, 2018,10(2): 71-88.
[27] Pitt R E. a descriptive model of mold growth and aflatoxin formation as affected by environmental-conditions [J]. Journal of Food Protection, 1993,56(2):139-146.
[28] Viitanen H, Ojanen T. Improved model to predict mold growth in building materials [J]. Ashrae, 2007:1-8.
[29] Choi K S, Park Y B, Kim J, et al. Characteristics of photosynthesis and leaf growth of Peucedanum japonicum by leaf mold and shading level in forest farming [J]. Korean Journal of Medicinal Crop Science, 2015,23(1):43-48.
[30] Yamaga I, Takahashi T, Ishii K, et al. Suppression of blue mold symptom development in satsuma mandarin fruits treated by low- intensity blue LED irradiation [J]. Food Science and Technology Research, 2015,21(3):347-351.
[31] Kalalian C, Abis L, Depoorter A, et al. Influence of indoor chemistry on the emission of mVOCs from Aspergillus niger molds [J]. Science of The Total Environment, 2020,741:140-148.
[32] Speckbacher V, Zeilinger S, Zimmermann S, et al. Monitoring the volatile language of fungi using gas chromatography-ion mobility spectrometry [J]. Analytical and Bioanalytical Chemistry, 2021, 413(11):3055-3067.
[33] Larsen T O, Frisvad J C. Comparison of different methods for collection of volatile chemical markers from fungi [J]. Journal of Microbiology Method, 1995,24(2):135-144.
[34] Stover R H, Freiberg S R. Effect of carbon dioxide on multiplication of fusarium in soil [J]. Nature, 1958,181(4611):788-789.
[35] Calvo A M, Wilson R A, Bok J W, et al. Relationship between secondary metabolism and fungal development [J]. Microbiology and Molecular Biology Reviews, 2002,66(3):447-459.
[36] Polizzi V, Adams A, De Saeger S, et al. Influence of various growth parameters on fungal growth and volatile metabolite production by indoor molds [J]. Science of The Total Environment, 2012,414:277- 286.
[37] Pawliszyn J. Handbook of solid phase microextraction [M]. Canada: Chemical Industry Press, 2012:42-50.
[38] Martos P A, Saraullo A, Pawliszyn J. Estimation of air/coating distribution coefficients for solid phase microextraction using retention indexes from linear temperature-programmed capillary gas chromatography. Application to the sampling and analysis of total petroleum hydrocarbons in air [J]. Analytical Chemistry, 1997,69(3): 402-408.
[39] Schleibinger H, Laussmann D, Brattig C, et al. Emission patterns and emission rates of MVOC and the possibility for predicting hidden mold damage? [J]. Indoor Air, 2005,15:98-104.
Characteristics and influencing factors of microbial volatile organic compounds from a common indoor mold.
WEN Sheng-chao, LIU Zhao-rong*
(College of Environmental Science and Engineering, Peking University, Beijing 100871, China)., 2022,42(11):5055~5062
was used as an example in this study and headspace-solid phase microextraction-gas chromatography-mass spectrometry (HS-SPME-GC-MS) was used to collect and analyze microbial volatile organic compounds (MVOCs). The effects of the growth time, the temperature, the light and the oxygen content on the characteristics of MVOCs were investigated, and each contribution to indoor VOCs was discussed. A total of 6categories and 14 MVOCs were detected, including higher-concentration MVOCs such as ethanol, acetone, acetic acid, ethyl acetate, isoamyl alcohol and anisole, and lower-concentration MVOCs such as isobutanol, 2-methylbutanol, 2-Furanmethanol, toluene, m-xylene, 1-octene-3-ol, 3-octanol and limonene. The most obvious effects on MVOCs emission were the oxygen content and the growth time, which mainly affected the competitive metabolism of ethanol and acetone. The amounts of acetic acid and ethyl acetate were higher when the oxygen content was lower. There were considerable discrepancies of the types and the quantities of metabolites ofalongthe growth time. The total amount of MVOCs reached maximum on the 4th ~ 6th day of inoculation. Except acetic acid and limonene, other substances were obviously affected by the growth time. The maximum amount of MVOCs was produced at 25℃, and the minimum was at 35℃. The components of MVOCs were influenced by temperature. The light intensity had no obvious effect on the metabolism of. Under three experimental temperatures with certain oxygen content and light, the emission intensity of total MVOCs was between 5031and 7650ng/(m2×d), and the contribution of MVOCs concentrations to indoor air ranged from 0.0256 to 444.0380ng/m3.
;MVOCs;HS-SPME-GC-MS;influence parameters;emission intensity
X172
A
1000-6923(2022)11-5055-08
温胜超(1995-),男,四川内江人,北京大学硕士研究生,研究方向为室内环境与健康.发表论文1篇.
2022-04-25
* 责任作者, 副教授, zrliu@pku.edu.cn

