聚氯乙烯和橡胶中化学成分的浸出行为及生态毒性
刘建超,胡雍容
聚氯乙烯和橡胶中化学成分的浸出行为及生态毒性
刘建超*,胡雍容
(河海大学环境学院,浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098)
为探究塑料中化学成分的浸出行为及其生态毒性,以环境中广泛存在的聚氯乙烯(PVC)和橡胶(CTR)为研究对象,筛选25种有机塑化剂和15种金属作为目标物质,分析其在PVC和CTR材料中的浸出潜能,利用大型溞的急性致死效应和慢性亚致死效应(心率、胸肢跳动和游泳活性)表征了PVC和CTR浸出液的生态毒性效应.结果表明,PVC和CTR浸出液中共检出21种化学成分,其中邻苯二甲酸二异丁酯(DiBP)、邻苯二甲酸二(2-甲氧基)乙酯(DMEP)、双酚A(BPA)、双酚F(BPF)、Ca和Zn的浸出浓度较高.CTR中浸出的塑化剂和金属总浓度分别是PVC的8.8倍和1.2倍,且CTR中浸出的新型塑化剂BPF浓度达到3.51 μg/g,显著高于BPA的浸出浓度.对比不同条件下浸出的物质量差异,发现光照能够加速PVC和CTR中DiBP、Zn和Ca等物质的释放,其赋存状态还受到细菌作用的干扰.CTR浸出液对大型溞的急性致死效应明显,48h半数致死浓度(LC50)为浸出原液的19.1%.慢性暴露条件下,PVC浸出液对大型溞心率、胸肢跳动和游泳活性产生明显抑制作用,并造成大型溞肢体肥大.PVC和CTR等塑料颗粒不断排放,并在环境中累积,其生物毒害效应不容忽视.
聚氯乙烯;橡胶;浸出液;大型溞;生态毒性
塑料广泛应用于人类的日常生活与生产中[1],在全球海洋、淡水、土壤等环境介质中大量赋存[2],并不断破碎形成微塑料,释放添加剂,对全球生态系统健康产生潜在负面影响[3].聚氯乙烯(PVC)作为全球年产量最高的塑料之一,广泛应用于管道、工业配件、电缆等产品制造工业[4].2020年,我国PVC的年产量已达到2000万t[5].PVC为不可降解塑料,其化学法回收工艺复杂、成本较高,用焚烧法处理时会向空气中释放二噁英和氯化氢等有害气体[6],造成空气污染[7].橡胶(CTR)作为三大高分子材料之一,含邻苯二甲酸酯类、脂肪二元酸酯类增塑剂,在轮胎、床垫、体育设施中使用广泛.轮胎等产品在使用过程中磨损速度快,微粒形成量大.这2类材料在环境残留高、不断老化形成微粒,随降雨径流进入河湖系后与其它污染物形成复合污染效应[8],对水生态系统安全产生负面影响.
在PVC和CTR等高分子材料生产过程中会添加增塑剂、缓凝剂、粘合剂和活化剂等,这些物质在材料自然老化过程中不断被释放[9-10].研究发现, PVC和CTR能够浸出双酚A(BPA)和邻苯二甲酸盐(PAEs)等物质[11],这些物质释放到环境后对水生生物和人类产生不利影响[12].Wei等[13]发现邻苯二甲酸(2-乙基)己酯(DEHP)会降低大型溞的抗氧化能力,对大型溞的24h-LC50为0.83mg/L.BPA和DEHP被人类摄取后也会干扰其内分泌代谢,并对人类健康产生不利影响[14].Al-Odaini等[15]在淡水和海水环境中发现了阻燃剂(六溴环十二烷(HBCD))的存在,其在聚苯乙烯泡沫(EPS)使用过程中随着材料的老化不断从内部向表面迁移,并溶出到环境[16-17].PVC和CTR不仅能浸出塑化剂等有机物,还能释放Zn等多种金属物质[18],高浓度的锌能够抑制生物的乙酰胆碱酯酶活性[19],并对水生生物的存活和繁殖产生不利影响[20].现有研究缺乏对PVC和CTR浸出液中PAEs、BPs及金属单体成分及浓度分析,浸出物质对水生生物的毒性效应仍需进一步开展.
本研究以水环境中检出率较高的25种塑化剂和15种金属为目标物,分析PVC和CTR材料在水环境中的浸出成分,探究不同稀释程度下浸出液对大型溞的急、慢性毒理效应,分析毒理效应与浸出物之间的关系,以期为生物种群资源保护和塑料的污染防控提供基础数据.
1 材料与方法
1.1 试剂与仪器
橡胶颗粒(粒径2.0mm),为汽车轮胎,购自于华益橡胶公司;PVC颗粒(粒径2.0mm),为硬质PVC饮用水管,来自于市场五金店,人工破碎;甲醇和二氯甲烷等试剂购自于Merk公司,纯度高于99%;内标物质103Rh、115In,购自美国Agilent公司:质量浓度均为100mg/L.
混合标准溶液包括16种邻苯二甲酸酯类(PAEs):邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二异丁酯(DiBP)、邻苯二甲酸二正丁酯(DnBP)、邻苯二甲酸二(2-甲氧基)乙酯(DMEP)、邻苯二甲酸丁基卞酯(BBP)、邻苯二甲酸二(4-甲基-2-戊基)酯(BMPP)、邻苯二甲酸二正辛酯(DNOP)、邻苯二甲酸二壬酯(DNP)、邻苯二甲酸二烯丙酯(DAP)、邻苯二甲酸二异癸酯(DPHP)、邻苯二甲酸二环己酯(DCHP)、邻苯二甲酸二(2-丁氧基)乙酯(DBEP)、DEHP、邻苯二甲酸二(2-乙氧基)乙酯(DEEP)、邻苯二甲酸二己酯(DHXP);9种双酚类物质(BPs):双酚(BPF)、BPA、双酚S(BPS)、双酚AF(BPAF)、聚氧乙烯醚(BPE)、双酚Z(BPZ)、双酚AP(BPAP)、双酚B(BPB)、四溴双酚A(TBBPA);15种金属:Mg、Ca、Cr、Mn、Fe、Ni、Cu、Zn、As、Se、Mo、Cd、Sn、Hg和Pb,购自百灵威科技有限公司.
1.2 PVC和CTR塑料浸出实验
实验所用水样取自南京某生态公园塘水,该公园生态塘无污染源排放,不与外界河流连通,水质优良.水样品取完立即送回实验室,用砂滤和1.2μm的玻璃纤维滤膜进行真空过滤,去除水样中颗粒性杂质.过滤后的水样分成2份,一份进行高温灭菌处理,一份不做处理.
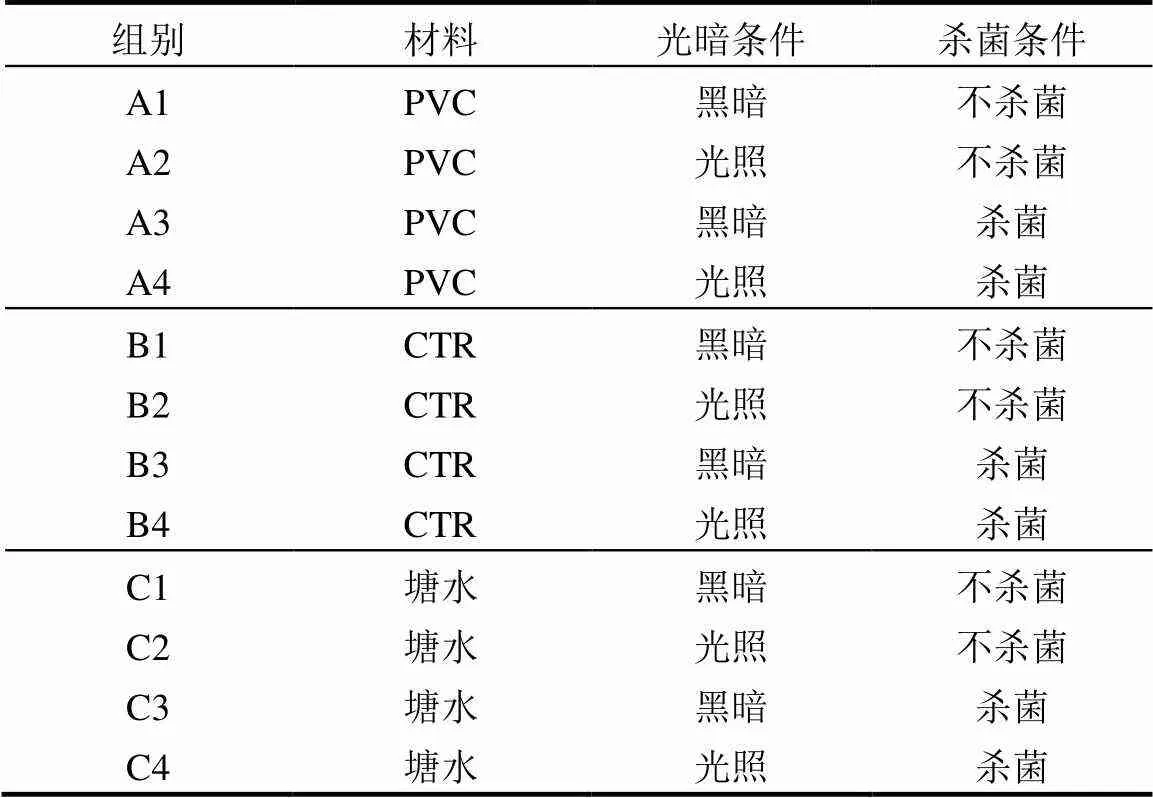
表1 暴露组设置情况
将PVC和CTR颗粒过筛,用清水清洗并干燥后分别称取5.0g样品,放入250mL锥形瓶中,每个锥形瓶加入200mL预处理后的水样,并设置塘水对照组,每组设置3个平行,实验组别设计见表1.为模拟河底黑暗环境,设置黑暗实验组,该组用锡纸把锥形瓶包裹起来(不留空隙),且用锡纸封住瓶口,以免杂质进入.然后将所有的锥形瓶放到振荡培养箱中进行浸出实验.振荡培养箱的具体参数设置为:温度25℃;振荡速度125r/min;光照强度2000lx.浸出42d后,从锥形瓶中用移液管移取10mL浸出液放入玻璃试管以备液-液萃取.对水样进行处理提取塑化剂参考Capolupo等[19]的方法,具体步骤如下:从10mL浸出液中取5mL样液加入2mL的二氯甲烷(DCM),涡旋1min,然后离心2min(转速2000r/min).离心后,用针管吸取下层水样放入干净试管中,重复上述步骤2次.在水样试管中再加入2mL的正己烷,涡旋1min,离心2min(转速2000r/min),再重复操作2次.然后合并4次提取溶液,加入1g无水硫酸钠(Na2SO4)干燥24h,取上清液放入棕色玻璃瓶并氮吹至0.5mL,然后用0.22µm滤膜过滤,以备液质联用仪检测分析.剩余的5mL浸出液直接放入棕色玻璃瓶用于金属组分浓度的测定.
1.3 仪器检测与分析
1.3.1 16种PAEs和9种BPs的检测方法 PAEs和BPs均采用超高效液相色谱-三重四级杆串联质谱联用仪(型号:Waters ACQUITY UPLC Xevo TQ)进行定性定量分析,该系统配有电喷雾离子源.采用规格为2.1mm×100mm×1.7μm的ACQUITY BEH C18色谱柱,柱温设定为40℃.PAEs流动相:A为水:甲醇 (98:2)+0.05% FA(甲酸),B为乙腈,流动相梯度见表2.样品进样体积为5μL,流速0.4mL/min.质谱条件:采用离子电喷雾正离子(ESI+),多反应离子监测(MRM)模式.设定离子源温度为150℃,毛细血管电压3.5kV;BPs流动相:A为0.01%(体积比)的氨水溶液,B为乙腈,流动相梯度见表2.样品进样体积为5μL,流速为0.3mL/min.质谱条件:采用离子电喷雾负离子(ESI-),多反应离子监测(MRM)模式;设定离子源温度为150℃,毛细管电压3.0kV.
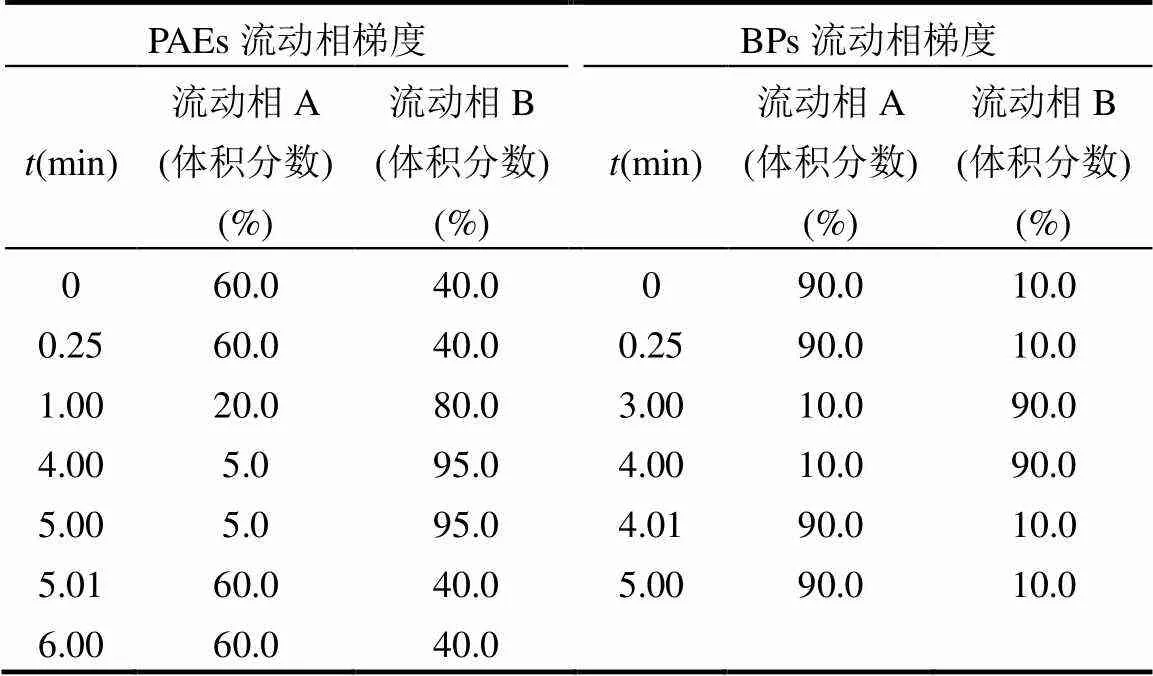
表2 PAEs和BPs流动相梯度
1.3.2 金属物质的测定 将浸出液用超纯水稀释,然后加入103Rh和115In作为内标.金属采用电感耦合等离子体质谱仪(型号:Thermofish iCAPQ)进行定性、定量分析.仪器条件设置为:检测模式(KED),射频功率1543W,载气流速1.038L/min,氦气流量4.88L/min,采样深度5mm,蠕动泵转速40r/min,重复取样3次,雾化器压力3.418bar,雾化室温度2.7℃.
1.3.3 质量控制与保证 整个前处理和分析过程中进行严格的质量控制程序,设置溶剂空白、清水空白、方法空白.标准曲线的浓度范围为0.1~200μg/L,线性相关系数R2>0.99,以3倍信噪比(=3)确定方法检出限(LOD),以10倍信噪比(=10)确定方法定量限(LOQ),塑化剂和金属的检出限(LOD)和检测限(LOQ)结果如表3、表4所示.通过10,100μg/L的PAE和BPs加标回收实验发现,16种PAEs和9种BPs的前处理方法平均回收率为79.8%~118.2%,相对标准偏差(RSD)为0.9%~10.2%,空白样品中目标物成分未检出或低于检测线,满足检测的基本要求.

表3 塑化剂的检出限LOD及检测限LOQ(ng/L)

表4 金属物质的定量限LOD(μg/L)
1.4 大型溞毒性实验
1.4.1 受试动物 大型溞()由中国科学院武汉水生生物研究所提供.实验开始前,大型溞在实验室驯化3代,驯化介质为曝气24h的纯净水.环境条件为温度:(20±1)℃;光暗周期:16h:8h;光照强度2000lx.大型溞每天定时喂食斜生栅藻()浓缩液,投喂密度为5.0× 104cell/mL.
1.4.2 实验方法 毒性暴露浓度设置:选择PVC和CTR浓度较高的黑暗杀菌环境浸出液为暴露溶液,黑暗杀菌塘水组为溶剂对照,清水作为空白对照.实验开始前对浸出液进行过滤(玻璃滤膜规格为:0.45μm),去除浸出液中的杂质,避免塑料微粒干扰实验结果.试验稀释水均为曝气纯净水.实验共设有PVC和CTR不同稀释程度浸出液10组(P0~P4和C0~C4)对照组分别为黑暗杀菌溶剂对照(D0~D4)和空白对照(W)具体情况见表5.

表5 暴露组中浓度设置
急性实验:参照OECD 211标准方法进行[21].取6~24h的幼溞进行急性暴露实验.在100mL烧杯中加入50mL稀释好的浸出液,随机加入5只溞龄在6~24h的健康幼溞,每个浓度设置4个平行,将烧杯放入人工光照培养箱进行培养,温度保持在(20.0±1)℃,光暗比16h:8h,设置光照强度为2000lx.急性毒性实验周期为48h,分别在第24,48h记录大型溞受抑制情况(振荡试验溶液,在15s内无反应,即为受抑制)和死亡率.实验过程中不喂食,不换液.
慢性实验:参照OECD211标准方法进行[21].在急性毒性实验的基础上进行7d慢性毒性实验,每天喂食斜生栅藻,喂食密度为5.0×104cell/mL,每隔24h记录大型溞存活情况.暴露7d结束,进行心率、胸肢跳动、游速和体长等指标测定.
1.4.3 测定项目 心率和胸肢跳动:利用体式显微镜对大型溞进行1min左右的录像,然后使用计数器对大型溞胸肢、心脏跳动次数进行计数,每组计3次,结果换算成“次/min”[22-23].
体长:在显微镜下用目微尺测量母溞体长,母溞身体与刻度尺平行,记录其对应的刻度(包括尾刺)[24].
游速:参考郭婧颖等[25]的方法,将大型溞放入培养皿,加入刚好没过大型溞身体的水量,使其只能水平游动,录制其游动的视频,再将视频导入tracker软件测量游泳轨迹、速度和加速度.
1.5 数据统计方法
使用Excel2016对实验数据进行整理,用SPSS计算各组均值及标准偏差,并进行单因素方差分析,用Origin2017进行绘图,并计算半致死浓度LC50及95%置信区间.
2 结果与讨论
2.1 PVC和CTR浸出液的主要成分检测
在PVC和CTR颗粒浸出液中共检测了40种化学成分,其中21种化学成分在PVC浸出液中被检出,包括7种PAEs(DMP、DEP、DiBP、DnBP、DMEP、DNOP和DNP)、4种BPs(BPF、BPA、BPS和BPAF)和10种金属(Ca、Cr、Mn、Fe、Ni、Cu、Zn、Se、Mo和Sn),其他5种金属(Mg、As、Cd、Hg、Pb)检出含量低于检出限或未检出,忽略不计.以实验组C1~C4为塘水污染物背景值,各浸出实验组扣除背景值后发现,PVC浸出的总塑化剂量为0.46~ 2.73μg/g,其中DMP(最大浸出浓度0.61μg/g)、DEP(0.52μg/g)、DiBP(2.71μg/g)、DMEP(1.16μg/g)和BPA(0.89μg/g)的浸出量较高.PVC浸出液中金属总质量为0.89~1066.07μg/g,其中Ca和Zn的浸出含量较高,分别为953.79μg/g和4.54μg/g.
在CTR浸出液中共检出19种化学成分,包括7种PAEs(DMP、DEP、DiBP、DnBP、DMEP、DNOP和DNP)、4种BPs(BPF、BPA、BPS和BPAF)和8种金属(Ca、Cr、Mn、Ni、Cu、Zn、Se和Mo),其他7种金属(Mg、As、Cd、Hg、Pb、Fe、Sn)检出含量远低于检出限或未检出,忽略不计.CTR浸出的总塑化剂量为10.34~17.68μg/g,其中DMEP和BPF的浸出量较高,最高浸出浓度分别达到13.22μg/g和3.51μg/g.CTR浸出的金属质量在35.50~1127.89μg/g之间,其中Ca和Zn的浸出含量仍然较高,分别为898.77,102.79μg/g.本实验中PVC和CRT浸出的PAEs、BPs和金属的种类与Marco等[26]进行的PVC和CTR浸出实验结果相似.PVC和CTR中Ca、Zn的检出浓度较高,可能与PVC和CTR制备过程中投加了大量用于提高材料热稳定性的钙锌稳定剂有关[27].DiBP和BPA是PVC浸出液中最主要的塑化剂,而CTR浸出液中的塑化剂成分主要是DMEP、BPF和BPA,这些物质都是水环境中广泛检出的高浓度新污染物.在对我国多处水系进行PAEs测定发现,部分地表水体中的DiBP浓度已经达到了μg/L级别[28],如九龙江的DiBP浓度范围高达2.28~ 3.81mg/L[29].BPF作为BPA的替代品,在塑料制品中广泛使用,我国太湖水体中BPF平均浓度已达到140ng/L[30].塑化剂在水体环境中广泛分布,其环境赋存特征与塑料污染的关系研究仍需进一步开展.

图1 PVC和CTR中浸出的塑化剂(A)、金属(B)种类和浓度
对比PVC和CTR浸出液中有机塑化剂成分,发现2种材料浸出的塑化剂组分基本一致,但CTR浸出的总塑化剂量明显高于PVC,每克CTR塑化剂浸出总量约为PVC的8.81倍.从塑化剂单体来看CTR浸出液中明显增加的塑化剂是DMEP、BPF、BPA和BPAF,平均浸出量分别是PVC组的29.14倍、50.08倍、4.01倍和2.37倍.从金属成分来看,PVC浸出液中检出10种金属,而CTR浸出液中仅检出8种,未发现Fe和Sn,但CTR浸出的总金属量高于PVC,每克CTR浸出的总金属量约为PVC的1.20倍.Zn和Mn在CTR浸出液中的含量明显高于PVC组,Zn和Mn在CTR浸出液中的平均含量是PVC组的21.34倍和30.84倍.CTR在光照杀菌组浸出的Zn质量最高达129.77μg/g(浓度为3.24mg/L),浸出液中Zn浓度是《地表水环境质量标准》[31]V类水标准的1.62倍.Tetu等[32]在探究微塑料浸出液对绿球藻的毒性效应时,发现在50g/L的PVC塑料溶液中Zn的浸出浓度达到6.28mg/L(质量比为125.6μg/g),Zn在所有检出的金属成分中浓度最高(该研究未检测Ca成分),这与本研究结果相一致.对比2种材质发现,由于CTR颗粒表面多孔疏松,比表面积大,同等浸泡条件下其浸出污染物的能力明显高于PVC.从工艺的角度上,PVC和CTR属于性质不同的2种物质,其组成成分存在较大差异,塑料以高分子合成树脂为主要组分,CTR以橡胶烃为主要成分,2种材料浸出的化学成分浓度也存在较大区别[33-34],在水环境中CTR产生的复合污染效应可能更加明显.
2.2 不同环境条件下PVC和CTR的浸出差异
2.2.1 光照对浸出的影响 对比杀菌条件下光暗环境对PVC溶出效应影响,发现光照能够增加PVC浸出液中总塑化剂的含量,尤其是BPA和DiBP(图2A).光照条件对CTR浸出液中总塑化剂浓度无明显影响,只有DiBP含量有增加趋势,而BPA、BPF和DMEP含量略有降低.光照条件下PVC和CTR浸出液中DiBP浓度对比黑暗条件下分别增加了52%和77%.此外,光照条件能够加速PVC和CTR材料中金属物质的溶出,金属总溶出量分别达到957.11μg/g和1002.30μg/g,是黑暗条件下的9.92倍和5.88倍(图2B).其中,PVC和CTR材料中Ca溶出量占到了金属总质量的99%和90%,光照条件下PVC和CTR浸出液中Ca的浓度分别是黑暗条件下的9.89和9.85倍.光照能够加速塑料的老化过程,导致塑料内部化学键断裂,降低分子迁移的扩散阻力,增加PAEs等塑化剂的溶出效应[35].
2.2.2 细菌对浸出的影响 对比黑暗条件下杀菌对PVC溶出效应的影响,发现杀菌条件下PVC浸出液中总塑化剂浓度略低于黑暗不杀菌,但主要浸出物DiBP的浓度略高,比不杀菌条件下增加了68%.从塑化剂组分来看,细菌存在导致PVC浸出液中塑化剂的成分构成更加复杂.杀菌条件下CTR浸出液中总塑化剂浓度略高于不杀菌条件,但CTR主要浸出物DiBP和BPA的含量增加明显,分别是不杀菌条件下的4.77和2.47倍.研究发现,水中细菌可以通过氧化骨架重排、本位取代及酚环羟基化-间位裂解等3种途径对BPA等双酚类物质进行降解,降低水中BPA的含量[36].对照有菌条件,细菌的存在会强化溶出物质的迁移转化过程,影响其水环境赋存特征.在无菌条件下,PVC和CTR浸出液中金属物质的浓度显著高于有菌条件,黑暗杀菌条件下PVC和CTR浸出液中Ca和Zn含量增加尤为明显,其中CTR中Zn的溶出量是黑暗不杀菌条件下的1.70倍.这可能是由于细菌的氧化作用改变了金属物质的存在形态[37].杀菌条件下,PVC和CTR溶出的Ca含量比不杀菌条件下高96.43, 91.24μg/g,这说明细菌存在有效利用了塑料浸出液中的Ca,且对部分PAEs(如DiBP)和BPs(如BPA、BPF)起到一定的降解作用.Rastkari等[38]发现,PAEs降解效果受溶液的pH值影响,在酸性光照条件下,DEP和DBP水解和光解率达到20%以上,而对DEHP无效.PVC和CTR浸出液中塑化剂、金属的含量受光照、pH值、细菌、材质等多种因素的共同作用,其生态危害与环境条件密切相关.
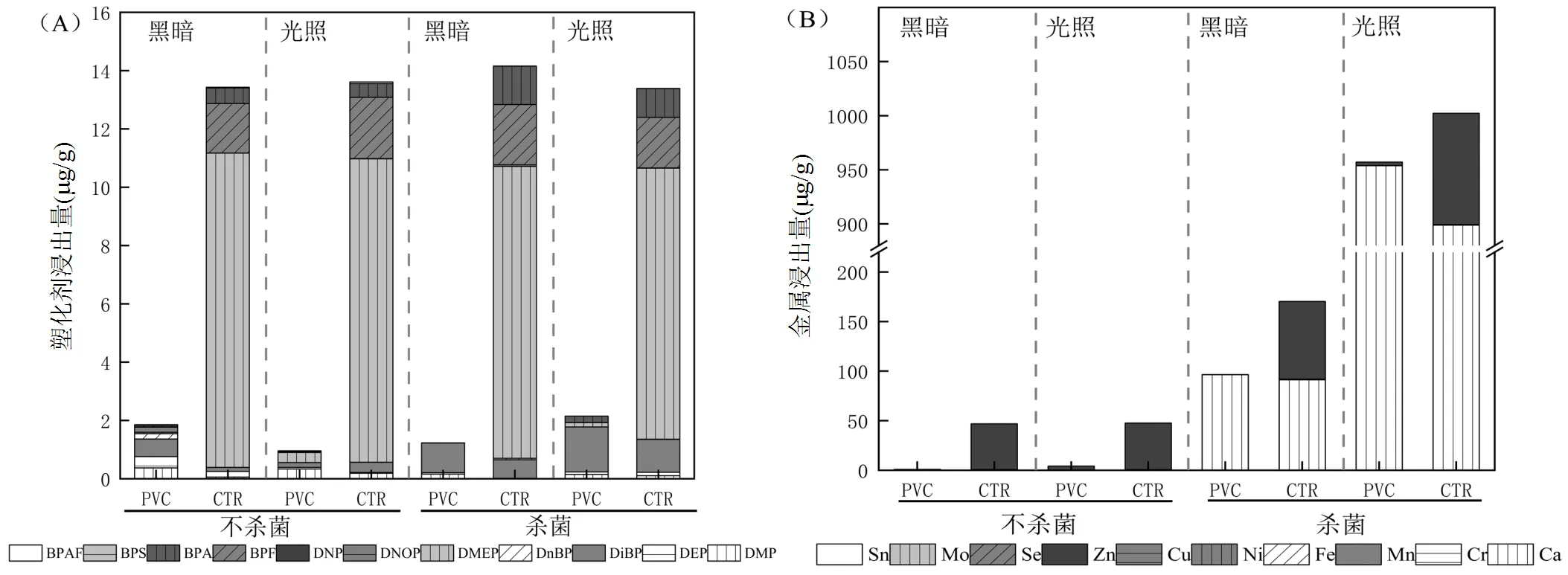
图2 不同环境条件下PVC和CTR浸出液中的塑化剂(A)和金属(B)浓度
2.3 浸出液对大型溞生长发育的影响
2.3.1 对大型溞的急性毒性 暴露期间对照组大型溞未发现死亡,PVC浸出液暴露组对大型溞的毒性较低,PVC暴露组死亡率均低于5%.在CTR浸出液暴露下大型溞死亡率随着CTR浸出原液稀释倍数的减小显著升高,暴露于C1组(50%浸出液)大型溞在48h的死亡率就已经达到100%,暴露72h后,除最大稀释组C4(6.25%浸出液)外,其余组大型溞全部死亡.通过使用logistic函数进行非线性回归计算,CTR浸出液对大型溞的24h-LC50和48h-LC50分别为58.3%和19.1%.研究发现,PVC微塑料悬浮液对大型溞96h-LC50为130.13mg/L,PVC浸出液毒性更小[39].CTR浸出液中DMEP、BPF和金属Zn浓度较高,虽然BPF对大型溞的48h-LC50值(8.7mg/L)远高于CTR浸出液中BPF的浓度(0.052mg/L)[30],但是CTR浸出液中Zn的浓度(2.94mg/L)相对偏高.Zn可通过置换酶分子中心的金属离子或者直接与酶功能基团结合降低酶活性,引起大型溞死亡,在3.2mg/L时导致大型溞在24h之内全部死亡[40].此外,DMEP为0.125~0.25mmol/L会显著降低细胞线粒体DNA(mtDNA)拷贝数,诱导细胞的线粒体损伤[41].这些结果表明,CTR浸出液中的Zn及主要塑化剂的毒害作用可能对大型溞的急性致死效应有一定贡献.但先前研究表明Zn的存在能够抑制邻苯二甲酸酯类污染物暴露导致的雄性生殖功能损伤,故本研究中对于浸出物复合污染下的毒性效应尚不明确[42].
2.3.2 对大型溞的慢性毒性 整个暴露期间,清水对照组(W)、溶剂对照组(D0~D4)、PVC浸出液组(P0~P4)和CTR最大稀释组(C4),大型溞死亡率低于10%,CTR浸出液组(C0~C3)中大型溞死亡率超过80%.由于清水对照组和溶剂对照组无明显区别,本文将溶剂对照作为参照组,CTR浸出液组(C0~C3)大型溞死亡率较高,其慢性毒性数据不再呈现.实验发现,不同稀释程度的PVC浸出液和最大稀释程度的CTR浸出液(6.25%原液)对大型溞的心率、胸肢跳动、游速等生态行为均产生显著抑制效应(图3).
大型溞的呼吸代谢、摄食生长和内分泌调节等健康状况与其体长、胸肢跳动、心率和运动活性密切相关[43].大型溞的心率和胸肢活动是评价污染物对大型溞呼吸、代谢速率和摄食产生不利影响的重要指标[44].与对照组相比,PVC浸出液能够抑制大型溞的胸肢跳动和心率,平均抑制率分别为15.86%和36.73%,最大抑制率达到17.39%和56.84%.最大稀释程度的CTR浸出液对大型溞胸肢跳动频率和心率的抑制率达到16.18%和66.32%,心率抑制可能是CTR浸出液高浓度暴露组中大型溞死亡的主要原因.大型溞有着与哺乳动物类似的肌源性心脏,其心率的变化能够反映出污染物对其能量代谢的影响以及污染物进入血液循环系统的程度[45].研究表明,PEAs(如DEP、DMP)的暴露浓度超过8mg/L时,大型溞的心率会明显受到抑制[46],并且溶液中浸出的BPF也对大型溞的心率产生抑制作用,当其浓度为10~100μg/L会显著抑制大型溞的心率,并且呈现浓度依赖关系[47].心率受到抑制导致供给胸肢跳动的能量减少,使胸肢跳动频率下降.同时,研究发现PVC浸出液中所含有的PAEs能够对大型溞的神经系统产生毒害作用,降低其机体协同能力[48].大型溞的心率和胸肢跳动降低会造成血液流动减缓、摄食不足,营养物质供给和气体交换能力减弱,对其生长发育构成威胁[49].
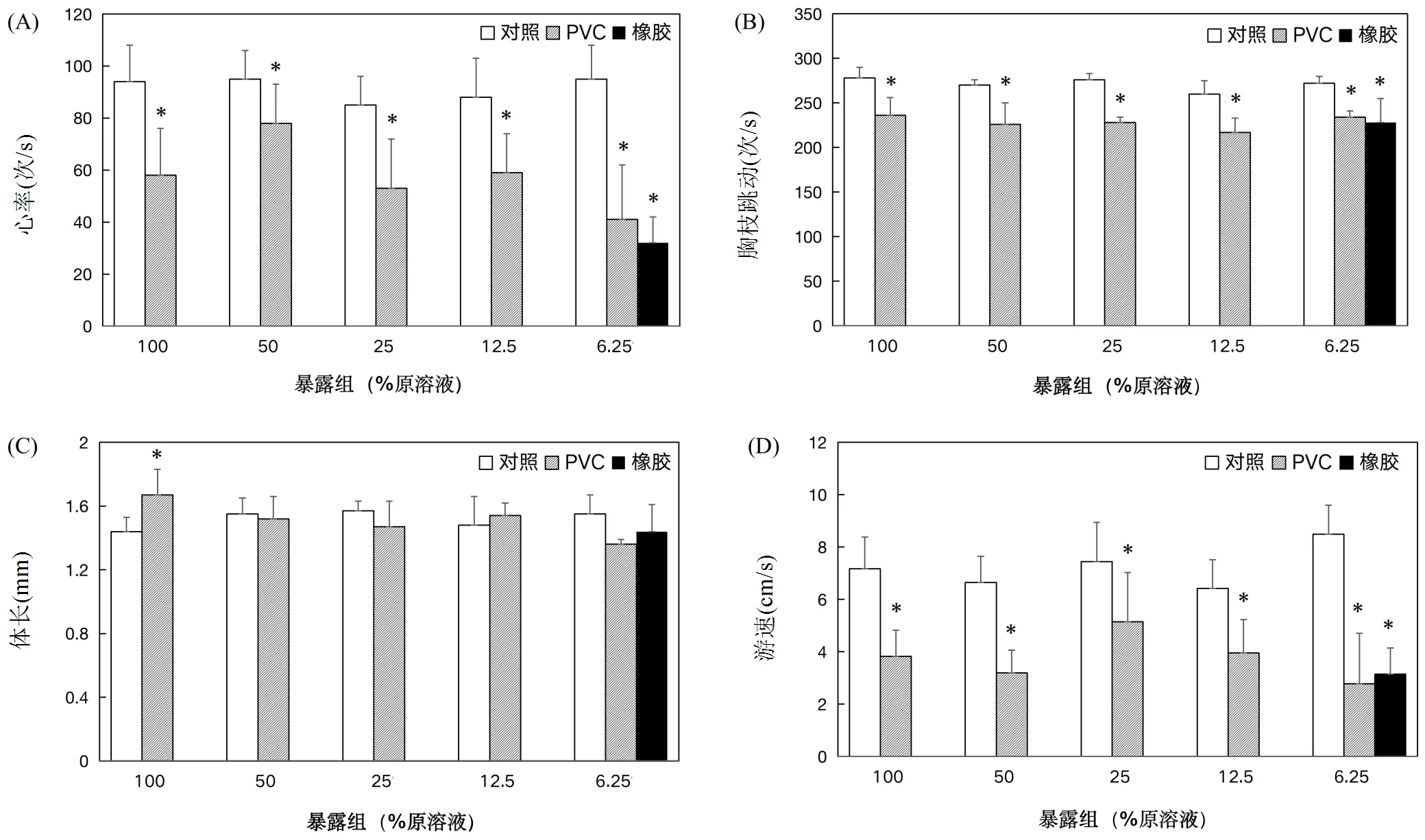
图3 PVC和CTR浸出液对大型溞心率(A)、胸肢跳动(B)、体长(C)、游泳活性(D)的影响
*表示差异显著(<0.05)
大型溞体长是指示生物健康程度的重要指标,体长的改变虽小,但其变化会影响物种的种群稳定性[50].PVC浸出液原液(P0组)显著增加了大型溞的体长,其他暴露组无明显改变.研究发现,1mol/L的DBP和DEHP能够增加大型溞体内的脂质积累[51],且BPA等双酚类物质能够在脂肪中积累[52],导致脂肪细胞代谢功能障碍,增加肥胖的风险[53].PVC浸出液原液中高浓度的PAEs和BPs作用可能是导致大型溞体长变大的主要原因.大型溞游泳行为受到生理、感知、神经和肌肉等系统多方面的影响,游泳能力强弱与其捕食、逃避天敌等行为直接相关[43].与对照组相比,不同浓度PVC浸出液均对大型溞的游泳速率产生显著抑制效应,最大抑制率达到67.26% (6.25%原溶液),最大稀释程度的CTR浸出液(C4)对大型溞游泳活性抑制率也达到63.02%.陈胜等[54]将大型溞置于11.4μg/L的BPA溶液中暴露21d,大型溞游泳速率抑制率达32.65%,BPAF对大型溞游泳速率有类似的抑制作用.乙酰胆碱酯酶(AChE)是水生生物中常用的神经毒性标志物,它的活性与生物的游泳活性呈显著正相关[55],AChE酶活性受到抑制会导致神经刺激延长,引起心率、游泳活性降低[56].研究发现,PVC浸出液能够下调贻贝AChE酶活性[19],浸出液中的金属Zn也是生物AChE酶活性的重要抑制剂,在6.5mg/L浓度下抑制率达到30%[57].且长期暴露于Zn溶液中,能够引起大型溞氧化损伤,抑制大型溞抗氧化酶的活性[58].
3 结论
3.1 经过42d的浸泡处理后,PVC浸出液的主要目标塑化剂是DiBP和BPA(最高浸出量分别为2.71, 0.89μg/g),主要金属物质是Ca和Zn(最高浸出量分别为953.79, 4.54μg/g); CTR浸出液中的主要塑化剂是DMEP和BPF(13.22, 3.51μg/g),主要金属是Ca和Zn(898.77, 102.79μg/g).CTR浸出液中塑化剂和金属物质总量均最高,分别达到17.68, 1127.89μg/g,是PVC的8.81倍和1.20倍.光照条件能够有力促进PVC中塑化剂和金属物质的环境释放,细菌对浸出液中DiBP、BPA等物质的降解或转化有一定的促进作用,对Ca的利用率接近100%.
3.2 急性毒性(48h)试验表明,PVC浸出液对大型溞无明显致死效应;CTR浸出液对大型溞的致死效应明显,随CTR浸出原液稀释倍数的减小而升高.通过计算得到CTR浸出液24h-LC50为浸出原液的58.3%,48h-LC50为浸出原液的19.1%,CTR的致死效应可能与浸出物质对大型溞心率抑制作用有关.
3.3 慢性毒性(7d)试验结果表明,PVC浸出液能导致大型溞肥胖,显著抑制大型溞的胸肢跳动、心率和游速活性;CTR浸出液最大稀释程度仍对大型溞生长发育产生显著抑制作用,PVC和CTR颗粒中化学物质的溶出对水生生物产生不利影响,且CTR的生态危害性更加严重和复杂.
[1] 陈 瑀,张 宴,苏良湖,等.南京城市污水处理厂中微塑料的赋存特征[J]. 中国环境科学, 2020,40(9):3835-3841.
Chen Y, Zhang Y, Su L H, et al. Occurrence characteristics of microplastics in Nanjing urban wastewater treatment plant[J]. China Environmental Science, 2020,40(9):3835-3841.
[2] 董姝楠,夏继红,王为木,等.典型水环境因素对聚酯微塑料沉降的影响机制研究[J]. 中国环境科学, 2021,41(2):735-742.
Dong S N, Xia J H, Wang W M, et al. Effect mechanism of aquatic environmental factor on the sedimentation of polyethylene terephthalate microplastic [J]. China Environmental Science, 2021, 41(2):735-742.
[3] Barboza L G A, Cózar A, Gimenez B C G, et al. World seas: An environmental evaluation 2nd Edition [M]. New York: Academic Press, 2018:325-351.
[4] Hidalgo-Ruz V, Gutow L, Thompson R C, et al. Microplastics in the Marine Environment: A review of the methods used for identification and quantification [J]. Environmental Science & Technology, 2012, 46(6):3060-3075.
[5] 孙小东,曹 鼎,胡倩倩,等.废弃塑料的化学回收资源化利用研究进展[J]. 中国塑料, 2021,35(8):11.
Sun X D, Cao D, Hu Q Q, et al.Progress in chemical recovery and resource utilization of waste plastics [J]. China Plastic, 2021,35(8):11.
[6] 任浩华,王 帅,王芳杰,等.PVC热解过程中HCl的生成及其影响因素[J]. 中国环境科学, 2015,35(8):2460-2469.
Ren H H, Wang S, Wang F J, et al. HCl generation reaction and its influence factors during PVC pyrolysis [J]. China Environmental Science, 2015,35(8):2460-2469.
[7] Sophonrat N, Sandstrm L, Johansson A C, et al. Co-pyrolysis of mixed plastics and cellulose: An interaction study by Py-GC×GC/MS [J]. Energy & Fuels, 2017,31(10):11078-11090.
[8] Hann S, Darrah C, Sherrington C, et al. Reducing household contributions to marine plastic pollution, report for “friends of the earth”[R]. Eunomia, 2018.
[9] Wagner S, Huffer T, Klockner P, et al. Tire wear particles in the aquatic environment-A review on generation, analysis, occurrence, fate and effects [J]. Water Research, 2018,139:83-100.
[10] Hahladakis J N, Velis C A, Weber R, et al. An overview of chemical additives present in plastics: Migration, release, fate and environmental impact during their use, disposal and recycling [J]. Journal of Hazardous Materials, 2018,344:179-199.
[11] 岑水斌,钟肖琼,吴 文,等.PVC中邻苯二甲酸酯类化合物的分析方法进展研究[J]. 塑料包装, 2021,31(3):53-56.
Cen S B, Zhong X Q, Wu W, et al. A review of paes testing methods development progress in PVC [J]. Plastics Packaging, 2021,31(3): 53-56.
[12] 赵雅辉,王小逸,林兴桃,等.邻苯二甲酸酯类化合物的体内代谢及毒性研究进展[J]. 环境与健康杂志, 2010,27(2):184-187.
Zhao Y H, Wang X Y, Lin X T, et al. Advances in researches on metabolic mechanism and toxicity of phthalate esters [J]. Journal of Environment and Health, 2010,27(2):184-187.
[13] Wei J, Shen Q, Ban Y L, et al. Characterization of acute and chronic toxicity of DBP to[J]. Bulletin of Environmental Contamination and Toxicology, 2018,101(2):214-221.
[14] Cheng Z, Nie X P, Wang H S, et al. Risk assessments of human exposure to bioaccessible phthalate esters through market fish consumption [J]. Environment International, 2013,58:75-80.
[15] Al-Odaini N A, Shim W J, Han G M, et al. Enrichment of hexabromocyclododecanes in coastal sediments near aquaculture areas and a wastewater treatment plant in a semi-enclosed bay in South Korea [J]. Science of the Total Environment, 2015,505:290-298.
[16] Schmidt N, Fauvelle V, Ody A, et al. The Amazon River: A major source of organic plastic additives to the tropical north atlantic? [J]. Environmental Science and Technology, 2019,53(13):7513-7521.
[17] Paluselli A, FauvelleV, Galgani F, et al. Phthalate release from plastic fragments and degradation in seawater [J]. Environmental Science & Technology, 2018,53(1):166-175.
[18] Gunaalan K, Fabbri E, Capolupo M. The hidden threat of plastic leachates: A critical review on their impacts on aquatic organisms [J]. Water Research, 2020,184:116170.
[19] Capolupo M, Franzellitti S, Kiwan A, et al. A comprehensive evaluation of the environmental quality of a coastal lagoon (Ravenna, Italy):Integrating chemical and physiological analyses in mussels as a biomonitoring strategy [J]. Science of the Total Environment, 2017, 598:146-159.
[20] Capolupo M, Gunaalan K, Booth A M, et al. The sub-lethal impact of plastic and tire rubber leachates on the Mediterranean mussel Mytilus galloprovincialis [J]. Environmental Pollution, 2021,283(4):117081.
[21] Test No. 211:reproduction test [S].
[22] Wang Q, Guo H, Wang L. Effect of cadmium on the feeding capacity and physiological status of[J]. Acta Hydrobiologica Sinica, 2018,42(3):616-621.
[23] 蔡清洁,何文辉,彭自然,等.pH和盐度对大型溞心率和摄食行为的影响[J]. 上海海洋大学学报, 2017,26(3):415-421.
Cai Q J, He W H, Peng Z R, et al. Effects of pH and salinity on heart rate and feeding behavior of[J]. Journal of Shanghai Ocean University, 2017,26(3):415-421.
[24] 徐鑫磊,刘建超,陆光华.8种典型PhACs在水中的赋存、生态风险及其对大型溞的影响[J]. 环境科学, 2020,41(5):2239-2246.
Xu X L, Liu J C, Lu G H. Occurrence and ecological risk of eight typical PhACs in surface water and its impact on[J]. Environmental Science, 2020,41(5):2239-2246.
[25] 郭婧颖,刘建超,李帅衡,等.双酚AF对大型溞生殖、生长等生态行为的影响[J]. 中国环境科学, 2019,39(10):4394-4400.
Guo J Y, Liu J C, Li S H, et al. Influences of bisphenol AF on the reproduction and growth of[J]. China Environmental Science, 2019,39(10):4394-4400.
[26] Capolupo M, Srensen L, Jayasena K, et al. Chemical composition and ecotoxicity of plastic and car tire rubber leachates to aquatic organisms [J]. Water Research, 2019,169:115270.
[27] 田维生,张会云,田 玲,等.钙锌稳定剂在RoHS型90℃绝缘级软PVC塑料上的应用[J]. 塑料助剂, 2017,2:36-38.
Tian W S, Zhang H Y, Tian L, et al. Application of calcium zinc stabilizer in 90℃ insulation degree soft PVC which meets the requirements of both RoHS and J-90 [J]. Plastics Additives, 2017,2: 36-38.
[28] 丁梦雨,康启越,张释义,等.全国23个城市水源水中邻苯二甲酸酯代谢物浓度调查 [J]. 中国环境科学, 2019,39(10):4205-4211.
Ding M Y, Kang Q Y, Zhang S Y, et al. National survey of phthalate metabolites in drinking source water of 23cities in China[J]. China Environmental Science, 2019,39(10):4205-4211.
[29] Li R, Liang J, Gong Z, et al. Occurrence, spatial distribution, historical trend and ecological risk of phthalate esters in the Jiulong River, Southeast China [J]. Science of the Total Environment, 2017,580:388- 397.
[30] Liu J, Zhang L, Lu G, et al. Occurrence, toxicity and ecological risk of bisphenol A analogues in aquatic environment-A review [J]. Ecotoxicology and Environmental Safety, 2021,208:111481.
[31] GB 3838-2002 地表水环境质量标准[S].
GB 3838-2002 Environmental quality standards for surface water [S].
[32] Tetu S G, Sarker I, Schrameyer V, et al. Plastic leachates impair growth and oxygen production in Prochlorococcus, the ocean’s most abundant photosynthetic bacteria [J]. Communications Biology, 2019,2(1):184.
[33] 彭燕莉,刘俊红.塑料水管材质中化学成分对水质影响的研究 [J]. 塑料工业, 2019,47(2):157-160.
Peng Y L, Liu J H. The research on the effect of chemical components in plastic water pipe material on water quality [J]. China Plastics Industry, 2019,47(2):157-160.
[34] 金一,苍飞飞.轮胎橡胶多组分分析方法的研究 [J]. 化学研究与应用, 2021,33(4):607-614.
Jin Y, Cang F F. Establishment of multi-component analysis method for tire rubber[J]. Chemical Research and Application, 2021,33(4): 607-614.
[35] 叶雪莹.PVC管材源微塑料中邻苯二甲酸酯的释放行为研究[D]. 杭州:浙江工业大学, 2020.
Ye X Y. The release behavior of phthalates from PVC pipe microplastics [D]. Hangzhou: Zhejiang University of Technology, 2020.
[36] 马力超,吕 红,魏 浩,等.双酚类化合物的生物降解研究进展[J]. 工业水处理, 2017,37(12):11-16.
Ma L C, Lu H, Wei H, et al. Advances in the research on biodegradation of bisphenols [J]. Industrial Water Treatment, 2017, 37(12):11-16.
[37] 叶茂友.铅锌硫化尾矿中金属的生物浸出行为及浸出机理的研究[D]. 广州:广东工业大学, 2017.
Ye M Y. Studies on bioleaching of metals and leaching mechanism from lead-zinc sulfide mine tailings [D]. Guangdong: Guangdong University of Technology, 2017.
[38] Rastkari N, Jeddi M Z, Yunesian M, et al. Effect of sunlight exposure on phthalates migration from plastic containers to packaged juices [J]. Journal of Environmental Health Science and Engineering, 2018, 16(1):27-33.
[39] 李 勤,李尚谕,熊 雄,等.微塑料对大型溞的急性毒性研究[J]. 水生生物学报, 2021,45(2):292-298.
Li Q, Li S Y, Xiong X, et al. Study on acute toxicity of microplastic to[J]. Acta Hydrobiologica Sinica, 2021,45(2):292-298.
[40] 张 楠,张清靖,贾成霞,等.重金属锌对大型溞SOD,CAT酶活性和GSH含量的影响[J]. 西南大学学报:自然科学版, 2017,39(1):69-75.
Zhang N, Zhang Q J, Jia C X, et al. Effects of heavy metal zinc on SOD and CAT activities and GSH content of[J]. Journal of Southwest University (Natural Science Edition), 2017,39(1): 69-75.
[41] Liu H, Zhu S, Han W, et al. DMEP induces mitochondrial damage regulated by inhibiting Nrf2and SIRT1/PGC-1α signaling pathways in HepG2cells [J]. Ecotoxicology and Environmental Safety, 2021,221: 112449.
[42] 孙 悦,杨 柳,史弘毅,等.锌对邻苯二甲酸酯类暴露致雄性生殖毒性的干预作用[J]. 温州医科大学学报, 2019,49(9):649-653.
Sun Y, Yang L, Shi H Y, et al. Intervention of zinc on the male reproductive toxicity caused by phthalates exposure [J]. Journal of Wenzhou Medical University, 2019,49(9):649-653.
[43] 郭鹄飞,张雪萍,孙 晨,等.镉对大型溞心率和摄食能力的影响[J]. 山西农业科学, 2018,46(4):568-571.
Guo H F, Zhang X P, Sun C, et al. Effect of cadmium on heart rate and feeding behavior in[J]. Journal of Shanxi Agricultural Sciences, 2018,46(4):568-571.
[44] Bownik A.swimming behaviour as a biomarker in toxicity assessment: A review [J]. Science of the Total Environment, 2017,601: 194-205.
[45] Campbell A K, Wann K T, Matthews S B. Lactose causes heart arrhythmia in the water fleapulex [J]. Comparative Biochemistry and Physiology Part B Biochemistry and Molecular Biology, 2004,139(2):225-234.
[46] Pu S Y, Hamid N, Ren Y W, et al. Effects of phthalate acid esters on zebrafish larvae: Development and skeletal morphogenesis [J]. Chemosphere, 2019,246:125808.
[47] Liu J, Shen J, Lu G, et al. Multilevel ecotoxicity assessment of environmentally relevant bisphenol F concentrations in Daphnia magna [J]. Chemosphere, 2020,240:124917.
[48] 李 欣,申晨晨,魏 杰,等.邻苯二甲酸酯对浮游生物的毒性效应研究进展[J]. 水产科学, 2020,39(6):11.
Li X, Shen C C, Wei J, et al. Progress on toxicity of phthalates to plankton: A Review [J]. Fisheries Science, 2020,39(6):11.
[49] Liang R, He J, Shi Y, et al. Effects of Perfluorooctane sulfonate on immobilization, heartbeat, reproductive and biochemical performance of[J]. Chemosphere, 2017,168:1613-1618.
[50] Imhof H K, Jakub R, Michaela T, et al. Do microplastic particles affectat the morphological, life history and molecular level? [J]. Plos One, 2017,12(11):e0187590.
[51] Seyoum A, Pradhan A. Effect of phthalates on development, reproduction, fat metabolism and lifespan in[J]. Science of the Total Environment, 2019,654:969-977.
[52] Trasande L, Attina T M, Blustein J. Association between urinary bisphenol A concentration and obesity prevalence in children and adolescents [J]. Journal of the American Medical Association, 2012, 308(11):1113-1121.
[53] Kim K Y, Lee E, Kim Y. The association between bisphenol A exposure and obesity in children—a systematic review with meta-analysis [J]. International Journal of Environmental Research and Public Health, 2019,16(14):2521.
[54] Chen S, Li X, Li H, et al. Greater toxic potency of bisphenol AF than bisphenol A in growth, reproduction, and transcription of genes in[J]. Environmental Science and Pollution Research, 2021,28(20):25218-25227.
[55] 王倩倩,王永花,汪贝贝,等.双酚F和双酚S联合暴露下的斑马鱼富集及神经毒性 [J]. 中国环境科学, 2020,40(2):865-873.
Wang Q Q, Wang Y H, Wang B B, et al. Accumulation and neurotoxicity of bisphenol F and bisphenol S in zebrafish under combined exposure[J]. China Environmental Science, 2020,40(2): 865-873.
[56] 曾 阳.神经抑制污染物连续暴露下大型溞()外在行为响应及内在机制研究[D]. 济南:山东师范大学, 2012.
Zeng Y. Behavioral responses and Internal Mechanism ofafter exposure to nerve inhibition pollutants [D]. Jinan: Shandong Normal University, 2012.
[57] Frasco M F, Fournier D, Carvalho F, et al. Do metals inhibit acetylcholinesterase (AChE)? Implementation of assay conditions for the use of AChE activity as a biomarker of metal toxicity [J]. Biomarkers, 2005,10(5):360-375.
[58] 张 融,范文宏,唐 戈,等.重金属Cd和Zn对水生浮游动物大型蚤()联合毒性的研究初探[J]. 内蒙古大学学报(自然科学版), 2008,6:704-709.
Zhang R, Fan W H, Tang G, et al. A preliminary study on joint toxicity of Cd and Zn on freshwater zooplankton[J]. Acta Scientiarum Naturalium Universitatis Neimongol, 2008,6:704-709.
Leaching behavior and ecotoxicity of chemical composition in polyvinyl chloride and rubber.
LIU Jian-chao*, HU Yong-rong,
(Key Laboratory for Integrated Regulation and Resources Development on Shallow Lakes, Ministry of Education, College of Environment, Hohai University, Nanjing 210098, China)., 2022,42(11):5408~5417
To investigate the leaching behavior and ecotoxicity of chemical composition in plastics, polyvinyl chloride (PVC) and rubber (CTR) widely existed in the environment were selected as the subjects of the study. Leaching potential of 25 organic plasticizers and 15 metals as the target substances were analyzed for PVC and CTR materials. The acute lethal effects and chronic sublethal effects (heart rate, thoracic limb activity and swimming activity) ofwere used to characterize the ecotoxicological effects of PVC and CTR leachates. The results showed that 21 chemical compositions were detected in PVC and CTR leachates, with higher leaching concentrations of diisobutyl phthalate (DiBP), di (2-methoxy) ethyl phthalate (DMEP), bisphenol A (BPA), bisphenol F (BPF), Ca and Zn. The total concentrations of plasticizers and metals leached from CTR were 8.8 times and 1.2 times higher than those from PVC, respectively. The concentration of the new plasticizer BPF leached from CTR reached 3.51μg/g, which was significantly higher than that of BPA. Comparing the concentration of substances leached under different conditions, it was found that light can accelerate the release of DiBP, Zn and Ca from PVC and CTR, and their occurrence characteristics were affected by bacteria. Acute toxicity of CTR leachate tois obvious, with the 48h-LC50of 19.1% of the leaching solution. For chronic toxicity, the PVC leachate significantly inhibited the heart rate, thoracic limb activity and swimming activity of, and caused body hypertrophy of. The biological toxic effects caused by the continuous discharge of PVC and CTR in the aquatic environment should not be ignored.
PVC;rubber;leaching solution;;ecotoxicity
X503
A
1000-6923(2022)11-5408-10
刘建超(1985-),河南商丘人,副教授,博士,主要从事新污染物环境行为、水环境保护与修复等方面的研究工作.发表论文90余篇.
2022-04-12
国家自然科学基金面上项目项目(521709063)
* 责任作者, 副教授, jianchao-liu@hhu.edu.cn

