芳构化法制2,5-二羟基对苯二甲酸热力学分析及反应特性研究
刘晓叶,钱刚
(华东理工大学 化工学院,上海 200237)
2,5-二羟基对苯二甲酸(DHTA)是一种重要的有机合成中间体,尤其是作为聚(2,5-二羟基-1,4-苯撑并吡啶双咪唑)纤维的单体之一,近年来受到广泛关注[1-7]。目前,合成DHTA的方法主要为Kolbe-Schmitt(科-施)法[8]和芳构化法[1]两种。其中科-施法通常需要较高的压力,危险性高;而芳构化法的条件相对温和,常压下即可进行[9]。
热力学分析可以为反应条件的选择以及反应装置的设计提供理论指导[10-14],但目前有关芳构化法合成DHTA的基础热力学数据还很缺乏。为此,本文对该过程进行了热力学分析,同时考察了反应条件对产品性能的影响,以期为优化反应工艺条件和可能的工业化生产提供参考。
1 热力学计算
1.1 反应原理
由1,4-环己二酮-2,5-二甲酸二甲酯(DMSS)经芳构化法制备DHTA的过程主要包括以下两个反应:①DMSS与双氧水反应生成2,5-二羟基对苯二甲酸二甲酯(DMDHT)(反应Ⅰ);②DMDHT进一步水解生成DHTA(反应Ⅱ),见图1。

图1 由DMSS制备DHTA过程中涉及的主要反应Fig.1 Main reactions involved in the preparation ofDHTA from DMSS
1.2 热力学数据估算
在芳构化法制备DHTA的反应体系中,双氧水、水和甲醇的热力学数据可直接从物性手册中获得,但是DMSS、DMDHT以及DHTA的热力学数据无法在现有的文献中得到,因此,首先采用基团贡献法计算了这些物质的热力学数据。


表1 各化合物热力学数据的估算值Table 1 Estimated thermodynamic data for each compound
(1)
式中,ΔHi和ΔHj分别为第一级和第二级基团值[16-17],其相应的基团个数为ni和nj。
(2)
式中,ΔHa和ΔHb分别为一级和二级基团贡献值[16-17],而对应的基团数为na和nb。
(3)
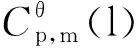
(4)
其中,a,b,c为参数;T为温度,单位K。
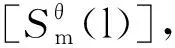
(5)

1.3 反应焓变、吉布斯自由能变以及平衡常数
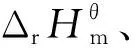
(6)
(7)
(8)
上述式中的vi为各物质的化学计量数。

表3 298.15 K时各反应的和reaction at 298.15 K
将得到的各组分标准摩尔定压热容与温度的关系式代入式(9),可以计算得到两个反应的热容计算式,如式(10)和式(11):
(9)
5.275×10-4T2
(10)
6.187×10-4T2
(11)
0.740T2-1.760×10-4T3
(12)
0.392T2-2.063×10-4T3
(13)
0.740T2+8.798×10-5T3-755.640T(14)
0.392T2+1.031×10-4T3+1 236.628T(15)
此外,由式(16)可以计算出两个反应的平衡常数[19]。
(16)
2 实验部分
2.1 材料与仪器
冰乙酸、1,4-环己二酮-2,5-二甲酸二甲酯、碘、碘化钾、30%双氧水、氢氧化钠、质量分数36%的盐酸均为化学纯;超纯水,实验室自制。
Acquity UPLC H-Class Bio超高效液相色谱;BPZ-6033LC真空干燥箱;TCW-32B电子分析天平;BT100-1J/YZ1515X微量注射泵;DF-101S集热式磁力搅拌器;S210 pH计;Master Touch-Q15去离子纯水机。
2.2 实验方法
向四口烧瓶中分别加入0.1 mol DMSS和一定量的冰乙酸,边搅拌边升温,至DMSS全部溶解,升温至105 ℃后开始回流,保持温度恒定并加入 0.025 mol 碘和0.025 mol碘化钾,然后缓慢加入 12 mL 30%的双氧水,反应一定时间后,停止加热,先后加入适量热水和冷水,自然冷却至室温,然后多次水洗抽滤,真空干燥,得到中间产品DMDHT。
向四口烧瓶中加入0.05 mol DMDHT和适量水,通入保护气搅拌成均匀糊状后,加入60 mL 20%的NaOH溶液直到DMDHT全部溶解,加热至 98 ℃,然后缓慢加入12 mL质量分数20%的HCl水溶液,紧接着反应一定时间,水洗抽滤后,真空干燥24 h,得到DHTA产品。
过程中产物的纯度采用超高效液相色谱进行分析,具体条件为:色谱柱型号Chromspher 5 C18;DMDHT 分析的流动相条件:V(甲醇)∶V(水溶液)=3∶2,流速0.4 mL/min,柱温30 ℃;DHTA分析的流动相条件:V(甲醇)∶V(0.002 5 mol/L磷酸二氢铵水溶液)=3∶2,流速0.8 mL/min,柱温30 ℃。
3 结果与讨论
3.1 热力学分析


图2 不同温度下反应Ⅰ(a)和反应Ⅱ(b)的Fig.2 Enthalpy changes for reaction Ⅰ (a) andreaction Ⅱ (b) at different temperatures
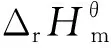
图3为反应的吉布斯自由能变与反应温度的关系。

图3 不同温度下反应Ⅰ(a)和反应Ⅱ(b)的Fig.3 Gibbbs free energy changes for reaction Ⅰ (a) andreaction Ⅱ (b) at different temperatures
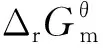
进一步地,由图4中反应平衡常数随温度的变化趋势可知,在所考察的温度范围内反应Ⅰ的平衡常数都很大,表明该反应的理论转化率可以达到100%,也即反应物可以完全转化;随着温度的升高,平衡常数降低,说明升高温度不利于该反应向生成物方向移动;而对于反应Ⅱ,在所考察的温度范围内,反应平衡常数均非常小,进一步说明了该反应难以进行。

图4 不同温度下反应Ⅰ(a)和反应Ⅱ(b)的平衡常数Fig.4 Equilibrium constants for reaction Ⅰ(a) andreaction Ⅱ (b) at different temperatures
3.2 工艺条件对反应性能的影响
3.2.1 反应温度的影响 首先,在相同的H2O2滴加速率和反应时间的条件下,考察了温度对反应Ⅰ,即DMSS反应生成DMDHT性能的影响,结果见图5。

图5 反应温度对DMDHT的纯度和收率的影响Fig.5 Influence of reaction temperature on thepurity and yield of DMDHT
由图5可知,当反应温度由85 ℃升高到105 ℃时,DMDHT的纯度和收率均随之增加;而当温度进一步升高时,其纯度和收率不断降低。这是因为反应温度越高反应速率越快,而且也越有利于DMSS异构成烯醇结构进而芳构化生成DMDHT[20];与此同时,前面的热力学计算结果表明,反应Ⅰ为放热反应,温度升高不利于其向生成物反应移动。因此,对于反应Ⅰ,存在较优的反应温度。
由前面的热力学分析可知,当温度为298.15~418.15 K时,DMDHT水解生成DHTA的反应(反应Ⅱ)不能自发进行。为此,向DMDHT水溶液中加入一定量的NaOH使其在碱的催化作用下进行水解反应,并探究了水解温度对反应Ⅱ性能的影响,结果见图6。
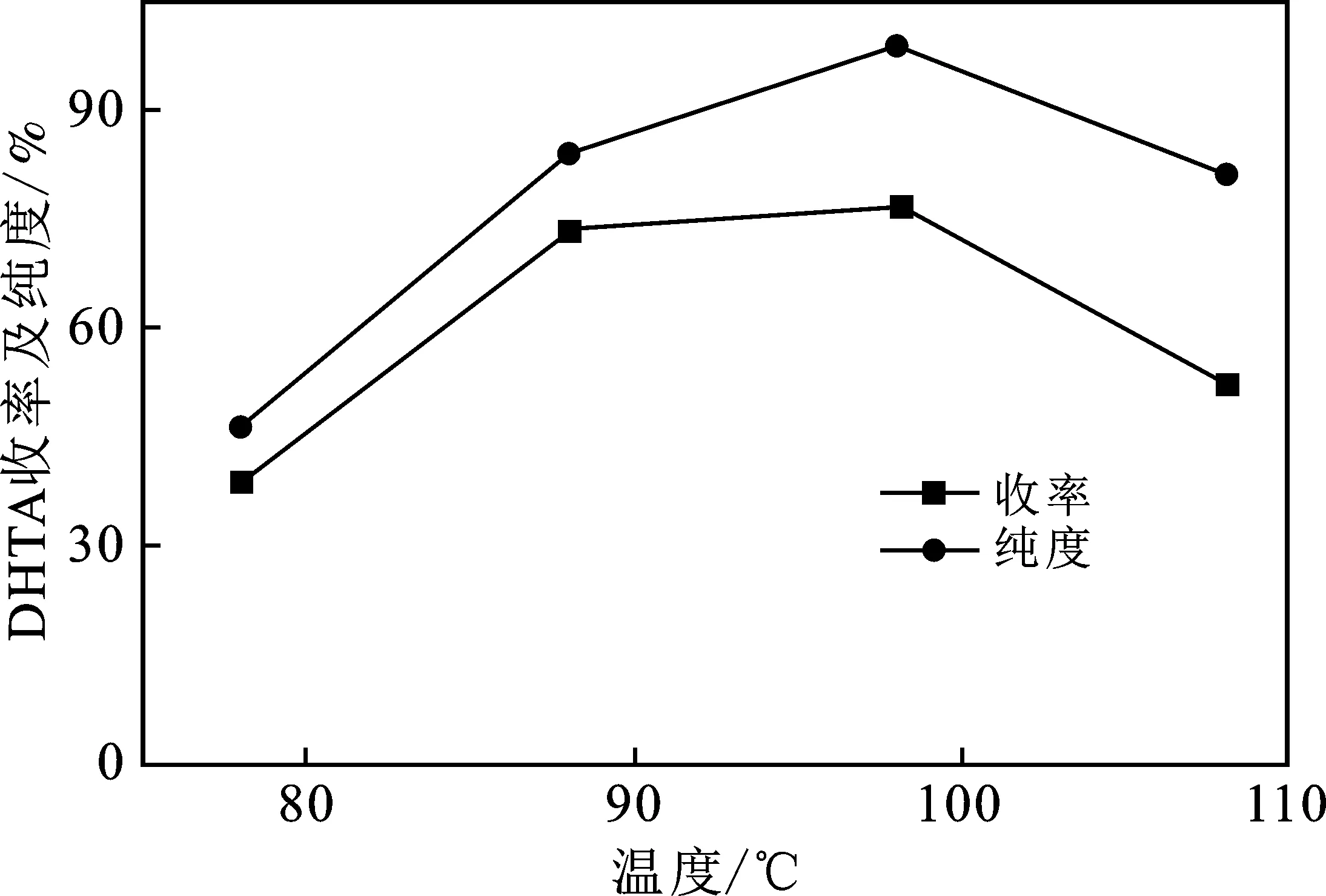
图6 水解温度对DHTA的纯度和收率的影响Fig.6 Influence of reaction temperature on thepurity and yield of DHTA
由图6可知,由于反应Ⅱ为吸热反应,升高反应温度不仅可以提高反应速率而且有利于反应向生成物方向进行,因此,当水解温度不断提高到100 ℃左右时,水解产物DHTA的纯度和收率快速增加。但是,进一步提高水解温度,可能会致使水解产物生成酚盐[20],从而影响了DHTA的纯度和收率。
3.2.2 反应时间的影响 图7为相同条件下(反应温度为105 ℃,H2O2滴加速率为12 mL/h),H2O2滴加完毕后不同反应时间对反应Ⅰ产物DMDHT的纯度和收率的影响。

图7 反应时间对DMDHT的纯度和收率的影响Fig.7 Influence of reaction time on the purityand yield of DMDHT
由图7可知,当反应时间在25 ~55 min时,DMDHT的纯度变化不大,均较高,其收率缓慢增加。但当反应时间进一步延长到65 min时,DMDHT 的纯度和收率均降低,这可能是由于副反应的发生导致的。
此外,也考察了水解反应中所有物料添加完毕后的反应时间对产物DHTA纯度和收率的影响,结果见图8。
由图8可知,随着水解时间由30 min增加到 50 min,DHTA的纯度和收率不断增加。进一步延长水解时间后,其纯度变化不大,收率略有降低。由此可见,水解过程中要保持足够长的时间以确保水解反应充分进行,但水解时间不宜过长以免副反应的发生。
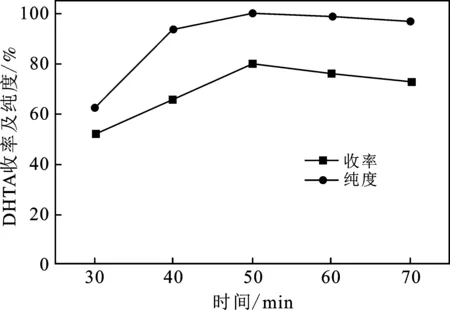
图8 水解时间对DHTA的纯度和收率的影响Fig.8 Influence of reaction time on the purityand yield of DHTA
3.2.3 双氧水滴加速率的影响 在反应Ⅰ的过程中保持反应温度为105 ℃,以不同的速率滴加H2O2,滴加完毕后继续反应55 min,考察不同的H2O2滴加速率对DMDHT纯度和收率的影响,结果见图9。
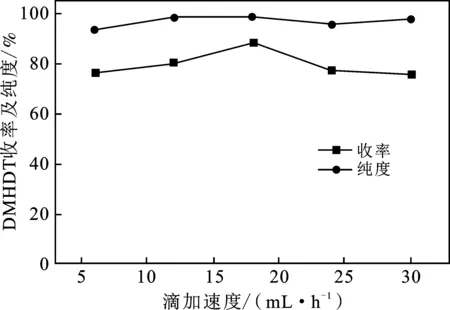
图9 H2O2滴加速率对DMDHT的纯度和收率的影响Fig.9 Influence of the feed rate of H2O2 on thepurity and yield of DMDHT
由图9可知,芳构化反应过程中,H2O2的滴加速率过慢会降低反应Ⅰ的反应效率,但滴加速率过快会导致体系温度迅速上升,不仅会增加实验的危险性,而且不利于反应向产物方向进行。因而,实际的反应过程中要控制双氧水的滴加速率,以 18 mL/h 为宜。
4 结论
(1)热力学计算得到了298.15~418.15 K时DMSS与双氧水反应生成DMDHT(反应Ⅰ)和 DMDHT 水解生成DHTA(反应Ⅱ)的反应焓变、反应吉布斯自由能变以及平衡常数,结果表明,反应Ⅰ为放热反应,且随着反应温度的升高放出的热量不断减少;反应Ⅰ的吉布斯自由能变均小于0且平衡常数非常大,预示着该反应可以自发进行且反应完全。反应Ⅱ为吸热反应,所吸收的热量受反应温度的影响较小;其吉布斯自由能变大于0且平衡常数均较小,这说明在所考察的温度范围内,反应Ⅱ无法自发进行。
(2)工艺条件影响的实验结果表明,反应Ⅰ和反应Ⅱ都存在一个较优的工艺条件。其中,反应Ⅰ的较优工艺条件为:反应温度105 ℃,反应时间 55 min,H2O2滴加速率为18 mL/h;反应Ⅱ的较优工艺条件为:反应温度98 ℃,反应时间50 min。

