BMP-2、iRoot BP Plus联合对牙髓细胞成牙本质分化的实验研究
李珍珍 柴文宇 殷亮亮 李春年
活髓保存材料的选择对于治疗的成功与否具有很大影响,理想的活髓保存材料应具有良好的抗菌性、生物相容性、密封性、可诱导修复性牙本质形成、低孔隙度和溶解度以及易于操作等特点,然而至今,仍没有任何一种材料能够拥有所有这些特性[1,2]。目前临床上使用的盖髓材料包括氢氧化钙类(如Dycal)、硅酸钙基材料类(如MTA、iRoot BP Plus)、树脂基类材料、玻璃离子类及生物因子材料类(如骨形成蛋白,BMPs)。
iRoot BP Plus是一种预混合型的新型生物陶瓷类材料,其操作简单,固化时间短,可以增强牙髓细胞的粘附、迁移、附着、增殖和矿化能力[3]。近年来大量研究[4~6]表明BMPs、VEGF、TGF-β等在牙本质修复机制中起着重要的作用,可以促进牙髓干细胞的增殖以及成牙本质/成骨的分化,其中BMP-2是BMPs家族中最具活性的信号蛋白之一[7],可诱导牙髓细胞向成牙本质细胞分化,在活髓保存方面具有很大前景。BMP-2、iRoot BP Plus作为常见诱导因子在牙髓细胞增殖分化方面是否存在差异,两者联合应用是否可发挥协同作用,尚无研究证明。所以本研究通过BMP-2、iRoot BP Plus、BMP-2与iRoot BP Plus联合作用于体外培养的人牙髓细胞,探究牙髓细胞牙本质化过程中BMP-2与iRoot BP Plus之间的相互作用及影响以期为活髓保存材料的选择提供实验参考。
材料与方法
1.主要试剂及仪器
胎牛血清(BI公司,以色列);DMEM培养基、0.25%胰蛋白酶(Gibco公司,美国);Mouse Anti-Human CD34-FITC、Mouse Anti-Human CD45-FITC、IgG-FITC(BioLegend公司,美国);碱性磷酸酶(ALP)试剂盒(上海碧云天生物技术有限公司,中国);Eastep® Super总RNA提取试剂盒(上海普洛麦格生物制品有限公司,中国);CCK-8细胞增殖检测试剂盒、一管式反转录试剂盒、2*Universal SYBR Green qPCR Premix(上海圣尔生物科技有限公司,中国);倒置相差显微镜(TH4-200,OLYMPUS,日本);酶标仪(Synergy-TH,Biotech,美国);实时荧光定量PCR仪(CFX96 Real-Time System,Thermo,美国)。
2.牙髓细胞分离、培养及鉴定
(1)牙髓细胞分离、培养:本实验已通过河北医科大学口腔医院伦理委员会审核批准,伦理批准号为[2020]027,且经过患者及家属的同意并签署知情同意书。
选取我院口腔颌面外科门诊,患者年龄为12~20岁,因阻生或者正畸而拔除的新鲜的完整的第三磨牙或前磨牙,1小时内转移至无菌实验室,将新鲜的离体牙用含有1%双抗的PBS冲洗三次,去除表面的血渍,如有多余的牙龈组织则先用眼科剪去除;然后将离体牙沿牙体长轴劈开,用拔髓针取出牙髓组织,并用眼科剪剪去根尖约2 mm的组织;将剩余的牙髓组织放入含有1%双抗的PBS中清洗三次,放入少量DMEM的培养液,并用眼科剪将牙髓组织剪成体积约1 mm3的组织块;之后将牙髓组织转移至含有3 mg/mLⅠ型胶原酶和4 mg/mL的中性蛋白酶的离心管中,吹打均匀,37℃水浴消化15分钟,每5分钟轻轻震荡一次,1000 r/min离心5 min,弃上清,加入DMEM培养液,重悬细胞,接种于培养瓶中;将培养瓶置于37℃、5% CO2的恒温培养箱中培养,每三天换液,于倒置显微镜下观察细胞形态及生长情况;待细胞汇合至培养瓶底约80%时,加入0.25%胰蛋白酶消化,进行传代培养。
(2)流式细胞仪法进行牙髓细胞的鉴定:取生长状态良好、细胞形态正常的2代牙髓细胞,加入2 mL 0.25%胰蛋白酶消化后,1000 r/min,离心5分钟,去上清,调整细胞密度为1×106个/mL,制备成单细胞悬液;取3个EP管,每管加入100 uL细胞悬液,分别加入CD34、CD45以及阴性对照IgG各5 uL,4℃避光孵育20分钟;PBS清洗离心后,每管加入300 uL PBS重悬细胞;流式细胞仪对3组样本表面标记物的表达进行鉴定。
3.条件培养液配制
(1)配制0.2 mg/mL iRoot BP Plus培养液:取0.5 g预混即用型iRoot BP Plus置于无菌模具中,放入37℃、5% CO2的恒温培养箱中,待其完全固化,研磨成粉,过筛备用。将研磨后的iRoot BP Plus粉末与25 mL DMEM培养液混合,37℃恒温培养箱内孵育7天,每24 h震荡5 min。将iRoot BP Plus混合液离心,收集上清,0.22 um滤菌器过滤除菌,配制成20 mg/mL iRoot BP Plus浸提液,4℃保存备用。取适量20 mg/mL iRoot BP Plus浸提液加入DMEM培养液,稀释成0.2 mg/mL iRoot BP Plus培养液,4℃保存备用。
(2)配制100 ng/mL BMP-2培养液:按照说明书将10 ug BMP-2冻干粉溶于100 uL超纯水中,配制成浓度为100 ng/uL的BMP-2溶液,分装成10份,-20℃保存备用。取一份100 ng/uL的BMP-2溶液,加入10 mL DMEM培养液,配制成100 ng/mL的BMP-2培养液,4℃保存备用。
(3)配制100 ng/mL BMP-2与0.2 mg/mL iRoot BP Plus混合培养液:取一份100 ng/uL的BMP-2溶液,加入5 mL DMEM培养液,配制成200 ng/mL的BMP-2培养液,4℃保存备用。取适量20 mg/mL iRoot BP Plus浸提液加入DMEM培养液,稀释成0.4 mg/mL iRoot BP Plus培养液,4℃保存备用。取适量200 ng/mL的BMP-2培养液,加入等量的0.4 mg/mL iRoot BP Plus培养液,混匀后配制成100 ng/mL BMP-2与0.2 mg/mL iRoot BP Plus混合培养液,4℃保存备用。
4.实验分组
A组:空白对照组,含常规DMEM培养液。
B组:0.2 mg/mL iRoot BP Plus培养液。
C组:0.2 mg/mL iRoot BP Plus与100 ng/mL BMP-2混合培养液。
D组:100 ng/mL BMP-2培养液。
5.BMP-2、iRoot BP Plus对牙髓细胞增殖的影响
取生长状态良好的3-5代牙髓细胞,经0.25%胰蛋白酶消化后,调整细胞密度为5×104个/mL,每孔100 uL接种于96孔内;24 h后吸去DMEM培养液后,随机分为四组分别处理牙髓细胞,每组设置5个副孔,隔天换液;分别在培养第1、3、5、7 d时用酶标仪检测450 nm时各孔的OD值,实验重复3次,并绘制细胞生长曲线。
6.BMP-2、iRoot BP Plus对牙髓细胞分化的影响
(1)碱性磷酸酶(ALP)活性检测:取生长状态良好的3-5代牙髓细胞,接种于6孔板中,待细胞融合至60%时,随机分为四组分别处理牙髓细胞,分别于培养第7天及14天时,每孔加入0.1% TritonX-100裂解液200 uL,收集混合液加入96孔板中,按照碱性磷酸酶试剂盒说明书加入50 uL待测样本及50 ul显色底液,37℃孵育30 min后加入100 uL终止液,酶标仪405 nm处检测各组OD值,实验重复3次。
(2)qPCR检测各组牙髓细胞成牙本质化相关基因的表达:取生长状态良好的3-5代牙髓细胞,调整细胞密度为5×104个/mL,接种于6孔板内,培养24 h后,随机分为四组分别处理牙髓细胞,隔天换液,分别于第5天及7天提取各组牙髓细胞的总RNA,根据逆转录试剂盒合成cDNA,以cDNA为模板,以GAPDH为内参,通过qPCR分析各组牙髓细胞DSPP、BSP、ALP的RNA相对表达量。引物由上海生工生物工程有限公司合成,具体引物序列见表1。

表1 qPCR基因引物序列
7.统计学分析
采用SPSS26.0软件对各组数据,进行单因素方差分析及t检验(检验水准α=0.05,P<0.05表明有统计学差异),Graphpad Prism5进行绘图。
结 果
1.牙髓细胞体外分离、培养及鉴定结果
(1)牙髓细胞体外分离、培养结果:分离的牙髓组织通过改良组织块酶消化法接种24h后,倒置显微镜下可观察到有散在的细胞贴壁生长(图1①),3天后可以观察到有细胞从组织块周围爬出,以组织块为中心,呈放射状生长,细胞形态均一,呈长梭形,有突起,细胞核呈圆形,居中(图1②);7天后细胞逐渐融合,即可生长至培养瓶底的80%(图1③);传代后2代细胞镜下可见细胞形态呈成纤维细胞样,较均一,呈放射状或者漩涡状生长(图1④)。
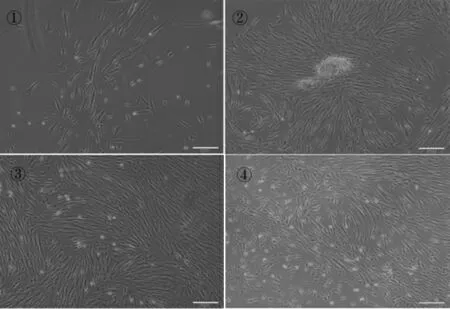
图1 hDPCs形态观察( ×100)
(2)人牙髓细胞鉴定结果:流式细胞仪检测结果:培养的hDPCs间充质干细胞表面标记物CD44(94.07%)表达呈阳性,造血干细胞表面标志物CD34(0.35%)表达呈阴性,表明所培养的牙髓细胞具有间充质干细胞特性,见图2。

图2 流式细胞仪检测hDPCs表面标记物
2.BMP-2、iRoot BP Plus对牙髓细胞增殖影响的结果
各组细胞贴壁后生长状态稳定,A组牙髓细胞生长曲线呈“S”形,接种后3天进入对数生长期,7天后进入平台期,细胞生长状态良好;诱导1天后,各组细胞OD值比较无明显差异(P>0.05);诱导3天后,B、C、D组OD值均高于A组OD值,差异具有统计学意义(P<0.05),其中C组OD值最高,差异具有统计学意义(P<0.05),B组与D组之间无明显差异(P>0.05);诱导5天后,各组细胞增殖较快,B、C、D组OD值均高于A组,差异具有统计学意义(P<0.05),其中C组OD值最高,B组与D组之间无统计学差异(P>0.05);诱导7天后,各组细胞增殖速度减缓,各组之间均有明显差异(P<0.05),其中C组OD值最高,其次依次是D组、B组,A组OD值最低,见图3。

图3 CCK8检测细胞增殖曲线
3.BMP-2、iRoot BP Plus对牙髓细胞分化影响的结果
(1)碱性磷酸酶(ALP)活性检测结果:诱导7天及第14天时,B、C、D组ALP活性均高于A组,其中C组最高,D组次之,最后是B组,差异具有统计学意义(P<0.05),同时第14天较第7天相比各组ALP活性均上调,见图4。

图4 ALP活性检测
(2)qPCR检测各组牙髓细胞成牙本质化相关基因表达的结果:诱导5天时,与A组相比除BSP基因相对表达量无明显差异外(P>0.05),ALP、DSPP基因mRNA相对表达量均提高,其中C组显著高于B、D组,D组高于B组,差异具有统计学意义(P<0.05);诱导7天时,各组基因表达均上调,各实验组DSPP、ALP、BSP基因mRNA相对表达量均高于A组,其中C组高于B、D组,D组高于B组,差异具有统计学意义(P<0.05),见图5。
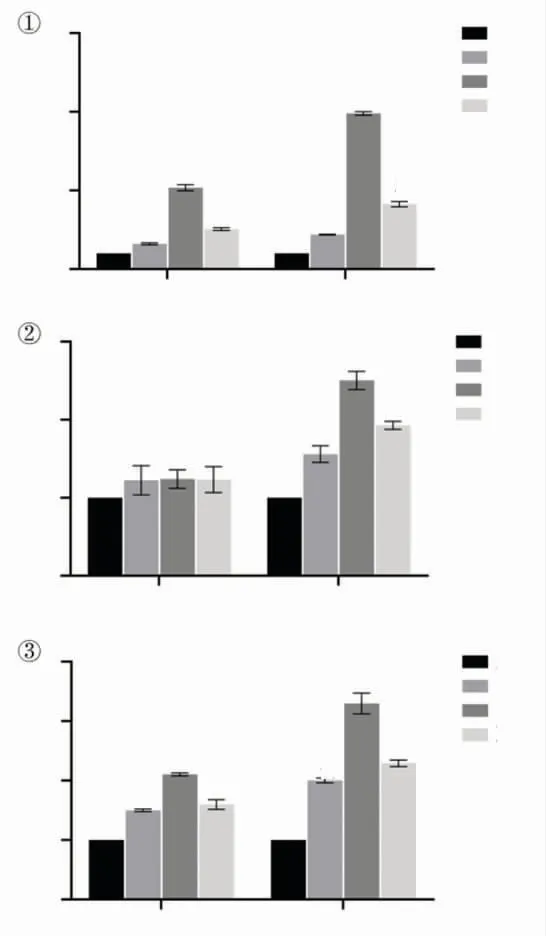
图5 qPCR检测各组牙髓细胞第5天及第7天(①)ALP,(②)BSP,(③)DSPP的相对表达量
讨 论
活髓保存的目的是保护牙髓,促进具有正常生理功能的牙髓-牙本质复合体的形成,维持牙齿的稳定。牙髓-牙本质复合体起源于胚胎时期的外胚间充质,主要由成牙本质细胞组成,不仅可以修复硬组织,还可以修复牙髓本身的软组织,包括血管生成和神经源性修复[8]。有研究表明iRoot BP Plus可促进暴露牙髓部位钙桥的形成,并促进人牙髓细胞增殖,在生物相容性方面与MTA相似甚至更高[8~10]。BMP-2也可促进人牙髓干细胞的增殖,并影响其早期向成骨细胞/成牙本质细胞的分化,在修复过程中的不同部位和阶段均有不同的表达量[11~14]。同时BMP-2还可与其他诱导因子发挥协同作用,刘彩宏等人[15]发现BMP-2与生长因子TGF-β1联合后可提高人牙周膜干细胞中成骨相关基因Runx2、ALP、OCN的蛋白及mRNA表达量;陆彦玲等人[16]发现BMP-2与糖皮质激素地塞米松联合后可明显促进牙髓细胞的增殖,提高相关基因ALP、DSPP、DMP-1 mRNA相对表达量。那么BMP-2是否可以联合iRoot BP Plus在牙髓细胞增殖分化过程中起到作用呢?因此,我们设计并进行了此次研究。
本研究通过BMP-2、iRoot BP Plus、BMP-2与iRoot BP Plus联合作用于牙髓细胞,经CCK-8细胞增殖检测发现,诱导第1天时各组牙髓细胞OD值之间无明显差异,第3、5、7天时C组OD值均高于其它各组,其中第3天、第5天时B组与D组之间无明显差异,第7天时D组OD值明显高于B组OD值,我们可以得出结论:BMP-2、iRoot BP Plus均能促进牙髓细胞增殖,且BMP-2促进作用优于与iRoot BP Plus,两者联合后可能起到协同作用,较单独使用BMP-2或者iRoot BP Plus更能促进人牙髓细胞增殖。关于BMP-2、iRoot BP Plus可对牙髓细胞增殖起到促进作用的结果与大多数研究[15~18]相一致,同时有研究指出iRoot BP Plus由于其低细胞毒性的原因随着诱导时间延长可能对牙髓细胞增殖产生影响[19],这有可能是导致本研究中第7天时D组OD值明显高于B组OD值的原因。
碱性磷酸酶(alkaline phosphatase,ALP)在羟磷灰石晶体的形成过程中具有重要的作用,是参与牙本质矿化重要的非胶原蛋白之一,其活性在成骨细胞和成牙本质细胞矿化的初始阶段上调,因此ALP可作为牙髓干细胞分化的早期标志物[20,21]。本研究中ALP活性检测结果显示第7天及第14天时,C组ALP活性均高于B组及D组,且D组高于B组,同时第14天较第7天相比各组ALP活性均上调;qPCR结果显示第5天和第7天时C组ALP基因相对表达量最高,其次是D组、B组,且随着诱导时间的延长ALP的相对表达量持续增长,有研究指出ALP在人牙髓干细胞处于分化初始阶段,未表达相关特异性牙本质蛋白时即可检测到,同时ALP表达量的上调与诱导时间的延长及牙髓干细胞的增殖活跃性密切相关[22],这与本研究结果相一致。
牙本质唾液磷蛋白(dentin salivary phosphoprotein,DSPP)是主要的牙本质细胞外基质蛋白,具有高度磷酸化的特性,是成牙本质细胞分化的特异性标记物[23,24]。有研究指出DSPP在牙本质的早期矿化过程中有重要的作用,能够调控牙本质矿化,诱导矿化晶体形成[25]。骨涎蛋白(bone sialoprotein,BSP)是成牙本质细胞/成骨细胞矿化检测的特征性标记物,是参与牙本质矿化重要的非胶原蛋白之一,主要是在成熟的骨组织中呈高表达,是成牙本质细胞/成骨细胞分化晚期的标志性蛋白,因此在诱导早期呈现低表达量[26]。本研究中qPCR结果显示第5天和第7天时C组DSPP基因相对表达量最高,其次是D组、B组,且随着时间的延长各处理组的DSPP基因相对表达量上调,第5天时各实验组BSP基因相对表达量较对照组均无明显差异,但在第7天时三组实验组BSP基因相对表达量均上调,且C组最高,其次依次为D组、B组。以上结果提示BMP-2与iRoot BP Plus联合可诱导牙髓细胞成功向成牙本质细胞分化,促使人牙髓细胞分泌更多的矿化基质,且作用效果较单独使用BMP-2、iRoot BP Plus效果更佳。有研究表明直接应用BMP-2或其下游转录因子的激活因子,可通过上调DSPP基因的表达来增强再生牙本质桥的形成[27]。同时Lu等人[28]也发现应用IRoot BP Plus可明显促进人牙髓干细胞中矿化相关基因DSPP、COL1、BSP、OPN、ALP的表达量,这与本研究结果相一致。
同时郭冕等人[29]研究发现,BMP-2可通过介导MAPK通路和BMP/Smad通路从而促进细胞增殖,并且有研究表明iRoot BP Plus可通过MAPK通路促进骨髓间充质干细胞的骨/牙源性分化[28],那么我们可以有理由推测BMP-2与iRoot BP Plus联合后可通过MAPK通路发挥协同作用,高效诱导人牙髓细胞增殖、分化,但是其中涉及的转录因子等机制有待我们进一步研究探讨。同时本研究中采用的iRoot BP Plus提取物是根据以往查阅的参考文献[30]并加以改良制作,而不是直接应用该材料,所以iRoot BP Plus对牙髓组织的作用效果有待进一步研究。
总之通过本研究发现,BMP-2较iRoot BP Plus在诱导hDPCs增殖、分化方面更具优势;两者联合可发挥协同作用,较单独使用对人牙髓细胞增殖及成牙本质分化有明显促进作用。

