北京黑猪FUBP3和USP43基因多态性与眼肌面积性状的关联分析
侯任达,张 润,牛乃琪,杨 曼,黄晓宇,李慧慧,张龙超*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193; 2.山西农业大学动物科学学院,晋中 030801)
在过去几十年里瘦肉型猪在猪肉消费市场中占有很大的份额,胴体瘦肉率在评价胴体品质方面是一个非常重要的指标,在胴体品质相关的性状中应用广泛[1-2]。然而育种场很难用大样本来测定瘦肉率且猪胴体瘦肉率测定过程复杂,耗时长,成本高。因此,在实际的猪性能测定中一般采用其他相关性强的性状来代替。何志平等[3]通过对杜×长二元杂交仔猪进行分析,发现瘦肉率与眼肌面积的相关系数为0.70,即瘦肉率与眼肌面积之间呈强相关。且通过眼肌面积来估测瘦肉率也可极显著的降低成本[4],所以在瘦肉猪的生产及选育工作中眼肌面积也是非常重要的指标[5]。影响眼肌面积的主要因素包括营养(如饲料的蛋白质含量)、环境、遗传等[6-9]。而遗传被广泛认为是眼肌面积发育的最重要因素,遗传度在0.35~0.47之间[10-12],表明这两个性状可以通过遗传方法进行改良。
远端上游元件结合蛋白属于单链DNA结合家族,家族成员为FUBP1、FUBP2和FUBP3。FUBP3是一种蛋白质编码基因[13]。有研究表明,FUBP3可结合并促进β-肌动蛋白mRNA在成纤维细胞的定位[14],且FUBP3与杜洛克猪的骨骼形成有关[15]。FUBP3是与猪肌肉发育和肉质性状相关的重要候选基因[16],也是影响眼肌面积的候选基因[17]。泛素特异性蛋白酶(USPs)也称去泛素酶,它是最大的泛素酶亚家族[18-19]。其成员USP43可识别并水解泛素C-末端甘氨酸处的肽键,参与多泛素前体及泛素化蛋白的加工[20]。Luo等[21]发现,USP43基因内含子内的SNP与多个肉品质性状显著相关。
北京黑猪是20世纪60年代由大白、巴克夏和中国地方猪种杂交形成的地方猪种[22],有着丰富的遗传背景[23]。本研究通过对FUBP3和USP43基因进行突变位点检测,并开展基因型与眼肌面积性状(5~6肋眼肌面积和最后肋眼肌面积)的关联分析,以期为今后北京黑猪眼肌面积性状的选育工作提供有效的分子辅助标记。
1 材料与方法
1.1 组织样品及表型数据收集
通过硫酸纸记录408头北京黑猪的5~6肋眼肌面积及最后肋眼肌面积轮廓,用联想M700扫描仪以300像素进行扫描,随后用PS2020选中眼肌面积轮廓所得到的像素值除以标准像素值即可算出实际眼肌面积。其中北京黑猪中所有公猪均被阉割,母猪占比53%,公猪占比47%。屠宰随着商业生产进行,170~280日龄,动物均饲养于北京黑六牧业科技有限公司。
1.2 DNA提取
用DNA提取试剂盒(QIAamp DNA Mini Kit)从组织样品中提取基因组DNA,随后通过超微分光光度计(IMPLEN)检测其DNA浓度,用2%的琼脂糖凝胶进行DNA质量评估并将质量合格的DNA样品放于-20 ℃保存。
1.3 RNA提取及cDNA的合成
对组织样品进行研磨,通过RNA提取试剂盒(TaKaRa MiniBEST Universal RNA Extraction Kit)按照说明书步骤进行RNA提取,随后通过超微分光光度计(IMPLEN)检测其RNA 浓度。对于合格的RNA,用反转录试剂盒(PrimeScript RT reagent Kit)按说明书步骤进行反转录,并对合格后的样品保存备用。
1.4 引物设计及聚合酶链式反应(PCR)
利用Primer Premier 5.0对FUBP3(NC_010443.5)、USP43(NC_010454.4)基因共设计43对引物,引物设计后由北京六合华大基因科技有限公司合成,部分引物见表1。
对408头北京黑猪使用96孔板采用25 μL反应体系进行PCR扩增,反应体系如下:2×Phanta Max Buffer 12.5 μL,聚合酶0.5 μL, DNA 1 μL,dNTP 0.5 μL,上、下游引物各 1 μL, RNase-free水 8.5 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,57~62 ℃退火30 s,72 ℃延伸30~90 s,35个循环;72 ℃延伸2 min。PCR产物琼脂糖凝胶电泳检测后送至北京六合华大基因科技有限公司平台进行双向Sanger测序。
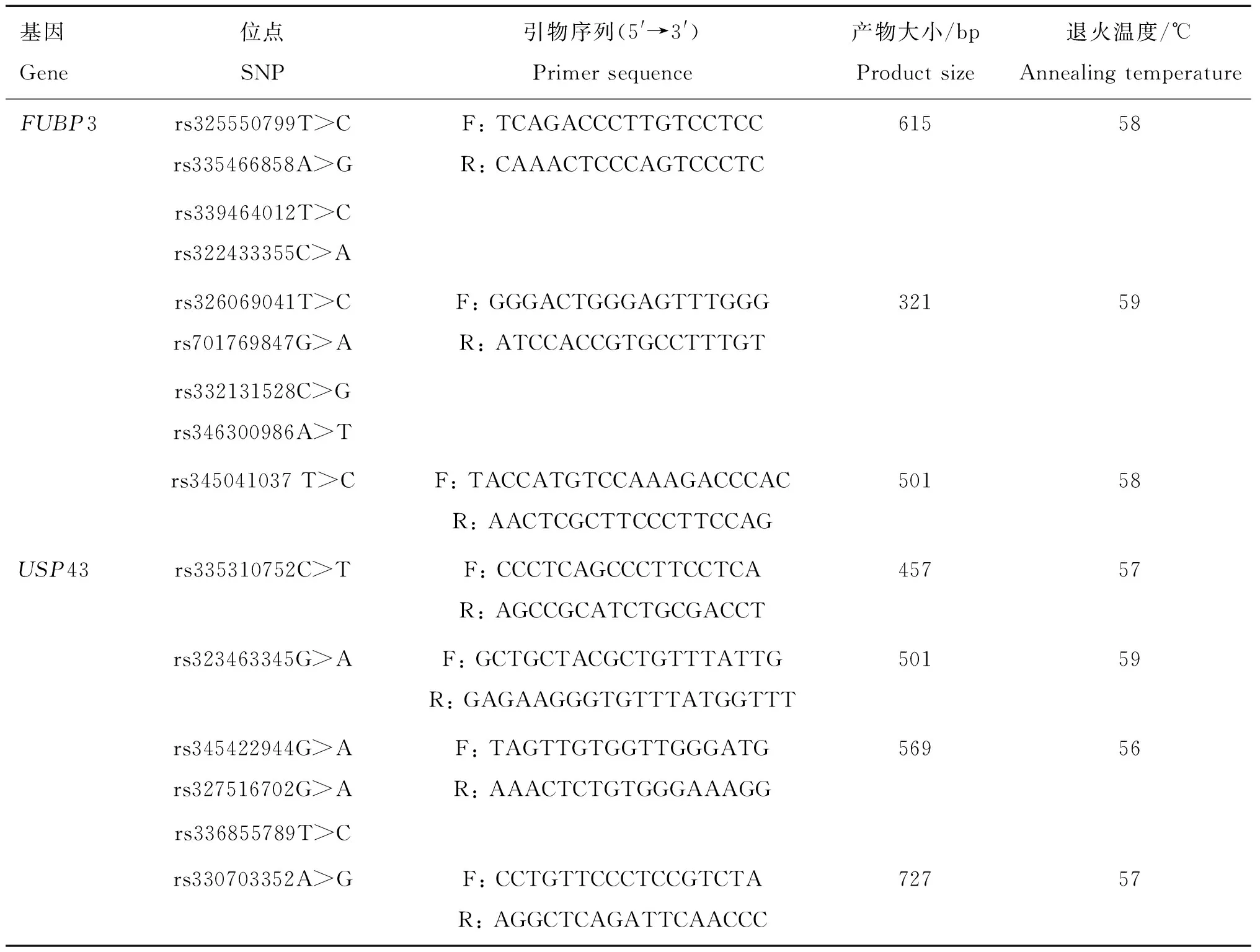
表1 PCR引物信息
1.5 引物设计及荧光定量PCR
利用Primer Premier 5.0对FUBP3的 rs701769847G>A位点和USP43的 rs323463345G>A位点共设计2对引物,引物设计后由北京六合华大基因科技有限公司合成,引物见表2。
取反转录后的cDNA,采用荧光定量试剂盒(TaKaRa TB Green)进行定量。以GAPDH基因为内参,用FUBP3及USP43基因定量引物分别扩增FUBP3和USP43的基因片段。每个样品设3个重复,20 μL反应体系:2×qPCR Mix 10.4 μL,上下游引物共0.8 μL,cDNA 2 μL,RNase-free ddH2O 6.8 μL。PCR反应条件为:95 ℃,30 s为模板的预变性阶段;95 ℃ 5 s,60 ℃ 34 s,共40个循环为模板的扩增阶段;60~95 ℃,以每10 s缓慢升温0.5 ℃建立熔解曲线阶段。
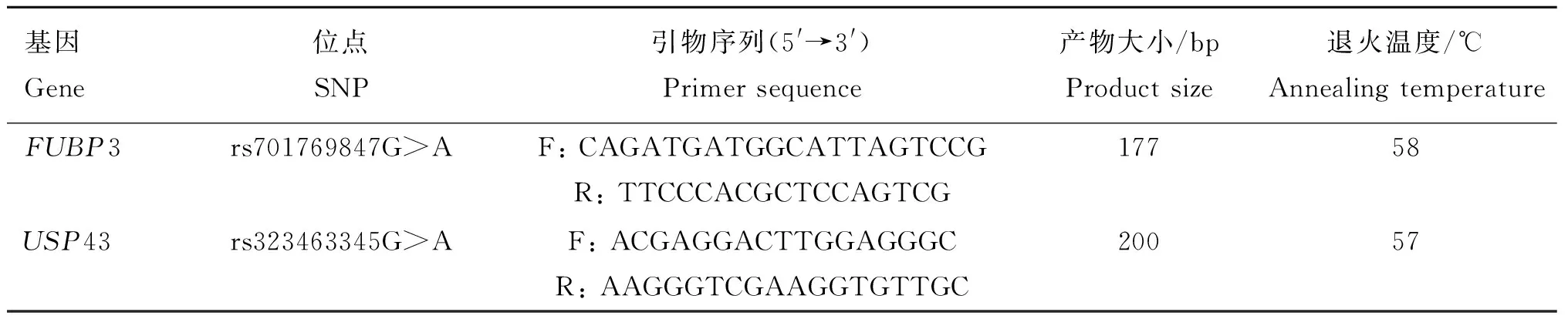
表2 RT-qPCR引物信息
1.6 数据统计分析
将测序结果使用DNAStar中的SeqMan进行比对分析,筛选突变个体的基因型。随后利用Microsoft Excel 2016软件进行各位点的等位基因频率和基因型频率的统计。使用SAS 9.4分析眼肌面积性状(5~6肋眼肌面积和最后肋眼肌面积)和基因型的关联性,采用Duncan’s多重检验用于评估不同基因型之间差异的显著性,数据使用“最小二乘均值±标准差”表示,P<0.05判定为差异显著。
2 结 果
2.1 表型数据整理
对408头北京黑猪的5~6肋眼肌面积和最后肋眼肌面积进行分析,发现最后肋眼肌面积均值大于5~6肋眼肌面积。其中5~6肋眼肌面积均值为17.63 cm2,最大值为30.48 cm2,最小值为10.45 cm2。最后肋眼肌面积均值为31.41 cm2,最大值为49.15 cm2,最小值为19.64 cm2(表3)。
2.2 FUBP3和USP43基因多态性检测及群体分布
通过对FUBP3及USP43基因进行PCR扩增后共发现15个突变位点(表4和表5),分别位于启动子区、CDS和剪切区。其中FUBP3中有8个启动子区域突变和1个同义突变;USP43基因中有1个启动子区域突变,1个错义突变,1个剪切区突变和3个同义突变。这15个SNPs的基因型频率变化范围为1%~88%,其等位基因频率变化范围为6%~94%。
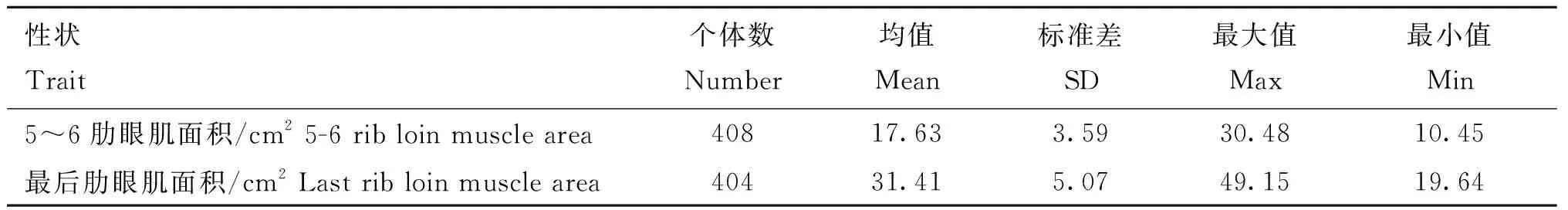
表3 5~6肋眼肌面积和最后肋眼肌面积性状的表型值统计
2.3 FUBP3、USP43基因多态性和眼肌面积性状的关联分析
将FUBP3和USP43基因通过PCR扩增筛选的11个SNPs位点(FUBP3上8个启动子区突变;USP43上1个启动子区突变,1个错义突变,1个剪切区突变)与北京黑猪的5~6肋眼肌面积和最后肋眼肌面积与基因型的关联分析结果见表6、表7。FUBP3的8个启动子区突变中rs701769847G>A与5~6肋眼肌面积和最后肋眼肌面积都显著关联,rs325550799T>C、rs339464012T>C和rs326069041T>C与最后肋眼肌面积关联显著,与5~6肋眼肌面积关联不显著,rs332131528C>G与5~6肋眼肌面积显著相关,与最后肋眼肌面积不相关,其余3个(rs335466858A>G、rs322433355C>A、rs346300986A>T)与5~6肋眼肌面积和最后肋眼肌面积关联均不显著。在USP43上位于启动子区rs335310752C>T和剪切区突变rs323463345G>A与最后肋眼肌面积关联显著,与5~6肋眼肌面积关联不显著,错义突变 rs330703352A>G与5~6肋眼肌面积和最后肋眼肌面积关联均不显著。
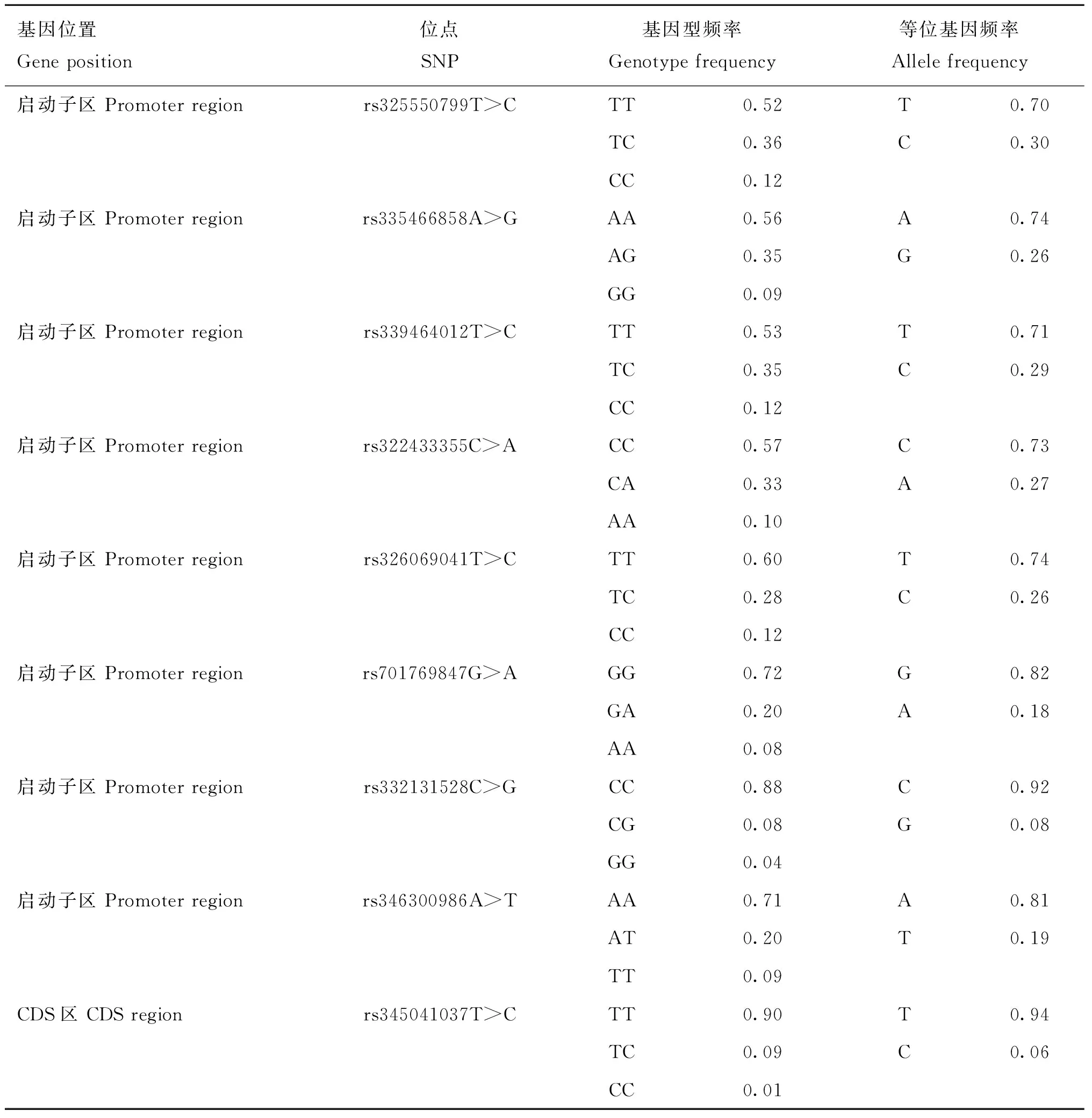
表4 北京黑猪FUBP3的基因型频率及等位基因频率统计
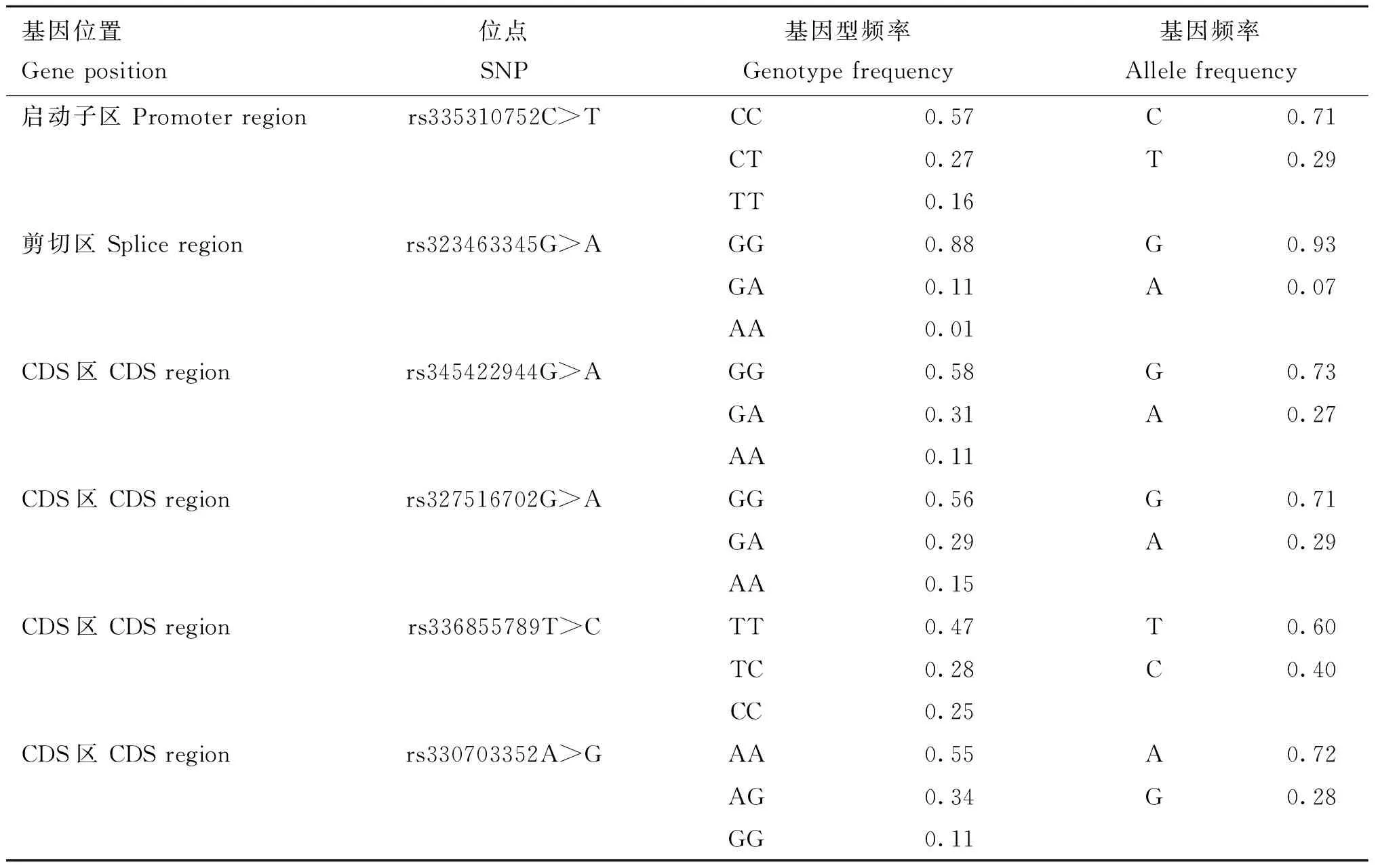
表5 北京黑猪USP43的基因型频率及等位基因频率统计
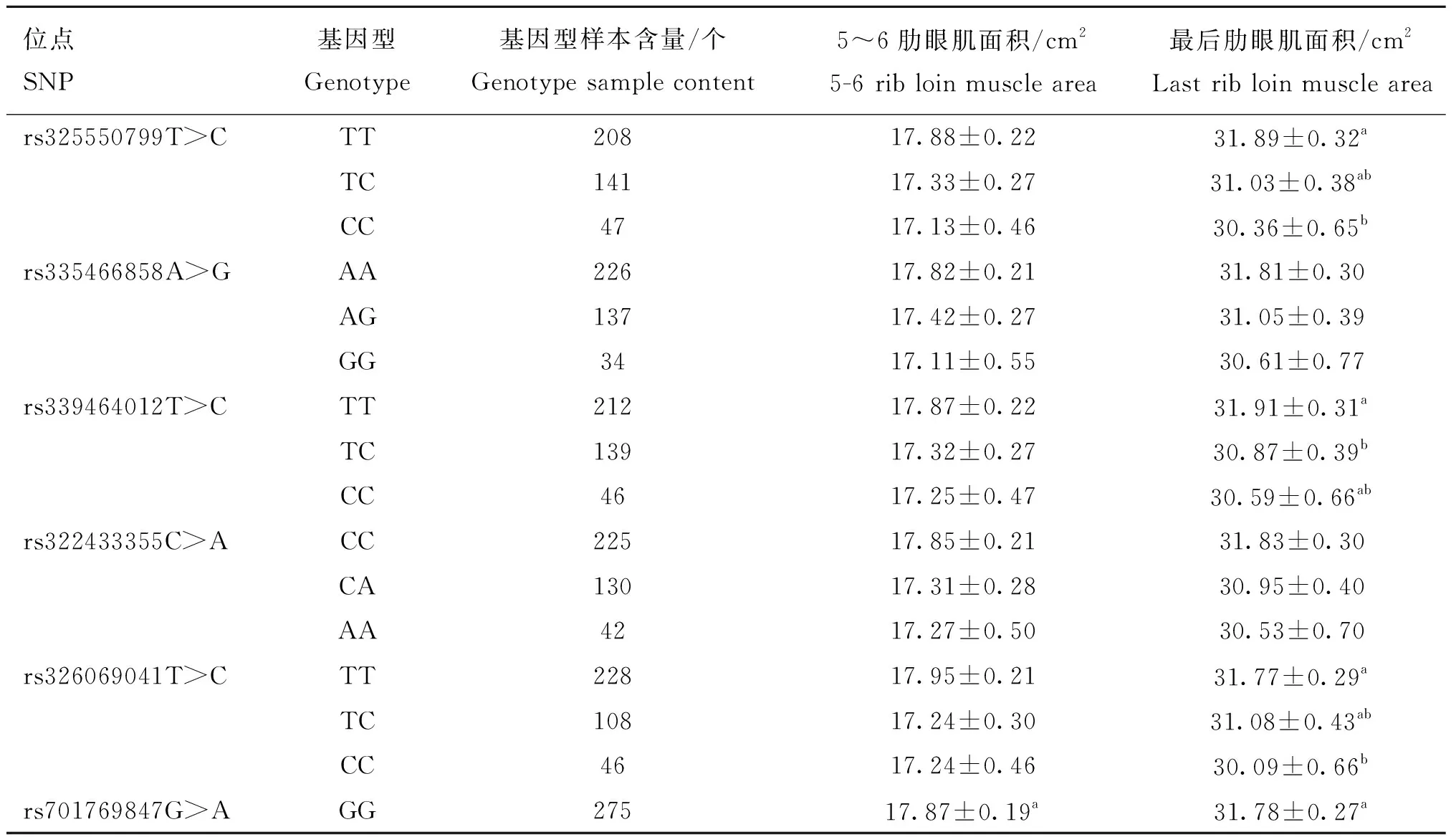
表6 FUBP3基因SNPs与5~6肋眼肌面积和最后肋眼肌面积性状的关联分析
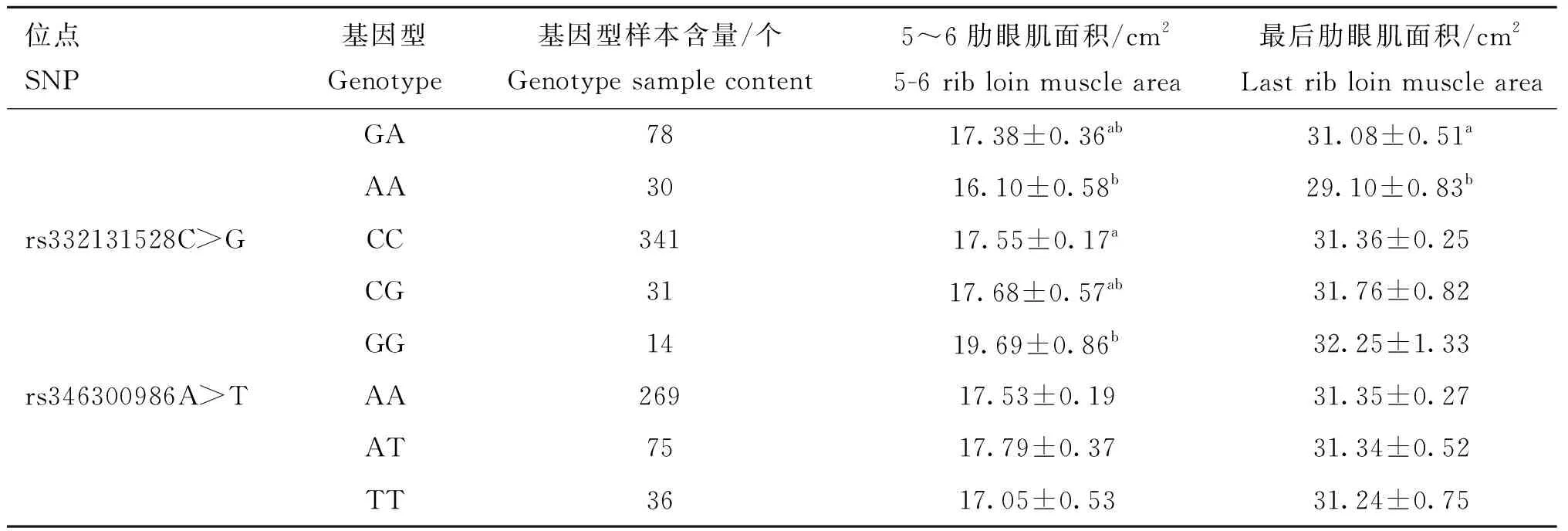
(转下页 Carried forward)
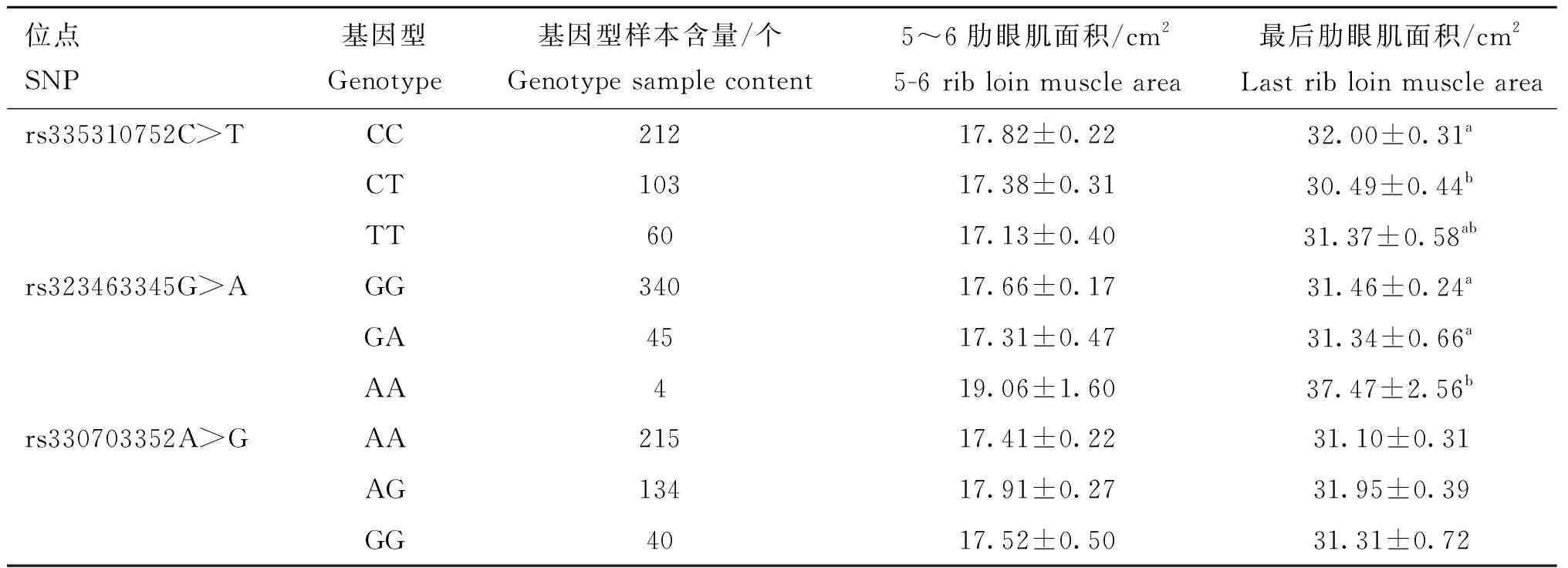
表7 USP43基因SNPs与5~6肋眼肌面积和最后肋眼肌面积的关联分析
2.4 FUBP3 rs701769847G>A位点和USP43 rs323463345G>A位点基因表达差异分析
根据rs701769847G>A位点基因型的不同分为眼肌面积较大的GG型和较小的AA型北京黑猪个体,随后利用RT-qPCR技术检测了FUBP3基因在4头GG型个体和4头AA型个体中的表达情况。定量结果显示,AA基因型个体的FUBP3表达量显著高于GG型个体(P<0.05),见图1。
根据rs323463345G>A位点基因型的不同分为眼肌面积较大的AA型和较小的GG型北京黑猪个体,随后利用RT-qPCR技术检测了USP43基因在3头AA型和5头GG型个体中的表达情况。定量结果显示,USP43基因在GG型和AA型个体中差异不显著,见图2。
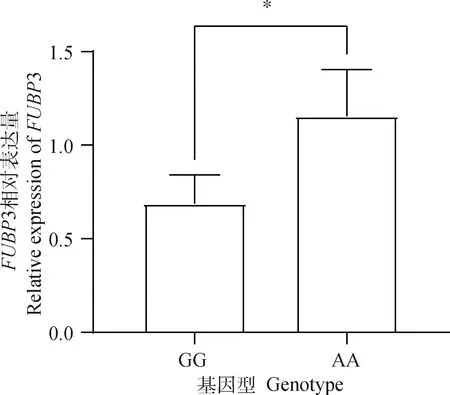
*. P<0.05。下同*. P<0.05. The same as below图1 FUBP3基因相对表达量Fig.1 Relative expression of FUBP3 gene
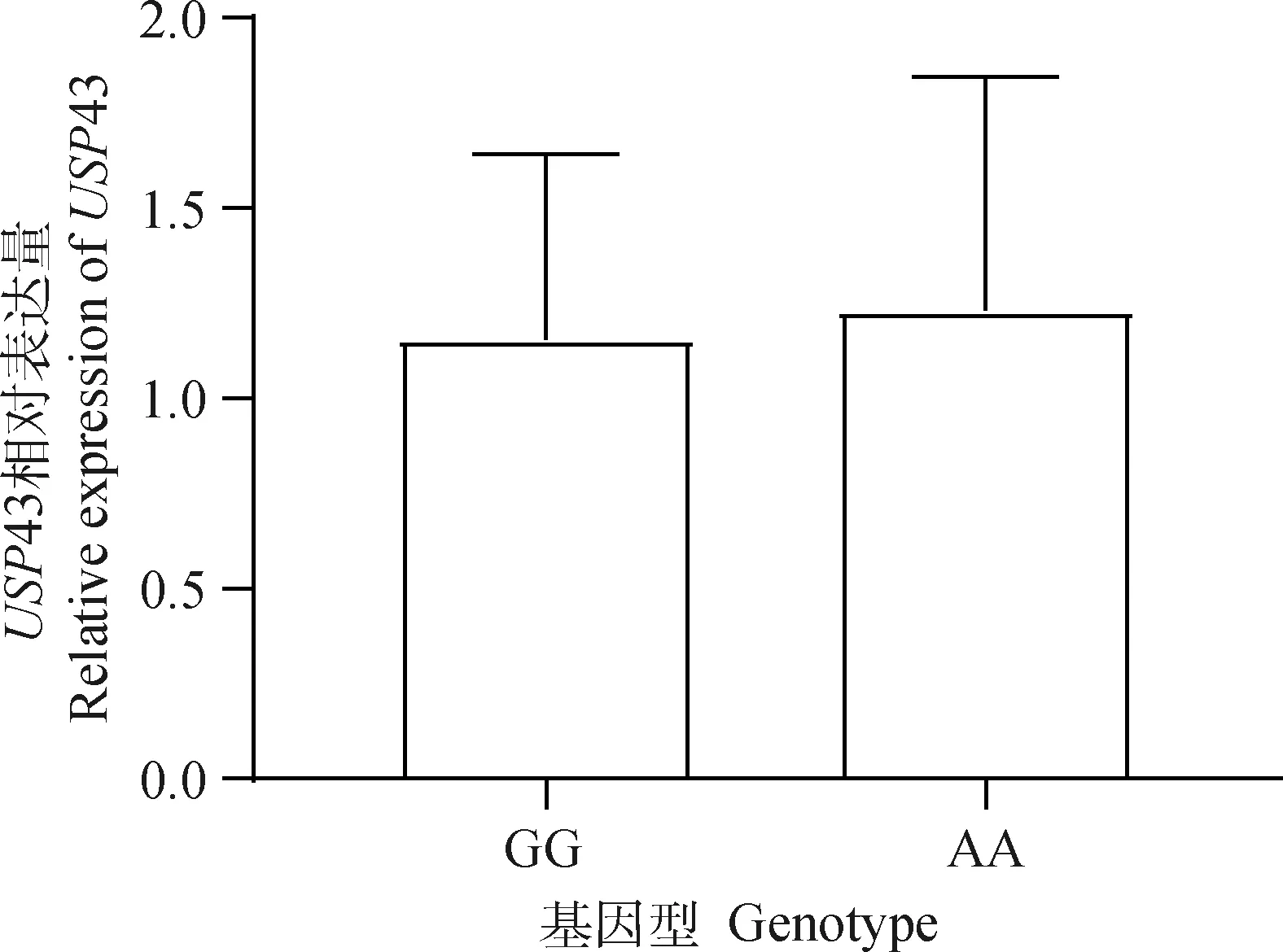
图2 USP43基因相对表达量Fig.2 Relative expression of USP43
3 讨 论
眼肌面积在决定胴体瘦肉率方面起着重要作用[24],且遗传是影响眼肌面积最主要的因素[1],所以在遗传层面的研究是非常有必要的。Rohrer和Keele[25]研究发现,SSC1上的QTL对眼肌面积有显著影响。有研究表明,通过全基因组关联分析发现SSC1上的FUBP3是影响眼肌面积性状的候选基因[17]。Wang等[26]通过对中国青峪猪和长白猪进行DNA甲基化分析发现FUBP3被鉴定为可能与肉质性状相关的候选基因。FUBP3也有促进细胞增殖的作用,Brauckhoff等[27]研究发现FUBP3可加快肝癌细胞的增殖,且它在肝癌细胞中的高水平表达与患者存活率的下降显著相关。FUBP3的结合基序(UAUA/UAUG)最近已被确定[28],而该基序存在于β-actinmRNA 下游460 nt 的3′UTR,包含该基序的79 nt区域被FUBP3结合。Mukherjee等[14]研究也表明,FUBP3的敲除会导致β肌动蛋白的增加。而β肌动蛋白是肌肉细丝及细胞骨架微丝的主要成分,与细胞生长和细胞迁移有关[29-32]。根据上述报道推测,FUBP3可能通过调控β肌动蛋白从而调控肌肉细胞的生长。本研究在北京黑猪群体中对FUBP3基因的8个位点与眼肌面积性状(5~6肋眼肌面积和最后肋眼肌面积)进行关联分析,结果发现rs701769847G>A位点与5~6肋眼肌面积和最后肋眼肌面积都显著相关,rs325550799T>C、rs339464012T>C和rs326069041T>C位点与最后肋眼肌面积显著关联,但与5~6肋眼肌面积相关不显著,而rs332131528C>G位点与5~6肋眼肌面积关联显著,与最后肋眼肌面积关联不显著,rs335466858A>G、rs322433355C>A、rs346300986A>T位点则对5~6肋眼肌面积和最后肋眼肌面积无显著影响。基因表达差异分析表明,rs701769847G>A中FUBP3基因mRNA水平GG基因型个体显著低于AA基因型个体(P<0.05)。
泛素特异性蛋白酶(USPs)在肿瘤形成和发展中具有重要作用。之前的研究表明,USP43在乳腺癌中是一种H2BK120脱泛素酶和潜在的肿瘤抑制因子,USP43和EGFR/PI3K/AKT之间相互抑制,从而抑制乳腺癌的发生[33]。此外,USP43可以通过调节乳腺癌的细胞周期和EMT过程来促进肿瘤发生[34]。USP43基因在一些癌症类型中高表达,如骨肉瘤[35]和结直肠癌[20]。许多USP成员参与肌肉的形成与发育[36],比如USP15参与调节SLIM1的转录翻译,从而调控心肌的肥大反应,这在肌病和心肌病的发病机制中发挥了重要作用[37]。USP14在骨骼肌萎缩的情况下可以被诱导到高水平[38],USP2亚型的过量表达可以调节肌肉细胞的分化进程[39]。USP19在啮齿动物萎缩肌肉中的mRNA表达量增加[40],而USP19缺失会导致主要的肌原纤维蛋白水平增加[41]。虽然目前没有文献直接报道USP43对于肌肉发育形成的作用机制,但是已经有研究发现USP43基因也是影响多个肉品质性状(肌内脂肪、大理石纹、水分,肉色等)的候选基因[21]。从而推测,USP43能促进肌肉的生长发育。本研究在北京黑猪群体中对USP43基因的3个位点与眼肌面积性状(5~6肋眼肌面积和最后肋眼肌面积)进行关联分析,结果发现rs335310752C>T和rs323463345G>A与最后肋眼肌面积显著关联,与5~6肋眼肌面积相关不显著。而rs330703352A>G与5~6肋眼肌面积和最后肋眼肌面积均相关不显著。基因表达差异分析表明,rs323463345G>A中GG和AA基因型个体的USP43基因mRNA水平差异不显著。
4 结 论
通过使用408头北京黑猪对FUBP3和USP43基因进行多态性探索及与眼肌面积性状关联分析,共发现15个SNPs,其中FUBP3、USP43上共有2个位点与5~6肋眼肌面积显著相关,6个位点与最后肋眼肌面积显著相关,其中FUBP3 rs701769847G>A中FUBP3基因mRNA水平GG基因型个体显著低于AA基因型个体(P<0.05)。以期探索调控性状变异的候选基因功能位点,为进一步阐释性状变异的遗传机理奠定基础。

