调控miR-181d-5p表达对宫颈癌细胞增殖、凋亡、侵袭的影响
仝亚坤,赵丹丹,安国静
(1.河北省石家庄市第三医院妇产科,河北 石家庄 050011;2.河北省石家庄市第四医院妇产科,河北 石家庄 050035;3.河北中石油中心医院妇产科,河北 廊坊 065000)
宫颈癌是全世界女性常见的癌症,随着预防和治疗概念和知识的发展迅速,人类乳头瘤病毒(human papilloma virus,HPV)已被确定为导致宫颈癌的主要因素[1-2]。虽然在大多数宫颈癌病例中发现了HPV感染[3],但疾病进展需要遗传和表观遗传学改变, DNA甲基化和组蛋白修饰引起的表观遗传改变在宫颈癌中已被广泛研究,非编码RNA,尤其是microRNA也在宫颈癌的发生发展中发挥重要作用[4-5]。MiR-181d是一种对肿瘤具有调控作用的microRNA,可通过调节胞内磷脂酰肌醇激酶(intracellular phosphatidylinositol kinase,PI3K)/苏氨酸蛋白激酶(threonine protein kinase,AKT)途径抑制胃癌细胞增殖和转移[6],还可以通过调节KNAIN2基因的表达对胰腺癌的发生起抑制作用[7],同时也可以通过调控IGF1/PI3K信号通路对胶质瘤细胞周期发挥干预作用[8]。由此可见miR-181d是多种肿瘤的分化、增殖、凋亡调控的重要调控分子,但其在宫颈癌中的作用尚不清晰。细胞硫酰化限速酶(sulfation rate-limiting enzyme,PAPSS2)/蛋白聚糖(proteoglycans,VCAN)是调控肿瘤细胞迁徙的重要信号通路,PAPSS2基因的甲基化/羟甲基化修饰也与宫颈癌的总体生存率显著相关[9], VCAN也可以作为癌症的独立风险预测标志物[10], miR-181d是否可以通过PAPSS2/VCAN信号通路对宫颈癌细胞发挥调控作用有待深入研究,因此本研究拟通过细胞实验探究转染miR-181d-5p对宫颈癌增殖、凋亡和侵袭的影响,分析是否会引发PAPSS2/VCAN表达的变化,并通过裸鼠荷瘤实验在体内证实miR-181d-5p对宫颈癌生长的影响,为miR-181d-5p在宫颈癌细胞中发挥的作用提供分子机制和理论基础。
1 材 料 与 方 法
1.1材料 人宫颈癌细胞系Hela购自国家模式与特色实验细胞资源库/国家科技资源共享服务平台(上海)。8周龄雌性SPF级裸鼠20只,(20±2)g,购于中生北动(北京)科技发展有限公司,使用许可证号:SYXK(京)2019-0051,饲养条件为:温度(22±2)℃,湿度(55±5)%,12 h黑暗/12 h光照,自由饮水饮食,适应性饲养1周后随机分组。
1.2主要器材及试剂 MTT Assay试剂盒(Cell Proliferation)(ab211091)、Annexin V-FITC Apoptosis Staining/Detection Kit(ab14085)购于美国abcam公司;Lipofectamine TM 3000 Reagent转染试剂购自于美国Thermo Fisher Scientific 公司;miR-181d-5p质粒及NC 质粒由吉玛基因有限公司合成;细胞培养皿等试验耗材购于美国BD公司,倒置显微镜购于德国蔡司公司;Western blot电泳仪器购自美国BIO-RAD公司;流式细胞分析仪FACS Calibur购于美国BD公司。
1.3方法
1.3.1细胞培养及质粒转染方法 人宫颈癌细胞Hela细胞培养条件:生长培养基DMEM(gibico,货号:11995040)+10% FBS(gibico 货号: 16000-044)+1% P/S(gibico,货号15140-022);培养条件:空气 95%;CO25%;温度37 ℃,培养密度:1×106cells/培养皿;换液及传代:每隔1 d更换培养液,2~3 d传代,传代比例为1∶3~4。转染条件:按照LipofectamineTM 3000说明书对细胞进行转染NC质粒和miR-181d-5p质粒,转染6~8 h后更换完全培养基,CO25%;温度 37 ℃培养。人宫颈癌细胞Hela细胞分为对照组、NC组和miR-181d-5p组。
1.3.2裸鼠荷瘤 将处于对数生长期的人宫颈癌细胞Hela以PBS调整细胞密度为1×107个/mL的细胞悬液。将细胞悬液用1 mL无菌注射器接种于20只裸鼠左侧背部皮下,每只裸鼠注射0.2 mL。随机分为对照组(n=10)和miR-181d-5p组(n=10)。对照组注射野生型Hela细胞,miR-181d-5p组注射转染miR-181d-5p的Hela细胞,7 d后测量肿瘤体积,建模成功的判断标准:皮下瘤块体积≥0.5 cm3,肿瘤生长达不到标准的进行裸鼠不进入实验,成瘤后每3 d用游标卡尺测量皮下瘤块的长短径,计算瘤体积=长径×短径×短径1/2[11],连续21 d,绘制2组裸鼠肿瘤生长曲线及每只裸鼠肿瘤生长曲线。
1.3.3MTT实验 将消化后的细胞用完全培养基重悬,接种于96孔培养板;细胞密度为103~104个/孔,每孔培养基总量200 mL,37 ℃、5%CO2培养箱中培养。严格按照MTT操作说明进行实验,加入2 g/L的MTT液(50 μL/孔),继续培养3 h,吸出孔内培养液后,加入DMSO液(150 μL/孔),将培养板置于荡器上振荡10 min,使结晶物溶解,酶标仪检测各孔OD值(波长=570 nm),每孔设置3个副孔,进行检测。
1.3.4细胞凋亡实验 将各组细胞用不含乙二胺四乙酸的胰酶消化后, 800 r/min 4 ℃离心5 min收集细胞。用预冷的PBS洗涤细胞2次,800 r/min 4 ℃离心5 min。收集细胞加入100 μL 1×Binding Buffer重悬细胞。严格按照试剂盒要求加入5 μL Annexin V-FITC和10 μL PI Staining Solution,轻轻混匀,反应条件为:避光、室温10~15 min;加入400 μL 1×Binding Buffer,混匀后放置于冰上;样品在1 h内用流式细胞仪检测。
1.3.5Transwell侵袭实验 按照Transwell说明在培养板下室加入300 μL完全培养基(含有FBS的培养基),37 ℃,5 %CO2培养24 h。擦去Matrigel凝胶和聚碳酯膜上表面的细胞,小心取出上室做好标记,用棉签擦去上室面细胞,取2 mL固定液加入孔板,放入Transwell,固定10~15 min,PBS清洗2次,每次5 min;在孔板中加入1 mL染色液,使Transwell浸泡在液体中, 10 min后弃掉染色液,加入1 mL调色液A,加一滴调色液B,温和混匀;用PBS清洗1次,用刀片取下膜,放在载玻片上,加1~2滴封片液,盖上盖玻片,随机选取3个视野进行计数显微镜下观察。
1.3.6Western blot 检测蛋白表达 取出生长对数期的细胞,加入1 mL RIPA提取裂解液制成蛋白提取液,使用BCA法测定蛋白浓度。加入5×SDS的蛋白上样缓冲液煮沸后,用1.5 mL EP管分装后保存于-80 ℃冰箱备用。将样品分别加入不同的泳道进行聚丙烯酰胺凝胶电泳,浓缩胶电压80 V,10 min,分离胶电压120 V,1.5 h, 转至PVDF膜,用5%BSA封闭。加入特异性一抗PAPSS2(1∶3 000,ab155585,abcam,英国),VCAN(1∶5 000,ab177480,abcam,英国),GAPDH(1∶10 000,ab16663,abcam,英国)于4 ℃冰箱过夜。TBST洗膜3次,加入特异性的羊抗兔二抗(1∶2 000),孵育1 h。TBST洗膜3次,采用ECL化学发光液曝光显影,使用photoshop图像分析软件系统进行半定量分析。
1.4统计学方法 应用SPSS 25.0统计软件分析数据。计量资料比较采用两独立样本t检验、单因素方差分析和SNK-q检验。P<0.05 为差异有统计学意义。
2 结 果
2.1miR-181d-a-5p对人宫颈癌细胞Hela细胞活力的影响 与对照组和NC组比较,miR-181d-5p组细胞增殖受到显著抑制,并且随着时间的增加抑制作用进一步增强,差异有统计学意义(P<0.01),NC组与对照组差异无统计学意义(P>0.05)。见表1。
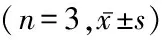
表1 miR-181d-a-5p对人宫颈癌细胞Hela细胞活力的影响Table 1 Effect of miR-181d-a-5p on the viability of human cervical cancer Hela cells
2.2miR-181d-5p对人宫颈癌Hela细胞凋亡的影响 miR-181d-5p对人宫颈癌Hela细胞具有显著的促进凋亡作用,流式结果表明,与对照组和NC组比较,miR-181d-5p组细胞凋亡显著升高,差异有统计学意义(P<0.01),NC组与对照组差异无统计学意义(P>0.05)。见图1,表2。
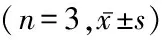
表2 miR-181d-a-5p对人宫颈癌细胞Hela细胞凋亡的影响Table 2 Effect of miR-181d-5p on apoptosis of human cervical cancer Hela cells
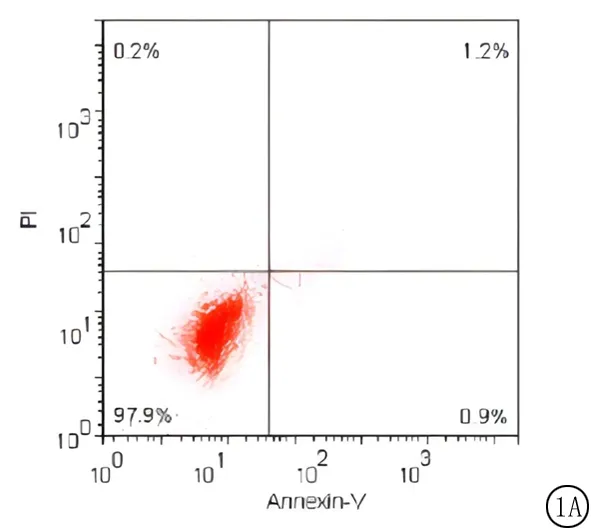
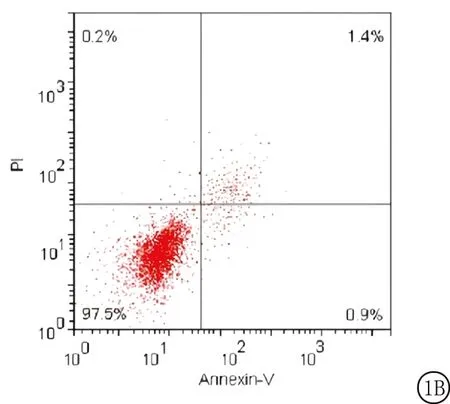
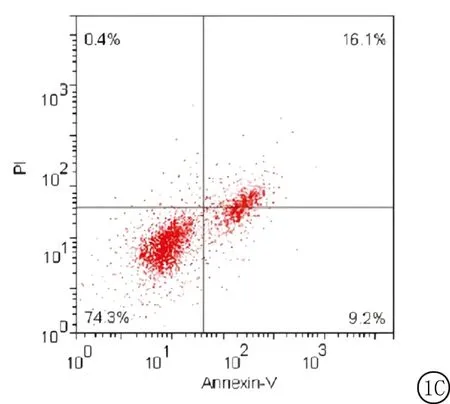
图1 miR-181d-5p对人宫颈癌细胞Hela细胞凋亡的影响
2.3miR-181d-5p对人宫颈癌细胞Hela迁移和侵袭能力的影响 Transwell 结果表明,miR-181d-5p对宫颈癌细胞侵袭具有显著的抑制作用,与对照组和NC组比较, miR-181d-5p组细胞侵袭数量显著降低,差异有统计学意义(P<0.01), NC组与对照组差异无统计学意义(P>0.05)。见图2,表3。
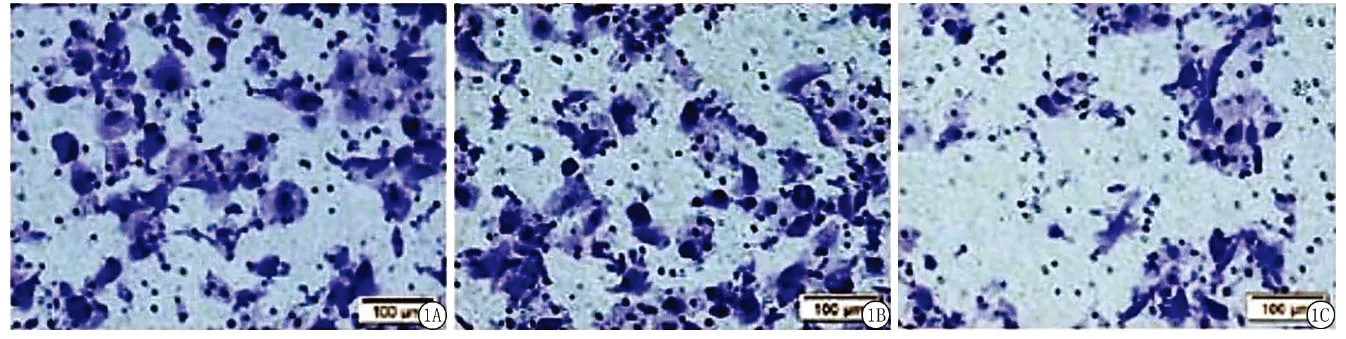
图2 miR-181d-5p对人宫颈癌细胞Hela侵袭能力的影响
表3 miR-181d-a-5p对人宫颈癌细胞Hela细胞侵袭数量的影响Table 3 Effect of miR-181d-a-5p on the invasion number of human cervical cancer Hela cells
2.4miR-181d-5p对人宫颈癌细胞Hela细胞PAPSS2/VCAN信号通路的影响 与对照组和NC组比较,miR-181d-5p组PAPSS2和VCAN蛋白表达均有降低趋势,差异有统计学意义(P<0.01),NC组与对照组差异无统计学意义(P>0.05)。见图3,表4。
2.5miR-181d-5p对裸鼠肿瘤生长的影响 两组裸鼠荷瘤后精神状态均较好、活动频繁、饮食饮水量正常。荷瘤第7天对小鼠进行筛选,各组有5只裸鼠肿瘤体积≥0.5 cm3且大小均一,超肿瘤体积未达到实验标准者未入组本试验。miR-181d-5p组裸鼠肿瘤体积显著低于对照组裸鼠,miR-181d-5p组裸鼠平均生长受到显著抑制,在第21天时肿瘤质量显著低于对照组小鼠,差异有统计学意义(P<0.01)。见表5。
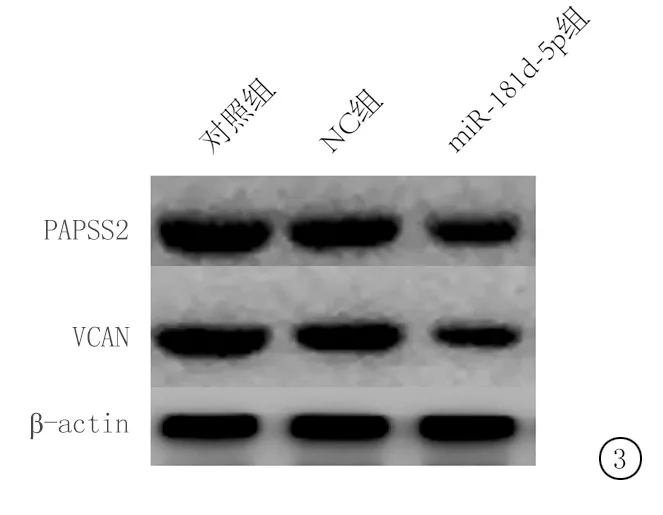
图3 miR-181d-5p对Hela细胞PAPSS2/VCAN蛋白的影响
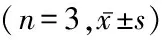
表4 miR-181d-a-5p对人宫颈癌细胞Hela细胞PAPSS2/VCAN信号通路蛋白的影响Table 4 Effect of miR-181d-a-5p on PAPSS2/VCAN signaling pathway proteins of human cervical cancer Hela cells

表5 miR-181d-5p对裸鼠肿瘤生长的影响Table 5 Effect of miR-181d-5p on tumor growth in nude mice
3 讨 论
子宫颈癌是女性癌症死亡的主要原因之一。在世界范围内,子宫颈癌是女性第四常见的恶性肿瘤,估计每年新增53万例,死亡27万例,全世界约85%的宫颈癌死亡发生在不发达国家或发展中国家,低收入和中等收入国家的病死率是发达国家的18倍[12-13]。HPV感染是宫颈癌发生的主要病因。高危型HPV感染和HPV基因组整合到宫颈上皮细胞的宿主染色体是宫颈病变肿瘤进展的关键早期事件[14]。高浸润性宫颈癌发生发展中伴随这基因组和表观基因组的调控,是由高危型HPV引起的,通常先于上皮内瘤变的一个长阶段。在侵袭之前,HPV宿主细胞中发生表观基因组改变,如microRNA表达失调,在肝癌中经常被观察到[15], MiR-181d-5p在多种组织中具有调控作用,如可通过PI3K/AKT途径促进PC12细胞的神经轴突生长[16], 同时miR-181d-5p和miR-409-3p在胶质母细胞瘤中的协同调控作用[17],miR-181d-5p可以通过调控骨保护素抑制破骨细胞的生成[18],但MiR-181d-5p在宫颈癌发生中的机制和作用方式仍不完全清楚。本研究通过人子宫颈癌细胞转染MiR-181d-5p证实,MiR-181d-5p可以抑制子宫颈癌细胞的增殖能力,增加细胞凋亡比例,提示MiR-181d-5p对肿瘤细胞的增殖发生干预和调控作用。
本研究通过Transwell实验证实MiR-181d-5p可以显著抑制肿瘤细胞的侵袭,因此关注了肿瘤细胞侵袭相关的重要信号通路PAPSS2/VACN信号通路在此过程中的变化。PAPSS2在肿瘤细胞的侵袭中发挥重要作用,PAPSS2的升高导致细胞中硫酸化修饰增加,破坏细胞外基质(extracellular matrix, ECM)的内稳定性。不平衡的ECM触发上皮-间充质转化程序并促进细胞迁移和转移[19]。VCAN属于硫酸软骨素蛋白多糖组,是细胞外基质的主要成分之一,通过直接或间接与细胞和分子相互作用,与细胞因子、生长因子、细胞表面和基质蛋白及其蛋白核心形成合适的细胞外微环境,从而诱导肿瘤侵袭和转移,在细胞黏附、存活、增殖、迁移和ECM组装中发挥重要作用[20]。本研究通过Western blot 实验证实,转染miR-181d-5p的细胞 PAPSS2蛋白和VCAN蛋白的表达水平显著降低,提示出宫颈癌胞外基质功能的紊乱,干预了细胞黏附相关的信号通路,从而抑制了肿瘤细胞的侵袭能力。同时通过建立裸鼠荷瘤模型进一步证实了MiR-181d-5p在体内的作用,MiR-181d-5p组小鼠的肿瘤生长显著受到抑制,生长曲线显著低于对照组,并且肿瘤质量降低,提示出MiR-181d-5p对肿瘤生长具有显著的抑制作用,进一步验证了细胞学实验的结论。
综上所述,miR-181d-5p具有抑制子宫颈癌细胞增殖、促进子抑制宫颈癌细胞凋亡及并抑制侵袭的作用,其机制可能与抑制PAPSS2/VCAN信号通路活性相关,本研究将进一步通过临床样本进行验证,探究PAPSS2/VACN蛋白在子宫颈癌组织和癌旁组织的表达,从原位上证实miR-181d-5p对宫颈癌的调控作用,而为临床诊断提供理论基础。

