左旋紫草素抑制NF-κB信号通路保护LPS/D-GalN诱导的小鼠急性肝损伤
侯金秋,邹 楠,袁今奇,杜梦鸽,张 薇,秦冬梅
(1.石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832002;2.石河子大学医学院第一附属医院,新疆 石河子 832002;3.新疆全安药业股份有限公司,新疆 库尔勒 841011)
急性肝损伤(acute liver failure,ALF)是一种致死性临床综合征,其病理特征是广泛的肝细胞坏死、剧烈的氧化应激和持续的炎症反应[1],引起急性肝损伤的因素较多,其中爆发性肝脏炎症是引起肝脏急性衰竭的主要原因[2]。研究表明[3],在ALF发病进程中,全身炎症反应的严重失调是导致大多数患者死亡的主要原因。炎症反应的特征是巨噬细胞的积累和激活[4],在ALF的早期阶段,大量的肝巨噬细胞被激活,通过过度产生促炎细胞因子和介质进一步导致炎症的传播和持续[5],从而加重疾病进程。因此,巨噬细胞的活化和ALF的发展密切相关。
革兰阴性细菌外壁层中的成分脂多糖(lipopolysaccharide,LPS)是一种内毒素,可以诱导激活巨噬细胞活化并与巨噬细胞表面的TLR4受体结合[6],从而进一步激活该受体介导的下游MAPK/NF-κB信号通路,使得NF-κB信号通路中的IKK激酶激活,从而导致IκB蛋白磷酸化,磷酸化的IκB蛋白泛素化降解,使得NF-κB二聚体释放后转移到细胞核中,其中MAPK是NF-κB的上游激动剂,参与调控NF-κB通路的激活[7],NF-κB p65的激活可以进一步促进巨噬细胞分泌细胞炎症因子,从而加重炎症反应,NF-κB p65主要参与炎症和免疫反应的调节。同时研究发现,LPS是肝损伤发病机制中的关键因素,而D-氨基半乳糖(一种特定肝毒素)D-GalN和LPS联合使用时又能加强LPS的急性毒性,因此,使用D-GalN结合LPS可以成功诱导动物肝损伤模型,该模型也与人类肝炎模型非常相似[8]。目前,ALF死亡率高,迫切需要找到有效的药物来改善急性肝损伤和避免严重并发症的产生,研究巨噬细胞引起的炎症反应可能是一种治疗ALF很有前途的治疗策略。
L-SK是从紫草科植物紫草萘醌类成分中提取分离得到的单体化合物,其具有较好的药理作用,包括抗菌、抗炎、抗肿瘤[9-10]等作用,本课题组在前期研究发现L-SK对于ConA诱导的小鼠免疫性肝损伤具有较好的保护作用[11],同时初步判断其有一定的抗炎作用,但对于L-SK的具体抗炎机制尚未阐明。前期研究考察的是免疫性肝损伤,本文探讨的是急性肝损伤,同时本文细胞与动物实验均采用LPS诱导,对于诠释在炎症相关肝损伤更具说服力,因此本研究主要探究左旋紫草素紫草抗炎保肝作用机制。
本研究拟通过建立诱导RAW264.7巨噬细胞炎症模型以及LPS/D-GalN诱导的急性肝损伤模型,从炎症角度进一步阐明L-SK的抗炎保肝作用机制,为其进一步开发提供实验依据。
1 试剂与仪器
1.1 实验动物80只SPF级♂ C57BL/6小鼠(20~22) g,均购自新疆维吾尔自治区实验动物研究中心,生产许可证号:SCXK(新)2016-0001,使用许可证号:SYXK(新)2016-0001,该动物实验在新疆医科大学动物实验中心进行,按照国家实验室动物饲养管理规范饲养,并经石河子大学医学院第一附属医院医学伦理委员会审核批准(批准号为:A2018-047-01)。
1.2 药品与试剂左旋紫草素(110769)购自上海源叶公司;小鼠巨噬细胞株(RAW264.7)(新疆自治区药物研究所惠赠);胎牛血清(FBS)(1828728)、胰酶(2193232)、DMEM Basic培养基(C11995500BT)均购自Gibco;HIFIScript cDNA Synthesis Kit(批号:CW2569M)购自康为世纪;QPCR引物购自生工生物公司;MTT试剂盒(20181224);脂多糖(620V0324)、青霉素-链霉素双抗(10000 u)购自Solarbio公司;TRNzol Universal Reagent试剂(80802)购自Ambion公司;ECL超敏发光液(202003)购自北京普利莱基因技术有限公司;INOS(10120S)、p-ERK1/2(4070T)、p-p38(4511T)、p-JNK(4668T)抗体均购自CST公司,COX-2(BS90326)购自Bioworld;ERK1/2(AM076)、p38(AM065)、JNK(AJ518)、p-p65(042919190703)、p65(031219190718)、p-IKKα/β(111518190703)、IKKα(102318190718)、IKKβ(111617190718)、GAPDH(070320200902)抗体均购自碧云天,山羊抗兔lgG/la辣根酶标记(214120813)购自中杉金桥;D-氨基半乳糖(011421210405)购自Bioworld;水飞蓟宾(H20040299)购自天津天士力圣特制药,MDA(批号20210616)、SOD(批号20210607)、AST(批号20210122)、ALT(批号20210123)、AKP(批号20210115)均购自南京建成生物工程研究所。
1.3 仪器台式离心机(上海安亭科学仪器厂,TDL-50型);旋涡混匀器(江苏海门其林医用仪器厂,TS-8型);电子天平(上海精密科学仪器有限公司,FA210B);分析天平(德国Sartorius赛多利斯,BP211D型);全波长扫描多功能读数仪(赛默飞世尔科技有限公司,3001 型);PCR荧光定量仪(美国罗氏,LightCycler 480);核酸蛋白检测仪(美国QUAWELL公司,Q5000型);凝胶成像系统(美国UVP公司,EC3600型);梯度基因扩增仪(北京大龙,TC1000-G);超净工作台(型号:BCM1300,苏洁医疗器械有限公司),CO2恒温培养箱(型号:3111型,赛默飞世尔科技有限公司)。
2 方法
2.1 动物分组及处理将80只♂ C57BL/6随机分为5组,每组16只,分别为正常组、模型组、L-SK高剂量组(8 mg·kg-1)、L-SK低剂量组(2 mg·kg-1)、阳性药物组(水飞蓟宾60 mg·kg-1),正常对照组、模型组小鼠每天同一时间灌胃生理盐水0.2 mL/只,L-SK高剂量组、低剂量组、阳性对照药1 d1次,连续灌胃14 d。末次给药2 h后,除正常对照组外,其余各组腹腔注射LPS(10 μg·kg-1)和D-GalN(700 mg·kg-1),正常对照组腹腔注射等量生理盐水,使小鼠形成急性肝损伤模型。禁食不禁水,观察小鼠状态,6 h后处死一半小鼠进行采血,解剖取其肝脏、脾脏组织,另一半小鼠用于检测生存率。
2.2 肝脾指数的测定每只实验小鼠处死前进行称重,取出肝脏和脾脏组织,用生理盐水洗净后滤纸擦干,分别称重,记录重量。肝脾指数按照以下公式进行计算: 肝指数/%=肝脏体质量/小鼠体质量×100,脾指数/%=脾脏体质量/小鼠体质量×100%。
2.3 动物相关指标检测造模6 h结束后将小鼠称质量,然后进行眼眶取血,置冰上30 min,3 000 r·min-1离心10 min,分离血清,分装血清置于4 ℃冰箱备用检测。取小鼠肝脏组织0.1 g,用4 ℃冷生理盐水洗净,加10倍量冰冷生理盐水,冰水浴下进行匀浆,然后置于4 ℃冷冻离心机中,以3 000 r·min-1离心10 min,取上清液,存于4 ℃下保存待测。取分装好的血清进行AST、ALT以及AKP酶活性检测,具体操作步骤按照说明书进行;将肝组织匀浆进行蛋白定量后,按照试剂盒说明书检测肝组织匀浆中的NO含量、丙二醛(MDA)含量和总超氧化物歧化酶(SOD)活性。
2.4 肝脏组织HE染色取小鼠肝脏组织,置4%多聚甲醛中固定,用石蜡包埋组织进行切片,常规HE染色观察组织病理学变化。
2.5 细胞处理将RAW264.7细胞分为正常对照组:在37 ℃、5% CO2培养条件下,用含有10%胎牛血清、1%青链霉素的DMEM培养基中培养细胞RAW 264.7细胞;脂多糖组:细胞培养24 h后,加入终浓度为1 mg·L-1LPS继续培养0.5、6、24 h;L-SK组:细胞培养24 h后,先加入50、100、200 μmol·L-1的L-SK溶液预处理30 min,然后加入终浓度为1 mg·L-1LPS继续培养0.5、6 、24 h。
2.6 细胞活性检测取对数生长期的RAW264.7细胞,按照1×105接种于96孔培养板中孵育过夜,弃去培养液,除空白对照组外,其余孔加入含不同浓度L-SK的培养基培养细胞24 h后弃去培养基,加入含10% MTT溶液的新鲜培养基于每孔200 μL,孵育4 h后弃去MTT试剂,每孔加入110 μL DMSO溶解液裂解细胞,于摇床上摇晃10 min后,在波长490 nm处测量吸光度A(λ)490值,按下列公式计算细胞存活率。
存活率/%=(A药物组值/A对照组值)×100%
2.7 NO实验细胞处理中加入终浓度为1 mg·L-1LPS培养24 h后,取100 μL细胞培养上清液与100 μL的Griess 试剂混合。5 min内于550 nm波长处使用酶标仪测量每孔的吸光度(A)值,通过标曲计算各组NO含量。
2.8 实时荧光定量-聚合酶链反应(RT-PCR)检测细胞处理中加入终浓度为1 mg·L-1LPS培养6 h后,按照TRIzol法提取细胞总RNA后,测定RNA浓度,按照反转录试剂盒HIFIScript cDNA Synthesis Kit将RNA反转为cDNA,按说明书于荧光定量PCR仪上检测各组的INOS、COX-2、IL-6、IL-1β、TNF-α以及IFN-β的mRNA表达,反应条件为95 ℃,10 min;95 ℃,15 s;57 ℃,15 s;72 ℃,15 s,扩增45个循环,最终72 ℃延长10 min,该实验数据采用的定量数据分析方法是2-ΔΔCT法,各组引物序列如下[12]:INOS上游:5′- CCCTTCCGAAGTTTCTGGCAGCAG-3′,下游:5′- GGCTGTCAGAGCCTCGTGGCTTTGG-3′,COX-2上游:5′-CACTACATCCTGACCCACTT-3′,下游:5′-ATGCTCCTGCTTGAGTATGT-3′GAPDH上游:5′-AGGAGAGTGTTTCCTCGTCC-3′,下游:5′-TGAGGTCAATGAAGGGGTCG-3′;IL-6上游:5′- CCGGAGAGGAGACTTCACAG-3′,下游:5′-TCCACGATTTCCCAGAGAAC-3′;IL-1β上游:5′-TGCAGAGTTCCCCAACTGGTACA-3′,下游:5′- GTGCTGCCTAATGTCCCCTTG-3′;TNF-α上游:5′-TCAGCCTCTTCTCATTCCTG-3′,下游:5′-TGAAGAGAACCTGGGAGTAG-3′;IFN-β上游:5′- CTGCGTTCCTGCTGTGCTTC-3′,下游:5′- CGCCCTGTAGGTGAGGTTGAT-3′。
2.9 Western blot检测蛋白表达水平细胞处理中加入终浓度为1 mg·L-1LPS培养30 min后,进行蛋白定量后加上样缓冲液,沸水煮沸20 min,即可用于Western blot蛋白检测,常规进行SDS-PAGE凝胶电泳、转膜、封闭后放入一抗中4 ℃过夜孵育,d 2用TBST洗PVDF膜3次后放入二抗孵育1 h后,TBST洗膜3次用凝胶成像系统UVP采集蛋白条带,用ImageJ软件进行定量分析,计算各组目的条带与内参GAPDH的比值,或磷酸化目的蛋白与非磷酸化蛋白的比值来反映目的蛋白的相对表达水平。一抗根据1∶1 000(ERK1/2)、1∶1 000(p-ERK1/2)、1∶1 000(JNK)、1∶1 000(p-JNK)、1∶1 000(p38)、1∶1 000(p-p38)、1∶1 000(INOS)、1∶1 000(COX2)、1∶1 000(p65)、1∶1 000(p-p65)、1∶1 000(p-IKKα/β)、1∶1 000(IKKα)、1∶1 000(p-IKKβ)、1∶2 000(GAPDH)以及1∶5 000(二抗)的稀释比例进行孵育。
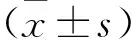
3 结果
3.1 L-SK缓解LPS/D-GalN所致的小鼠急性肝损伤注射完造模药后观察小鼠的状态,结果表明,模型组的24 h生存率为0,L-SK给药组明显提高动物生存率,其中阳性药组和L-SK高剂量组作用明显(Fig 1A)。与正常组相比,模型组小鼠的肝脏、脾脏指数明显增加(P<0.05或P<0.01),说明造模成功。与模型组相比,L-SK低、高剂量组和阳性药组的肝脏指数有所降低,但差异无显著性(P>0.05),而L-SK给药组以及阳性药组均明显降低脾脏系数(P<0.01)(Fig 1B和1C)。小鼠血清转氨酶及AKP酶的异常升高,说明肝脏实质受到损伤,肝脏细胞受损,本研究中,模型组小鼠血清中的AST、ALT及AKP酶均明显增加(P<0.01),其中L-SK各剂量组能明显降低AST、ALT及AKP的活性(P<0.05或P<0.01),阳性药物组均能极明显降低小鼠血清中的AST、ALT及AKP酶活性(P<0.01)(Fig 1D~F)。
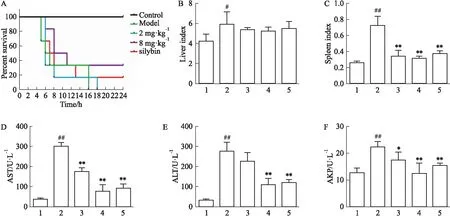
Fig 1 Effect of L-SK on LPS/D-GalN-induced acute liver injury in
3.2 L-SK改善LPS/D-GalN所致急性肝损伤小鼠的肝功能研究发现NO含量可预测肝脏损伤程度,并且MDA含量升高和SOD酶活性降低均表明肝脏组织发生氧化损伤。本研究中LPS/D-GalN诱导的模型组小鼠肝脏组织上清中的NO和MDA含量均明显增加(P<0.01),SOD酶活性明显降低(P<0.01),与模型组相比,L-SK治疗组均能明显降低NO含量(P<0.01)和MDA含量(P<0.05)(Fig 2A和Fig 2B),且呈一定的剂量依懒性,SOD酶的活性明显升高(P<0.01),阳性药物组均能明显降低小鼠肝组织上清中NO含量和升高SOD酶的活性(P<0.01)(Fig 2A和Fig 2C)。此实验结果表明,L-SK通过影响氧化/抗氧化平衡从而对LPS/D-GalN所致急性肝损伤起到保护作用。
通过对小鼠肝脏组织进行HE染色后发现,正常组小鼠肝脏表面光滑、质地坚韧、色泽红润、镜头下观察肝细胞大小均一,结构正常、排列有序、且细胞核位于肝细胞中央,炎症细胞浸润较少,模型组小鼠肝脏组织充血严重,表面粗糙,颜色发暗,为黑红色,镜下观察肝组织结构异常,肝细胞排列紊乱,肝索异常,肝细胞明显变性,胞质内充满小气泡且有明显的红染,炎性细胞浸润明显。L-SK低、高剂量组相较于模型组,其肝组织有所改善,尤其是高剂量组,肝细胞排列比较均匀,肝细胞胞质均匀且间隔变窄,炎性浸润明显减轻,阳性药相对于模型组也具有明显改善,其肝脏细胞的形态基本正常,炎性浸润程度明显减轻,细胞间隙也较窄,有轻微的肿胀(Fig 2D)。
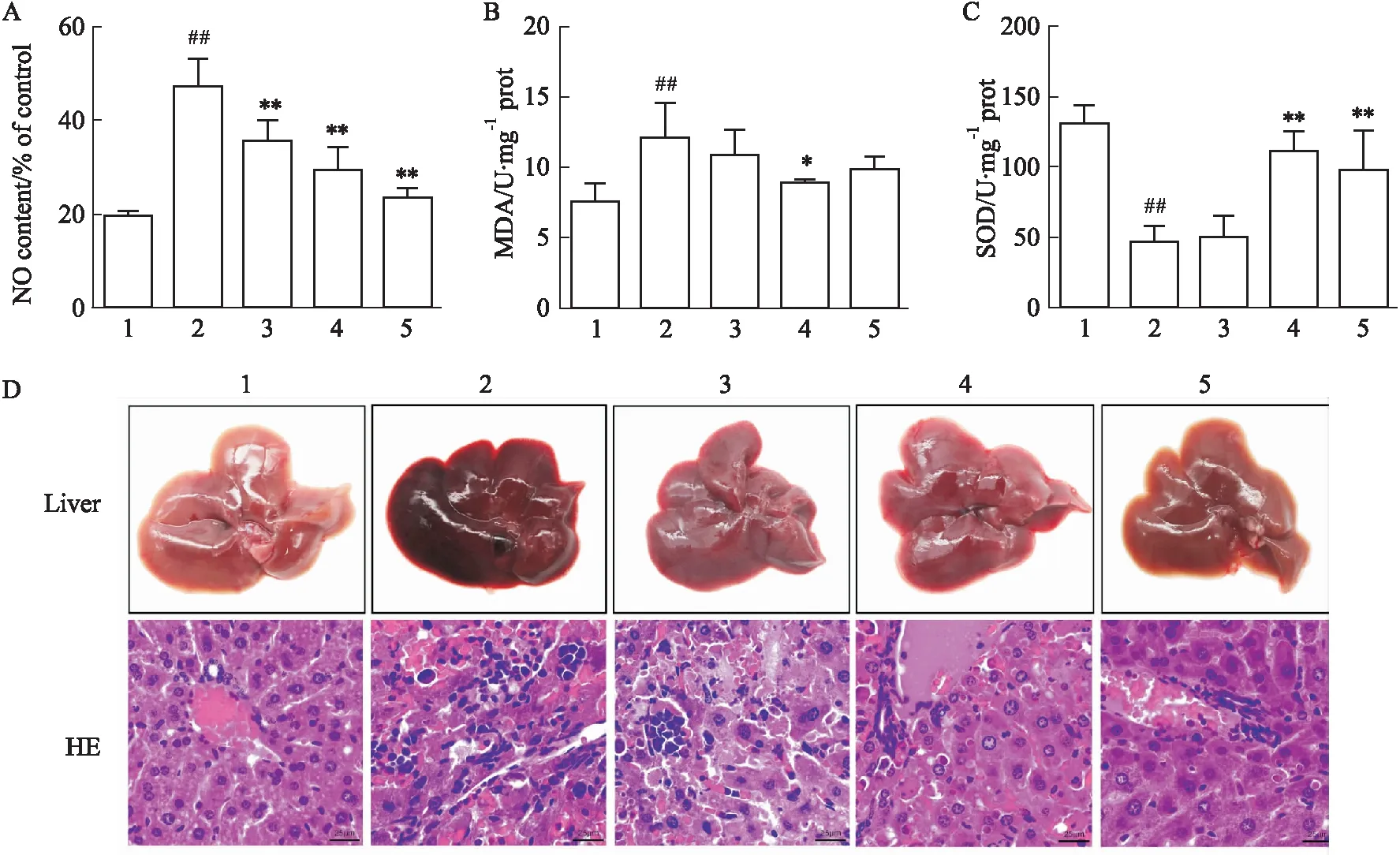
Fig 2 Effects of L-SK on oxidative indices and liver tissue injury in
3.3 L-SK对RAW264.7细胞活性和释放NO的影响细胞存活率实验表明,细胞在0 μmol·L-1至200 μmol·L-1的范围内,各剂量组对Raw264.7巨噬细胞无细胞毒性,无统计学意义(P>0.05)(Fig 3A),浓度计量范围参考本课题组前期研究[11]。NO结果显示,与模型组比较,L-SK在50 μmol·L-1、100 μmol·L-1以及200 μmol·L-1均能够明显降低NO水平(P<0.01),且呈现一定的浓度依赖性(Fig 3B)。
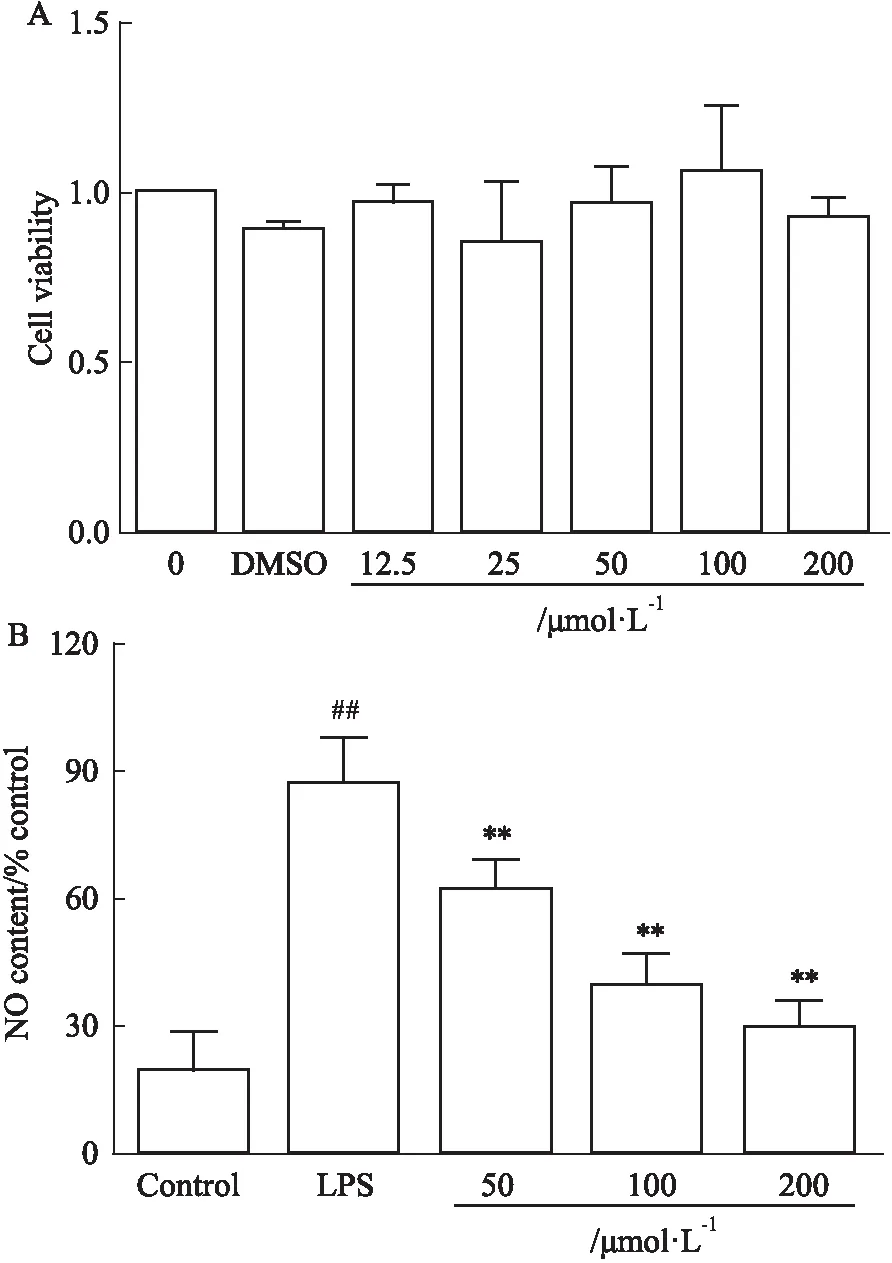
Fig 3 Effect of L-SK on NO
3.4 L-SK对RAW264.7细胞炎症基因mRNA表达水平影响本研究进一步探究了L-SK在LPS刺激6 h后的炎症相关基因的mRNA表达水平变化,在LPS刺激下,模型组的INOS、COX-2、IFN-β、IL-6、TNF-α及IL-1β的mRNA水平相较于空白对照组明显升高(P<0.01),与模型组比较,L-SK的高剂量组极明显下调IFN-β和TNF-α的mRNA水平(P<0.01),明显下调INOS和COX-2的mRNA水平(P<0.05),L-SK的中、高剂量组均能极明显下调IL-6及IL-1β的mRNA水平(P<0.01)。这些结果表明,L-SK能够通过抑制炎症基因的表达发挥其抗炎作用(Fig 4)。
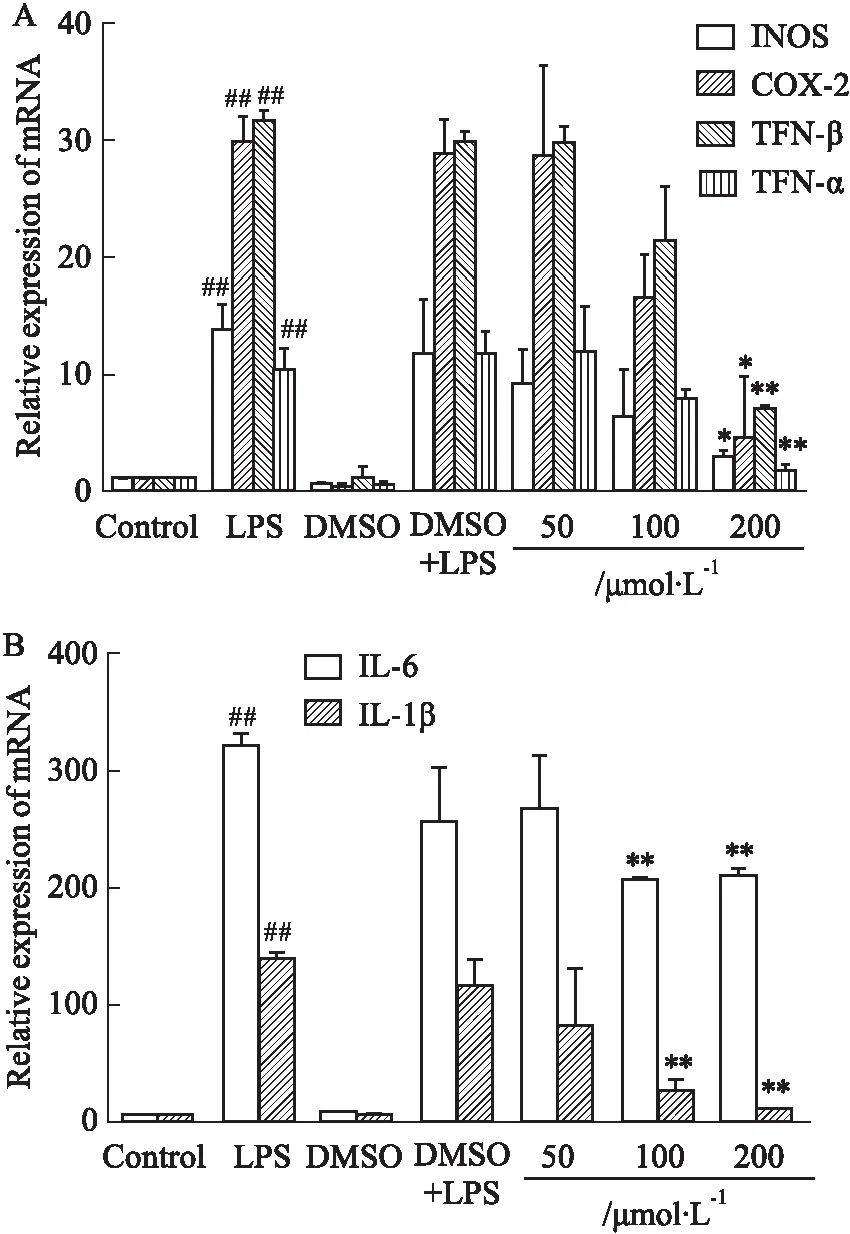
Fig 4 Effect of L-SK on expression of relevant
3.5 L-SK对RAW264.7细胞中的MAPK/NF-κB通路蛋白表达影响本实验探究了L-SK对RAW264.7细胞MAPK/NF-κB通路中的INOS、COX-2、p38、ERK1/2、JNK、p65和IKKα/β蛋白表达。Western blot结果显示,与空白组比较,模型组中的INOS、COX-2的蛋白水平明显升高(P<0.01),与模型组比较,L-SK高剂量组能够极明显下调INOS蛋白水平(P<0.01)(Fig 5A),中、高剂量组能够明显下调COX-2的蛋白表达(P<0.01)(Fig 5B);在MAPK信号通路中,与空白组比较,模型组的p-p38、p-ERK1/2的蛋白表达水平均极明显上调(P<0.01),但L-SK各剂量组与模型组比较差异均无显著性(P>0.05)并且L-SK给药后p-JNK蛋白表达水平明显升高(Fig 5C);在NF-κB信号通路中,模型组的p-p65和p-IKKα/β的蛋白表达水平相较于空白组均极明显上调(P<0.01),与模型组比较,L-SK的高剂量组能明显下调的p-IKKα/β蛋白表达(P<0.01),L-SK中、高剂量组均明显下调p-p65蛋白水平(P<0.01)(Fig 5D)。Western blot结果表明L-SK发挥抗炎作用是通过下调NF-κB通路中INOS、COX-2、p-p65和p-IKKα/β的蛋白表达,对于MAPK信号通路蛋白无明显抑制作用。
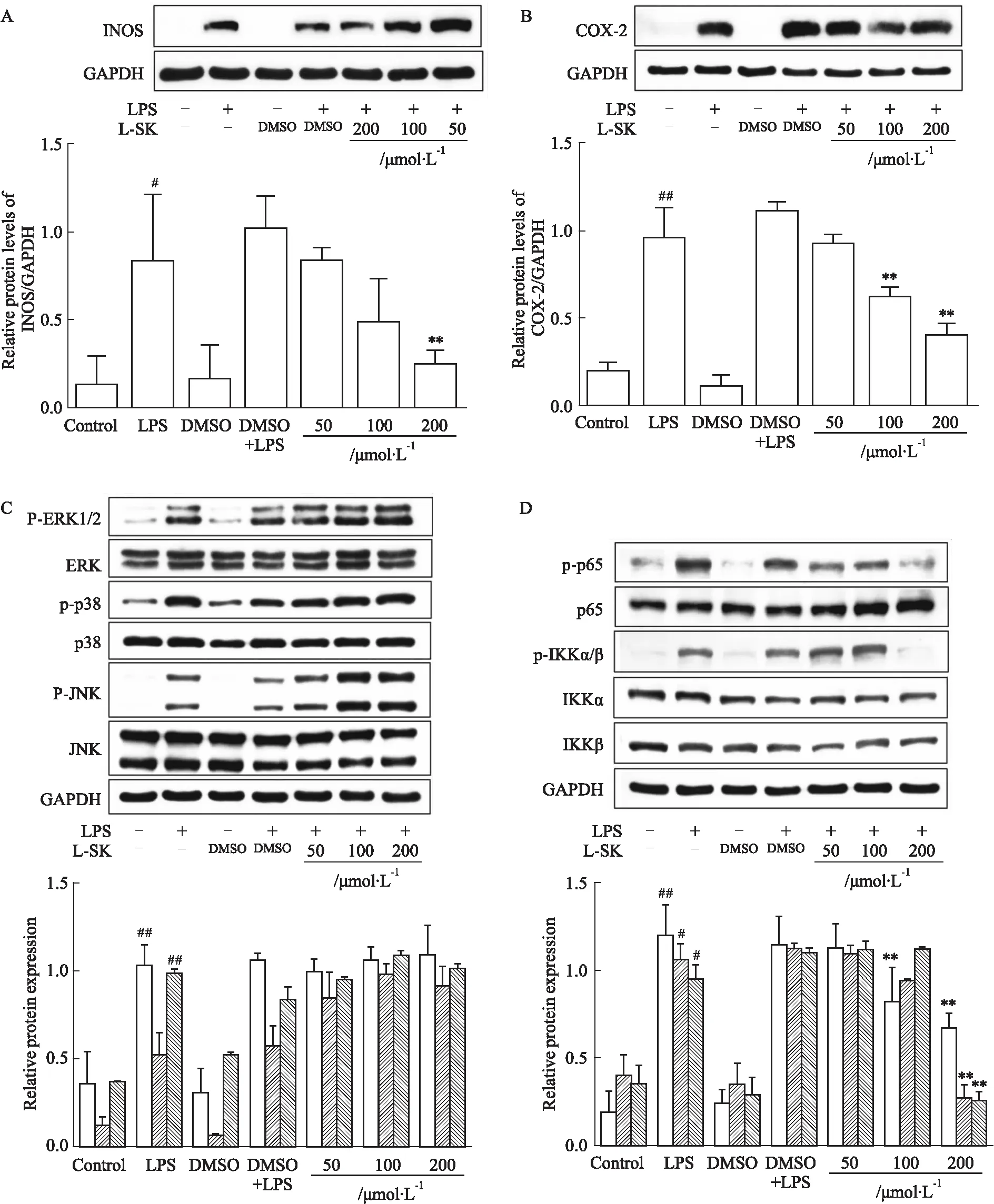
Fig 5 Effect of L-SK on LPS-induced protein expression in RAW264.7 cells
4 讨论
急性肝损伤(ALF)是致命的临床综合征之一,其特点是肝功能迅速恶化导致肝性脑病,全身炎症反应综合征甚至多器官衰竭,从而对患者生命构成严重威胁[1]。常见的ALF造模方法较多,其中LPS联合D-氨基半乳糖(D-galactosamine,D-GalN)是一种经典的ALF诱导方法[8],D-GalN是一种强效的RNA合成抑制剂,可导致肝细胞出现不可逆的损伤以及巨噬细胞浸润[13]。LPS是一种内毒素,可以引起免疫刺激的级联反应,其中LPS诱导激活巨噬细胞产生炎症反应,是经典的体外炎症模型[6],而D-GalN和LPS联合使用时又能加强LPS的急性毒性。因此,本研究通过建立LPS刺激RAW264.7巨噬细胞的体外炎症模型以及建立LPS/D-GalN诱导的小鼠体内急性肝损伤模型,探讨L-SK抗炎保肝作用及其作用机制。
体内实验采用LPS/D-GalN诱导的小鼠急性肝损伤模型,本研究中我们发现L-SK能明显提高小鼠存活率,降低模型小鼠血清中的的AST、ALT、AKP酶活性,该实验结果表明L-SK具有一定的保肝作用。我们研究还发现小鼠组织中的NO含量明显降低,NO可与过氧化物结合生成过氧亚硝酸盐化合物,是氧化损伤的主要自由基之一,可预测肝脏损伤程度[14];同时发现小鼠组织中的MDA的含量明显降低,SOD酶活性明显提升,MDA可以间接反映氧化损伤的严重程度,SOD可以阻断脂质过氧化反应的发生,维持机体代谢平衡,当机体发生氧化应激时,MDA含量升高,SOD活性降低,自由基的积累将使细胞膜的脂质发生过氧化作用进一步加重而引起膜裂变, 从而导致细胞损伤甚至死亡[15],该实验结果表明L-SK可以通过改善氧化损伤起到保肝作用,同时给药组可不同程度恢复肝功能异常,减轻肝脏炎症。以上结果均表明,L-SK对ALF具有一定的治疗作用,通过改善组织的炎症反应及氧化损伤从而延缓疾病的发展进程。
炎症被认为是决定了ALF的发病进程的关键因素,而炎症反应的特征是巨噬细胞的积累和激活[4],因此巨噬细胞的激活与ALF有着密切联系。LPS诱导活化巨噬细胞后导致诱导性一氧化氮合酶(iNOS)和环氧化酶(COX-2)表达增加,INOS诱导产生的NO又可以进一步促进细胞因子如IL-6、TNF-α和IL-1β的增加[16],从而进一步加剧炎症反应。体外模型中,L-SK给药组能够明显抑制细胞NO含量以及炎症因子mRNA水平,并且L-SK在基因和蛋白水平上均能抑制INOS和COX-2的表达,由此可知L-SK的抗炎作用与抑制炎症因子表达和降低促炎症酶活性有关。在LPS诱导的炎症反应中,丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)和NF-κB(nuclear factor-κB)信号通路是两条经典的通路,其中NF-κB起到关键作用[17],是炎症反应和抗炎的中心环节,MAPK参与调控NF-κB信号通路的激活,NF-κB通路的激活促使NF -κB p65与NF-κB p65 抑制剂(IκB)二聚体分离,并由胞质向胞核转移[7],MAPK和NF-κB的磷酸化均能够促使炎症因子IL-6、TNF-α和IL-1β的释放[18],进一步加重炎症反应。我们考察了L-SK对两条信号通路的作用,结果发现,模型组细胞的MAPK及NF-κB信号通路均被激活,磷酸化的ERK1/2、JNK、p38、p65和IKKα/β蛋白表达明显上调,L-SK给药后MAPK信号通路相关蛋白与模型无变化,然而L-SK给药组明显抑制了磷酸化的p65和IKKα/β蛋白表达,因此我们得出结论,L-SK发挥抗炎作用是通过抑制NF-κB信号通路中的p65和IKKα/β蛋白的表达,对于MAPK信号通路几乎无作用(Fig 6)。
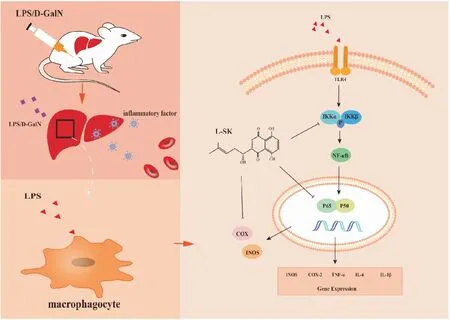
Fig 6 Anti-inflammatory mechanism diagram
综上所述,本文研究结果证明,L-SK主要是通过抗炎作用进行预防和保护由LPS/D-GalN诱导的小鼠急性肝损伤,其抗炎作用是抑制炎症因子的表达以及相关蛋白表达,作用机制可能与降低COX-2、iNOS酶蛋白的表达,调控NF-κB信号通路相关,该研究为后续临床开发用药提供理论依据。

