水分胁迫对醉马草生长的影响
蔡 沙,岳永寰,靳瑰丽
(新疆农业大学草业与环境科学学院/新疆草地资源与生态实验室,乌鲁木齐 830052)
0 引 言
【研究意义】在水分胁迫下,植物通过生长变化来抵御干旱,表现为株高降低、枯叶增加、叶片卷曲、增厚、蜡质化,叶长、叶宽、叶面积下降等,可以减少蒸散面积、降低蒸腾速率;细根数量增多、根茎维管组织结构性状增粗等,并增加根系吸收深层土壤水分结构,摄取更多水分,保持植物体内水分流、以此来保障植物体内水分平衡、物质传递和交换;增强其在生态环境中的适应性[1-3]。醉马草(Achnatheruminebrians)为禾本科多年生草本植物,具有抗旱性强和家畜不喜食等特点,在退化草地群落种间竞争中具有较大优势,在干旱、退化草地中的蔓延日益严重。[4]是我国西北干旱和半干旱地区草原毒杂草。【前人研究结果】植物叶器官的生长对水分胁迫较敏感[5],叶片延伸速率与膨压呈显著线性相关关系,叶生长会因不同胁迫方式做出不同调节[6-7];在轻度水分胁迫下赖草(Leymussecalinus)叶片扩展速率显著降低,白草(Pennisetumflaccidum)未达到显著水平,而在重度水分胁迫时均显著下降[8];垂穗披碱草(Elymusnutans)、肥披碱草(E.excelsus)、紫芒披碱草(E.purpuraristatus)在水分胁迫下株高相对增长量、平均生长速率均下降;水分胁迫14 d,植株生长受到了抑制[9]。植物地上、地下部分生长对水分胁迫的响应存在差异,会受水分胁迫过程时间长短呈现不同的变化,水分胁迫早期,小麦根系生长影响较小,但苗根比降低[10];对无芒雀麦(Bromusinermis)、苇状羊茅(Festucaarundinacea)、鸭茅(Dactylisglomerata)等10种禾草研究表明根冠比对水分胁迫表现出较强的适应性,在轻度水分胁迫下增加了各器官生物量的积累,中度和重度水分胁迫下各器官生物量的积累量降低[11]。【本研究切入点】在以往的研究中,发现醉马草在荒漠草地、草原草地、草甸草地均有分布。往往入侵、扩张植物对水分的适应更加宽广,能较强的应对各种环境条件并进行扩散[12],醉马草幼苗对水分胁迫的适应性,是其能在水分变化差异大的生境下得以扩张的重要条件之一。需研究水分胁迫对醉马草生长的影响。【拟解决的关键问题】以醉马草为材料,采用温室盆栽试验,选取醉马草有效叶性状表型变化、株高,绿叶面积、各器官生物量鲜干重、根冠比等,分析其在持续干旱过程中的变化规律,分析叶性状和生物量的分配变化规律和醉马草抗旱机制,为预测醉马草幼苗阶段个体生存、种群建立提供理论基础。
1 材料与方法
1.1 材 料
1.1.1 种 子
于2019年8月在乌鲁木齐南山谢家沟草原带(E:87°00′53″,N:43°31′01″,海拔1 660 m),选取醉马草为优势种的群落成熟期植株,剪取醉马草植株穗部带回实验室阴干后,挑选饱满均匀的种子装入信封袋中,贮存于温度为(25±2)℃、湿度为(29%±4%)的室内备用。
1.1.2 育苗
试验在新疆农业大学草业与环境科学学院植物生长室进行,将醉马草种子按均匀间距播种于装入蛭石(300±0.5 g)的花盆内[13],花盆上径:108 mm,下径:70 mm,高:180 mm,底部不漏水,20粒/盆,置于温度27.8℃、湿度46%,光照/黑暗(8 h/16 h)温室,光通量密度为102 μmoL/(m2·s)。前期适量浇水以便种子正常萌发和幼苗生长,幼苗生长至2叶期时,定苗至12株/盆,并浇1/2 Hoagland营养液(青岛高科技工业园海博生物技术有限公司),1次/周,50 mL/次,每周随机调换盆栽摆放位置。
1.2 方 法
1.2.1 试验设计
温室醉马草幼苗生长至第35 d时,采用模拟自然干旱法进行水分胁迫实验处理。参考夏超[14]的方法测得蛭石饱和含水量为326.3 g,试验材料随机分为2组,对照组(CK,正常浇水)和水分胁迫组(胁迫组)。对照组:蛭石饱和含水量始终维持在80%~85%,水分胁迫组:一次性浇85%蛭石饱和含水量后,使其自然干旱,不再添加水。处理后每7 d测定醉马草生长指标。
胁迫组35 d时,对水分胁迫处理材料进行1次性复水(以下简称复水)至蛭石饱和含水量85%,并于复水后第7 d(复水 7 d)观测,即分别在干旱胁迫第7、14、21、28、35、42 d(复水 7 d)6次观测醉马草生长指标,于当天随机选取CK、胁迫组实验处理盆栽各10盆,挑选位于盆栽中心位置的醉马草植株测定叶性状、株高、生物量指标。每个处理10个重复。每天18:00采用称重法对CK处理补水,使水分维持在试验设定值。
1.2.2 测定指标
叶片数量:采用直接统计法统计醉马草叶片数、枯叶数、有效叶片数(植株全部可见且未完全干枯脱落的叶片总数)[15]。
叶性状:采用30 cm钢直尺、游标卡尺量取醉马草每片完全展开叶的叶长(Li)、叶宽(Di),其中,全展叶的叶长(Li)是指叶片基部(从叶环开始)至叶尖的叶片长度,如果叶尖受旱干枯,则整叶面积减去干枯部分面积;叶宽(Di)是指叶片最宽处的宽度。未展叶的叶长以从上一片叶中露出的部分为准,宽度按照其原状(不展开)测量。计算单株绿叶总叶面积(S)(简称叶面积)和叶面积生长速率[15-17]。
株高:采用30 cm钢直尺测量植株株高,计算株高生长速率。
生物量:取出花盆中的植株,清除净蛭石。用剪刀将根、地上部分器官分开,置于千分之一天平称量各部分鲜重,装入信封纸袋,放入烘箱105℃杀青15 min,80℃烘干24 h后,采用1/1000 d平称量各部分干重。计算植株总生物量、根冠比。
有效叶片数(片)=叶片数-枯叶数;

叶面积生长速率(cm2/d)=
株高生长速率(cm/d)=
植株总生物量(g)=地上生物量+地下生物量;

1.3 数据处理
采用Office 2010 Excel整理数据,SPSS 19.0对CK和胁迫组处理条件下试验数据单因素方差分析(One-way ANOVA),采用LSD法进行显著性检验,SigmaPlot 14.0进行图制作。
2 结果与分析
2.1 水分胁迫对醉马草叶片生长性状的影响
2.1.1 水分胁迫对醉马草叶数量特征的影响
研究表明,随着持续水分胁迫时间的延长,醉马草叶片数呈先升后降的变化趋势,胁迫组28 d时,胁迫组与CK相比,醉马草叶片数显著减少17.95%(P<0.05);且醉马草叶片数达到最大值。胁迫组增加了醉马草枯叶数,枯叶数由0.00片增加到1.10片,且胁迫组14 d、28 d时胁迫组与CK存在显著性差异,胁迫组14 d时增加100%(P<0.01);胁迫组28 d时,减少40%(P<0.05),醉马草有效叶片数在水分胁迫过程中逐渐减少,由3.00片减少到2.20片,胁迫组抑制了醉马草有效叶片数增长,在胁迫组14 d时显著减少18.18%(P<0.05)。
复水7 d时,胁迫组与CK间醉马草叶片数、枯叶数、有效叶片数恢复生长,但其生长能力低于CK,分别较CK减少14.58%(P>0.05)、31.58%(P>0.05)、3.45%(P>0.05)。但与CK相比不存在显著差异。
在整个水分胁迫过程中,胁迫组显著抑制了醉马草叶片数,有效叶片数的增长,水分胁迫28 d时,醉马草叶片数达到最大值3.2片;胁迫组增加了醉马草枯叶数,但低于CK。复水7 d时,醉马草叶片数,有效叶片数生长得以恢复,但恢复能力低于同期CK,CK与胁迫组枯叶数均达到最大值。图1

注:CK,对照;WS,水分胁迫;*表示处理组与对照组在0.05水平上有显著性差异(P<0.05),**表示处理组与对照组在0.01水平上有极显著性差异(P<0.01),图中值“42”表示复水7 d的数据,下同
2.1.2 水分胁迫对醉马草叶表型的影响
研究表明,随着持续水分胁迫时间的延长,醉马草叶片平均叶长、平均叶宽呈先升后降的变化趋势。胁迫组7~14 d时,胁迫组促进叶片长、宽的生长;胁迫组21~35 d,叶面积生长受到抑制;胁迫组7、35 d时,叶长在水分胁迫与CK间存在显著性差异(P<0.05),前者比CK增加15.73%;后者比CK减少16.21%。胁迫组7 d、14 d时,与CK相比,叶宽比CK增加3.08%、8.77%;胁迫组21、28、35 d时,叶宽在胁迫组与CK处理间存在极显著差异(P<0.01),分别较CK减少42.98%、50.00%、26.32%。胁迫组处理醉马草叶面积和叶面积生长速率随处理时间的增加呈逐渐下降的趋势,由1.564 cm2/株下降到0.475 cm2/株,胁迫组7 d时,胁迫组促进叶面积的生长(P>0.05),较CK升高13.01%;胁迫组28 d、35 d时,叶面积与CK相比存在显著性差异,分别减少57.58%(P<0.05)、39.41%(P<0.01),叶面积生长速率在胁迫组与CK间不存在显著性差异,但在胁迫组7 d时,叶面积生长速率达到最大值0.085 cm/d。
复水7 d时,胁迫组与CK处理间叶长、叶宽、叶面积、叶面积生长速率不存在显著差异,但在复水7 d时,叶片得以恢复生长,其中叶长小于CK,叶宽、叶面积、叶面积生长速率生长高于CK。
在水分胁迫早期或者是适度中度水分胁迫,促进醉马草叶片的生长,在水分胁迫后期或者是中度水分胁迫,抑制叶片的生长,而在整个水分胁迫时间内,醉马草叶面积伸展受到抑制,叶面积生长速率降低;复水 7 d时,醉马草叶性状生长得以恢复,醉马草叶面积生长速率及叶面积快速生长优先用于醉马草叶长的生长。图2

图2 水分胁迫和复水下醉马草叶性状变化
2.2 水分胁迫对醉马草株高和株高生长速率的影响
研究表明,水分胁迫前期促进醉马草株高的生长,胁迫组21~35 d,株高生长受到抑制。胁迫组35 d,株高在水分胁迫与CK处理间存在显著性差异(P<0.05),较CK降低15.46%,胁迫组28 d时,醉马草株高达到最大值,12.27 cm/株。株高生长速率在水分胁迫处理期间逐渐下降,由0.158 cm/d下降到-0.260 cm/d,并且与CK不存在显著性差异。
复水7 d时,醉马草株高和株高生长速率在胁迫组与CK处理间不存在显著差异,在复水 7 d时,醉马草株高生长得以恢复,与复水 7 d比,胁迫组处理株高和株高生长速率达到最大值。
水分胁迫早期或者是中度水分胁迫促进醉马草株高的生长,水分胁迫后期,株高生长明显遭受水分胁迫的抑制,在水分胁迫期间生长速率受到了抑制。在水分胁迫过程中,降低醉马草株高生长速率来抑制株高的生长。图3
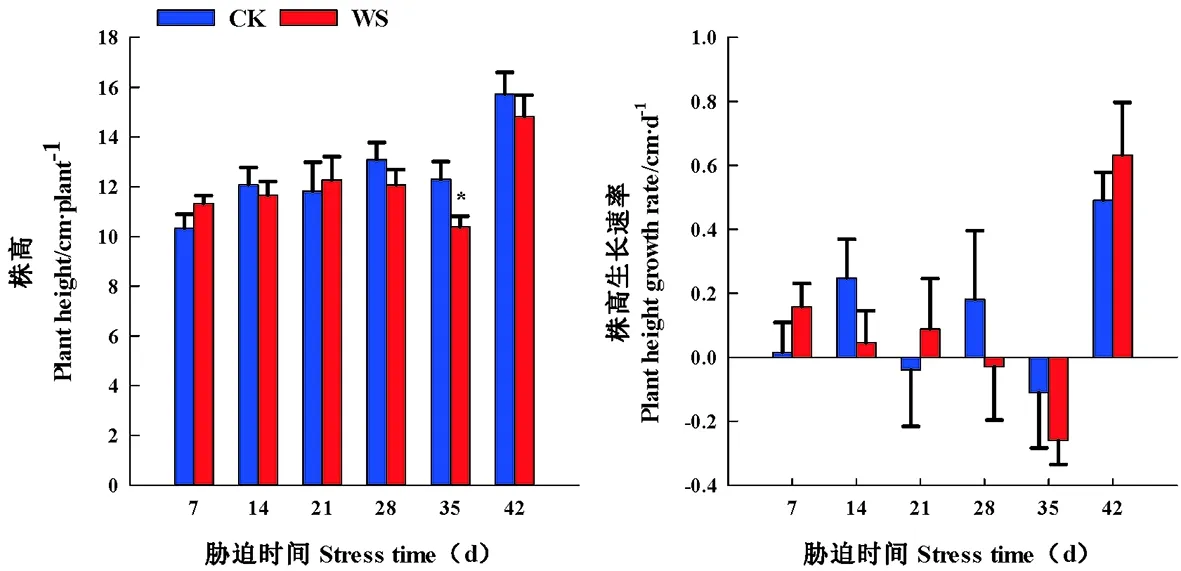
图3 水分胁迫和复水下醉马草株高和株高生长速率变化
2.3 水分胁迫对醉马草生物量的影响
研究表明,随着持续水分胁迫时间的延长,水分胁迫处理醉马草地上生物量、总生物量呈先升后降的变化趋势,地下生物量呈逐渐下降的变化趋势,胁迫组前期(7~14 d),促进醉马草生物量的积累,胁迫组后期(21~35 d),生物量减少。胁迫组7 d、28 d、35 d时,醉马草地上、地下以及总生物量在胁迫组与CK处理间存在显著性差异,胁迫组21 d时,醉马草地各部分生物量达到最大值,分别为0.028、0.008、0.036 g/株。
复水7 d时,胁迫组与CK处理间醉马草地上、地下以及总生物量不存在显著差异,其中醉马草地上生物量和总生物量低于CK。
在水分胁迫早期或者是适度中度水分胁迫,生物量增加,在水分胁迫后期或者中度水分胁迫后,生物量则减少,醉马草植株鲜重极易受到土壤水分亏缺的影响。图4
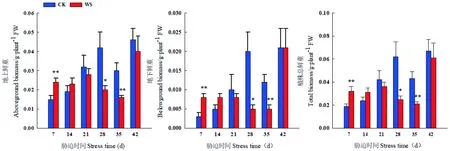
图4 水分胁迫和复水下醉马草各器官生物量鲜重变化(平均值±标准误)
随着持续水分胁迫时间的延长,水分胁迫处理醉马草地上、地下、植株干重、根冠比呈先升后降的变化趋势。胁迫组前期(7~14 d),水分胁迫增加了醉马草地上、地下、植株干重、根冠比,胁迫组后期(21~35 d),水分胁迫减少了醉马草地上、地下、植株干重、根冠比。胁迫组7 d、14 d时,水分胁迫促进了醉马草各器官干重增重,胁迫组7 d时,醉马草地上、地下、植株干重、根冠比分别较CK增加了0.00%(P>0.05)、50.00%(P>0.05)、14.29%(P>0.05)、17.08%(P>0.05);醉马草地上、地下、植株干重、根冠比在胁迫组14 d时,分别较CK增加20.00%(P>0.05)、150.00%(P<0.05)、42.86%(P>0.05)、130.16%(P<0.05);胁迫组28 d时,水分胁迫显著减少醉马草地上、地下、植株干重,较CK分别减少了50.00%(P<0.01),57.14%(P<0.05)、52.94%(P<0.05);胁迫组35 d时,醉马草根冠比与CK对比,提高了8.26%(P>0.05)。
复水7 d时,胁迫组与CK处理间醉马草地上、地下以及植株干重不存在显著差异,醉马草各部分生物量干重得以恢复,其中醉马草地下、植株干重、根冠比高于CK,分别比CK增加了50.00%(P>0.05)、22.22%(P>0.05)、117.83(P>0.05),根冠比达到最大值。
在水分胁迫早期或者是适度水分胁迫增加醉马草地上、地下、植株干重、根冠比(P<0.05),在水分胁迫后期或者是中度水分胁迫后,水分胁迫减少醉马草植株地上、地下以及植株干重(P<0.05),增加根冠比;复水 7 d时,醉马草地上、地下、植株干重得以恢复。图5
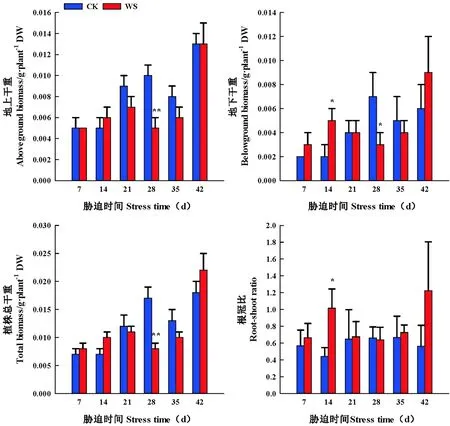
图5 水分胁迫和复水下醉马草各器官生物量干重和根冠比变化(平均值±标准误)
3 讨 论
3.1 水分胁迫对醉马草叶表型的影响
叶片是植物对干旱响应最敏感的器官之一[18-19],水分胁迫至14 d时,植株生长明显受到抑制[9];水分胁迫初期植物通过自身调节物质分配达到适应不良环境,促进幼苗生长的目的[20]。植物应对水分胁迫的应激性反应主要是减少叶面积和增加叶片厚度[21-23]。当叶片生长至最大面积时遭遇水分胁迫,叶片会通过萎蔫、卷曲等运动[24],降低直接辐射面积,防止叶片温度升高,导致水分进一步亏缺[25]。
禾草对水分胁迫在形态学方面表现出较强的适应性[11],水分胁迫对植物株高产生很大影响[26]。在土壤水分逐渐下降过程中,不同胁迫时间下,水分胁迫对植物的生长存在不规则变化规律。在重度干旱(21 d)胁迫下,醉马草株高达到水分胁迫过程中的最大值,叶片数在干旱28 d时达到最大值,而醉马草枯叶数、有效叶片数、平均叶长、叶宽在水分胁迫过程中逐渐减少,与夏超[14]研究结果不同。原因可能是植物在资源充足的环境中具有较高的资源吸收和周转速率,会通过不断产生新的组织和器官使其生长速率最大化,因为有足够的资源迅速补偿其生产组织和器官的消耗;而在资源匮乏的环境中,植物资源吸收和周转的速率较低[15,27]。较慢的周转速率延长了植物的存活率,但造成较慢的生长速率[28],植物在水分胁迫早期一般会加快生长进程,但在水分胁迫较为严重时,植物将会推迟发育,甚至导致植物停止生长发育[29]。研究中,盆栽表面是暴露在空气中,且种植密度大等,暴露在空气下以及种植密度的增加,增加单位面积植物水分蒸散量,加速了土壤水分的蒸散,减少了植物有效利用的水分,抑制并减缓光合作用。植物能量积累下降,导致植物株高呈先升高后降低,醉马草对水分胁迫具有一定的抵抗能力。
3.2 水分胁迫对醉马草株高和株高生长速率的影响
水分胁迫对牧草株高增加与干物质积累影响相对较小[30]。随着水分胁迫时间的延长和胁迫程度的加重,披碱草属6种野生禾草苗高的相对增长量和平均生长速率均呈现下降的趋势;当水分胁迫到14 d时,植株生长明显受到了抑制[24,31]。当PEG从低浓度上升到高浓度时,苗长开始下降,轻度水分胁迫下植物通过自身调节营养分配达到适应不良环境,促进幼苗生长[20],与研究的结果相似,随着持续水分胁迫时间的延长,水分胁迫处理的醉马草株高呈先升后降的变化趋势,株高生长速率呈逐渐下降趋势。持续干旱14、35 d时,干旱显著阻碍醉马草的生长。株高生长速率在持续干旱14 d时,水分胁迫处理醉马草株高生长速率降低,此时CK处理株高生长速率是水分胁迫的4倍,持续干旱第7 d、第21 d,干旱促进了株高生长速率。复水后醉马草株高生长速率和株高迅速恢复生长。
3.3 水分胁迫对醉马草生物量的影响
水分胁迫往往对植物的生物量积累和能量分配产生很大影响[26]。根、冠关系是植物受遗传和环境因素表现出的互作综合效应[32-33]。植物干物质分配被认为是植物适应逆境胁迫的重要策略之一[34],通过调节地上、地下生物量分配可以改善自身对干旱的适应性。植株地上部冠层和地下部根系是相互作用的共同有机体,水分胁迫作为影响植物生长发育的主要因素,影响植物的生长生理过程,最终以植物各部分生物量的积累体现出来[35]。
试验结果显示,随着水分胁迫时间的持续,醉马草地上及整株器官鲜重与地下鲜重呈现出相反的变化规律,随着水分亏缺加剧,根、地上、植株生物量干重呈现一致的变化规律,水分胁迫降低了醉马草各植物器官鲜重,与夏超[14]研究结果一致,这是因为水分胁迫初期,植物生理代谢维持在相对平衡的状态,在植物生长生境中,各种资源充足且土壤表层水分充足,叶面积减小、植株有效绿叶面积减少,通过蒸腾作用提升植物把根部“富水”输送到地上的叶器官,在平衡蒸散与生理间需水关系后,叶片仍有较高的叶片持水量,加速光合器官能量加工效率,促进能量物质积累、增加了地上部分以及植株的生物量鲜重及干重,抑制了根部的生物量积累及分配[36]。而在水分胁迫后期,植物生长环境中水分减低,枯黄叶片脱落,叶性状进一步降低,加上水分胁迫给光合器官带来的轻微损伤,植物物质生产工厂效率下降,植物把更多的能量物质分配给地下部分生长,地下生物量增加,根冠比增大[34],与李飞[4]研究结果一致;叶、茎,地上生物量干重,植株干重降低。
4 结 论
随着持续水分胁迫时间的延长,醉马草减少叶片数、有效叶片数,叶长、叶宽、叶面积、株高、地上生物量,增加枯叶数、根冠比是为了减少水分蒸散面,水分从叶面的散失量面积由1.56 cm2减少0.48 cm2,水分运输距离由11.33 cm降至10.39 cm,增加水分转换效率,维持幼叶生长和缩短物质向根部转运距离。适度水分胁迫扩展了醉马草光合叶面积,增加了株高增长、根冠比及生物量积累。复水后,醉马草通过增加地下生物量分配,扩宽了水分获取空间,大量吸收土壤水分,提升植株含水量,加速醉马草叶长、叶面积、株高的恢复生长。
参考文献(References)
[1] 王勋陵,王静.植物形态结构与环境[M].兰州:兰州大学出版社,1988:138-148.
WANG Xunling, WANG Jing.PlantMorphologyandEnvironment[M]. Lanzhou: Lanzhou University Press, 1988:138-148.
[2]Castro-Díez P, Cornelissen J P. Leaf structure and anatomy as related to leaf mass per area variation in seedlings of a wide range of woody plant species and types [J].Oecologia, 2000, 124(4):476-486.
[3]孙彩霞,沈秀瑛.作物抗旱性鉴定指标及数量分析方法的研究进展[J].中国农学通报,2002,18(1):49-51.
SUN Caixia, SHEN Xiuying. Advances in studies on identification indexes and method of quantitative analysis for crop drought resistance [J].ChineseAgriculturalScienceBulletin, 2002, 18(1): 49-51.
[4]李飞.内生真菌对醉马草抗旱性影响的研究[D].兰州:兰州大学,2007.
LIFei.Effectsofendophyteinfectionondroughtresistancetodrunkenhorsegrass(Achnatheruminebrians) [D]. Lanzhou: Lanzhou University, 2007.
[5]Koyro H W. Effect of salinity on growth, photosynthesis, water relations and solute composition of the potential cash crop halophytePlantagocoronopusL. [J].EnvironmentalandExperimentalBotany, 2006, 56(2): 136-146.
[6]许宏.葡萄砧木和栽培品种抗旱性研究[D].泰安:山东农业大学,2004.
XU Hong.Studyondroughtresistanceofgraperootstocksandvarieties[D].Tai’an: Shandong Agricultural University, 2004.
[7]李德全,邹琦,程炳高.土壤水分胁迫对小麦叶片的渗透调节与延伸生长的影响[J].植物学报,1992,34(2):121-125.
LI Dequan, ZOU Qi, CHENG Binggao. Effect of soil water stress on osmotic adjustment and elongation growth of wheat leaves [J].ActaBotanicaSinica, 1992, 34(2):121-125.
[8]任安芝,高玉葆,梁宇,等.白草和赖草无性系生长对干旱胁迫的反应[J].中国沙漠,1999,19(34):30-34.
REN Anzhi, GAO Yubao, LIANG Yu, et al. Effects of drought stress on clonal growth ofPennisetumcentrasiaticunandLeymussecalinus[J].JournalofDesertResearch, 1999, 19(34): 30-34.
[9]祁娟,徐柱,马玉宝,等.披碱草属六种野生牧草苗期抗旱胁迫的生理变化[J].中国草地学报,2008,30(5):18-24.
QI Juan, XU Zhu, MA Yubao, et al. Physiological changes of six wild species inElymusunder drought stress at seedling stage [J].ChineseJournalofGrassland, 2008, 30(5):18-24.
[10]冯广龙,刘昌明,王立.土壤水分对作物根系生长及分布的调控作用[J].生态农业研究,1996,4(3):5-9.
FENG Guanglong, LIU Changming, WANG Li. Roles of soil water in regulating root growth and distribution [J].Eco-AgricultureResearch, 1996,(3):5-9.
[11]孙铁军,苏日古嘎,马万里,等.10种禾草苗期抗旱性的比较研究[J].草业学报,2008,17(4):42-49.
SUN Tiejun, SU Riguga, MA Wanli, et al. Drought resistance of ten seedling grasses [J].ActaPrataculturaeSinica, 2008, 17(4):42-49.
[12]胡小英.入侵植物意大利苍耳对干旱胁迫的形态及生理响应[D].沈阳:沈阳大学,2018.
HU Xiaoying.MorphologyandphysiologicalresponseofinvasiveplantXanthiumitalicumtodroughtstress[D]. Shenyang: Shenyang University, 2018.
[13]孙一丹.病原真菌对野大麦内生真菌共生体的影响[D].兰州:兰州大学,2015.
SUN Yidan.Effectsofendophyteinfectiononfungalpathogensofwildbarley(Hordeumbrevisubulatum) [D]. Lanzhou: Lanzhou University, 2015.
[14]夏超.醉马草-内生真菌共生体对干旱胁迫的响应[D].兰州:兰州大学,2018.
XIA Chao.ResponsesofEpichlo⊇gansuensis-Achnatheruminebrianssymbionttodroughtstress[D]. Lanzhou: Lanzhou University, 2018.
[15]麻雪艳,周广胜.干旱对夏玉米苗期叶片权衡生长的影响[J].生态学报,2018,38(5):1758-1769.
MA Xueyan, ZHOU Guangsheng. Effect of drought on the trade-off growth of leaf traits of summer maize in the seedling stage [J].ActaEcologicaSinica, 2018, 38(5):1758-1769.
[16]王敏政.基于遥感信息与气温的夏玉米土壤水分模拟[D].北京:中国气象科学研究院,2016.
WANG Minzheng.Evaluatingsoilmoistureofsummermaizeecosystembasedonremotesensingdataandairtemperature[D]. Beijing: Chinese Academy of Meteorological Sciences, 2016.
[17]王秋玲.夏玉米生理生态与生长特性对干旱过程的响应研究[D].北京:中国气象科学研究院,2015.
WANG Qiuling.Studyontheresponseofsummermaizephysiologicalecologyandgrowthcharacteristicstodroughtprocess[D]. Beijing: Chinese Academy of Meteorological Sciences, 2015.
[18]Elhaak M A. Response ofPlantagoalbicansleaves of environmental drought [J].FeddesRepertorium, 1990, 101(11/12): 645-650.
[19]叶龙华,黄香兰,薛立.干旱对树木叶片性状及抗旱生理的影响[J].世界林业研究,2014,27(1):29-34.
YE Longhua, HUANG Xianglan, XUE Li. Effects of drought on leaf traits and drought resistant physiologyoftrees [J].WorldForestryResearch, 2014, 27(1): 29-34.
[20]严青,马玉寿,施建军.三种禾草萌发期抗旱性研究[J].青海畜牧兽医杂志,2006,36(5):11-13.
YAN Qing, MA Yushou, SHI Jianjun. Study on drought resistance of three kinds of herbage grasses in the seed germination stage [J].ChineseQinghaiJournalofAnimalandVeterinarySciences, 2006, 36(5):11-13.
[21]Erice G, Louahlia S, Irigoyen J J, et al. Biomass partitioning, morphology and water status of four alfalfa genotypes submitted to progressive drought and subsequent recovery [J].JournalofPlantPhysiology, 2010, 167(2):114-120.
[22]齐佳.羊耳蒜(Liparisjaponica)对水分胁迫的响应[D].哈尔滨:东北林业大学,2009.
QI Jia.TheresponseofLiparisjaponicatowaterstress[D]. Harbin: Northeast Forestry University, 2009.
[23]蔡丽敏.引进萱草和景天新品种评价及景天品种繁殖与抗旱性的研究[D].北京:北京林业大学,2007.
CAI Limin.StudyonevaluationofHemerocallisandSedumandpropagationanddroughtresistanceofSedumcultivar[D]. Beijing: Beijing Forestry University, 2007.
[24]阿旺白玛,王传旗,武俊喜,等.禾本科牧草抗旱性研究进展[J].草学,2017,(1):13-16, 20.
Awangbaima, WANG Chuanqi, WU Junxi, et al. Research progress on drought resistance of Gramineae forages grass [J].JournalofGrasslandandForageScience, 2017,(1):13-16, 20.
[25]Jones H G, Corlett J E. Current topics in drought physiology [J].JournalofAgriculturalScience, 1992, 119(3):291-296.
[26]赵雅洁,李周,宋海燕,等.喀斯特地区土壤厚度降低和水分减少对两种草本植物混种后光合的影响[J].草业科学,2017,34(7):1475-1486.
ZHAO Yajie, LI Zhou, SONG Haiyan, et al. Effects of declinein soil depth and water resource on the photosynthesis of two grasses under mixed plantation in Karst regions [J].PrataculturalScience, 2017, 34(7): 1475-1486.
[27]麻雪艳,周广胜.夏玉米苗期主要生长指标的土壤水分临界点确定方法[J].生态学杂志,2017,36(6):1761-1768.
MA Xueyan, ZHOU Guangsheng. A method to determine the critical soil moisture of growth indicators of summer maize in seedlingstage [J].ChineseJournalofEcology, 2017, 36(6):1761-1768.
[28]Sterck F J, Poorter L, Schieving F. Leaf traits determine the growth-survival trade-off across rain forest tree species[J].TheAmericanNaturalist,2006,167(5):758-765.
[29]胡明新,周广胜.拔节期干旱和复水对春玉米物候的影响及其生理生态机制[J].生态学报,2020,40(1):274-283.
HU Mingxin, ZHOU Guangsheng. Phenological change and its ecophysiological mechanism of spring maize responding to drought at jointing stage and rewatering [J].ActaEcologicaSinica, 2020, 40(1):274-283.
[30]易津,谷安琳,贾光宏,等.赖草属牧草幼苗耐旱性生理基础的研究[J].干旱区资源与环境,2001,(S1):47-50.
YI Jin, GU Anlin, JIA Guanghong, et al. Studies on the drought hardiness in seedlings ofLeymusHochst. [J].JournalofAridLandResourcesandEnvironment, 2001,(S1):47-50.
[31]李传荣,董智.破坏山体的造林绿化及植被恢复[M].北京:知识产权出版社,2012.
LI Chuanrong, DONG Zhi.Afforestationandvegetationrestorationthatdestroythemountains[M]. Beijing: Intellectual Property Publishing House, 2012.
[32]宋海燕,张静,李素慧,等.基于容器分区处理探究黑麦草生长对喀斯特不同土壤生境和水分的响应[J].生态学报,2019,39(10):3557-3565.
SONG Haiyan, ZHANG Jing, LI Suhui, et al. Growth response ofLoliumperenneL. under different soil habitats and water conditions based on container partition in a Karst area [J].ActaEcologicaSinica, 2019, 39(10):3557-3565.
[33]裴芸,别之龙,杨小峰.不同灌水量对生菜生长和光合作用的影响[J].华中农业大学学报,2007,26(1):98-101.
PEI Yun, BIE Zhilong, YANG Xiaofeng. Effects of different irrigation quantity on the growth and photosynthesis of lettuce [J].JournalofHuazhongAgriculturalUniversity, 2007, 26(1):98-101.
[34]赵俊芳,杨晓光,陈斌,等.不同灌溉处理对旱稻根系生长及水分利用效率的影响[J].中国农业气象,2004,25(4):44-48.
ZHAO Junfang, YANG Xiaoguang, CHEN Bin, et al. Effects of different irrigation treatments on root growth and water use efficiency of upland rice[J].ChineseJournalofAgrometeorology, 2004, 25(4):44-48.
[35]杨建设.我国北方旱区农业发展的成就与展望[J].干旱地区农业研究,1997,15(4):86-92.
YANG Jianshe. Achievements and prospects for dryland farming development in North China [J].AgriculturalResearchintheAridAreas, 1997, 15(4):86-92.
[36]武玥.外源5-氨基乙酰丙酸(ALA)缓解黄瓜幼苗盐胁迫的效果及机理研究[D].兰州:甘肃农业大学,2018.
WU Yue.Mechanismsofexogenous5-aminolevulinicacid(ALA)onalleviatingsaltstressincucumberseedlings[D]. Lanzhou: Gansu Agricultural University, 2018.

