尼克酰胺对人胚胎干细胞向神经嵴细胞分化的诱导作用
段豪云 李文静 贾艳妮 赵灿 周庆军 李宗义
1山东第一医科大学附属眼科研究所 山东省眼科学重点实验室-省部共建国家重点实验室培育基地,青岛 266071;2山东第一医科大学附属眼科研究所 山东第一医科大学附属眼科医院(山东省眼科医院),济南 250000
角膜移植是当前临床治疗角膜内皮病变和内皮失代偿的首选方式,然而角膜供体的严重匮乏制约了其临床应用。2018年,研究者利用培养的原代人角膜内皮细胞对大疱性角膜病变患者进行注射移植获得成功,为角膜内皮功能失代偿的治疗提供了新途径[1]。然而,该方法仍不能摆脱对供体材料的需求[2]。因此,寻找其他的细胞来源仍是目前的研究热点之一。在脊椎动物眼胚胎发育过程中,角膜内皮的形成源于颅面部神经嵴细胞的迁移和分化[3-4]。人胚胎干细胞(human embryonic stem cells,hESCs)因具有无限的自我更新和多向分化能力成为良好的种子细胞来源[5-6]。将hESCs诱导分化为神经嵴细胞,再进一步诱导分化为角膜内皮细胞是获得足量内皮细胞的有效方法。采用饲养层细胞共培养或条件培养基等方式诱导hESCs分化模拟了体内发育过程[7-8],然而诱导体系成分的不确定极易导致细胞异质性的产生,且诱导时间长、神经嵴细胞诱导效率低[9],影响了目的细胞的获得。随着神经嵴分化过程中信号通路的研究,对BMP/SMAD、WNT、转化生长因子β(transforming growth factor β,TGF-β)等信号通路进行调控,在无饲养层条件下利用小分子化合物,如糖原合成酶激酶3、TGF-β抑制剂能够促使hESCs由神经外胚层向神经嵴细胞分化[10-12]。此外,联合生长因子及多种信号通路抑制剂的“鸡尾酒”体系也被用于神经嵴细胞的诱导[13-14]。但上述方法仍存在诱导时间较长、诱导体系复杂、可能伴随其他神经外胚层细胞混杂、诱导试剂费用昂贵等问题[15-16]。进一步简化诱导体系,经济、高效获得较高纯度的hESCs来源神经嵴细胞将极大促进角膜内皮再生领域的发展。尼克酰胺(nicotinamide,NIC)可用于干细胞重编程,促进并维持干细胞向视网膜色素上皮、神经、胰腺等不同谱系分化,是维持干细胞多能性、调节诱导分化的重要因子[6,17-20]。本研究拟探讨NIC在hESCs诱导分化为神经嵴细胞过程中的作用,以期为hESCs进一步分化为角膜内皮细胞提供实验基础。
1 材料与方法
1.1 材料
1.1.1细胞来源 hESCs细胞系H1由陆军军医大学第一附属医院眼科阴正勤教授课题组惠赠。
1.1.2主要试剂及仪器 hESCs无血清培养基mTeSRTM1、ReLeSRTM消化液(加拿大Stem Cell公司);DF12培养基、血清替代物(knockout serum replacement,KSR)、非必需氨基酸、L-谷氨酰胺、β-巯基乙醇(美国Gibco公司);碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国R&D公司);逆转录试剂盒(RR037A,日本TaKaRa公司);SYBR GreenER(美国Qiagen公司);DAPI(上海碧云天生物科技公司);兔抗人成对样同源域转录因子2(paired-like homeodomain transcription factor 2,PITX2)多克隆抗体(ab98297,1∶ 200)、兔抗人转录因子激活蛋白2β(transcription factor AP-2β,AP-2β)多克隆抗体(ab221094,1∶ 100)(美国Abcam公司);兔抗人P75多克隆抗体(OM267105,1∶ 150)(美国Omnimabs公司);小鼠抗人人自然杀伤因子1(human natural killer 1,HNK-1)单克隆抗体(C6680,1∶ 50)(美国Sigma公司);Alexa Fluor 488标记驴抗兔IgG(A21206)、Alexa Fluor 488标记驴抗小鼠IgG(A21202)(美国Invitrogen公司);流式检测抗体P75(抗人CD271-PE,345106,1∶ 100)、HNK-1(抗人CD57-FITC,359604,1∶ 100)(美国Biolegend公司);NIC、Sirtinol、白藜芦醇(resveratrol,Res)(美国Sigma公司);Matrigel 354277(美国Corning公司)。NanoDrop One超微量分光光度计(美国Thermo Scientific公司);PCR仪(Rotor-Gene Q,德国Qiagen公司);激光扫描共聚焦显微镜(Eclipse TE2000-U,日本尼康公司);流式细胞仪(Aria Ⅱ,美国BD公司)。
1.2 方法
1.2.1hESCs的培养及诱导分化 采用mTeSRTM1将H1细胞培养在Matrigel包被的培养板中,每天换液。培养5~7 d至hESCs克隆接近融合时使用ReLeSRTM消化,以1∶ 10比例传代。传代后倒置相差显微镜下观察H1细胞扩增至约70%融合,进行诱导分化。根据诱导培养基(DF12、体积分数20% KSR、非必需氨基酸、L-谷氨酰胺、bFGF、β-巯基乙醇)中干预组分的不同分为未添加NIC组(仅使用诱导培养基)、NIC添加组(含10 mmol/L NIC的诱导培养基)、NIC+Res组(含10 mmol/L NIC和10 μmol/L Res的诱导培养基)和Sirtinol组(含10 μmol/L Sirtinol的诱导培养基)。各组细胞每天换液,连续诱导7 d。小分子化合物NIC诱导hESCs分化为神经嵴细胞流程如图1所示。

图1 hESCs来源神经嵴细胞诱导流程示意图 hESCs:人胚胎干细胞;NCs:神经嵴细胞;NIM:神经嵴诱导培养基;NIC:尼克酰胺Figure 1 Schematic diagram of hESCs-derived neural crest cells induction process hESCs:human embryonic stem cells;NCs:neural crest cells;NIM:neural crest induction medium;NIC:nicotinamide
1.2.2实时荧光定量PCR法检测hESCs和神经嵴相关标志物的基因表达 分别收集诱导1、3、5、7 d未添加NIC组和NIC添加组的诱导细胞并提取总RNA,采用NanoDrop One测得RNA浓度以及纯度。以提取的总RNA为模板,按照逆转录试剂盒提供的步骤逆转录为cDNA,配制20 μl体系,37 ℃反应15 min,85 ℃反应5 s,4 ℃终止反应。以cDNA为模板加入SYBR GreenER和相应引物进行实时荧光定量PCR;引物由青岛德罗海达生物技术有限公司合成,各引物序列见表1。PCR反应条件:95 ℃预变性2 min;95 ℃变性5 s,60 ℃退火并延伸10 s,扩增40个循环。以GAPDH为内参,采用2-ΔΔCt法计算各基因的相对表达量。所有实验均重复3次以上。

表1 目的基因引物序列Table 1 Primer sequences of target genes引物引物序列(5'-3')扩增片段长度(bp)OCT4正向:CTGGGGGTTCTATTTGG-GAAG222反向:GTTGCCTCTCACTCGGTTCTNANOG正向:ACCTCAGCTACAAACAGGT-GAAG140反向:AGAGTAAAGGCTGGGGTAG-GTSOX10正向:CCTCACAGATCGCCTACACC161反向:CATATAGGAGAAGGCCGAG-TAGAP75正向:TTCATCCACGGATATTTG-CAGG137反向:GCTGGGGTAAGTGTACTGCCHNK-1正向:CAGCGAAGCCAGGCCTACT166反向:CATTCACCAGCACTGGCT-TCTSOX9正向:CCCAACAGATCGCCTACAG100反向:GAGTTCTGGTGGTCGGTG-TAGTCGAPDH正向:CATGTTCGTCATGGGTGT-GAA150反向:CATGGACTGTGGTCAT-GAGTCCT 注:OCT4:八聚体结合转录因子4;NANOG:同源域蛋白;SOX:SRY相关HMG盒;P75:神经营养因子受体;HNK-1:人自然杀伤因子1;GAPDH:甘油醛-3-磷酸脱氢酶 Note:OCT4:octamer transcription factor 4;NANOG:homeodomain proteins;SOX:SRY-related HMG box;P75:neurotrophic factor recep-tor;HNK-1:human natural killer 1;GAPDH:glyceraldehyde-3-phos-phate dehydrogenase
1.2.3免疫荧光染色法测定hESCs来源神经嵴细胞相关标志蛋白表达 未添加NIC组和NIC添加组诱导培养7 d的细胞样品使用质量分数4%多聚甲醛室温固定10 min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,体积分数0.1% Triton-X100破膜10 min,PBS洗3次,质量分数5%牛血清白蛋白室温封闭1 h,吸去封闭液分别加入P75、HNK-1、AP-2β和PITX2一抗4 ℃孵育过夜。次日,PBS清洗3次,加入荧光二抗(1∶ 300)室温避光孵育1 h。DAPI复染细胞核10 min,激光扫描共聚焦显微镜下观察并拍照。所有实验均重复3次以上。
1.2.4流式细胞术分析hESCs来源神经嵴细胞表面标志物阳性细胞比率 未添加NIC组和NIC添加组细胞样品使用0.25%胰蛋白酶-0.02% EDTA消化,制备细胞悬液。使用含体积分数2%胎牛血清(fetal bovine serum,FBS)-PBS清洗细胞2遍,250×g离心5 min,150 μl细胞染色缓冲液(2% FBS-PBS)重悬细胞,加入P75-PE和HNK-1-FITC,4 ℃染色30 min。染色结束后PBS洗涤细胞2遍上机检测,使用流式细胞仪对2个组细胞进行分析。收集NIC+Res组及Sirtinol组细胞样品进行HNK-1-FITC流式染色分析,比较各组HNK-1+细胞比率。所有实验均重复3次以上。
1.3 统计学方法

2 结果
2.1 未添加NIC组与NIC添加组不同时间点全能性及神经嵴细胞相关基因mRNA相对表达量比较
实时荧光定量PCR检测结果显示,NIC添加组与未添加NIC组诱导不同时间点全能性基因OCT4和NANOG mRNA相对表达量总体比较,差异均有统计学意义(OCT4:F分组=61.370,P<0.001;F时间=21.460,P<0.001;NANOG:F分组=26.210,P<0.001;F时间=3.410,P=0.043)。其中与未添加NIC组相比,NIC添加组诱导3、5、7 d时OCT4 mRNA相对表达量显著降低,诱导3 d和5 d时NANOG mRNA相对表达量显著降低,差异均有统计学意义(均P<0.05)。2个组诱导后不同时间点神经嵴细胞标志物P75、HNK-1、SOX9及SOX10的mRNA相对表达量总体比较差异均有统计学意义(P75:F分组=29.210,P<0.001;F时间=31.220,P<0.001;HNK-1:F分组=96.350,P<0.001;F时间=17.700,P<0.001;SOX9:F分组=55.330,P<0.001;F时间=17.990,P<0.001;SOX10:F分组=54.740,P<0.001;F时间=18.640,P<0.001)。与未添加NIC组比较,NIC添加组P75和SOX10 mRNA相对表达量在诱导3、5、7 d时升高,HNK-1 mRNA相对表达量在诱导5 d和7 d升高,SOX9 mRNA相对表达量在诱导1、3、5、7 d时升高,差异均有统计学意义(均P<0.05)(表2~7)。

表2 诱导不同时间点未添加NIC组与NIC添加组OCT4 mRNA相对表达量比较(x±s)Table 2 Comparison of relative expression levels of OCT4 mRNA between two groupsat different time points (x±s)组别样本量诱导不同时间点OCT4 mRNA相对表达量1 d3 d5 d7 d未添加NIC组30.623±0.1260.777±0.0700.592±0.0620.489±0.031NIC添加组30.557±0.0620.477±0.101a0.364±0.019a0.155±0.044a 注:F分组=61.370,P<0.001;F时间=21.460,P<0.001.与相应时间点未添加NIC组比较,aP<0.05(两因素方差分析,LSD-t检验) NIC:尼克酰胺;OCT4:八聚体结合转录因子4 Note:Fgroup=61.370,P<0.001;Ftime=21.460,P<0.001.Compared with the group treated without NIC at corresponding time points,aP<0.05 (Two-way ANOVA,LSD-t test) NIC:nicotin-amide;OCT4:octamer transcription factor 4
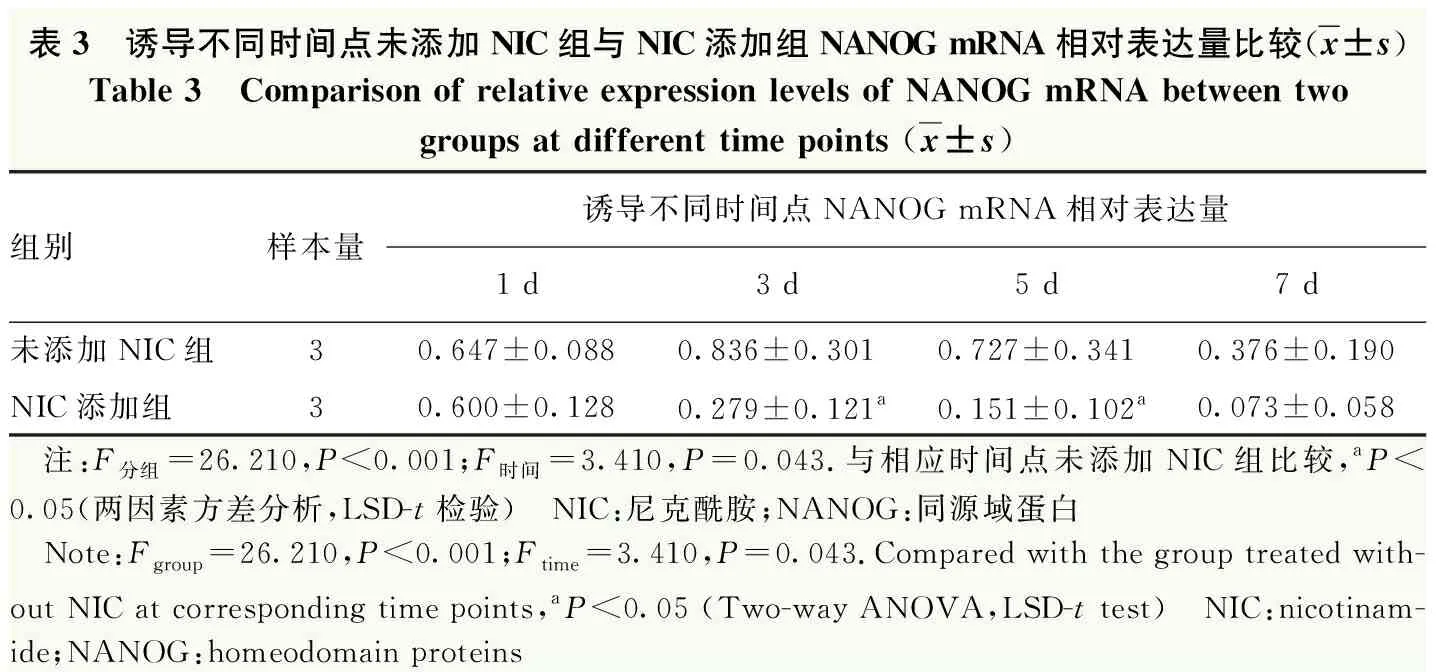
表3 诱导不同时间点未添加NIC组与NIC添加组NANOG mRNA相对表达量比较(x±s)Table 3 Comparison of relative expression levels of NANOG mRNA between twogroups at different time points (x±s)组别样本量诱导不同时间点NANOG mRNA相对表达量1 d3 d5 d7 d未添加NIC组30.647±0.0880.836±0.3010.727±0.3410.376±0.190NIC添加组30.600±0.1280.279±0.121a0.151±0.102a0.073±0.058 注:F分组=26.210,P<0.001;F时间=3.410,P=0.043.与相应时间点未添加NIC组比较,aP<0.05(两因素方差分析,LSD-t检验) NIC:尼克酰胺;NANOG:同源域蛋白 Note:Fgroup=26.210,P<0.001;Ftime=3.410,P=0.043.Compared with the group treated with-out NIC at corresponding time points,aP<0.05 (Two-way ANOVA,LSD-t test) NIC:nicotinam-ide;NANOG:homeodomain proteins

表4 诱导不同时间点未添加NIC组与NIC添加组P75 mRNA相对表达量比较(x±s)Table 4 Comparison of relative expression levels of P75 mRNA between twogroups at different time points (x±s)组别样本量诱导不同时间点P75 mRNA相对表达量1 d3 d5 d7 d未添加NIC组30.979±0.1901.348±0.4121.702±0.2621.630±0.112NIC添加组30.845±0.0731.995±0.195a2.813±0.291a2.220±0.297a 注:F分组=29.210,P<0.001;F时间=31.220,P<0.001.与相应时间点未添加NIC组比较,aP<0.05(两因素方差分析,LSD-t检验) NIC:尼克酰胺;P75:神经营养因子受体 Note:Fgroup=29.210,P<0.001;Ftime=31.220,P<0.001.Compared with the group treated without NIC at corresponding time points,aP<0.05 (Two-way ANOVA,LSD-t test) NIC:nicotinamide;P75:neurotrophic factor receptor

表5 诱导不同时间点未添加NIC与NIC添加组HNK-1 mRNA相对表达量比较(x±s)Table 5 Comparison of relative expression levels of HNK-1 mRNA between twogroups at different time points (x±s)组别样本量诱导不同时间点HNK-1 mRNA相对表达量1 d3 d5 d7 d未添加NIC组30.411±0.0530.708±0.1920.440±0.1130.462±0.056NIC添加组30.553±0.1110.895±0.1551.049±0.154a1.563±0.117a 注:F分组=96.350,P<0.001;F时间=17.700,P<0.001.与相应时间点未添加NIC组比较,aP<0.05(两因素方差分析,LSD-t检验) NIC:尼克酰胺;HNK-1:人自然杀伤因子1 Note:Fgroup=96.350,P<0.001;Ftime=17.700,P<0.001.Compared with the group treated without NIC at corresponding time points,aP<0.05 (Two-way ANOVA,LSD-t test) NIC:nicotinamide;HNK-1:human natural killer 1

表6 诱导不同时间点未添加NIC组与NIC添加组SOX9 mRNA相对表达量比较(x±s)Table 6 Comparison of relative expression levels of SOX9 mRNA betweentwo groups at different time points (x±s)组别样本量诱导不同时间点SOX9 mRNA相对表达量1 d3 d5 d7 d未添加NIC组30.504±0.2380.732±0.0441.231±0.1451.490±0.277NIC添加组31.055±0.365a1.851±0.287a1.847±0.090a2.257±0.346a 注:F分组=55.330,P<0.001;F时间=17.990,P<0.001.与相应时间点未添加NIC组比较,aP<0.05(两因素方差分析,LSD-t检验) NIC:尼克酰胺;SOX9:SRY相关HMG盒9 Note:Fgroup=55.330,P<0.001;Ftime=17.990,P<0.001.Compared with the group treated without NIC at corresponding time points,aP<0.05 (Two-way ANOVA,LSD-t test) NIC:nicotinamide;SOX9:SRY-related HMG box 9

表7 诱导不同时间点未添加NIC组与NIC添加组SOX10 mRNA相对表达量比较(x±s)Table 7 Comparison of relative expression levels of SOX10 mRNA between twogroups at different time points (x±s)组别样本量诱导不同时间点SOX10 mRNA相对表达量1 d3 d5 d7 d未添加NIC组30.434±0.1200.811±0.2891.150±0.3581.120±0.596NIC添加组30.740±0.2332.188±0.263a2.186±0.548a3.625±0.667a 注:F分组=54.740,P<0.001;F时间=18.640,P<0.001.与相应时间点未添加NIC组比较,aP<0.05(两因素方差分析,LSD-t检验) NIC:尼克酰胺;SOX10:SRY相关HMG盒10 Note:Fgroup=54.740,P<0.001;Ftime=18.640,P<0.001.Compared with the group treated without NIC at corresponding time points,aP<0.05 (Two-way ANOVA,LSD-t test) NIC:nicotinamide;SOX10:SRY-related HMG box 10
2.2 未添加NIC组与NIC添加组hESCs来源神经嵴细胞的形态变化和免疫荧光鉴定
诱导后7 d,未添加NIC组诱导细胞排列欠规则,细胞间形态差异较大,部分呈长梭形;NIC添加组细胞形态更规则,呈多边形排布(图2)。免疫荧光染色鉴定结果显示,未添加NIC组诱导细胞中神经嵴标志性蛋白P75表达较弱,HNK-1仅有零星表达,AP-2β及PITX2均未见阳性着色,NIC添加组细胞中P75、HNK-1、AP-2β及PITX2均呈广泛强阳性表达(图3)。

图2 未添加NIC组与NIC添加组hESCs来源神经嵴细胞形态(×100,标尺=100 μm) A:诱导后7 d,未添加NIC组细胞排列欠规则 B:诱导后7 d,NIC添加组细胞形态呈多边形排布Figure 2 Morphology of hESCs-derived neural crest cells in groups treated with and without NIC (×100,bar=100 μm) A:Irregular arrangement of hESCs-derived neural crest cells was seen in group treated without NIC after 7 days of induction B:Polygonal arrangement of hESCs-derived neural crest cells was observed in group treated with NIC after 7 days of induction
2.3 未添加NIC组与NIC添加组hESCs来源P75+HNK-1+和P75+细胞比率比较
流式细胞术检测结果显示,未添加NIC组P75+HNK-1+和P75+细胞比率分别为(33.200±11.197)%和(81.100±9.553)%,低于NIC添加组的(88.433±1.365)%和(97.700±1.179)%,差异均有统计学意义(t=8.481,P=0.001;t=2.987,P=0.041)(图4)。

图4 流式细胞分析hESCs来源神经嵴细胞中P75+及HNK-1+细胞比率 A:诱导后7 d,NIC添加组诱导细胞中P75+ HNK-1+细胞比率较未添加NIC组明显升高 B:诱导后7 d,2个组细胞中P75+和P75+ HNK-1+细胞比率比较 与未添加NIC组比较,aP<0.05(独立样本t检验,n=3) NIC:尼克酰胺;HNK-1:人自然杀伤因子1;P75:神经营养因子受体Figure 4 Percentage of P75+ and HNK-1+cells in hESCs-derived neural crest cells by flow cytometry A:The percentage of P75+ HNK-1+ cells was significantly higher in group treated with NIC than that in group treated without NIC after 7 days of induction B:Comparison of the proportions of P75+ and P75+ HNK-1+ cells between two groups after 7 days of induction Compared with the group treated without NIC,aP<0.05 (Independent samples t-test,n=3) NIC:nicotinamide;HNK-1:human natural killer 1;P75:neurotrophic factor receptor
2.4 各组hESCs来源HNK-1+细胞比率比较
流式细胞术检测结果显示,未添加NIC组、NIC添加组、NIC+Res组和Sirtinol组HNK-1+细胞比率分别为(34.267±12.522)%、(89.633±1.358)%、(64.667±6.429)%和(86.300±3.460)%,总体比较差异有统计学意义(F=36.799,P<0.001);其中,NIC+Res组HNK-1+细胞比率均低于NIC添加组和Sirtinol组,差异均有统计学意义(均P<0.05)(图5)。

图5 调控SIRT1对HNK-1+细胞比率的影响 A:各组诱导后7 d流式细胞图 B:各组HNK-1+细胞比率比较 F=36.799,P<0.001.与NIC+Res组比较,aP<0.05(单因素方差分析,LSD-t检验,n=3) NIC:尼克酰胺;Res:白藜芦醇Figure 5 Impact of SIRT1 regulation on the percentage of HNK-1+ cells A:Flow cytometry of HNK-1+ cells after 7 days of induction B:Comparison of the percentage of HNK-1+ cells F=36.799,P<0.001.Compared with the NIC+Res group,aP<0.05 (One-way ANOVA,LSD-t test,n=3) NIC:nicotinamide;Res:resveratrol
3 讨论
既往研究显示,神经嵴细胞作为脊椎动物胚胎发育过程中的一种瞬态干细胞,能够产生多种具有临床意义的组织细胞[21-23]。在眼的胚胎发育过程中,角膜内皮、小梁网、睫状肌等多个组织结构的发生均来源于神经嵴细胞的迁移和分化[3-4]。Ju等[24]研究发现,来自大鼠神经嵴细胞的角膜内皮细胞能够修复大鼠的角膜内皮缺损。随着干细胞技术的不断发展,利用干细胞对病变组织进行修复成为具有良好前景的治疗手段[5,25]。然而神经嵴细胞的分离、干细胞治疗的安全性筛选均对目的细胞的产量有着较高要求[26]。因此,经济、高效地诱导多能干细胞分化为神经嵴细胞成为定向获得角膜内皮细胞等衍生细胞的关键步骤。本研究发现,NIC能够通过调节SIRT1活性提高hESCs来源HNK-1+细胞比率,最终促进hESCs向神经嵴细胞分化。
WNT、BMP和FGF信号通路在脊椎动物神经嵴细胞形成过程中具有重要作用,基于此既往研究建立了多种神经嵴诱导体系[14]。如使用SMAD抑制剂、TGF-β抑制剂调控WNT/BMP/TGF-β信号,促使hESCs经由神经外胚层生成神经嵴细胞;或同时联合表皮生长因子、bFGF促进神经干细胞向神经嵴细胞分化,并维持神经嵴细胞的增生能力和高迁移性[10-12]。本研究结果显示,仅通过使用NIC即可高效完成诱导hESCs向神经嵴细胞的分化过程,且诱导时间较短、无其他分化阶段干扰,所获得细胞高表达神经嵴细胞特异性基因SOX10、SOX9、P75、HNK-1及相应蛋白标志物P75、HNK-1、AP-2β和PITX2。
HNK-1是一种髓鞘相关蛋白,能够结合细胞黏附分子的碳水化合物表位,参与细胞与细胞、细胞与基质之间的相互作用。研究报道HNK-1在神经嵴细胞迁移过程中高表达[27-29],当神经嵴细胞分化成熟时HNK-1表达减弱或消失[30]。因此,是否表达HNK-1能够反映诱导细胞是否处于神经嵴细胞阶段。本研究对诱导细胞中P75+HNK-1+细胞比率进行分析发现,NIC显著提高了P75+HNK-1+细胞比率,尤其提高了诱导细胞中HNK-1的表达(HNK-1+细胞比率≥90%),而未添加NIC组HNK-1+细胞比率不足40%;免疫荧光染色也显示,未添加NIC组细胞几乎不表达其他神经嵴标志物,如AP-2β和PITX2,说明NIC具有促进HNK-1表达,诱导hESCs向神经嵴细胞分化的作用。
根据以往研究,NIC能够抑制SIRT1活性,调控细胞命运[15,17-19]。为探索NIC是否通过抑制SIRT1从而诱导神经嵴细胞的产生,本研究分别使用SIRT1激动剂Res及抑制剂Sirtinol对hESCs向神经嵴细胞分化的过程进行干预和模拟,并通过流式分析对神经嵴细胞重要表面标志物HNK-1+细胞比率进行评价,结果显示SIRT1抑制剂Sirtinol表现出与NIC类似的诱导效果,同样促进了HNK-1+细胞的产生;而SIRT1激动剂Res则会抵抗NIC对HNK-1+细胞的诱导效应,说明NIC很可能通过调控SIRT1信号通路介导神经嵴细胞的分化过程。也有研究表明,通过调节Rho激酶(Rho-associated kinase,ROCK)/Myosin Ⅱ通路,可以不依赖WNT/β-catenin信号影响神经嵴细胞的分化命运[31]。NIC对ROCK、酪蛋白激酶1等多种激酶也具有抑制活性[20],其对神经嵴细胞的诱导分化作用是否也部分通过调控ROCK/Myosin Ⅱ进行,仍需要进一步研究证实。此外,作为维生素B3的酰胺形式,NIC具有多种生物学功能,广泛参与细胞营养、抗氧化、抗凋亡等生物学过程,其是否也参与了神经嵴细胞的体外维持也需要加以验证。
综上,本研究发现NIC可以用于高效生成hESCs来源神经嵴细胞,为其他眼部神经嵴衍生细胞的进一步诱导分化提供稳定的细胞来源支持,也为神经嵴细胞相关的疾病治疗,如角膜内皮移植提供了新的种子细胞来源。
利益冲突所有作者均声明不存在利益冲突
志谢感谢陆军军医大学第一附属医院眼科阴正勤教授提供H1细胞系
作者贡献声明段豪云:参与设计实验、实施研究、采集/分析数据、起草及修改文章;李文静、贾艳妮、赵灿:实施研究、采集/分析数据;周庆军:参与选题的确定;李宗义:参与实验设计的把控、文章审阅及定稿

