镉污染土壤中生物炭对紫花苜蓿镉吸收、土壤性质及氮矿化的影响
夏广英, 高庚渠
(河南质量工程职业学院,河南平顶山 467000)
由于集约化农业迅速发展和土壤地质高背景,农业土壤中重金属污染程度日益严重,其中镉(Cd)污染是胁迫农田健康的主要重金属之一[1]。镉(Cd)具有高移动性和高毒害性等特征,可对农业生产构成严重威胁,同时通过食物链进一步威胁牲畜和人类健康,因此迫切需要采用生态友好的方法对污染土壤进行修复[2]。作为绿色友好的修复措施,植物修复技术可有效去除污染物[3]。紫花苜蓿(MedicagosativaL.)是世界范围内被广泛用作修复重(类)金属的功能植物,相对于其他修复植物紫花苜蓿具有根深蒂固、高产、耐旱等诸多明显优势[4]。生物炭是废弃物、畜禽粪便和污泥等生物质材料在限氧或无氧条件下,经热裂解得到的一种富碳产品[5]。研究表明,生物炭由于其多孔结构、较大的比表面积、较高的表面电荷密度以及高pH值,可以有效吸附和固定重金属离子[6],目前已广泛运用于修复镉(Cd)、铅(Pb)、铬(Cr)等金属离子污染的土壤。
对于农业土壤修复,除了去除或钝化土壤污染物外,还应关注土壤养分保持和生物地球化学循环的作用[7]。土壤养分受植物摄入量和根系分泌物调节,功能性植物可以通过改变土壤物理结构来影响有机质分解、养分释放和土壤呼吸等[8]。因此,植物修复可以显著改变受污染土壤的理化性质,从而影响功能微生物的丰度,进而影响土壤的生物地球化学循环[7,9]。土壤氮(N)矿化是地球生物化学N循环的重要过程,主要由功能性微生物介导[10]。作为N矿化的重要表征,蛋白酶在分解土壤蛋白质以提供矿物质氮方面发挥着关键作用[11],编码土壤蛋白酶的功能基因包括nprA和aprA基因,除蛋白酶外,几丁质酶亦参与了土壤有机质中矿物N的释放,微生物中编码几丁质分解酶的关键功能基为chiA基因[12]。属于水解酶的土壤蛋白酶和几丁质酶可以反映整个土壤微生物的活性,同时皆参与了污染物的转化和降解[13]。众多研究表明,蛋白酶和几丁质酶在恢复土壤生态系统服务中扮演着极其重要的角色。
此外,功能性氨氧化古菌(AOA)和细菌(AOB)对土壤污染物反应较为敏感,因此相对于其他生化过程,由于功能多样性较低,土壤矿化对不同类型污染源的敏感性存在差异[14]。因此,N素矿化率(Rm)是反映功能微生物丰度、土壤理化性质和污染物含量的重要表征,已被广泛用作量化土壤环境质量的有效指标[7]。尽管一些研究已经报道了污染土壤中N矿化速率的变化特征,然而很少有研究同时关注酶活性和相应的功能基因丰度。基于此,本研究通过盆栽试验探讨了Cd污染土壤中生物炭对紫花苜蓿镉吸收、土壤性质及氮矿化相关基因的影响,研究结果可为生物炭和植株修复广泛运用于修复污染土壤提供理论依据。
1 材料与方法
1.1 试验地点与材料
试验于2021年4—7月在河南质量工程职业学院研究场地温室中进行,棚中昼/夜平均温度为 28 ℃/19 ℃,相对湿度为75%。
供试紫花苜蓿种子来自河南省农业科学院,紫花苜蓿种子在体积分数10%的过氧化氢溶液中进行表面消毒,在黑暗中潮湿的滤纸上催芽24 h。供试生物炭来自河南省生物炭工程技术研究中心,采用玉米和小麦秸秆(质量比1 ∶2)在低氧、450 ℃条件下连续炭化60 min制得,其基本性质为:全碳含量49.5%,总氮含量2.15%,比表面积为15.48 m2/g,容重为0.27 g/cm3,pH值为8.32,主要官能团为羟基、烷烃和酰胺基。
供试土壤取自河南省平顶山某镉污染农田土壤0~20 cm表层。土壤类型为褐土,pH值为8.06,土壤全Cd含量为5.28 mg/kg,根据国家标准环境质量标准(GB 15618—1995),pH值>7.5,Cd含量>1 mg/kg,即为镉超标,该农田土壤Cd含量为限额的5.28倍。土壤理化性质为:有机质含量 20.26 g/kg,全氮含量1.05 g/kg、碱解氮含量140.86 mg/kg,有效磷含量17.52 mg/kg,速效钾含量115.61 mg/kg。
1.2 试验设计
试验采用完全随机设计,设置5个处理分别为,MX:单独种植紫花苜蓿;MX+BC1:种植紫花苜蓿+1%生物炭;MX+BC2:种植紫花苜蓿+2%生物炭;MX+BC4:种植紫花苜蓿+4%生物炭;不种植苜蓿植物修复和不添加生物炭的为空白对照处理(CK);其中1%、2%、4%生物炭指添加生物炭质量与盆栽用土质量的百分比。每个处理3次重复。每盆装土2 kg。将相应处理的生物炭比例与土壤提前混合均匀。每盆播撒种子3粒(按田间种植密度8×107粒/hm2),保持70%土壤持水量。种植期间不定时加入自来水,其他管理措施同作物培育方法,试验培育期90 d。
1.3 样品采集及测定分析
1.3.1 植株生物量、Cd含量及土壤Cd含量测定 培育结束后收获紫花苜蓿植株,采用清水小心清洗根系,将苜蓿不同部位分离,小心快速冲洗,然后置于烘箱中105 ℃杀青30 min,70 ℃烘干至恒质量并称质量记录。采用石墨炉-原子吸收光谱法测定植物提取物中的Cd浓度。
称取1.00 g土壤样品于Teflon PFA窄口瓶中,加入2 mL HNO3和2 mL 30% H2O2在封闭条件下高温消解得到消解样品。采用电感耦合等离子体光谱仪(ICP-OES)测定土样中的Cd浓度。
1.3.2 土壤理化性质、土壤酶活性测定 采用奥豪斯ST3100/F型pH值计进行土壤pH值测定(水 ∶土=2.5 ∶1),采用K2Cr2O7氧化还原滴定法测定土壤有机碳(SOM)含量,总氮(TN)含量采用半微量凯氏定氮法测定,速效氮含量采用碱解扩散法测定,阳离子交换量(CEC)采用EDTA-铵盐快速法[15]测定。
土壤中性蛋白酶活性(SNPA)、碱性蛋白酶活性(SAPA)及土壤几丁质酶活性(SCA)分别采用试剂盒BC0275、BC0880及BC1935-100T/48S测定(Solarbio,北京)。

1.3.4 土壤酶活基因及功能基因丰度测定 称取新鲜土壤样品500 mg,采用FastDNA®SPIN土壤试剂盒(MP Biomedicals,USA)提取土壤DNA。并用NanoDrop ND-1000紫外-可见分光光度计(NanoDrop Technologies,Wilmington,简称DE)采用紫外分光光度法检测DNA质量和浓度,并将DNA 悬浮液保持在-20 ℃环境。采用实时荧光定量 PCR (RT-PCR) 测定土壤氮循环中关键酶基因的丰度,土壤酶活基因(nprA、aprA、chiA)引物参考Man[17],AOA及AOB基因引物为常规(古)细菌氨氧化基因引物[18](表1)。使用SYBR GREEN PCR Master Mix(Toyobo,Osaka,Japan)和Bio-Rad CFX96光学实时检测系统(Bio-Rad Laboratories,Inc. Hercules,CA)上进行RT-PCR反应。反应体系为20 μL,包括10 μL SYBR® Premix ExTaqTM(TaKaRa Biotech,中国大连)、7.6 μL ddH2O、0.2 μL 正向引物(10 μmol/L)、0.2 μL反向引物(10 μmol/L)、2.0 μL模板DNA。qRT-PCR反应步骤为:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。通过对含有评估基因的纯化质粒进行10倍连续倍比稀释(101~108倍)获得标准曲线。每个反应组都运行包含无菌ddH2O作为模板的空白对照,标准曲线的R2值范围为0.991~0.999。

表1 实时定量 PCR的引物序列信息
1.4 数据处理与统计分析
采用Microsoft Excel 2016进行数据整理,采用SPSS 22.0进行检验分析(α=0.05),采用Origin 9.1进行图形绘制。
2 结果与分析
2.1 镉污染土壤中生物炭对紫花苜蓿生物量累积及镉吸收的影响
由表2可知,紫花苜蓿地上部生物量、根系生物量及总生物量均表现为生物炭MX+BC1、MX+BC2、MX+BC4处理皆显著大于单一苜蓿种植处理(MX),且生物炭处理中,皆表现为随着生物炭用量增加生物量累积量降低,各处理生物量顺序皆呈 MX+BC1>MX+BC2>MX+BC4>MX处理,与 MX+BC1处理相比,地上部生物量、根系生物量及总生物量分别显著降低27.24%~68.93%、29.12%~72.97%、27.77%~70.07%。在根系Cd浓度中,与MX处理相比,MX+BC1、MX+BC2、MX+BC4处理分别显著降低23.25%、27.33%、26.02%;地上部Cd浓度表现为MX+BC4>MX+BC1>MX>MX+BC2处理,但处理间无显著差异。各处理植株Cd累积量与根系生物量累积规律基本一致。

表2 镉污染土壤中生物炭对紫花苜蓿生物量累积及镉吸收的影响
2.2 镉污染土壤中生物炭及紫花苜蓿对土壤理化性质的影响
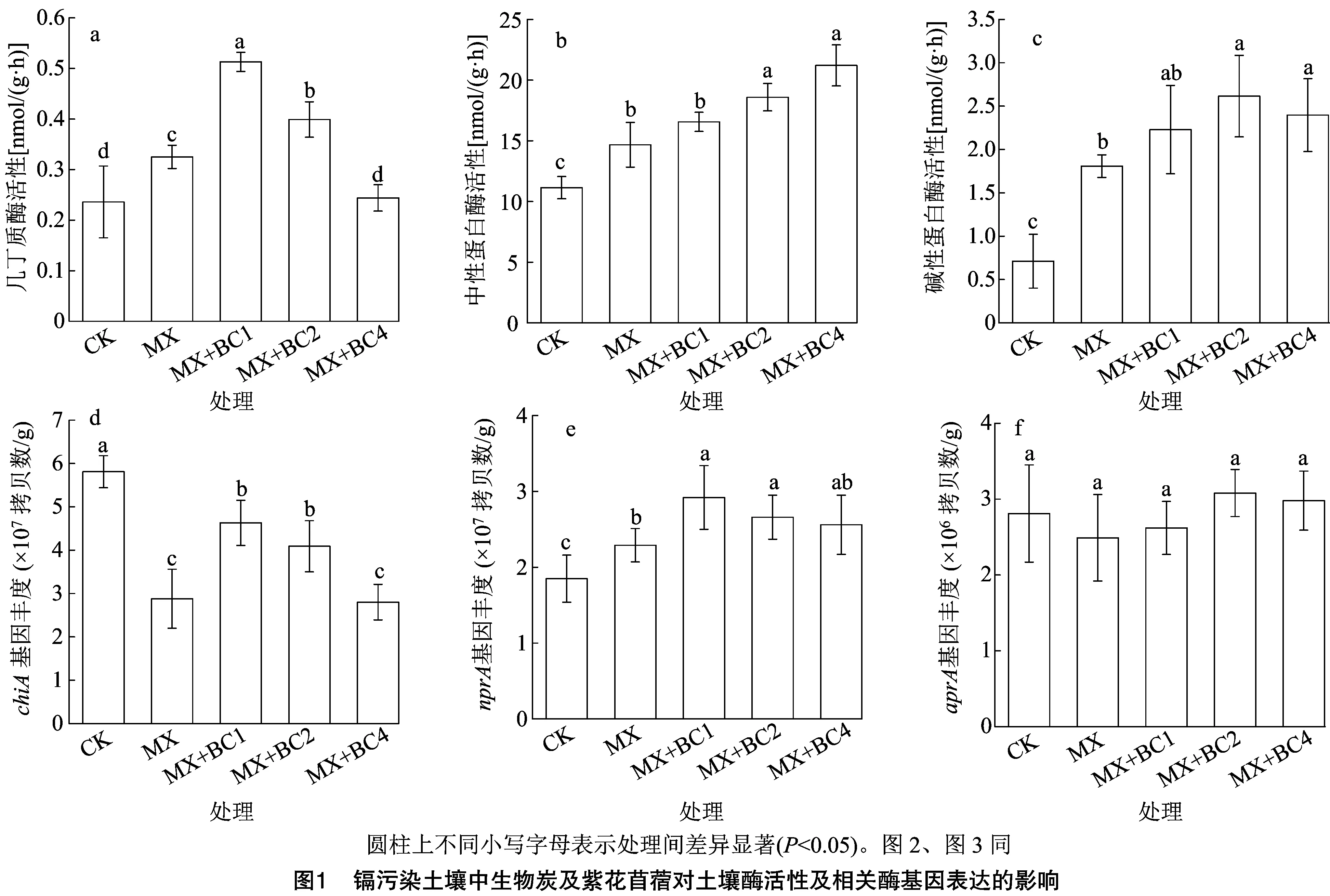
由表3可知,pH值整体以生物炭处理MX+BC1、MX+BC2、MX+BC4大于CK、MX处理,其中MX+BC4处理显著大于CK、MX处理。土壤有机质中,不同处理呈MX+BC4>MX+BC2>MX+BC1>MX>CK处理,且较MX+BC4处理相比,MX+BC2、MX+BC1、MX、CK处理分别显著降低9.87%、15.07%、17.35%、20.67%。阳离子交换量中,MX处理显著大于CK,且生物炭处理均显著高于CK、MX处理。各处理全氮含量、速效氮含量规律基本一致,即生物炭处理MX+BC1、MX+BC2、MX+BC4皆显著小于CK、MX处理,由于表现在速效氮指标中,且上述3个指标中生物炭处理间无显著差异。土壤有效Cd浓度中,以苜蓿+生物炭处理MX、MX+BC1、MX+BC2、MX+BC4较低,皆显著低于CK,同时生物炭处理间呈MX+BC4 表3 镉污染土壤中生物炭及紫花苜蓿对土壤理化性质的影响 相关酶活性中,土壤几丁质酶以MX+BC1处理活力最大,MX+BC2处理其次,二者差异显著且皆显著大于其他处理,同时CK、MX+BC4这2个处理显著低于MX处理(图1-a)。由图1-b可知,各处理中性蛋白酶活性表现为MX+BC4>MX+BC2>MX+BC1>MX>CK处理,较CK相比,苜蓿及生物炭处理MX、MX+BC1、MX+BC2、MX+BC4显著提高31.69%~90.39%。土壤碱性蛋白酶活性仍以CK最低,MX+BC2、MX+BC4、MX+BC1、MX处理较其分别显著提高267.79%、236.99%、213.50%、154.29%。 相关酶基因丰度中,chiA基因丰度以CK最高,其他处理较其显著降低20.31%~51.81%,此外,MX、MX+BC4处理显著低于MX+BC4、MX+BC4这2个处理(图1-d)。nprA基因丰度中,整体以生物炭处理MX+BC1、MX+BC2、MX+BC4较高,均显著高于CK,且MX+BC1、MX+BC2处理显著大于MX处理(图1-e)。aprA基因丰度中,各处理呈MX 由图2-a可知,AOA-amoA基因中,以CK丰度最低,1.35×108拷贝数/g,MX、MX+BC1、MX+BC2、MX+BC4处理较其显著增加31.85%、77.78%、104.44%、51.11%,其中CK与MX+BC1、MX+BC2、MX+BC4均存在显著差异。AOB-amoA基因中,以CK丰度最低,显著低于其他处理,且各处理呈MX+BC4>MX+BC2>MX+BC1>MX>CK处理,MX+BC4处理显著高于其余各处理(图2-b)。而在AOA-amoA/AOB-amoA中,CK、MX、MX+BC1、MX+BC2处理间差距较小,处理间无显著差异;以MX+BC4处理比例最低,CK、MX、MX+BC1、MX+BC2较其分别显著提高68.35%、49.89%、62.50%、76.02%。 由图3可知,氮矿化率以生物炭处理MX+BC1、MX+BC2、MX+BC4大于CK、MX处理,且生物炭处理间表现为MX+BC1>MX+BC2>MX+BC4处理,且MX+BC1处理显著大于MX+BC4处理。以CK矿化率最低,MX处理较其显著提高58.55%。与单一紫花苜蓿处理MX相比,MX+BC1、MX+BC2、MX+BC4处理分别显著提高270.62%、235.04%、182.75%。 从表4可以看出,Rm与全氮(TN)、速效氮(AN)土壤有效Cd浓度(A-Cd)均呈极显著负相关,Rm与pH值、有机质(SOM)、碱性蛋白酶(SAPA)、nprA、AOB-amoA呈极显著正相关,与AOA-amoA呈显著正相关。A-Cd与土壤性质、功能基因丰度之间的相关性分析则和Rm相反。由表5可知,在Rm与相关功能基因的逐步回归分析中,回归模型为Rm=18.27×AOB-amoA+6.92×10-7×nprA-5.45,且P<0.01,同样,Rm与有效Cd浓度的逐步回归分析显示Rm与A-Cd浓度存在对数关系,且P<0.01。 土壤Cd污染已成为制约农业安全发展的重要因素,物理修复和植物修复已被证明可极大地作用于土壤Cd修复[19-20]。本研究中,在Cd污染土壤中,紫花苜蓿地上部生物量累积大于根系,而在Cd浓度分布趋势则反之,且在植株Cd累积量中,表现为MX+BC1>MX+BC2>MX+BC4>MX处理,这意味着紫花苜蓿的修复作用涉及根系的吸收富集,从而从根部转移到地上部,然后在地上组织中积累,生物炭可进一步促进紫花苜蓿的修复效果。从植物吸收和土壤微生物的利用角度来看,有效重金属含量是决定植物组织中重金属的吸收和累积的重要因素[21]。本研究结果表明,紫花苜蓿植物修复处理均显著降低了土壤有效镉含量,造成这种现象的原因可能是:(1)苜蓿根系分泌物与Cd络合,降低了有效Cd含量[22];(2)紫花苜蓿根系可以吸附金属离子,且改变土壤微生物群落,从而进一步固定更多的重金属Cd[23]。 表4 氮矿化速率与土壤性质、功能基因丰度之间的相关性分析 表5 氮矿化速率与功能基因丰度、有效镉(A-Cd)之间的逐步回归分析 土壤氮含量、有机质及阳离子交换性能等土壤特性会显著影响土壤氮素代谢微生物活性、生物量和群落结构,从而影响氮素矿化等过程[7]。本研究中,单一紫花苜蓿种植或与生物炭组合施用均改变了一系列土壤特性,即苜蓿种植显著增加了SOM、CEC含量,并且相对于苜蓿单一种植,应用生物炭进一步提高了SOM、CEC含量。然而,生物炭及紫花苜蓿提高SOM的机制可能不同,前人研究表明,苜蓿具有广泛的主根系统,苜蓿根系分泌物(碳水化合物、酚酸和脂质)有利于根际微生物的建立,具有促进土壤微生物生物量和活性的潜力[22],因此苜蓿种植可通过功能性微生物(如根瘤菌和丛枝菌根真菌)作用的生物效应增加SOM含量[24],而生物炭则主要通过非生物功能增加SOM含量。 作为N矿化的重要表征,蛋白酶在分解土壤蛋白质以提供矿物质氮方面发挥着关键作用[25]。本研究中,紫花苜蓿处理的蛋白酶(中性、碱性)和几丁质酶活性高于对照,这可能是由于土壤蛋白酶和几丁质酶由土壤细菌和真菌活动所介导[4],在植物修复后细菌和真菌的生物量增加[21],蛋白酶和几丁质酶因此增加。另一方面,紫花苜蓿生长需要从试验土壤中摄取矿质N并降低有效N含量[23],这可能对土壤N矿化产生正反馈效应并进一步刺激酶活性[11,25]。土壤酶的整个生物学过程包括DNA复制、mRNA转录和蛋白质表达[17]。重金属Cd可能对mRNA 转录产生有害影响并下调功能基因表达[26]。本研究结果表明,CK土壤有效Cd浓度最高,各处理的相关土壤酶基因的绝对丰度波动不大。然而,尽管CK中aprA和chiA基因丰度与单一苜蓿处理(MX)中的差距不大,但CK的酶活性更低,这意味着蛋白质转录过程受到Cd抑制。本研究中,添加生物炭处理MX+BC1、MX+BC2、MX+BC4对3种酶活性和相应的酶功能基因丰度整体提高,这与前人的研究结果[27]趋于一致。原因可能是添加生物炭后改变了土壤特性如土壤持水能力、pH值和SOM含量,从而影响mRNA转录和蛋白质表达[28]。 氨氧化古菌基因(AOA-amoA)和细菌功能基因(AOB-amoA)是反映土壤微生物性N转化的重要表征。Ribbons等研究表明,土壤氮转化尤其是氮矿化过程受AOA-amoA、AOB-amoA介导[29]。相关研究表明,土壤氮矿化率活性主要与AOA-amoA相关[23]。本研究结果表明,苜蓿种植处理的AOA-amoA、AOB-amoA丰度皆整体高于CK,且AOA-amoA基因丰度始终高于AOB-amoA,这与之前的研究结果一致,即基于植物修复可以显著刺激受污染土壤中AOA类固氮微生物的繁殖及其功能活性[30]。氮素矿化率单一苜蓿处理显著高于CK,而生物炭处理显著大于上述2个处理,表明生物炭在促进土壤氮矿化中具有显著的促进作用。相关性分析表明,Rm与AOA-amoA、AOB-amoA皆呈明显正相关,且与AOB-amoA关系更密切。此外,本研究结果表明,AOA-amoA/AOB-amoA的比值与土壤有效Cd含量之间存在正相关关系,表明土壤AOB对Cd的生物毒性比其古细菌更敏感。逐步回归分析表明,AOB-amoA基因比其AOA-amoA更能影响Rm,表明AOB是影响农业土壤中的土壤氮素转化的主要功能菌类[23,31-32]。
2.3 镉污染土壤中生物炭及紫花苜蓿对土壤酶活性及基因丰度的影响
2.4 镉污染土壤中生物炭及紫花苜蓿对土壤氮转化基因丰度的影响
2.5 镉污染土壤中生物炭及紫花苜蓿对土壤氮矿化率的影响
2.6 氮矿化速率与土壤性质、功能基因丰度之间的关系


3 讨论与结论