肺炎支原体SAT 检测的室内质量控制与室间质量评价
王 冰 许佳音 李亚迪 刘子晗 韩欣洋 魏光灿 郝军荣,2 李 双 董明纲 刘心星
1.河北北方学院药学院,张家口,075000,中国
2.河北省神经药理学重点实验室,张家口,075000,中国
3.张家口健垣精准医学有限公司,张家口,075000,中国
4.河北北方学院学报编辑部,张家口,075000,中国
支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)是一种主要的非典型肺炎,在流行病期间,肺炎支原体(mycoplasma pneumoniae,MP)在普通人群中引起20% 至40% 的社区获得性肺炎(communityacquired pneumonia,CAP),在封闭人群中高达70%[1]。而且MPP 好发于儿童或青少年,在门诊患儿中约20%~40%感染MP,而住院CAP 患儿中感染率约为10%~20%[2-3],发病无明显季节性[4]。并且MPP 有一定的传染性,有临床统计显示,自二十世纪九十年代以后支原体肺炎有大流行趋势[5]。其发病机制主要是肺炎支原体直接与间接损伤,导致支原体吸附在呼吸道黏膜上皮细胞引起氧化应激反应或者引起呼吸系统以外的反应及免疫功能抑制或紊乱等[6]。支原体肺炎临床上以发热、无痰或者少痰的持续性咳嗽为主要表现,也有厌食、胸骨下疼痛等特征,从症状上很难与其他肺炎相区别。对MP 进行早期快速诊断不仅可以降低并发症的发生率,也可遏制其继续传播,减轻患者及家人的痛苦。RNA 实时荧光恒温扩增检测技术(simultaneous amplification and testing,SAT)可以用于MP 感染早期诊断。
SAT 是以rRNA 为靶标,与带有T7 启动子的引物结合,开始逆转录为cDNA;在M-MLV RT 酶的R Nase H 活性下,靶标RNA 链降解,形成单链cDNA;之后反向引物与cDNA 结合,在M-MLV RT 酶的聚合酶活性作用下,产生靶标核酸(RNA)的一个双链DNA 拷贝,且该双链带有T7 启动子,在T7 RNA 聚合酶的作用下,一条DNA 双链上产生多个(100~1 000 个)RNA 拷贝;每一个RNA 拷贝再从反转录开始下一个扩增循环;同时,带有荧光标记的探针和拷贝的RNA 特异结合,产生荧光。检验结果根据实时荧光信号的出现时间和强度,对检验结果进行判定。
与传统的PCR 检测DNA 技术相比SAT 技术具有更高的准确性。并且MP-DNA 提取采用煮沸裂解法,而MP-SAT 的提取采用磁珠提取法,相关研究证实,磁珠法的提取效率是煮沸裂解法的10 倍[7],大大缩短了检验所需时间,可以达到快速诊断的要求。且通过林苗苗[8]等研究可知,MP-SAT 检测对MP 感染的诊断敏感度、特异度及准确率均高于MP-DNA,可以明显缩短窗口期,对支原体肺炎的早期快速诊断具有重要意义。
本研究在张家口健垣医学检验实验室采用SAT 检测方法对MP 进行检测,结合质控品、阳性对照、阴性对照以及内标信号检测结果的比较验证实验方法的精密度和准确性以完成室内质量控制(internal quality control,IQC),并将对质控品的检测结果与天津儿童医院儿研所分子实验室提供的MP 标本检测结果进行比较进行室间质量评价(external quality assessment,EQA)。
1 材料与方法
1.1 实验材料
1.1.1 试剂
MP 核酸检测试剂盒,批号:2018.01.01,上海仁度生物科技有限公司提供;试剂盒A:裂解液、核酸提取液、洗涤液;试剂盒B:反应液、酶液、检测液、阳性对照、内标、阴性对照;0.9%生理盐水。
1.1.2 仪器
TL-998 实时荧光定量PCR 仪,西安天隆科技;HWS-24 电热恒温水浴锅,上海一恒科技;Mini-6k 微型离心机,常州梅香仪器;QL-901 漩涡混匀器,上海双旭科技;BHC-1300IIB2 生物安全柜,上海一恒科技;移液器,大龙科技;TU-100C 干式恒温仪,上海一恒科技;5~120 μL 连续加样枪,大龙医疗。
1.2 实验方法
1.2.1 标本处理
将天津儿童医院儿研所分子实验室提供MP 的9例样本与适量的生理盐水混匀,将此混合液和裂解液按照1∶1 比例(各取500 μL)混匀备用,即为待测样品。
1.2.2 试剂准备
将试剂盒A 和B 置于室温下溶解,充分混匀。并将试剂盒B 内各试剂充分溶解后离心,放到桌面静置备用。其中检测液要避光保存,且所有试剂应避免反复冻融。
扩增检测液的准备:以每个样品40 μL 反应液和25 μL 检测液的比例,配制所需扩增检测液,混匀,3 000~4 000 rpm 离心10 秒备用。
稀释内标:取90 μL 裂解液于EP 管内,再加入10 μL内标,进行10 倍稀释,混匀备用。
质控品稀释:取质控品10 μL,加入90 μL 的裂解液混匀,作为阳性对照。取上述阳性对照40 μL,再加入360 μL 的裂解液进行10 倍稀释;在稀释10 倍质控品的基础上再稀释10 倍,进行100 倍稀释。同理再进行1 000 倍稀释,其中100 和1 000 倍稀释分别准备四管。
1.3 操作流程
将MP 质控品进行10 倍稀释后作为阳性对照,并在阳性对照的基础上进行10 倍、100 倍和1 000 倍的稀释,其中100 倍和1 000 倍稀释重复进行四次,与阴性对照和阳性对照在相同条件下,采用SAT 法对进行检验,观察曲线,检测灵敏度和精密度。并将天津儿童医院儿研所分子实验室提供MP 的多例样本,进行检测。
1.3.1 质控样品准备
首先准备11 个1.5 mL EP 管,以阴性对照、稀释后的质控品和阳性对照的顺序依次标记为阴性对照、质控品10 倍、100 倍A、100 倍B、100 倍C、100 倍D、1 000 倍A、1 000 倍B、1 000 倍C、1 000 倍D 和阳性对照。再准备11 个1.5 mL EP 管,依次标记为阴性对照、MP①、MP②、MP③、MP④、MP⑤、MP⑥、MP⑦、MP⑧、MP⑨和阳性对照。
每管分别加入混匀的100 μL 核酸提取液和10 μL步骤1.2.2 中稀释好的内标。
阴性对照、阳性对照和质控品稀释管中各加入200 μL 的生理盐水和200 μL 的裂解液。
阴性对照管中加入10 μL 的阴性对照,混匀。样本管中加入待测样品400 μL,混匀。阳性对照和质控品稀释管中各加入10 μL相应的阳性对照和稀释的质控品,混匀。
将所有充分混匀的EP 管,置于60℃电热恒温水浴锅中保温5 min,然后再室温放置10 min。
1.3.2 样品RNA 手工提取
将所有EP 管置于磁珠分离装置上,静置5 min,待磁珠清晰地吸附于管壁内侧后,用移液器吸干净管盖和管里的气泡和液体,保留磁珠吸净后应清晰可见磁珠。每管加入1 mL 洗涤液,尽量将磁珠冲洗下来,涡旋混匀。洗涤步骤进行两次。将EP 管移出,每管分别加入40 μL 扩增检测液,涡旋混匀,取30 μL 混悬液于新的微量反应管中待测。
1.3.3 核酸扩增检测
打开荧光检测仪器并完成预热:设定反应条件:温度为42℃,40 个循环,每个循环1 min,荧光素通道设定为F1 和F2,荧光信号每分钟收集一次,反应体系30 μL。
将上述准备好的微量反应管置于已设置好的干式恒温仪中,其中60℃保持10 min,42℃保持5 min,同时将酶也预热到42℃。用连续加样器向每个微量反应管中分别加入10 μL 已预热的酶液,立即盖上管盖,涡旋混匀。微量反应管迅速转至荧光检测仪器,立即启动反应程序,期间不要随意退出界面。
1.4 观察指标
1.4.1 室内质量控制
灵敏度检测:通过观察10 倍稀释、100 倍稀释和1 000 倍稀释质控品的曲线,看稀释曲线是否为较完美的“S”形曲线,是否显示阳性,且随着浓度的减小,观察拟合荧光数据,从而观察检测方法的灵敏度。
精密度检测:观察100 倍稀释的4 条曲线和1 000倍稀释的4 条曲线,通过比较曲线的重复性观察检测方法的精密度。
1.4.2 室间质量评价
将天津儿童医院儿研所分子实验室提供的9 例MP 标本,用SAT 检测方法进行盲测,并将本实验室的检测结果与天津儿童医院儿研所分子实验室提供的结果进行对比,进行EQA。
2 结果与分析
2.1 室内质量控制
2.1.1 灵敏度检测
对比质控品10 倍、100 倍和1 000 倍稀释的曲线,发现1 000 倍稀释的质控品能够检出阳性结果,近似为“S”型曲线,CT 值小于30 循环数,且随着浓度的减小,拟合荧光数据也减小(Fig.1),表明在1 000 倍稀释的情况下,能够检测出具有应用价值的结果,即灵敏度高。
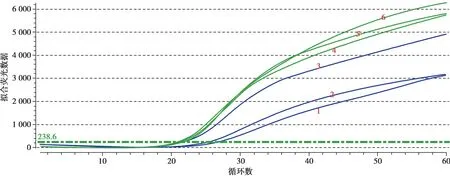
Fig.1 The curves of quality control products diluted at 10、100 and 1 000 are compared
2.1.2 精密度检测结果
对比100 倍稀释的四条曲线(Fig.2);对比1 000 倍稀释的四条曲线(Fig.3),均为“S”形曲线,重复性良好,即精密度高。

Fig.2 Comparison of curves diluted by 100A,100B,100C and 100D

Fig.3 Comparison of curves diluted by 1 000A,1 000B,1 000C and 1 000D
2.2 室间质量评价
以阴性看内标、阳性看靶标的标准观察,发现只有第一个标本为阳性,其余均为阴性(Fig.4、Fig.5),张家口健垣医学检验实验室检测结果与天津儿童医院儿研所分子实验室提供的结果一致(Tab.1),准确度极高,符合EQA 的要求,表明这次室间比对实验通过。
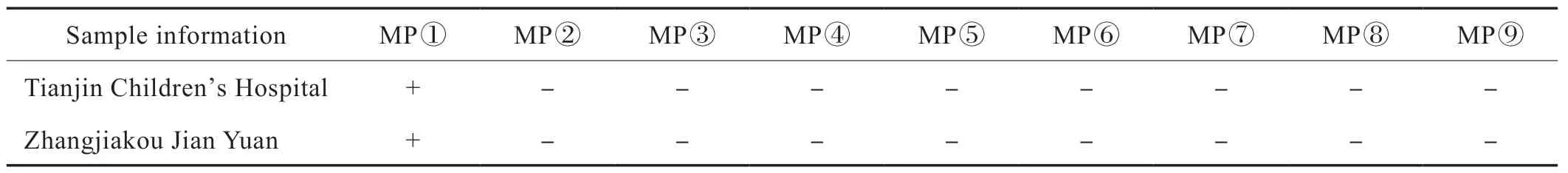
Tab.1 MP-RNA test

Fig.4 Comparison of positive control,MP①,MP②,MP ③,MP④ and negative controls
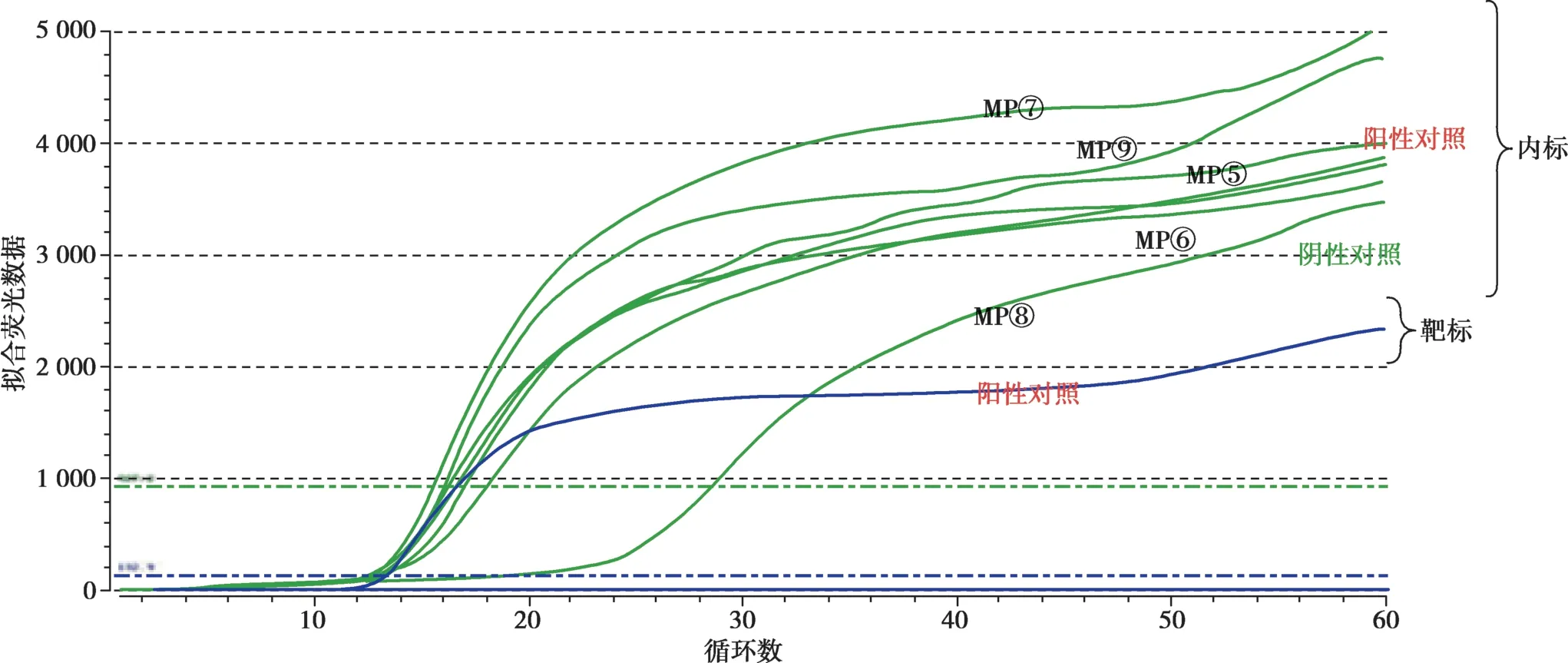
Fig.5 Comparison of negative control,MP⑤,MP⑥,MP⑦,MP⑧,MP⑨ and negative controls
3 讨论与结论
当前用于诊断MP 感染引起的肺炎的方法主要有血清学诊断、分离培养和分子生物学的诊断。MP 分离培养是诊断MP 感染的金标准[9]。然而它的成功培养不仅需要特殊的培养基、严格的实验室卫生环境,还需要耗费长时间进行培养,样本来源的途径等因素对MP感染的诊断也具有重要的影响。并且有结果显示利用分离培养的方法灵敏度仅为60%[10],对于我们要达到早期快速临床诊断的要求相距较远。在我国常通过检测血清学中MP 特异性抗体来判断是否是MP 感染,然而随着试剂盒商品化,患者年龄和标本采集时间等对MP感染的诊断产生影响,Beersma 等[11]以实时定量PCR 为金标准,比较12 种商品试剂盒的灵敏度和特异性的实验中得到证实。抗体检测是目前国内MP 检测的主要诊断手段。然而,单一的血清学检测,无论样本中抗体滴度是否高,对MPP 的早期诊断价值有限[10]。
支原体肺炎缺乏特异的临床和影像学表现,早期不易做出诊断[12],我们急需一种新方法来打破这个僵局。SAT 可在2~3 h 内完成,非常适合MP 的快速检测[13]。它比传统的细菌培养和血清学分析更快,而且重现性良好。所以SAT 作为新型的分子诊断技术,直接以存在活菌体内的MP 病原体的RNA 片段为靶标进行扩增从而达到快速诊断脱颖而出。且无创伤、操作简便、灵敏度高以及能明显缩短窗口期。更值得注意的是,SAT 技术属于活菌检测,不仅可以精确的检测患者体内有无病菌,更可以准确反应病原微生物在体内是否存活与繁殖,便于患者的疗效观察和临床指导用药等优点,被广泛应用于呼吸系统感染的检测中。并有研究表明,MP-SAT 的检测结果与相关研究结果相符[14-16]。在儿童MP 感染时,此方法尤受推崇。
IQC 和EQA 是实验室全面质量管理体系的两个非常重要的环节。其中,IQC 可以监测和控制实验测定系统的精密度,有效的IQC 是保证实验室检测结果可靠的关键因素。IQC 为检验人员按照一定的频度连续测定稳定样品中的特定组分,并采用一系列方法进行分析,按照统计学规律推断和评价本批次测量结果的可靠程度,以此判断检验报告是否可发出,及时发现并排除质量环节中的不满意因素[17]。将IQC 的数据同实验室间进行对比,能同时提供正确度和精密度的信息,可用于评价实验室的检测的质量。
本研究依据2012 版《医学实验室质量和能力认可准则》和2012 版《医学实验室质量和能力认证准则》对医学实验室检测系统性能评价的相关要求,对SAT 定性检测项目的分析性能进行评价。通过实验室内用SAT检测MP 的方法灵敏度、精密度都好,说明实验方法符合验证要求。将用SAT 对MP 的检测结果与天津儿童医院儿研所分子实验室进行EQA,结果显示,在目前的实验条件和方法下,本实验室用SAT 方法检测MP 的数据准确可靠。要想达到这样结果,需要对实验室的实验人员进行严格培训,并对正确的样本采集、留取、操作和保存以及对实验室内的温度、湿度、压力等进行严格控制,而且需要保证实验使用的设备与试剂均符合要求。
本研究结果显示:IQC 的验证是通过观察灵敏度、精密度和准确度来进行验证,结果显示良好,符合对IQC 的要求,表明本实验室对SAT 定性检测MP 的分析符合;通过与天津儿童医院儿研所分子实验室提供的结果进行EQA,显示结果一致,表明本实验室对SAT技术检测MP 的EQA 通过验证,该SAT 技术检验MP能够在本实验室投入使用。

