SWI、3D-ASL及IVIM鉴别高低级别脑胶质瘤的研究
杜常月 齐旭红 温智勇 王仁贵,*
1.首都医科大学附属北京世纪坛医院放射科(北京 100038)
2.首都医科大学电力教学医院放射科 (北京 100073)
脑胶质瘤的起源是颅内的神经胶质细胞,可分为4级:Ⅰ、Ⅱ级为低级别胶质瘤,Ⅲ、Ⅳ级为高级别胶质瘤[1]。目前临床的治疗方式主要是手术和标准放化疗,通常低级别脑胶质瘤的预后比较好,而高级别脑胶质瘤患者容易复发[2]。所以术前评估肿瘤的级别对指导治疗及评估预后有重要的临床意义。
磁共振成像是肿瘤诊断、术后随访必不可少的成像工具。磁敏感加权成像(即SWI)可以反映瘤灶所在区域的血管生成和出血,对胶质瘤进行分级有重要作用[3]。三维动脉自旋标记成像(即3D-ASL)能够无创地评估瘤灶内的微循环和肿瘤血管生成,并量化肿瘤灌注异常情况[4-5]。Le Bihan等[6-7]提出的体素内不相干运动(即IVIM)是一种双指数模型,不需要注射外源性的对比剂,就可以获得水的分子扩散和毛细管网中血液的微循环信息,能够帮助鉴别高级别与低级别脑胶质瘤。
本研究通过使用3.0T磁共振扫描仪,对脑胶质瘤患者增加SWI、3D-ASL及IVIM扫描,探讨三种技术在鉴别高级别与低级别脑胶质瘤中的意义。
1 资料与方法
1.1 一般资料本研究为回顾性研究,本研究经过国家电网公司北京电力医院医学伦理委员会批准(批准文号:ky-2018-014-1),免除受试者知情同意。选取2016年5月至2018年2月期间到院就诊的病例共计97例(男性55例,女性42例,平均年龄约47.88岁),其中低级别患者35例,高级别患者62例。所有病例均经过手术进行切除,且术后病理证实为胶质瘤,并于术前完成了头颅磁共振平扫及增强扫描,同时增加了SWI、3D-ASL及IVIM序列的扫描。排除标准:MR扫描禁忌症。
1.2 方法本研究应用的设备是GE Discovery 750W 3.0T 磁共振扫描仪。扫描序列包括:(1)常规MRI平扫:T1加权成像(TE 24.0 ms,TR 2087.4 ms)、T2加权成像(TE 104.0 ms,TR 5281.0 ms)、T2脂肪抑制成像(TE 95.0 ms,TR 9000.0 ms),层厚5.0 mm,层间距1.5 mm,FOV是 24 cm×24 cm。(2) SWI序列参数:TE 22.9 ms,TR 38.3 ms,FA 15°,视野 24.0 cm×21.6 cm,NEX为0.69,层厚2.0 mm,无层间距。(3) 3D-ASL序列参数:TE 10.7 ms,TR 4683.0 ms,带宽62.5 KHz,矩阵512×512,NEX=3,Post Lable Delay 1525.0 ms,层厚4.0 mm,层数40,无间隔,扫描时间4 min 32 s。(4)IVIM成像,视野 24 cm×24 cm,矩阵130×160,层厚5.0 mm,层间距1.5 mm,b值分别为0s/mm²、25s/mm²、50s/mm²、75s/mm²、100s/mm²、150s/mm²、200s/mm²、400s/mm²、600s/mm²、800s/mm²、1000s/mm²、1500s/mm²、2000s/mm²、3000s/mm²。扫描所需的头颅线圈采用的是24通道头颅表面线圈。
1.3 数据分析将图像载入GE ADW 4.6工作站进行后处理,测量并记录肿瘤实质区域的各参数值。(1)通过reformat后处理,获得SWI的后处理图像,即最小信号强度投影图(minimum intensity projection,MinIP)。在MinIP 图上,统计瘤灶内肉眼可见的低信号病灶,并进行记录和评分,即肿瘤所在区域的敏感性信号强度(intratumoral susceptibility signal intensity,ITSS)[8]评分。通过Park等人提出的半定量分析方法[8],ITSS评分为以下几个等级:0分为没有ITSS;1分为1~5个点状或细线性低信号;2分为6~10个点状或细线性低信号;3分为11个或更多的点状或细线性低信号。(2)利用Functool软件对3D-ASL图像进行拟合,获得灌注伪彩图像。确定灌注伪彩图像上肿瘤实性部分所在的区域,并分别选择三个50 mm2左右的感兴趣区(region of interest,ROI)进行测量,获得三个瘤灶所在区域的脑血流灌注值,然后取均数。在同一个层面,利用镜像对称的方法,测量肿瘤对侧正常脑白质区、脑灰质区以及镜像区的血流灌注。然后取相对值,获得血流灌注值得相对值,包括:r1 (TBFmax/对侧正常白质区血流量)、r2 (TBFmax/对侧正常灰质区血流量)及r3(TBFmax/镜像区脑血流量)。为了尽可能的避免测量误差,感兴趣区的设置尽可能的避开囊变、坏死。(3)通过利用Functool软件对IVIM图像进行后处理,获得各参数的伪彩图像。分别在各参数(fast ADC、slow ADC、f值)的伪彩图上选取40mm2左右的感兴趣区(ROI),ROI的设置在肿瘤实质区,保证同一患者的ROI大小一致,最终获得ROI的平均值进行记录。为避免误差,ROI的选择尽可能避开囊变、坏死区域。
各参数的测量都是由两位有经验的研究人员测量取得。当两位的测量结果差距比较大时,由另一名高级职称的影像诊断医师进行测量,获得结果。
1.4 统计学方法应用SPSS 17.0统计软件,用Mann-Whitney U 检验对SWI的参数进行统计学分析,P<0.05表示有统计学差异。用两独立样本t检验的方法对3D-ASL及IVIM各参数进行统计学分析,P<0.05表示差异有统计学意义。并采用ROC曲线对SWI、3D-ASL及IVIM各参数以及拟合的三种技术进行分析。
2 结果
脑胶质瘤SWI、IVIM及3D-ASL后处理图像见图1。统计结果表明,SWI的参数ITSS值表现为,在高级别胶质瘤组明显高于低级别胶质瘤组(P<0.05)(见表1)。3D-ASL的参数(包括TBFmax值、r1值、r2值及r3值)表现为,在高级别胶质瘤组明显高于低级别胶质瘤组(P<0.05)(见表2)。IVIM的参数(包括fast ADC值、f值)表现为,在高级别胶质瘤组明显高于低级别胶质瘤组(P<0.05);而高级别胶质瘤组的slow ADC值低于低级别胶质瘤组,差异有统计学意义(P<0.05)(见表2)。

表1 高、低级别脑胶质瘤组的SWI参数表
通过ROC曲线评估SWI、3D-ASL及IVIM在鉴别高低级别胶质瘤中的意义。利用约登指数最大,确定各参数的诊断敏感性、特异性,见表3。并通过拟合,获得三种技术在脑胶质瘤分级中的AUC值、诊断敏感性、特异性(见表4,图3)。
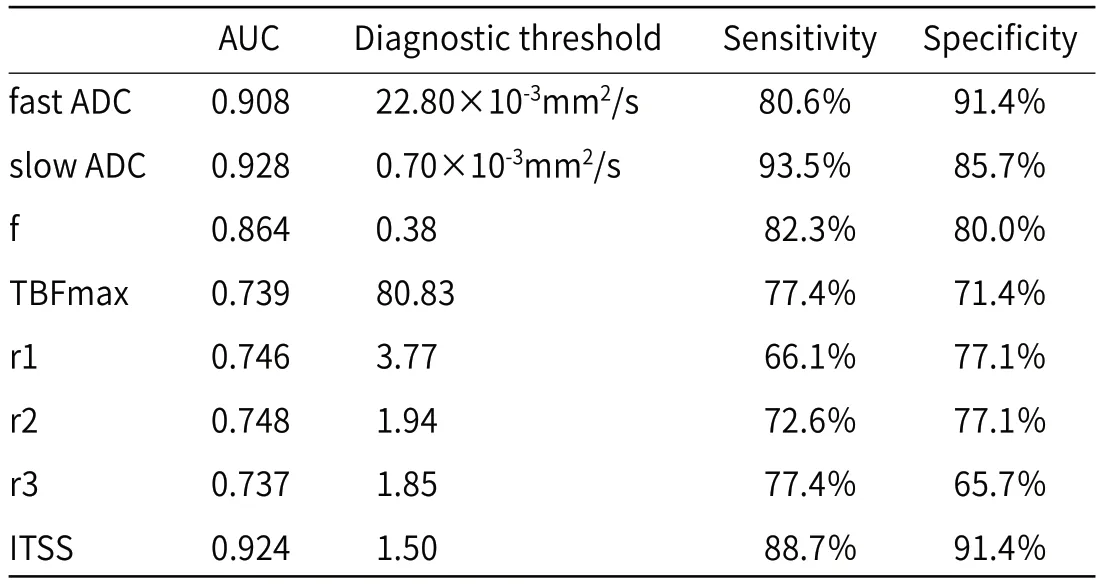
表3 各参数在胶质瘤分级中的效能表
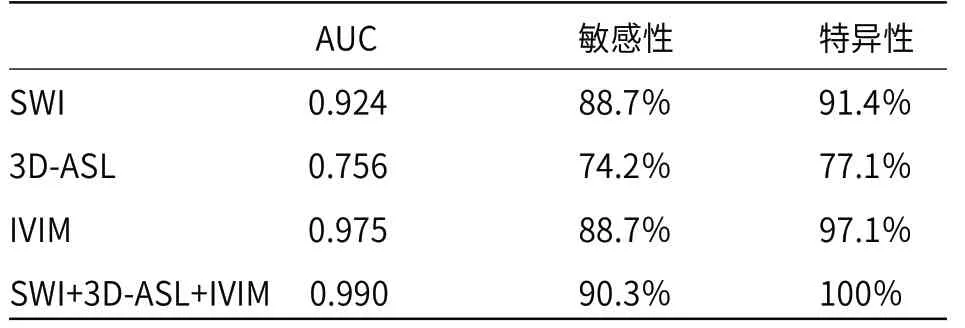
表4 SWI、3D-ASL和IVIM三种技术在胶质瘤分级中的效能表

脑胶质瘤各序列参数图。图1 男,49岁,右侧额叶,少突胶质细胞瘤,WHO II级。图1A:SWI后处理的MinIP图。图1B:IVIM参数fast ADC伪彩图。图1C:IVIM参数slow ADC伪彩图。图1D:IVIM参数f值伪彩图。图1E:3D-ASL的血流灌注图像。图2 女,53岁,右侧额叶,胶质母细胞瘤,WHO IV级。图2A:SWI后处理的MinIP图。图图2B:IVIM参数fast ADC伪彩图。图2C:IVIM参数slow ADC伪彩图。图2D:IVIM参数f值伪彩图。图2E:3D-ASL的血流灌注图像。图3 SWI、3D-ASL和IVIM三种技术鉴别高、低级别胶质瘤的ROC曲线图。
3 讨论
胶质瘤的级别越高,具有细胞增殖、坏死、血管生成以及侵袭性等特点越显著[9],说明肿瘤细胞增殖、病理血管的形成是瘤细胞增殖的必备条件。
SWI对具有磁化作用的血液制品比较敏感,包括铁血黄素和脱氧血红蛋白[10],所以能够明显的显示出小静脉和出血点,并进行放大,反映肿瘤血管的生成及瘤内出血情况,通过后处理得到的SWI Min IP图,可以更好地显示低信号,提高对磁效应差异的敏感性[11]。本研究结果显示,高级别的胶质瘤表现出的ITSS评分值高于低级别,这与以往[12-15]的研究结果一致。这表明,高级别脑胶质瘤的新生血管系统比低级别胶质瘤更加密集,低级别胶质瘤的ITSS评分值一般在2分以下,而高级别脑胶质瘤的ITSS评分一般为2分或3分。然而,本研究中,在低级别胶质瘤组中存在2个患者的ITSS评分值是3。以往有部分研究表明,低级别的胶质瘤小部分可以出现出血的情况[16]。本研究中这种情况的产生,分析原因可能是肿瘤血管形成初期比较薄弱,以至于产生脱氧血红蛋白及出血;或者是由于SWI沉积高浓度的含铁血黄素,导致少量的出血将低信号灶放大[14]。同时,高级别脑胶质瘤组存在7例ITSS低于2分,并且存在1例的ITSS评分值为0。通过观察这例患者的3D-ASL参数值,发现TBFmax为21.69mL/(min.100 g),低于本研究所得的临界值80.83mL/(min.100 g),说明此例肿瘤病灶的血流灌注也比较低,血管生成较少,与SWI相吻合。之前有研究表明,高级别脑胶质瘤的静脉结构存在各种形状、不均匀厚度及成簇情况[15],部分很难达到一定的数量,这可能影响实际的脑胶质瘤分级。
3D-ASL可以用于评估肿瘤的血流灌注情况,反映肿瘤内的微血管生成。通过量化脑血流量值(CBF),预测各级别脑胶质瘤中的血管生成情况[17],评估脑胶质瘤的级别。本研究中,高低级别脑胶质瘤的肿瘤区最大脑血流量TBFmax 及其相对值r1、r2及r3均具有统计学差异。这说明,高级别脑胶质瘤表现为更高的血流灌注,病理血管生成更加丰富,这一点与SWI的结果相吻合。但是,3D-ASL各参数鉴别高低级别脑胶质瘤的曲线下面积均比较低,敏感性和特异性也低于SWI、IVIM的各参数。而且,3D-ASL的诊断效能不如SWI、IVIM。分析原因可能是,新生血管形成并没有引起相应程度的血流灌注增加,可能是因为在高级别胶质瘤中,血脑屏障破坏造成瘤周血管源性水肿,使正常脑组织血流灌注降低[18]。此外,3D-ASL设定的参数,包括标记后延迟、动脉通过时间,很容易影响结果的不准确[19]。
IVIM的双指数模型公式为Sb/S0=(1-f)exp(-bD)+fexp[-b(D*+D)][6],D值(即slow ADC)表示肿瘤内的水分子弥散;D*值(即fast ADC)表示肿瘤血管的微循环灌注;f值表示fast ADC在 IVIM中的百分比。在本研究中:IVIM的参数(包括fast ADC值、f值)表现为,在高级别胶质瘤组明显高于低级别胶质瘤组(P<0.05);而高级别胶质瘤组的slow ADC值低于低级别胶质瘤组(P<0.05)。这与以往的研究结果类似[20-22]。这提示:高级别胶质瘤表现的细胞增殖比较显著,细胞密度及细胞体积更大,细胞间的空间减小,水扩散明显受限[22]。同时说明,高级别脑胶质瘤的瘤内微血管比较密集。此外,这一结果进一步证实了,本研究中所选择的b值具有一定的诊断效能。
本研究涉及的所有参数中,slow ADC值的AUC值(0.928)最大,具有较高的敏感性(93.5%)和特异性(85.7%) 。同时,SWI、3D-ASL及IVIM均可以用来鉴别高低级别脑胶质瘤,而且IVIM模型的AUC(0.975)、敏感性(88.7%)和特异性(97.1%)最高。有研究表明,多参数放射组学模型是较好的脑膜瘤分级预测模型[23],这其中涉及到SWI及ADC值得参数,与本研究中两项检查方式类似。而本研究结果表明,联合三种磁共振技术,可以进行优势互补,能更加准确的评估肿瘤细胞的增殖及血管生成情况,可以广泛适用于临床胶质瘤患者的术前分级。
本研究中存在的不足:3D-ASL的受影响因素较多,无法完全排除,需要未来技术升级,拓展其临床应用。

