力生长因子对牙周膜干细胞增殖分化的影响
屠腾, 刘艳丽, 王惠, 赵萤,2, 张旻
1. 军事口腔医学国家重点实验室 国家口腔疾病临床医学研究中心 陕西省口腔疾病国际联合研究中心 第四军医大学口腔医院急诊与综合临床科,陕西 西安(710032); 2. 西北大学附属人民医院,西安市人民医院(西安市第四医院),麻醉与围术期医学中心,陕西 西安(710100)
牙周组织是人体改建最为活跃的组织之一,这与牙周组织担负咀嚼功能,承载咬合应力有关。大量研究发现,牙周膜细胞的活性高低直接关系到牙周组织的适应性改建能力以及牙周健康状况。正常的咬合力刺激可促进牙周膜自身的改建与再生能力维持,而咬合力缺失可导致牙周膜组织再生与改建能力减弱甚至丧失。牙周膜的改建和再生修复与力学刺激密切相关,但其机制目前尚未完全阐明。研究发现,牙周膜中存在牙周膜干细胞(periodontal ligament stem cell,PDLSCs),具有多向分化的潜能,在牙周膜改建以及再生修复中具有非常重要的功能[1-3]。课题组前期为了探明力对牙周膜改建及修复的影响,模拟咬合力对体外培养的牙周膜干细胞加载力学刺激,发现PDLSCs 中可表达一种促组织再生修复的力生长因子(mechano growth factor,MGF)[4]。
由于MGF 与力学刺激关系密切,课题组前期研究发现MGF 作用下PDLSCs 中的力敏感蛋白Yes相关蛋白(Yes-associated protein,YAP)357 位酪氨酸位点磷酸化水平显著升高。研究发现,YAP 蛋白是一种力学刺激敏感蛋白,广泛存在于细胞内的转录共激活因子[5]。且YAP 为转录辅助因子,并不直接结合DNA 发挥转录调节作用,而主要是依赖DNA 结合因子执行调节基因转录的功能。YAP 蛋白最早在果蝇体内被发现,具有高度保守性,在胚胎的发生发育、干细胞的自我更新以及组织的再生修复中发挥着关键的调控作用[6]。而MGF 作为一种与力相关的生化因子,可以激活力敏感蛋白YAP,其作用和分子机制值得进一步的探讨。本研究采用人工合成的MGF 功能肽段,MGF-Ct24E 肽作用于体外培养的PDLSCs,观察其对细胞增殖分化的影响,并以YAP 为关键分子,探讨MGF 作用下细胞响应的分子机制。
1 材料和方法
1.1 材料
胎牛血清(四季青公司,中国);MGF E 肽(Phoenix 公司,美国);ɑ-MEM 培养基(gibco 公司,美国);小鼠抗人STRO-1 单克隆抗体(Biolegend 公司,美国);抗小鼠IgM 免疫磁珠(MiltenyiBiotec 公司,德国);PE 标记抗人CD29、CD90、CD105、CD34和CD45 抗体(Biolegend 公司,美国);成骨诱导分化培养液、成脂诱导分化培养液、茜素红染液、油红O 染液(Cyagen 公司,美国);CCK8 检测试剂盒、BCA 蛋白定量试剂盒(新赛美公司,中国);兔抗人PCNA、Scleraxis、Osterix 蛋白单克隆抗体(Abcam 公司,英国);兔抗人YAP、P-YAPY357蛋白单克隆抗体(CST 公司,美国);小鼠抗人GAPDH 蛋白单克隆抗体、ECL 化学发光试剂盒、DAPI 染液(壮志公司,中国)。
1.2 PDLSCs 的分离培养、分选与鉴定
取得患者知情同意,收集患者因正畸拔除的健康无龋第一前磨牙,选取患者年龄集中在18 ~30 岁之间,采用酶消组织块法获得原代细胞。该研究已获得空军军医大学口腔医院伦理委员会的伦理豁免。第一次更换培养液为培养后7 d,进行半量更换,随后3 ~4 d 换液1 次,当细胞生长融合度达到80%时,以1∶3 ~1∶4 的比例进行传代。定期在光镜下观察并进行拍照。
取P2 代生长状态良好的细胞,采用免疫磁珠法分选获得STRO-1/MACS(+)细胞,方法简述如下:胰酶消化后,制备单细胞悬液,加入小鼠抗人STRO-1 抗体(1∶50)进行孵育,随后采用抗小鼠IgM 免疫磁珠孵育后,细胞于免疫磁珠分选装置中分选。将分选的STRO-1 阳性细胞接种于培养瓶中,当细胞生长融合度达到80%时,以1∶3 ~1∶4 的比例进行传代。
1.2.1 细胞表面标记物鉴定 取生长状态良好的STRO-1/MACS(+)细胞,胰酶消化后,调整细胞密度为1×107个/mL。将细胞分装至无菌EP 管中,每管200 μL,共6 管,分别加入PE 标记的细胞表面标记物抗体CD34、CD45、CD29、CD90 和CD105,充分混匀后置于4 ℃条件下避光孵育1 h。随后800 rpm离心5 min,弃去上清,加入200 μL 无菌PBS 对细胞进行重悬清洗,该过程重复2次。最后加入200 μL无菌PBS 对细胞进行重悬,采用流式细胞仪对细胞表面标记物的表达进行分析。
1.2.2 克隆形成能力鉴定 取生长状态良好的STRO-1/MACS(+)细胞,胰酶消化后,调整细胞密度为1×103个/mL。向培养皿中加入100 μL 细胞悬液,每3 d 更换一次培养液,14 d 后终止培养。4%多聚甲醛室温固定30 min 后,加入0.1%结晶紫的PBS 室温染色15 min。PBS 冲洗并置于大体下及光镜下观察并拍照。选取含有50 个以上的细胞组成的团块为一个细胞克隆,计算克隆形成率。克隆形成率=细胞克隆数/总细胞数×100%。
1.2.3 多向分化能力鉴定 取生长状态良好的STRO-1/MACS(+)细胞,胰酶消化后,调整细胞密度为1×104个/mL。将细胞接种于6 孔板中,置于孵箱中培养,当细胞生长融合至80%时,更换成骨诱导液及和成脂诱导液,成骨诱导21 d 后进行茜素红染色;成脂诱导14 d 后进行油红O 染色。
1.2.4 生长曲线 取生长状态良好的STRO-1/MACS(+)细胞,胰酶消化后,调整细胞密度为1×104个/mL。将细胞接种于96 孔板中,每孔加入细胞悬液100 μL。共设计9 组,每组6 个复孔,分别于接种后0~8 d采用CCK8法检测细胞活性。0 d为接种后12 h 进行检测,每孔加入CCK8 溶液10 μL,置于孵箱中培养1 h,随后采用酶标仪于450 nm 波长处检测各孔吸光度值(即OD 值),并取平均值。随后每天均于该时间点采用同样方法对细胞进行CCK8 检测,以时间为横坐标,吸光度值为纵坐标,绘制细胞生长曲线。
1.3 CCK8 检测MGF-Ct24E 肽作用下PDLSCs 细胞增殖活性的变化
取生长状态良好的PDLSCs,胰酶消化后,调整细胞密度为1×104个/mL。将细胞接种于96 孔板中,孵箱培养24 h,待细胞贴壁后,更换无血清培养液培养12 h 进行同步化处理。为检测MGF 对PDLSCs 细胞增殖活性的影响,细胞进行分组处理:对照组、10 ng/mL MGF 组、50 ng/mL MGF 组和100 ng/mL MGF 组,每组设置6 个重复样本。按实验分组更换含有不同浓度MGF-Ct24E 肽的无血清培养液,置于孵箱中培养24 h。随后加入CCK8 溶液每孔10 μL,置于孵箱中培养1 h,采用酶标仪于450 nm 波长处检测各孔吸光度值。
1.4 Western blot 检测细胞中PCNA、Scleraxis、Osterix、YAP、P-YAPY357蛋白表达
取生长状态良好的PDLSCs,胰酶消化,完成后加入2 mL 完全培养基终止消化,800 rpm 离心5 min,弃去上清并重悬细胞。将细胞以1×106个/mL接种于12 孔板。共设计4 组:对照组、10 ng/mL MGF 组、50 ng/mL MGF 组和100 ng/mL MGF 组。
待细胞贴壁后更换无血清培养液培养12 h进行同步化处理,随后按设计分组更换含有不同浓度MGF E 肽的无血清培养液,置于孵箱中培养24 h 后提取细胞总蛋白。采用BCA 法检测蛋白浓度后,加入Loading Buffer 煮沸10 min,-80 ℃保存。取等量总蛋白样品,进行SDS-PAGE 电泳,随后将蛋白转移到PVDF 膜上,将膜置于对应一抗中,4 ℃孵育过夜,次日孵育二抗,室温震荡孵育2 h。用条带蘸取发光液,进行显影成像,采用ImageJ 软件进行蛋白条带吸光度进行数据采集。
1.5 免疫荧光检测MGF-Ct24E 肽作用下PDLSCs中YAP 的核定位
取生长状态良好的PDLSCs,胰酶消化,完成后加入2 mL 完全培养基终止消化,800 rpm 离心5 min,弃去上清并重悬细胞。将细胞以1×104个/mL接种于24 孔板。共设计2 组:对照组和50 ng/mL MGF 组。
待细胞贴壁后更换无血清培养液培养12 h 进行同步化处理,随后按设计分组更换含有不同浓度MGF-Ct24E 肽的无血清培养液,置于孵箱中培养24 h 后,弃去培养液、4% 多聚甲醛室温固定1 h,随后弃去固定液,加入封闭液室温封闭20 min,弃去封闭液,加入一抗,4 ℃孵育过夜,次日采用PBST 以1∶500 稀释荧光二抗,室温避光孵育2 h,弃去二抗,随后加入DAPI 工作液,室温避光孵育15 min,荧光显微镜下观察并拍照。
1.6 siRNA 干 扰YAP 的 蛋 白 表 达
选取生长状态良好的PDLSCs,分为control 组、siRNA-NC 组、YAP siRNA 1 组、YAP siRNA 2 组、YAP siRNA 3 组,其中未转染细胞仅加入转染试剂,而转染细胞干扰序列如下:siRNA-NC F: UUCUCCGAACGUGUCACGUTT,R: ACGUGACACGUU CGGAGAATT;YAP siRNA 1 F: GACCAAUAGCUCA GAUCCUUUTT,R: AAAGGAUCUGAGCUAUUGGUCTT;YAP siRNA 2 F: CAGGUGAUACUAUCAACCA AATT,R: UUUGGUUGAUAGUAUCACCUGTT;YAP siRNA 3 F: GCCACCAAGCUAGAUAAAGAATT,R:UUCUUUAUCUAGCUUGGUGGCTT,转染步骤参照Lipofectamine 2000 说明书。转染48 h 后,采用Western blot 检测细胞中YAP 的蛋白水平。选取干扰效率高的siRNA 干扰YAP 的表达后,采用MGFCt24E 肽作用PDLSCs,Western blot 检测细胞中PCNA、Scleraxis 和COL1A1 的表达。
1.7 统计学分析
所有数据采用SPSS 19.0 进行统计分析,使用均数±标准差表示,采用t检验进行两组的比较;采用单因素方差分析进行多个处理组的比较,两两比较采用SNK-q 检验,P<0.05 为差异具有统计学意义。
2 结 果
2.1 PDLSCs 的分离培养、分选与干细胞鉴定
采用酶消组织块法对牙周膜细胞进行分离培养,2 周后可见梭形细胞从组织块周围爬出,细胞迅速增殖,围绕组织块呈放射状排列,培养4 周后可见细胞围绕组织块大量增殖(图1a、1b)。细胞传代后,可见大量梭形细胞。采用免疫磁珠法对传代获得的P2 代细胞进行磁珠分选后,得到大小、形状均一的梭形细胞(图1c),阳性细胞数目为细胞总量的1% ~2%。
对细胞生长曲线进行检测后发现,细胞生长曲线呈“S”形,并且细胞于接种后3 d 开始进入对数生长期,而到6 d 后,细胞生长速度明显降低,进入了平台期(图1d);细胞多向分化能力检测发现,经过成骨诱导21 d 后,茜素红染色可见红色钙结节出现;经过成脂诱导21 d 后,油红O 染色可见红色脂滴出现(图1e、1f);细胞克隆形成能力分析发现,经过结晶紫染色后,可见大量集落样生长的细胞,呈明显的细胞团块状聚集在一起,经过计数,其克隆形成率约为(46 ± 4.8)%(图1g、1h)。
采用流式仪对细胞表面标记物进行分析后,发现该细胞的CD29 表达量为99.8%、CD90 表达量为99.8%、CD105 表达量为97.8%、CD34 表达量为1.7%、CD45 表达量为1.4%,以上结果说明经过免疫磁珠分选得到的STRO-1/MACS(+)细胞可高表达干细胞表面标志物,低表达造血细胞表面标志物,具有干细胞特性(图1i ~1n)。
2.2 MGF-Ct24E 肽作用下PDLSCs 增殖能力增强
当不同浓度MGF 作用于PDLSCs 后,采用CCK8 法对细胞活性进行检测后发现,当MGF 浓度为50 ng/mL,100 ng/mL,作用24 h 后,细胞活性明显上调,与对照组相比差异具有统计学意义(F=4.67,P<0.05)(图2a);采用Western blot 对细胞PCNA 蛋白表达量进行检测后发现,当MGF 浓度为50 ng/mL、100 ng/mL,作用24 h 后,细胞PCNA 蛋白表达量明显上调,与对照组相比差异具有统计学意义(F= 12.48,P<0.05)(图2b、2c)。提示当MGF 浓度为50 ng/mL 时,能够明显提高PDLSCs 的增殖能力。
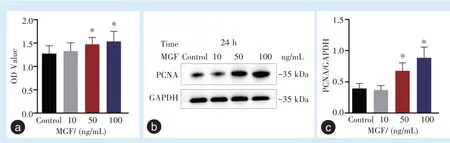
图2 MGF 对PDLSCs 增殖活性的影响Figure 2 MGF regulated the proliferation of PDLSCs
2.3 MGF-Ct24E 肽作用下PDLSCs 成纤维分化能力增强、成骨分化能力减弱
当不同浓度MGF 作用于PDLSCs 后,采用Western blot 对细胞Scleraxis、Osterix、COL1A1 蛋白表达量进行检测(图3a),当MGF 浓度为50 ng/mL,100 ng/mL,作用24 h 后,细胞Scleraxis、COL1A1 蛋白表达量明显上调,与对照组相比差异具有统计学意义(F= 35.36,F= 6.73,P<0.05)(图3b、3c);此外,MGF 在各个浓度下,作用24 h 后,细胞的Osterix 蛋白表达量明显下调,与对照组相比差异具有统计学意义(F= 40.91,P<0.01)(图3d)。提示当MGF 浓度为50 ng/mL,100 ng/mL 时,能够明显提高PDLSCs 的成纤维分化能力;同时,MGF 在各个浓度下,均能明显降低PDLSCs 的成骨分化能力。
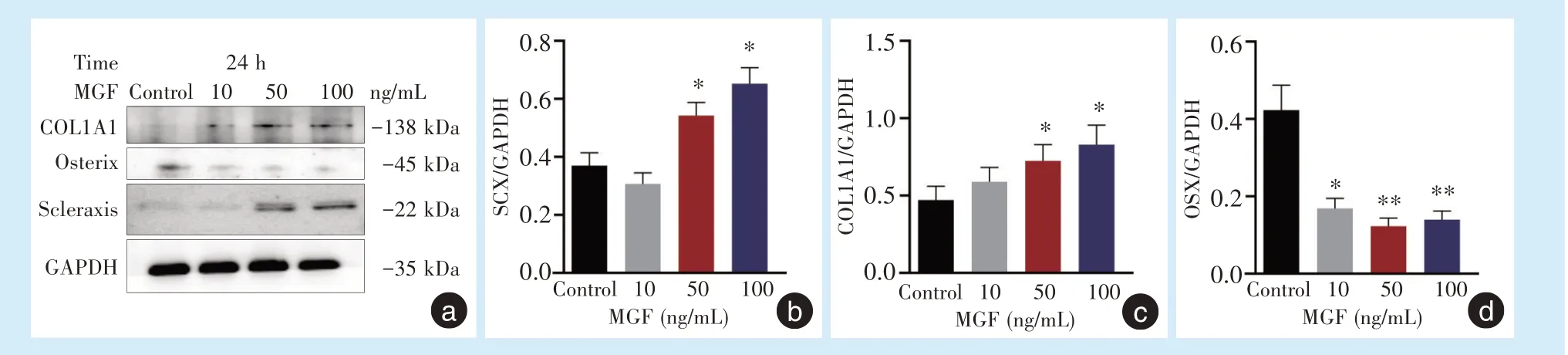
图3 MGF 对PDLSCs 分化的影响Figure 3 MGF regulated the differentiation of PDLSCs
2.4 MGF-Ct24E 肽作用下PDLSCs 中YAP 蛋白磷酸化程度增强,并聚集于细胞核
当50 ng/mL 的MGF 作 用 于PDLSCs 后,采 用Western blot 对 细 胞P-YAPY357、YAP 蛋 白 表 达 量 进行检测后发现,细胞P-YAPY357/YAP 相对表达量明显上调,与对照组相比差异具有统计学意义(t=3.63,P<0.05)(图4a、4b);采用免疫荧光染色对细胞YAP 蛋白定位情况进行检测后发现,YAP 蛋白定位于细胞核,呈现明显的核聚集情况,与对照组相比差异具有统计学意义(t= 3.92,P<0.01)(图4c、4d)。
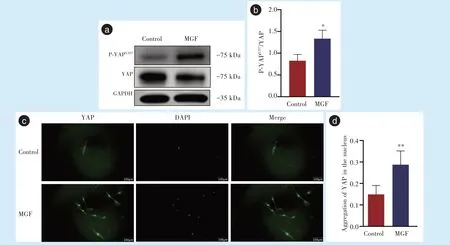
图4 MGF 激活PDLSCs 中YAP 蛋 白Figure 4 MGF activated YAP protein in PDLSCs
2.5 抑制YAP 表达后对MGF-Ct24E 作用下PDLSCs细胞增殖及分化的影响
研究发现,YAP siRNA 1 组筛选效果最佳,采用YAP siRNA 1 组抑制YAP 表达后,MGF-Ct24E 作用下PDLSCs 细胞增殖标志蛋白PCNA(F= 11.59,P<0.01)以及细胞成纤维分化标志蛋白Scleraxis(F= 77.25,P<0.01)和COL1A1(F= 24.27,P<0.01)的表达显著下调(图5a、5b)。
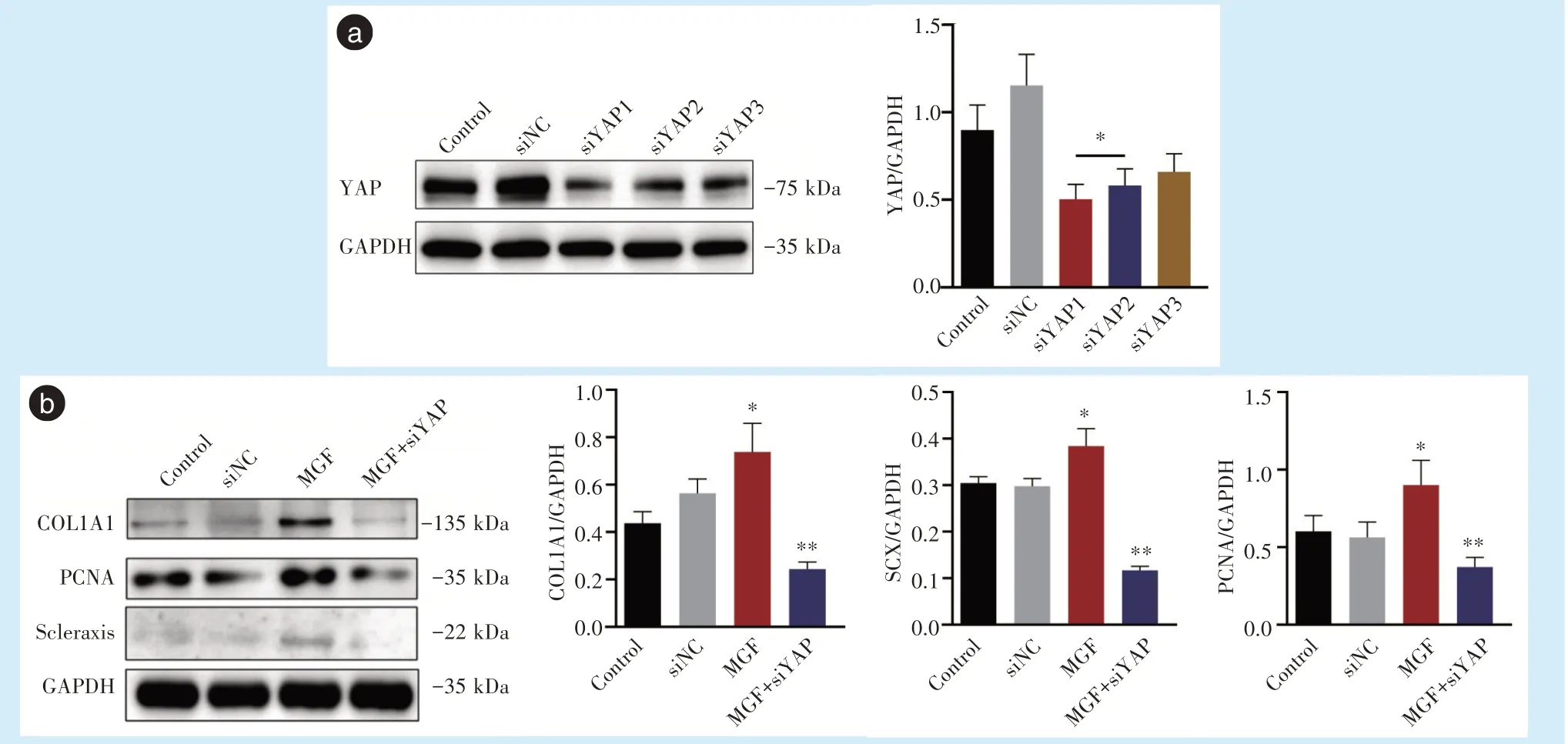
图5 干扰YAP 蛋白后可抑制MGF 促PDLSCs 增殖分化作用Figure 5 Interference with the YAP protein inhibited the proliferation and differentiation of PDLSCs induced by MGF
3 讨 论
牙周膜是保证牙齿稳固,维持正常口颌系统稳态的重要结构[7-8]。但疾病、外伤等因素可能造成牙周膜组织损伤,且损伤后难以再生修复,最终导致牙齿松动甚至造成牙齿脱落[9]。课题组前期研究根据力可调控牙周膜改建这一特征,体外模拟咬合力后作用牙周膜细胞后发现,力刺激下牙周膜细胞中可表达促组织再生修复的力生长因子MGF。为探明MGF 在牙周组织中的作用,本实验采用其功能肽段,MGF-Ct24E 肽作用于体外培养的PDLSCs,MGF-Ct24E 肽可促进PDLSCs 增殖并向牙周膜成纤维细胞分化。以上结果提示,MGF 具有促进牙周膜组织再生修复的功能。本研究同时发现,MGF-Ct24E 肽可激活力敏感蛋白YAP 信号通路,并通过YAP 调控PDLSCs 增殖分化。
MGF 是力学刺激作用下胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)基因选择性剪接产生的变异体,是力学刺激激活细胞核内的剪切因子产生的[10]。MGF 作为力相关细胞因子,最早是由Yang 等[10]在1996 年对肌肉组织中的IGF-1 进行研究时发现的,MGF 作为IGF-1 的剪接变异体,其特征之一就是随着力学刺激而迅速产生,而当在不受力的情况下,MGF 的表达量则比较低。MGF 在体内的分布十分广泛,可在肌肉、神经、骨和软骨等组织中表达,并具有促进组织再生修复的功能[11-13]。且MGF 调控的组织多集中在与力学刺激相关的肌骨系统中,如肌肉、骨、韧带及软骨等组织中。在肌肉组织损伤修复中,MGF-Ct24E 具有促进肌干细胞增殖的作用。研究发现,MGFCt24E 可改善小鼠肌营养不良等症状[14]。此外,在骨、软骨再生过程中,MGF-Ct24E 可促进成骨、成软骨细胞增殖,促进软骨基质合成[15]。值得注意的是,在肌腱韧带组织的再生修复中,MGF-Ct24E 可促进成纤维细胞增殖,并促进胶原的合成[16]。本研究同样证实了MGF-Ct24E 可提高PDLSCs 的增殖活性,并促进细胞中COL1A1 胶原的合成。另一方面大量研究发现MGF-Ct24E 具有促进细胞分化的功能,且根据环境不同分化方向也不同。本研究发现,MGF-Ct24E 可促进细胞向成纤维分化,提示MGF 可能会通过这种方式促进牙周膜损伤的再生修复。
大量研究关注了MGF 调控的相关信号通路蛋白,MGF 虽然是IGF-1 的剪接变异体,但该蛋白功能的发挥并不是通过与IGF-1R 结合来实现的。目前研究发现,MGF 主要可通过丝氨酸/苏氨酸激酶AKT 及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路对细胞进行调控[17]。本研究发现,MGF-Ct24E 可激活力敏感蛋白YAP 蛋白Y357 位点发生磷酸化修饰,并发生核转位,而抑制YAP 的活性则可对细胞增殖分化造成影响。大量研究发现,YAP 蛋白的胞内定位通常与细胞的增殖及分化调控有关,当细胞增殖活跃时,YAP 蛋白定位于胞核内,与转录因子TEAD 结合,进而发挥其下游调控功能;当细胞处于静息状态时,YAP 蛋白定位于胞质中,并进一步被降解[18]。同时,YAP 作为为转录辅助因子,可与DNA结合因子执行调节基因转录的功能,并调控细胞分化。除本研究之外,Jing 等[15]研究同样发现,MGF 通过RhoA 信号通路调控YAP 的活化以及核转位,影响细胞迁移。作为力敏感蛋白,MGF 对其激活是否可与力激活形成叠加,促进组织再生修复,仍值得进一步探讨。
综上所述,笔者研究发现MGF 通过激活YAP蛋白的活性,促进PDLSCs 增殖及成纤维分化。本研究为后续进一步探究MGF 调控牙周膜再生修复提供实验依据,并为临床中治疗牙周膜缺损提供新的策略。
【Author contributions】Tu T and Zhao Y wrote the article. Liu YL,Wang H, Zhang M revised the article. Zhang M designed the study. All authors read and approved the final manuscript as submitted.

