创新药新增适应症的医保准入国际经验研究
张天问 张 奥 郭思琦 陈 怡
(清华大学医院管理研究院 北京 100084)
我国制药行业的创新潜力不断激发释放,分子靶向、免疫治疗、细胞与基因治疗方兴未艾,药物新增适应症的情况明显增多。根据国家医保局和国家药监局的数据统计,2020 年—2021 年, 约20 余种谈判药品的新增适应症先后被纳入我国医保药品谈判范围。截至2021 年12 月,附条件批准药品共30 个,附条件批准适应症共33 个。
我国针对创新药新增适应症的医保准入规则也在逐步完善。2020年之前的国家医保药品目录调整工作方案通过限制创新药某些适应症的医保报销行为,实行创新药适应症医保费用管理。《2021 年国家医保药品目录调整工作方案》首次将协议内药物的新增适应症纳入谈判范围,《2022 年国家医保药品目录调整工作方案》首次明晰协议内药物续约规则、支付范围与支付标准。但我国创新药新增适应症的价值评估、医保准入流程与支付标准仍有较大完善空间。
本文基于文献资料整理法和国际专家访谈法,多元化选取同中国医疗保险制度相似的以社会保险为主的日本、韩国、荷兰、法国、瑞士等五个国家,对其创新药新增适应症的医保准入规则、准入流程与支付标准进行梳理分析,结合专家意见,为我国构建更完善的创新药新增适应症医保准入规则提供参考与借鉴。
1 研究对象及资料来源
1.1 研究对象及定义
1.1.1 研究国家选择。我国的多层次医疗保障体系以基本医疗保险为主体,医疗救助为托底,补充医疗保险、商业健康保险等共同发展。目前我国药品按照通用名管理。基于医疗保险制度和药品管理制度两个维度,本文选取日本、韩国、荷兰、法国、瑞士五个以社会医疗保险为主,药品按通用名管理的国家作为研究对象。商业医疗保险模式且药品按适应症管理的国家(如美国)不纳入研究范围,确保案例国家的医保制度及药品管理模式对我国创新药管理更具有借鉴意义。
1.1.2 创新药定义。欧洲药品管 理 局(European Medicines Agency,EMA)对创新药的定义为“从前未获得授权的含有活性物质或活性物质组合的药物”。2020年我国药监局发布《化学药品注册分类及申报资料要求的通告》(2020年第44 号),将化学药分为5 类,即创新药、改良型新药、原研药物境内未上市的仿制药、原研药物境内已上市的仿制药、境外已上市境内未上市化学药品。本文研究对象特指化学药品注册分类中的创新药,即“境内外均未上市的创新药。含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品”。
1.1.3 新增适应症定义。2020年国家药监局发布《已上市药品临床变更技术指导原则(征求意见稿)》,提到已上市药物的适应症变更包括:①增加新适应症(如先前未定义的疾病治疗);② 批准适应症的修订(如用药人群年龄的扩大或基于临床研究证实缺乏有效性而对某个适应症进行的限定)。本文结合医保准入流程将创新药新增适应症定义为创新药在医保准入后新上市/获批的适应症。
1.1.4 医保准入流程。药物从通过国家医疗保障局等部门或相关专家的审查到纳入医保报销范围的整个流程,包括技术性审查和经济性审查。例如,对药品的临床价值、药品价格等多项指标进行审查。
1.1.5 医保支付标准。医保基金支付医保目录内药品费用所设定的标准。
1.2 资料来源
资料来源于日本、韩国、荷兰、法国、瑞士五个国家的药品监督管理部门、医疗保障部门、国家卫生管理部门等政府机构官方网站的公开政策文件、相关文献以及对国际专家进行访谈所得内容。
2 典型国家创新药新增适应症医保准入经验介绍
2.1 日本:政府定价与市场扩张后的特殊药物再定价规则
日本创新药新增适应症由厚生劳动省进行医保准入及官方定价工作,新增适应症超出一定销售额后将按比例下调医保支付标准。日本厚生劳动省为日本国家卫生管理部门,其设立的医保目录不仅是国家健康保险药品价格标准(NHI Drug Price Standard),也兼具药品“项目表”与药品“价格与报销表”的功能。新药进入医保目录首先需经药品器械审评审 批 机 构(Pharmaceuticals and Medical Devices Agency,PMDA)的上市批准,PMDA 会对药品的创新性、有效性等指标进行评估,同时也会将市场规模、是否考虑儿童及罕见病用药需求纳入考量因素,综合各类因素对新药进行溢价性定价。同时,参考英国、德国、法国、美国(2017 年之后,由于美国药物价格过高将美国排除)的价格,根据具体公式进行价格调整,从而得出最终定价,将最终定价告知药企,若企业无异议则批准药物进入医保目录。
药品新增适应症属于日本药品已上市药物变更规则(Post-Approval Change Regulations)中的部分变更批准申请(a partial change approval application,PCA),按照新药上市程序进行审批定价,同时纳入医保目录。日本药品新增适应症适用于市场扩张后的特殊药物再定价规则(repricing for market expansion applicable for special cases),这一特殊规则来源于2014 年在日本上市的欧狄沃(Opdivo),当时欧狄沃仅有黑色素瘤一种适应症,但2016 年该药新增非小细胞肺癌(NSCLC)和肾细胞癌(RCC)适应症,扩大了药品覆盖范围,导致日本医保预算压力增加。因此,政府便引入“适用于市场扩张后的特殊药物再定价规则”。通过跟踪国家数据库,确定药品市场规模,针对年销售额在1000 亿日元—1500 亿日元,且超过预计销售额150%的药品,至多下调25%的药品价格;年销售额超过1500 亿日元,且超过预计销售额130%的药品,至多下调50%的药品价格。
2.2 韩国:量价挂钩与风险分担协议
韩国创新药新增适应症的医保准入模式为量价挂钩(Price-Volume Agreement Program,PVAP)与风险分担协议(Risk Sharing Agreement) 两 种 方式。韩国要求药品进入医保目录需递交相应的药物经济学评价报告,由健康保险审核和评估服务局(Health Insurance Review&Assessment,HIRA)进 行 成 本效益评估,评估通过后可与国民健康保险公司(National Health Insurance Corporation,NHIC)进行谈判,确定药品的医保支付价格,谈判达成一致后由卫生与社会福利部(Ministry of Health and Welfare,MOHW)将药品正式列入医保目录。
药品新增适应症后,医保准入支付范围将会变更,具体有两种变更途径。
(1)量价挂钩模式。NHIC 会根据新增适应症的扩大报销范围进行成本效益分析,在一定范围内按量价挂钩模式进行降价,超过一定范围重新进行谈判定价。比如,预期医保基金增长范围为15 亿韩元—100 亿韩元,通过预期额外医保报销和医保报销率增长值得出贴现价值,进行价格调整(降价);如果预期医保基金增加额超过100 亿韩元,则通过谈判进行价格调整(降价)或者签署风险分担协议,未完成谈判无法进入医保报销范围。
(2)风险分担协议定价模式。对于部分药品新增适应症(适用于治疗严重危及生命的疾病,但目前缺乏替代药品、临床等效药物、临床等效治疗方法,且需药物审查委员会进行技术认定),采取风险分担协议体系进行定价,政府和制药公司共同承担新药临床结果的不确定性及其对医保基金预算的影响。双方可以协商选取合适的风险分担协议类型,包括财政退款型、继续有条件治疗型、支出上限型和使用上限型四种协议类型。
2.3 荷兰:限制报销与多年多种适应症协议
荷兰对于新增适应症的药品医保准入流程及支付标准存在现行路径和试点路径两种模式。
现行路径是将多适应症药品价格按已协商的第一适应症价格水平定价,若后续适应症无法在此价格下获得成本效益,可谈判更低价格,扩大药品覆盖范围,若谈判失败则无法报销获批新适应症。同时,新适应症获批后,价格高或风险高的药物将限制医保报销。具体有以下两种限制报销情况:①新适应症获批后,多适应症药物总费用在医保预算中超过4000 万欧元,所有适应症限制报销,即暂时无法获得医保报销;②新适应症患者(单人)年治疗费用超过50000欧元,且该新增适应症总共在医保预算中超过1000 万欧元,新增适应症将限制报销。限制报销后,由荷兰卫生保健局下设的科学咨询委员会(De Wetenschappelijke Adviesraad,WAR) 和 计 划 咨询委员会(De Adviescommissie Pakket,ACP)对新增适应症进行有效性、经济性评估,若需纳入医保报销范围,则由卫生部门与药品制造商进行谈判。
试点路径是由医保支付部门和药企签订多年多种适应症(MYMI)协议,即时间范围上横跨多年,包含多种适应症的“一揽子”医保准入模式。为了确保医保部门和药品企业双方对未来价格调整有一定的预测能力,支付方与企业在综合评估所有新增适应症的情况后,事先制定一个统一的支付价格,应用于支付现在和未来所有的适应症,一般协议期为三年。在三年协议过程中,医保部门也会定期监测药品使用和价格波动情况,并评估不同适应症实际临床价值,对价格进行必要的调整。
2.4 法国:谈判准入与临时使用授权计划
(1)谈判准入。在法国,新药/新增适应症医保准入需经过谈判,对于未上市的突破性治疗药物也有可纳入的医保协议。法国的新药/新增适应症上市需要通过欧洲药品管理局的批准以及法国国家药品安全管理局(ANSM)的认定。法国药企享有对药品出厂价自由定价的权利,若申请进入医保报销范围,则需要经过法国国家卫生管理局(HAS)下属的透明度委员会(TC)的临床价值评估与卫生产品经济委员会(CEPS)的临床价值评估与价格谈判(注:HAS 与CEPS 为两个独立机构)。临床价值评估将对拟申请准入的药品进行临床价值/药效(SMR 评级,Service Médical Rendu)和实际提升效益(ASMR评 级,Amélioration du Service Médical Rendu)评估。
SMR 评级将疾病严重程度、对发病率和死亡率的影响、药物的有效性和安全性、药品预防、治疗目的纳入考虑范围,综合确定药品的医保报销比率。ASMR 评级则聚焦与同类药物相比疗效与安全性的增量。CEPS 将经过TC 评估过新药或新适应症的SMR 评级和ASMR 评级结果作为经济性评估的考量范围,同时参考国际价格进行定价。法国医疗保障部门出台最终的产品定价及医保报销标准,并以5 年为一个评估周期。
(2)临时使用授权计划。2021 年法国的《社会保障融资法(LFSS)》为药物临时使用授权(ATU)的医保报销制度奠定了基础。该法案本质上是一种对未批准上市但临床急需的创新药物/新适应症获得临时医保报销的制度。当药品符合以下5 个条件时,将获得100%报销额度。①药品在相关适应症中没有获批上市时,根据治疗试验结果表明药品具有显著的有效性和安全性;②适用于严重、罕见或致残的疾病;③目前暂无合适的治疗方式存在;④临床急需,不能耽误的临床治疗;⑤与临床效果相比而言,该药品被认为是创新的。药物申请进入ATU 需要满足上述5 个条件,并同法国卫生局(HAS)签订治疗使用协议及数据收集协议(包括疗效、不良反应与药物实际使用条件等)。
当药品获得上市批准后,ATU状态则失效,制造商需提交已获批适应症真实世界数据到HAS,经过HAS 下 属 的TC 与CEPS 对 药品进行医疗效益与经济性评估,最终谈判定价,如果谈判定价的价格低于ATU 阶段价格,则药品制造商会被要求偿还两者差额。
2.5 瑞士:企业自主选择准入路径与量价协议
瑞士药品监督管理局(Swissmedic) 负 责 药 品 医 保目录的许可准入,包括对拟申请准入的药品进行卫生技术评估,即药品的有效性、经济性和适应性的评价。瑞士联邦公共卫生局(FOPH)在前者的基础上,进一步对药品的效能、成分、副作用进行评估,并综合参考德国、荷兰、瑞典等多个国家的国际价格(TQV)和现有疗法的费用(APV)进行定价,最终达成协议,允许药品进入医保目录。
瑞士的企业可自主选择药物新增适应症的医保准入路径,包括“有效性、经济性和效用性”模型(以下简称“WWZ 模式”)与适用人群定价模型(以下简称“prevalence pricing 模式”)。
在瑞士,药品新增适应症按照创新程度进行分类管理,分为重大创新与一般创新,企业可自主选择上述两种模式进行申请。新增适应症若涉及药物临床疗效显著、在临床上有不可替代的价值和作用或代表重大创新则使用“WWZ 模式”,即瑞士药品监督管理局与瑞士联邦公共卫生局对药物的有效性、经济性、适应性的资料进行评估,结合国际参考价格、国内适应症类似药物的价格进行谈判定价。
新增适应症若涉及适度创新、次要创新或相同创新程度的则使用“Prevalence pricing 模 式” 进行简化程序的评估,其本质是量价协议,即根据新增适应症之前的实际销售量(已发生值)、新增适应症之后的销售量(预估值)、销售额确定总体价格的降幅。“WWZ模式”与“Prevalence pricing 模式”的选择交由企业自主决定。
3 国际经验总结
综上所述,本文对国际上药品新增适应症医保准入流程及支付标准调整模式进行总结(见表1)。
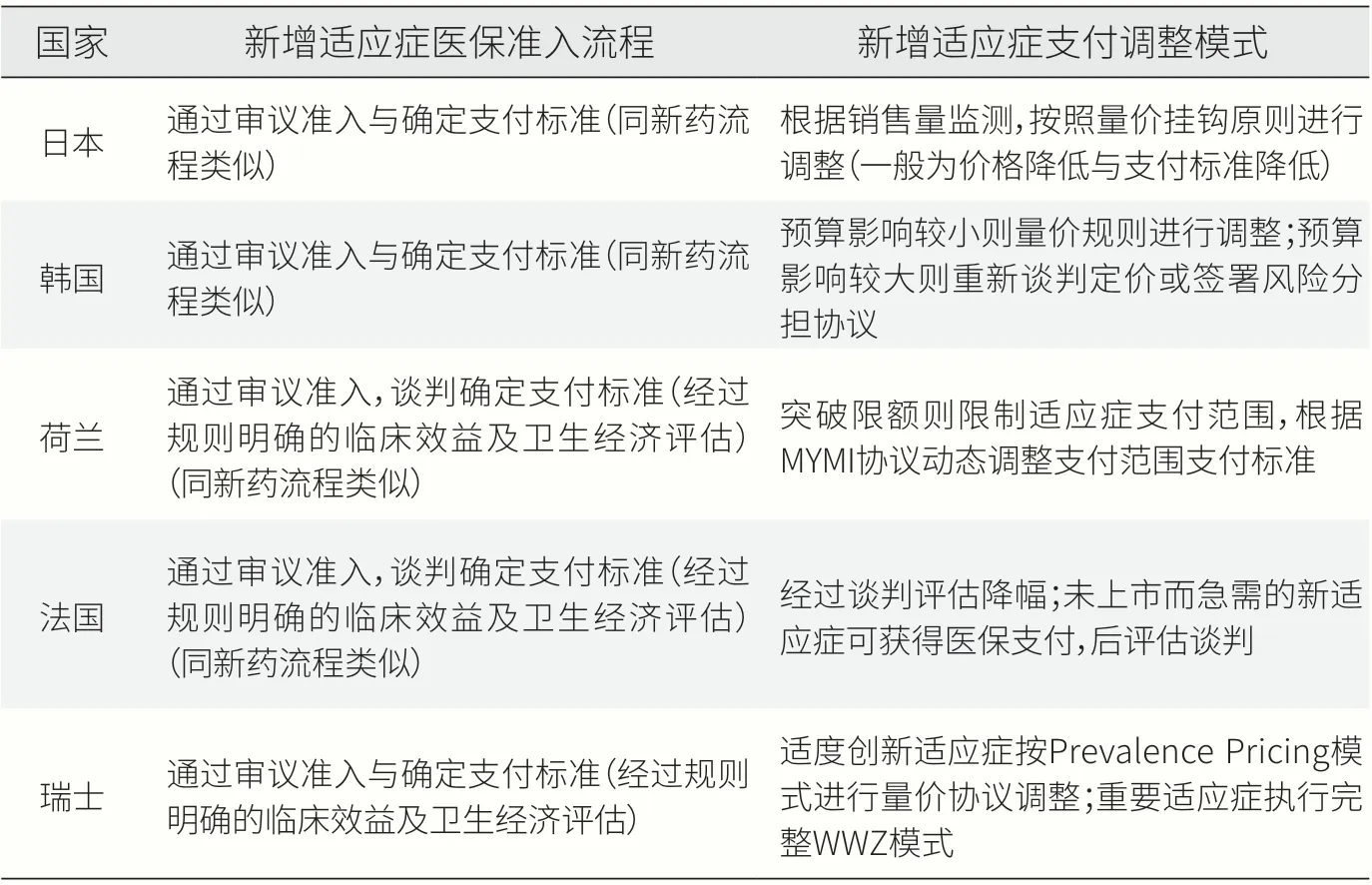
表1 国际上新增适应症医保准入流程及支付标准调整模式
3.1 新增适应症医保准入流程
新增适应症医保准入流程同新药医保准入流程类似,日本、韩国、荷兰、法国及瑞士都需要通过国家医药卫生部等部门对药物新增适应症进行药物经济学及卫生技术评估,确定药品或新适应症的有效性、安全性、经济性等指标,评定药物的价值。我国2020 年出台的《基本医疗保险用药管理暂行办法》(国家医疗保障局令第1 号)规定“独家药品通过准入谈判的方式确定支付标准”(独家药品可理解为创新药/创新药某一适应症)。但我国目前暂未公开披露创新药以及其新增适应症的价值评判指标与标准,这增加了医药产业界同政府在谈判准入中的沟通成本,以及学界及社会各界对创新药医保准入价值评定的认知与研究成本。
3.2 新增适应症医保准入后的药品支付标准
国际上新增适应症医保准入后的药品支付标准调整主要分为两种模式。
(1)量价挂钩或量价协议模式。典型的国家如日本、韩国(对医保基金预算影响较小的药品/适应症)、瑞士(一般重要性适应症)。通过明确的量价规则、销售量增幅、医保基金预算增幅与产品价格降幅相联系,确定药品医保支付标准。
(2)谈判模式。典型国家如韩国(对医保基金预算影响较大的药品/适应症)、瑞士(重要适应症)、法国。通过对新增适应症的临床价值、经济性、国际价格参考等指标同企业进行谈判确定医保准入价格。其中法国通过ATU 协议对未上市的新增适应症进行报销,相当于扩大了医保支付范围。其他非典型模式如荷兰,对超出预算额度的适应症进行限制报销,即医保支付标准为0。荷兰的MYMI 协议通过事先确定支付标准,并在协议期内对支付标准进行调整。
2022 年我国医保目录调整方案也初步形成上述两种模式。(1)简易续约/量价挂钩模式,将药品销量、新增适应症后的药品销量与医保基金预算相联系,进而调整医保支付标准。(2)重新谈判模式,对独家药品以及不符合“简易续约规则”的药品重新进行医保谈判。目前我国暂未有如风险分担协议等创新支付方式,以及将突破性治疗药物提前纳入医保支付范围等创新型医保准入流程与支付标准。
4 对我国创新药新增适应症医保准入的启示
4.1 明晰与完善创新药新增适应症的医保准入流程,构建多维度评估指标
日本、法国、瑞士等国家,拥有公开、明确的药品卫生技术评估规则路径、准入规则或方案。具体内容包括:(1)临床价值指标,如安全性、有效性或整体评级等指标;(2)经济指标,即参考国内、国际上类似适应症价格;(3)其他指标,如社会指标,即考虑儿童、罕见病患者的用药需求。
我国应继续完善创新药新增适应症医保准入流程,制定明确的适应症卫生技术评估的细则,例如在对药物及其新增适应症进行相关评审评估的文件中,公开且定性定量地明确具体指标的维度与内涵,包含临床价值指标、价格指标、社会指标等多维度指标,将药物的价格与价值、医保基金支出与患者利益相统一。
4.2 完善创新药新增适应症支付标准的量价挂钩模式
同2021 年相比,《2022 年国家医保药品目录调整工作方案》逐步完善,首次明确提出公开简易续约规则,针对调整医保支付范围的药品(可理解为适应症发生变化的药品,一般情况下为新增适应症),按照因调整支付范围所致的基金支出预算增加值,与原支付范围的基金支出预算和本协议期内基金实际支出两者中的高者相比,确定支付标准的变更范围。但可能出现药物及新增适应症按照预想情景降价,却未达到预设销售量的情况。
建议积极利用大数据手段,通过医疗大数据对销售量等指标进行科学合理地预测,进而确定支付标准。进一步探索建立对新增适应症降幅更小、更缓和的支付标准,若产品被证实有超预期的销售量,企业可通过返还销售额给医保基金的方式降低医保准入后的销售风险。
4.3 探索未上市新适应症医保准入模式
对于临床急需的创新药,尤其在肿瘤学领域的新产品和新适应症,我国药监局通常采取更加创新、灵活的批准上市通道— 附条件批准上市。但新的适应症可能会随着临床需求进入市场带来临床疗效的不确定性,这对医保按价值付费带来不确定性和一定风险。目前法国通过药物临时使用授权制度(ATU)建立未上市新药医保准入绿色通道机制,并使用真实世界数据库以辅助医保准入决策。
建议我国建立新药、新增适应症医保准入绿色通道,提高居民用药的可及性与可负担性,联合药品企业、医疗机构建立真实世界数据库,为药品医保准入价值评估奠定基础,做好鼓励产业创新和缓解医保基金支付压力的平衡。
— 多适应症药物准入评估方法比较研究

