C10orf99下调对银屑病角质形成细胞LCN2表达的影响
陈彩凤 陈 黎 张丹群
福建医科大学省立临床医学院,福建省立医院皮肤科,福建福州, 350001
银屑病是一种慢性炎症性复发性皮肤病,本病发病率高,全球发病率约2%~4%[1]。典型临床表现为局限或泛发性鳞屑性红斑或斑块[1,2]。该病发病机制尚未阐明。此病反复发作、迁延不愈,给患者带来巨大的精神心理负担和经济负担,极大影响了患者的生活质量[1,3]。
C10orf99是近年采用免疫组学策略发现并鉴定的新细胞因子,笔者前期通过体内外实验发现C10orf99通过参与银屑病角质形成细胞的增殖和炎症调控影响银屑病的发生发展[4]。
LCN2是lipocalin蛋白超家族的成员,是一种分泌的糖蛋白。多项研究显示LCN2在银屑病患者皮损及血液中表达量均明显升高,并且参与了银屑病中的炎症调节和细胞增殖调控[5-7]。但关于其上游调控机制尚不清楚,本实验旨在检测C10orf99下调对于银屑病角质形成细胞中LCN2表达的影响。
1 材料和方法
1.1 材料 HaCaT长期保存于本实验室。
1.2 主要试剂 重组人 IL-1α、IL-17、IL-22、TNFα及OSM均购自美国Peprotech公司;Trizol核酸抽提试剂购自Invitrogen公司;cDNA反转录试剂盒和实时定量荧光底物购自TaKaRa公司;PCR引物由上海生工生物工程股份有限公司合成;RIPA细胞裂解液购自北京普利莱基因技术有限公司;兔抗人LCN2(YT7924)购自ImmunoWay公司;通用型SP试剂盒、DAB试剂盒、鼠抗人β-actin及实验中所用二抗均购自中杉金桥生物公司;慢病毒载体的构建和包装来自上海吉玛生物科技发展有限公司。
1.3 实验方法
1.3.1 HaCaT培养 采用含10% FBS的高糖DMEM常规培养HaCaT,放置于37℃含5% CO2的细胞培养箱中培养,2天更换1次培养基。以1∶5比例进行传代培养。选择对数生长期HaCaT进行后续细胞实验。
1.3.2 银屑病细胞模型的建立 选择对数生长期的HaCaT,按5×105个细胞/孔接种六孔板。待细胞生长至80%融合度时,更换为无血清的高糖DMEM培养。次日将培养基换成含10% FBS的高糖DMEM,并加入M5(IL-1α、IL-17、IL-22、TNFα及OSM,终浓度为10 ng/mL)刺激细胞48 h。
1.3.3 银屑病动物模型的建立 参照既往实验方法采用咪喹莫特乳膏构建银屑病动物小鼠模型[4]。
1.3.4 慢病毒的转染 将处于生长期的HaCaT以5×105个细胞/孔接种六孔板。待细胞融合度为40%时,将培养基换成含有polybrene(终浓度为5 μg/mL)的无抗高糖DMEM培养基,加入100 μL已解冻的慢病毒颗粒(sh-C10orf99)。对照组加入等量的阴性对照慢病毒颗粒(sh-NC)。轻柔混匀孔中内容物,放回CO2细胞培养箱中。转染病毒48 h后,更换为完全培养基,转染72 h后,开始使用嘌呤霉素(5 μg/mL)筛选,共筛选14天。
1.3.5 实验分组及处理 细胞实验总共分为4组,分别为对照组(Control组)、M5模型组(M5组)、阴性对照组(sh-NC组,即干扰空载感染稳筛细胞组)和实验组(sh-C10orf99,即干扰C10orf99感染稳筛细胞组)。Control组即正常对照组;其余三组均予M5干预。
1.3.6 qRT-PCR 用Trizol提取各组细胞总RNA,反转录得到cDNA。具体引物序列见表1。进行实时定量PCR反应,获取各组标本的标准曲线,采用计算机分析Ct值。用β-actin标准化后用2-ΔΔCt计算相对表达量。
1.3.7 Western Blot 使用RIPA裂解各细胞组的蛋白质,应用BCA试剂盒测定蛋白浓度。样品煮沸后开始进行上样、电泳、转膜和5%的牛奶室温封闭。一抗4℃恒温摇床孵育过夜;次日,二抗室温摇床2 h,后使用化学发光液进行显影。
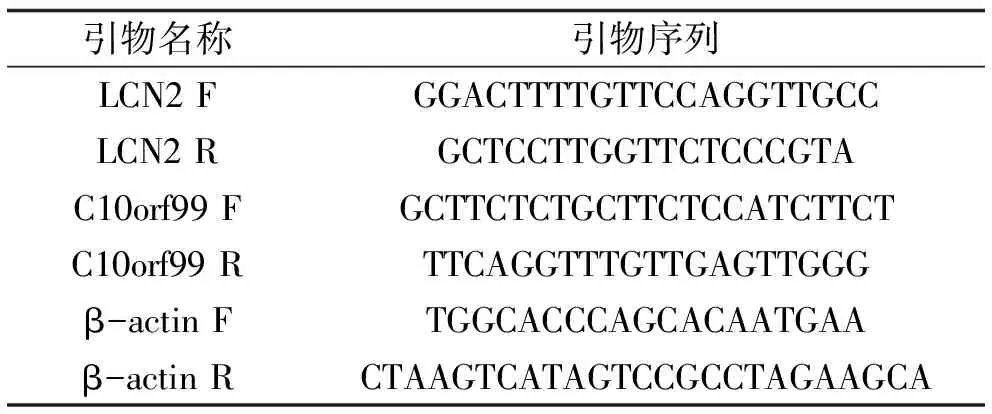
表1 所用引物序列
1.3.8 免疫组化 石蜡标本5 μm切片,常规脱蜡、水化;使用3%过氧化氢阻断内源性过氧化物酶活性;用枸橼酸缓冲液进行抗原修复;血清封闭后37℃封闭10 min,一抗4℃过夜;二抗孵育后DAB显色,后行复染、脱水,最后封片。
1.4 统计学方法 采用Graphpad Prism 5.0统计软件进行统计学分析和作图,组间数据比较采用T-test分析,P<0.05为差异有统计学意义。
2 结果
2.1 LCN2在银屑病小鼠模型皮损中的表达情况 采用咪喹莫特乳膏构建银屑病的动物模型,获取组织总RNA后,使用qRT-PCR检测LCN2的表达情况,结果显示:咪喹莫特模型组(Model组)小鼠皮损处LCN2 mRNA的表达水平明显高于对照组(Control组)小鼠皮肤处的表达量(P<0.05)。见图1。同时采用免疫组化法进行蛋白水平的检测,结果显示LCN2低表达于正常小鼠皮肤组织中的表皮层,而其高表达于咪喹莫特银屑病小鼠皮损中增厚的表皮棘层及下延的表皮突中。见图2。
2.2 C10orf99慢病毒转染效率的验证 根据吉玛公司提供的实验指导,我们成功获得了稳定感染慢病毒的HaCaT株。为明确慢病毒的效果,我们收集了病毒转染后的HaCaT,提取了细胞总RNA。qRT-PCR结果显示:与sh-NC相比,C10orf99慢病毒感染的sh-C10orf99组HaCaT中C10orf99 mRNA的表达水平大幅度下降。见图3。
2.3 LCN2在银屑病细胞模型中的表达情况及C10orf99表达下调后HaCaT中LCN2的表达情况 采用M5刺激HaCaT细胞来构建银屑病细胞模型。结果示:与正常组相比,M5模型中LCN2 mRNA和LCN2蛋白的表达水平均明显上升,差异有统计学意义(P<0.05),说明LCN2在M5银屑病细胞模型中表达量明显增加。此外,当我们使用慢病毒敲低HaCaT中C10orf99后,数据显示,与sh-NC组相比,C10orf99敲低组中LCN2 mRNA和LCN2蛋白的表达水平明显下降,表明C10orf99的敲低下调了银屑病细胞模型中LCN2的表达。见图4、5。
图1 LCN2 mRNA在各组小鼠皮损组织中的表达情况(* P<0.05) 图2 银屑病小鼠(2a)与正常小鼠(2b)皮肤组织中LCN2的表达(SP)
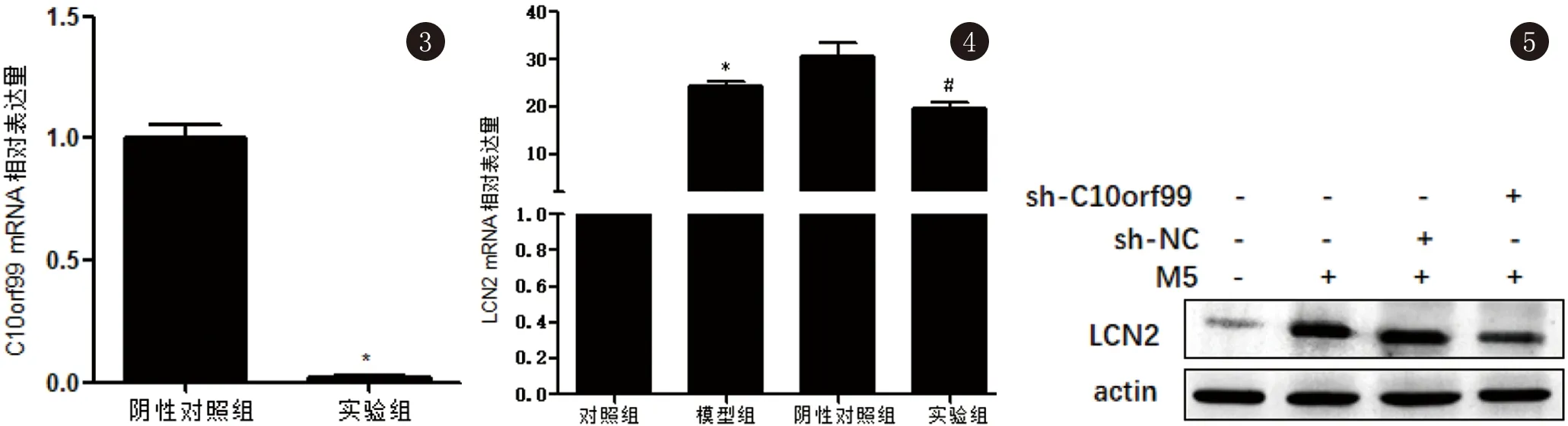
图3 qRT-PCR 法检测各细胞组中C10orf99 mRNA的相对表达量(*P<0.05) 图4 LCN2 mRNA在各细胞组中的表达情况(*P<0.05 vs Control; # P<0.05 vs sh-NC) 图5 LCN2蛋白在各细胞组中的表达情况
3 讨论
银屑病是常见的慢性系统性炎症性皮肤病。其发病机制复杂,尚未阐明。目前银屑病治疗方法多样,但是该病病情顽固、易反复,尚不能治愈,且患者常罹患代谢综合征、心脏病等多种合并症,对患者的生活质量造成严重影响[1,8,9]。因此,银屑病是亟待解决的世界性健康难题之一,进一步研究及探寻更有效安全的治疗新策略或者新靶点是银屑病研究领域的重点和难点。
近来多项研究显示LCN2高表达于银屑病、湿疹和损伤皮肤等多种炎性皮肤病和角化棘皮瘤、鳞癌等皮肤肿瘤中,提示其在抗炎、细胞增殖分化中扮演重要角色[5,6,10-12]。作为中性粒细胞趋化因子,LCN2通过调节中性粒细胞的功能和放大TH17细胞功能参与银屑病发病机制,IL-17也诱导LCN2的产生和分泌,形成炎症循环进一步放大炎症网络[7,13]。动物实验示中和LCN2后明显改善银屑病表皮的异常增生和炎症情况[13]。但关于其具体上游调控机制有待进一步明确。
C10orf99是潜在新细胞因子,其异常表达于浸润性导管癌、食管癌、肝细胞癌、基底细胞癌等多种肿瘤组织[14,15]。最新研究发现其是孤儿受体GRR15的天然配体,参与调节皮肤及胃肠道处淋巴细胞的募集[16,17]。另有研究发现C10orf99 mRNA在银屑病皮损中表达增加[18]。笔者既往研究发现C10orf99通过ERK1/2和NF-κB信号通路参与了角质形成细胞的增殖调控[4]。动物实验提示C10orf99还通过调节炎症反应参与银屑病发生发展,但具体有待进一步实验研究[4]。
本次研究我们发现LCN2高表达于银屑病细胞模型中,并确认了其在银屑病动物模型中表达量是增加的,此结果与既往报道一致[7,13]。通过慢病毒转染成功获得了C10orf99低表达的HaCaT株,并发现C10orf99的下调抑制了炎症微环境HaCaT中LCN2的表达,表明C10orf99很可能通过调控LCN2的表达来参与银屑病炎症反应的调节,具体有待后续进一步实验研究。该实验发现进一步证实C10orf99在银屑病发生机制中扮演着重要角色,为探寻银屑病潜在治疗靶点提供了新的思路。

