痛泻要方拆方对腹泻型肠易激综合征大鼠脑肠肽的影响研究
王科凯,杨焱麟,周彦妮,肖瑾,谢欣,吴芹萍,陈敏
肠易激综合征(irritable bowel syndrome,IBS)是世界范围内常见的肠脑互动紊乱的疾病之一,据估计全球约有10%的人受到影响[1],其中我国以腹泻型肠易激综合征(IBS-D)多见[2]。临床上IBS以腹部不适、排便习惯不良或大便异常为主要特征[3],其病程迁延,容易反复发作,严重影响患者身心健康[4]。IBS发病机制尚未完全明确,但内脏高敏是公认的病理生理基础[4-5],内脏高敏的发生是一个复杂的病理过程,其作用机制亦未完全明确,脑肠肽(brain-gut peptide)异常表达与内脏高敏密切相关[6],其中P物质(substance P,SP)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)作为相关神经肽参与了IBS-D的发展过程,对肠神经系统具有调节作用[7-8]。关于IBS-D的治疗目前指南推荐采用止泻药、解痉药、益生菌、精神药物治疗等方式[9],但多数患者使用指南推荐的一线药物后症状仍难以改善[10],转而寻求中医药治疗。既往研究表明痛泻要方可以通过调节脑-肠轴[11-13]、内脏高敏[14-15]、肠道通透性[16]、BDNF 表达[17],改善IBS-D患者腹痛和腹泻症状。
前期研究发现,痛泻要方可调节大鼠海马及结肠组织中的BDNF mRNA表达,呈现双向调节脑肠轴的作用[17]。中医认为肝郁脾虚是IBS-D基本病机,常用痛泻要方治疗,方中“抑木”组分之白芍防风善于柔肝理气止痛,“培土”组分之陈皮白术长于补脾胜湿止泻,四药合用,补脾柔肝,共奏佳效[6]。然而,目前的临床证据多关注痛泻要方整体药物的疗效及机制。基于中医理论及前期研究成果,笔者推测“抑木”组分之白芍防风是缓解内脏髙敏、改善腹部不适症状的重要部分。本研究将痛泻要方拆分为“抑木”组分与“培土”组分,以IBS-D模型大鼠为研究对象,以BDNF和SP表达为切入点,在前期证实痛泻要方有效性的基础上[18],深入探索痛泻要方治疗IBS-D的作用机制。
1 材料与方法
1.1 实验动物与分组 于2020年7月选取6周龄SPF级雄性Wistar大鼠共32只,体质量为(190±20)g,采购于成都达硕生物技术有限公司,动物生产许可证号:SYXK(川)2020-030,饲养于标准Ⅱ级动物房,室温(21±2)℃,相对湿度(50±10)%,明暗比1∶1。适应性饲养7 d后,采用抽签法随机分为空白组、模型组、白芍防风(B-F)组和陈皮白术(C-B)组,每组8只大鼠,实验期间不限制大鼠进食、饮水。实验方案通过成都中医药大学附属医院实验动物伦理审查,伦理编号:2020DL-001。
1.2 主要试剂及药物 戊巴比妥钠(上海斯信生物科技有限公司)、BCA蛋白浓度测定试剂盒(上海西唐生物科技有限公司,批号:WB101)、BDNF酶联免疫吸附测定(ELISA)试剂盒(上海西唐生物科技有限公司,批号:F15100)、SP ELISA试剂盒(上海西唐生物科技有限公司,批号:F16804)。痛泻要方组成:白术12 g、白芍8 g、陈皮6 g、防风4 g,中药由四川省中医院中药房采购于四川新荷花中药饮片公司,并由该院药剂科经浸泡、煎煮、过滤浓缩等工艺制作中药浸膏混悬液。
1.3 造模方法 参照文献[19-20]方法建造IBS-D大鼠模型,除空白组外,其余各组大鼠均采用结直肠扩张+慢性束缚应激的造模方法建立内脏敏感型IBS-D大鼠模型。结直肠扩张:将自制的气囊涂抹石蜡油后塞进大鼠肛门约7 cm,在肛门外1 cm处用胶带将其固定在大鼠尾根部,在80 mm Hg(1 mm Hg=0.133 kPa)气囊的压力下维持5 min,气囊每次使用前后均需要进行酒精消毒处理。慢性束缚应激:将大鼠仰卧位固定于束缚架(20 cm×6 cm×5 cm)上2 h,限制活动。1次/d,共14 d。使用腹部撤退反射(abdominal withdrawal reflex,AWR)[21]评价模型大鼠内脏敏感性,评分越高表明腹部撤退反应越敏感;当结直肠扩张压力达到75 mm Hg及以上时,AWR评分<3分则视为造模失败。
1.4 干预方法 按照体表面积系数换算,以成年人70 kg、大鼠200 g,换算系数6.3计算大鼠每日中药饮片用量[22]:白芍0.72 g/kg、防风0.36 g/kg、陈皮0.54 g/kg、白术1.08 g/kg。浸膏溶液浓度为:白芍0.180 g/ml、防 风 0.090 g/ml、陈 皮 0.135 g/ml、白 术 0.27 g/ml。空白组和模型组均予以5 ml/kg蒸馏水灌胃,B-F组予以白芍浸膏4 ml/kg、防风浸膏4 ml/kg灌胃,C-B组予以陈皮浸膏4 ml/kg、白术浸膏4 ml/kg灌胃,1次/d,共14 d。
1.5 观察指标及检测方法 一般状态:造模前、造模后、治疗后每14 d观察四组大鼠的精神状况、活动情况、皮毛色泽、饮食量及体质量变化情况。
大便性状:分别于造模前1 d、造模后和治疗后对每只大鼠单笼饲养,收集4 h大便,依据布里斯托大便分类法(Bristol Stool Classification)对大便进行分级评分[23]。
AWR评分:于造模后及治疗后各检测1次。检测时将自制的气囊涂抹石蜡油后塞进大鼠肛门内约7 cm,用血压计向气囊内缓慢加压,观察大鼠在20、40、60、80 mm Hg压力梯度下对气囊扩张刺激的反应,每个压力梯度测3次取评分均值,每次测量间隔5 min。AWR评分由2名不知实验分组的工作人员共同进行。
结肠和海马体组织BDNF、SP表达水平检测:采用ELISA法进行检测。治疗结束后1 d,每只大鼠按2.5 ml/kg的剂量予2%戊巴比妥钠腹腔注射,麻醉后迅速沿大鼠腹中线用剪刀剖开腹部暴露肠道,距肛门5~7 cm处取出结肠片段长约2 cm。同时用咬钳剪开大鼠颅骨,剥离完整大鼠海马体组织。将组织标本转移至-80 ℃冰箱中保存直至检测。参照试剂盒说明书操作,酶标仪测定450 nm处OD值,分别计算大鼠结肠组织和海马组织BDNF、SP表达水平。
1.6 统计学方法 采用SPSS 25.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,方差齐时多组间比较采用单因素方差分析,组间两两比较采用LSD-t法;不满足正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-Wallis检验,组间两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠一般状态 造模前四组大鼠精神状态良好,活泼好动,情绪平和,皮毛顺滑有光泽,肛门周围较为清洁。造模后模型大鼠逐渐出现精神萎靡,活动减少,易躁动或畏惧,饮食、饮水量减少,皮毛晦暗易脱落,肛门周围有较多稀便附着,AWR评分在压力75 mm Hg及以上时均≥3分,说明造模后大鼠内脏敏感性增高,成功建立IBS-D模型大鼠,所有大鼠存活。B-F组和C-B组大鼠治疗后精神状态较治疗前有不同程度好转,活动增多,反应迅速,饮食饮水量恢复,皮毛逐渐恢复光泽,肛门周围较模型组干净。
2.2 大鼠体质量变化情况 四组大鼠初始体质量比较,差异无统计学意义(P>0.05);四组大鼠造模后体质量增长量、治疗后体质量增长量比较,差异有统计学意义(P<0.05)。
模型组大鼠造模后、治疗后体质量增长量小于空白组,差异有统计学意义(P<0.05);B-F组大鼠造模后体质量增长量小于空白组,治疗后体质量增长量大于模型组,差异有统计学意义(P<0.05);C-B组大鼠造模后、治疗后体质量增长量小于空白组,同时治疗后体质量增长量大于模型组,差异有统计学意义(P<0.05);B-F组及C-B组大鼠造模后、治疗后体质量增长量比较,差异无统计学意义(P>0.05),见表1。
表1 四组大鼠初始体质量和造模后、治疗后体质量增长量比较(±s,g)Table 1 Comparison of the baseline weight and the growth of weight during the modeling period and subsequent treatment between four groups of rats
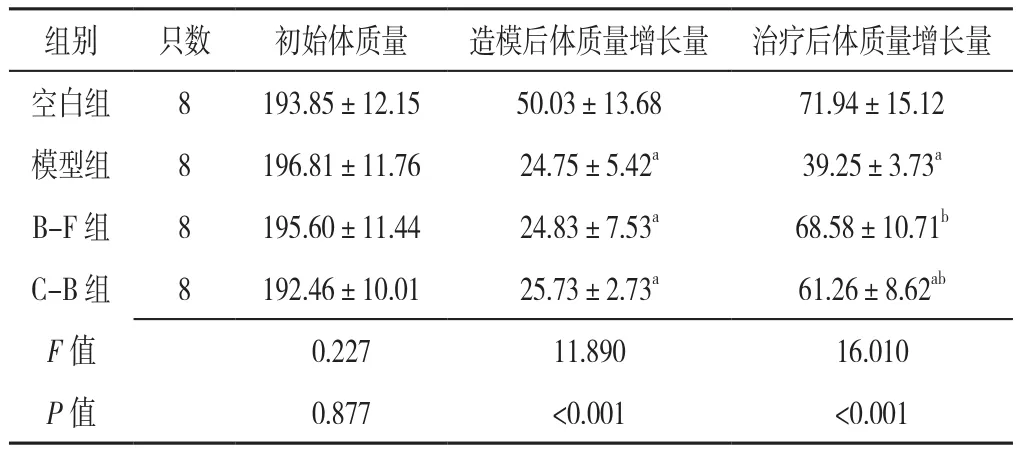
表1 四组大鼠初始体质量和造模后、治疗后体质量增长量比较(±s,g)Table 1 Comparison of the baseline weight and the growth of weight during the modeling period and subsequent treatment between four groups of rats
注:a表示与空白组相比P<0.05,b表示与模型组相比P<0.05;B-F组为白芍防风组,C-B组为陈皮白术组
组别 只数 初始体质量 造模后体质量增长量 治疗后体质量增长量空白组 8 193.85±12.15 50.03±13.68 71.94±15.12模型组 8 196.81±11.76 24.75±5.42a 39.25±3.73a B-F 组 8 195.60±11.44 24.83±7.53a 68.58±10.71b C-B 组 8 192.46±10.01 25.73±2.73a 61.26±8.62ab F值 0.227 11.890 16.010 P值 0.877 <0.001 <0.001
2.3 大鼠布里斯托大便分类法评分 四组大鼠造模前布里斯托大便分类法评分比较,差异无统计学意义(P>0.05);四组大鼠造模后、治疗后布里斯托大便分类法评分比较,差异有统计学意义(P<0.05)。
模型组、B-F组和C-B组大鼠造模后布里斯托大便分类法评分高于空白组,差异有统计学意义(P<0.05)。模型组大鼠治疗后布里斯托大便分类法评分高于空白组,差异有统计学意义(P<0.05);B-F组和C-B组大鼠治疗后大鼠布里斯托大便分类法评分低于模型组,差异有统计学意义(P<0.05);B-F组及C-B组大鼠造模后、治疗后布里斯托大便分类法评分比较,差异无统计学意义(P>0.05),见表2。
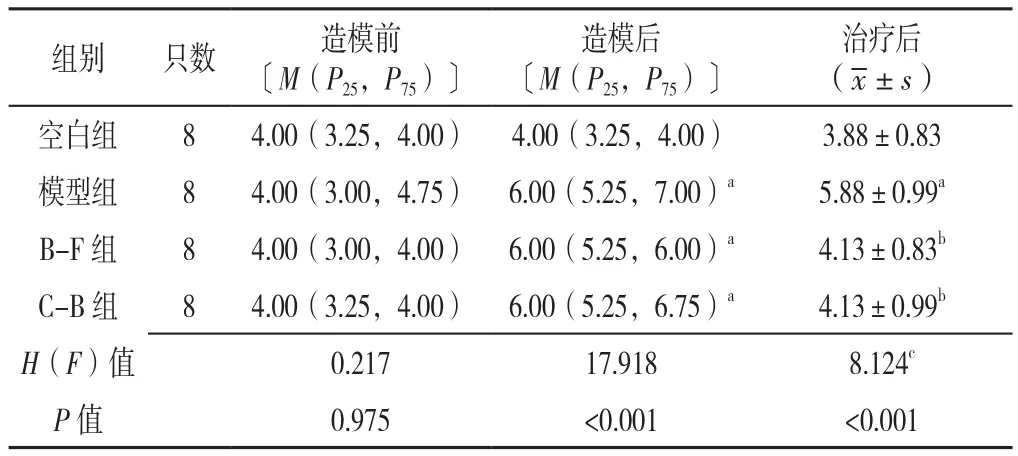
表2 四组大鼠造模前、造模后、治疗后布里斯托大便分类法评分比较(分)Table 2 Comparison of scores of the Bristol Stool Scale of rats in four groups at baseline,after the modeling period and after treatment
2.4 大鼠AWR评分
2.4.1 大鼠造模后不同压力梯度时AWR评分变化 四组大鼠造模后在气囊压力为20、40、60 mm Hg时AWR评分比较,差异有统计学意义(P<0.05);四组大鼠造模后在气囊压力为80 mm Hg时AWR评分比较,差异无统计学意义(P>0.05)。
造模后在气囊压力为20、40、60 mm Hg时:模型组、B-F组和C-B组大鼠AWR评分均高于空白组,差异有统计学意义(P<0.05);模型组、B-F组、C-B组大鼠AWR评分比较,差异无统计学意义(P>0.05),见表3。
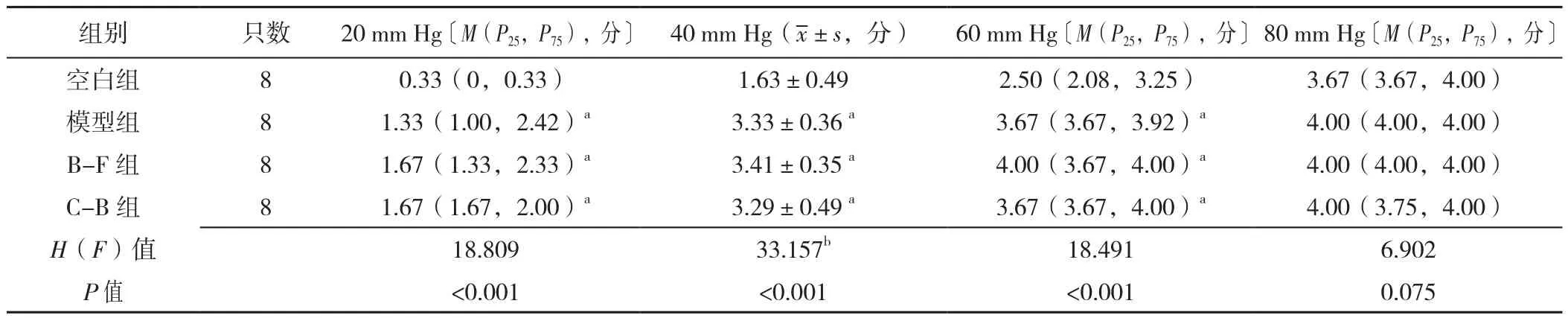
表3 四组大鼠造模后不同压力梯度下AWR评分比较Table 3 Comparison of AWR score of rats in four groups under different pressure gradients after modeling
2.4.2 大鼠治疗后不同压力梯度时AWR评分变化 四组大鼠治疗后在气囊压力为20 mm Hg时AWR评分比较,差异无统计学意义(P>0.05);四组大鼠治疗后在气囊压力为40、60、80 mm Hg时AWR评分比较,差异有统计学意义(P<0.05)。
治疗后在气囊压力为40 mm Hg时:模型组、C-B组大鼠AWR评分高于空白组,差异有统计学意义(P<0.05);B-F组大鼠AWR评分低于模型组,差异有统计学意义(P<0.05)。
治疗后在气囊压力为60 mm Hg时:模型组大鼠AWR评分均高于空白组,差异有统计学意义(P<0.05);B-F组大鼠AWR评分低于模型组、C-B组,差异有统计学意义(P<0.05)。
治疗后在气囊压力为80 mm Hg时:B-F组大鼠AWR评分低于模型组、C-B组,差异有统计学意义(P<0.05),见表4。

表4 四组大鼠治疗后不同压力梯度下AWR评分比较〔M(P25,P75),分〕Table 4 Comparison of AWR scores of rats in four groups under different pressure gradients after treatment
2.5 大鼠治疗后结肠、海马组织BDNF表达水平 四组大鼠治疗后结肠、海马组织BDNF表达水平比较,差异有统计学意义(P<0.05)。
模型组、C-B组大鼠治疗后结肠组织BDNF表达水平高于空白组,差异有统计学意义(P<0.05);B-F组大鼠治疗后结肠组织BDNF表达水平低于模型组和C-B组,差异有统计学意义(P<0.05)。
模型组大鼠治疗后海马组织BDNF表达水平低于空白组,差异有统计学意义(P<0.05);B-F组大鼠治疗后海马组织BDNF表达水平高于模型组,差异有统计学意义(P<0.05),见表5。
表5 四组大鼠治疗后结肠、海马组织BDNF表达水平比较(±s,μg/L)Table 5 Comparison of BDNF expression levels in colon and hippocampus of rats in four groups after treatment
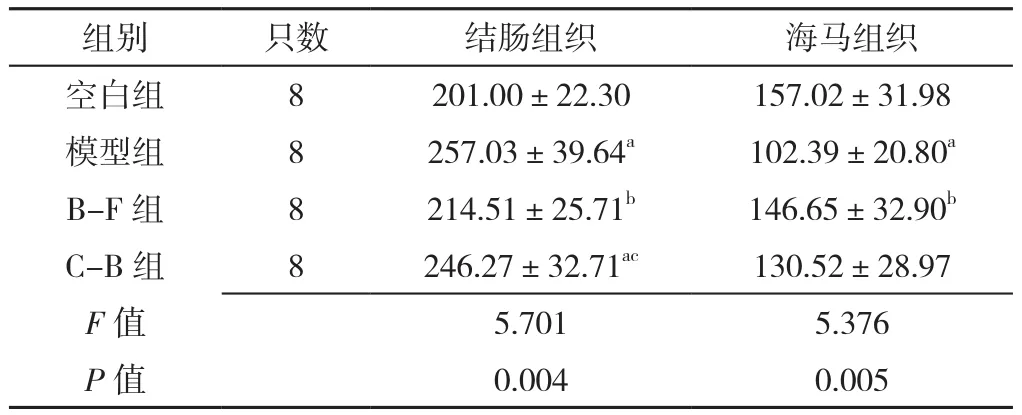
表5 四组大鼠治疗后结肠、海马组织BDNF表达水平比较(±s,μg/L)Table 5 Comparison of BDNF expression levels in colon and hippocampus of rats in four groups after treatment
注:a表示与空白组相比P<0.05,b表示与模型组相比P<0.05,c表示与B-F组相比P<0.05
组别 只数 结肠组织 海马组织空白组 8 201.00±22.30 157.02±31.98模型组 8 257.03±39.64a 102.39±20.80a B-F 组 8 214.51±25.71b 146.65±32.90b C-B组 8 246.27±32.71ac 130.52±28.97 F值 5.701 5.376 P值 0.004 0.005
2.6 大鼠治疗后结肠、海马组织SP表达水平 四组大鼠治疗后结肠、海马组织SP表达水平比较,差异有统计学意义(P<0.05)。
模型组、C-B组大鼠治疗后结肠组织SP表达水平高于空白组,差异有统计学意义(P<0.05);B-F组大鼠治疗后结肠组织SP表达水平低于模型组和C-B组,差异有统计学意义(P<0.05)。
模型组、C-B大鼠治疗后海马组织SP表达水平高于空白组,差异有统计学意义(P<0.05);B-F组大鼠治疗后海马组织SP表达水平低于模型组,差异有统计学意义(P<0.05),见表6。
表6 四组大鼠治疗后结肠、海马组织SP表达水平比较(±s,μg/L)Table 6 Comparison of SP expression levels in colon and hippocampus of rats in four groups after treatment
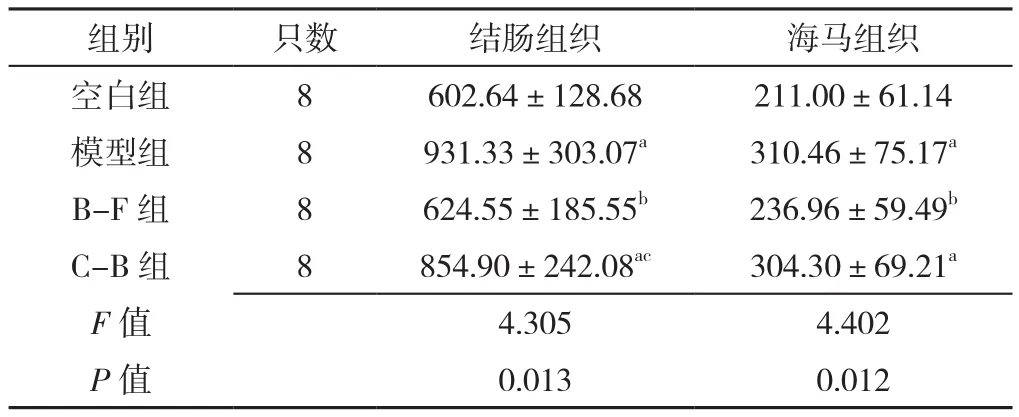
表6 四组大鼠治疗后结肠、海马组织SP表达水平比较(±s,μg/L)Table 6 Comparison of SP expression levels in colon and hippocampus of rats in four groups after treatment
注:a表示与空白组相比P<0.05,b表示与模型组相比P<0.05,c表示与B-F组相比P<0.05
组别 只数 结肠组织 海马组织空白组 8 602.64±128.68 211.00±61.14模型组 8 931.33±303.07a 310.46±75.17a B-F 组 8 624.55±185.55b 236.96±59.49b C-B组 8 854.90±242.08ac 304.30±69.21a F值 4.305 4.402 P值 0.013 0.012
3 讨论
IBS是一种脑-肠交互紊乱的疾病,其特征是腹痛和排便习惯改变[1]。腹痛腹胀症状是内脏高敏反应的典型特征,也是辨别IBS与其他功能性胃肠疾病的重要临床症状[24]。BDNF与SP等其他脑肠肽相互作用以调节肠道感觉并影响结肠敏感性[25]。AWR评分是量化肠道敏感性的一个重要指标[26],能够体现大鼠肠道敏感性变化情况。本研究通过拆解痛泻要方,从中枢及外周BDNF、SP表达切入,探讨痛泻要方中“抑木”组分白芍防风缓解IBS-D的内脏高敏的疗效机制。
BDNF是感知疼痛的重要调节因子[27-28],在大脑中活跃于海马皮质,参与神经元功能的调节,适量的BDNF可以维持感觉神经的正常功能,BDNF异常升高会导致各种与疼痛相关的感觉,如慢性疼痛、炎症性疼痛和内脏痛[25],并可能与IBS患者焦虑和抑郁症状存在关联[29]。也有充分的证据表明 BDNF 在内脏高敏反应中发挥重要作用[30]。
SP异常表达与内脏超敏密切相关[31],其参与了内脏的痛觉传递和痛觉产生过程,在内脏高敏性及调控痛敏感中发挥作用[32-33],海马中SP可参与情绪及应激功能调节[34],包括压力和焦虑相关行为[35]。有研究发现在IBS-D患者肠黏膜中SP阳性细胞数目和染色强度增加,认为高表达的SP与IBS-D腹痛、腹泻症状具有显著相关性[36]。SP作为一种胃肠激素,会促进肠蠕动、增高结肠内压力,从而易引起腹泻。
痛泻要方作为治疗IBS-D常用方剂之一[18],其能有效缓解腹痛和腹泻,并恢复患者消化道的稳态[37]。方中白术味甘苦、性温,甘以补脾胃之虚,苦温以燥湿肠中之湿;陈皮味辛苦、性温,辛温而助白术燥湿醒脾、兼而理气;白芍味酸、性微寒,可泻肝火而酸阴柔肝,以达到理肝气、缓急止痛的效果;防风味辛甘、性微温,既能辛散肝中郁气,又香醒脾气,辛温又能助白术除湿而止泻,且为脾经引经药。全方四药相配,补脾虚柔肝阴,理肠中之气,清肠中之湿,共奏止泻止痛之功。在本实验中,经过药物治疗的两组大鼠,精神状态良好,体质量增加高于模型组,表明食欲良好,受造模影响较小;此外布里斯托大便分类法评分均低于模型组,表明白芍防风药对与陈皮白术药对均有较好止泻效果。IBS-D模型大鼠AWR评分升高,表明肠道敏感性增加,治疗后B-F组在多个压力梯度下AWR评分优于C-B组,白芍防风发挥柔肝止痛之功而缓解内脏高敏。研究发现痛泻要方可通过下调SP表达,改善大便,缓解腹痛、腹泻症状,有效提高生活质量[36]。模型组中BDNF和SP在结肠内的表达显著增加,而在海马体内BDNF表达降低、SP表达增加,表明它们共同参与了IBS-D内脏高敏反应的形成。白芍防风能更显著地下调海马组织SP和结肠组织中BDNF、SP的表达,上调海马体内BDNF的表达,修复脑肠肽的平衡,缓解IBS-D症状。
综上所述,痛泻要方中白芍防风药对、陈皮白术药对均能明显增加IBS-D大鼠体质量、改善腹泻情况。相较于陈皮白术药对,白芍防风药对可更好地下调海马组织SP和结肠组织BDNF、SP的表达,上调海马组织BDNF的表达,从而改善肠道高敏状态,缓解腹泻症状。
作者贡献:王科凯、谢欣负责论文起草,并进行结果的分析与解释;王科凯、杨焱麟、周彦妮负责动物模型的制备、实验指标的检测;王科凯、吴芹萍进行数据收集、整理;肖瑾、谢欣进行统计分析、绘制图表;陈敏提出研究的构思与设计,负责研究的实施推进与可行性分析,负责最终版本修订,对论文负责。
本文无利益冲突。

