银杏叶提取物防治慢性阻塞性肺疾病的机制研究:基于PI3K/Akt/mTOR信号通路调控肺泡巨噬细胞自噬
郭栋伟,张鹏飞*,任明君,廖丽君,黄茹妍,罗湘蓉
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的慢性呼吸系统疾病,疾病负担严重,根据世界卫生组织(WHO)预测,到2030年COPD将成为人类第三大死亡原因[1]。COPD发病机制主要包括慢性气道炎症、氧化-抗氧化失衡、蛋白酶-抗蛋白酶失衡及免疫相关机制[2],其中巨噬细胞参与免疫相关的调节,通过释放促炎递质,包括趋化因子、细胞因子、蛋白酶等,在协调COPD的炎症过程中发挥重要作用[3]。肺巨噬细胞数量增加与功能受损是COPD发病的重要机制[4]。自噬是细胞通过自噬溶酶体溶解细胞内受损蛋白质、细胞器等来维持细胞稳态的一种重要的分解代谢过程[5],为细胞修复、再生及延续提供条件。自噬在维持肺部炎性反应系统的正常功能和COPD的病情进展中起着至关重要的作用[6]。吸烟是COPD的首要发病因素,研究发现吸烟者的肺泡巨噬细胞存在自噬功能缺陷,吸烟者的肺泡巨噬细胞内出现自噬体的异常蓄积,从而导致自噬体成熟障碍,引起蛋白质聚集清除受损,线粒体功能失调,以及细菌向溶酶体的传递缺陷[7]。如何抑制巨噬细胞释放促炎因子,改善COPD患者肺泡巨噬细胞自噬缺陷已逐渐成为防治COPD的新热点。
磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)通路是细胞内重要的信号传导途径之一,参与调控细胞生长、增殖、分化、自噬和凋亡等[8],在细胞自噬中发挥关键作用[9]。银杏叶提取物(ginkgo biloba extract,GBE)是从银杏的干燥叶中提取而来的以黄酮类、萜类内酯为主要活性成分的混合物,具有改善血液循环、抗血小板聚集、清除自由基、抗氧化等主要药理作用[10],临床上被广泛应用于治疗心脑血管疾病。近年来有关GBE治疗COPD的报道日益增多。梁炜等[11]研究发现GBE可抑制COPD大鼠气道和全身炎性反应,且早期干预效果更好。谭玉萍等[12]发现GBE能在一定程度上改善COPD大鼠气道重塑及肺血管重塑情况,但GBE治疗COPD的具体作用机制尚不清楚。本研究旨在验证GBE能否通过调控PI3K/Akt/mTOR信号通路促进肺泡巨噬细胞自噬,起到防治COPD的作用,为GBE在COPD防治中的应用提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 研究时间 本实验的研究时间为2020年11月至2022年3月。
1.1.2 实验动物与分组 7周龄SPF级雄性Wistar大鼠90只,体质量(200±20)g,由长沙市天勤生物技术有限公司提供,许可证号:SCXK(湘)2019-0013。实验前1周将大鼠置于实验环境中饲养,室温25~28 ℃,空气流通好,颗粒麦麸饲养。饲养笼具、饲料、饮水、垫料均按照SPF级实验动物的要求进行制备与消毒。按照随机数字表法将大鼠随机分为正常对照组、COPD模型组、GBE组、比卡鲁胺组、雷帕霉素组、Taselisib组,每组15只。本实验由广西中医药大学实验动物福利伦理委员会批准(批准编号:DW20220615-063)。
1.1.3 实验试剂与仪器设备 银杏叶提取物选用舒血宁注射液(国药准字Z13020795,河北神威药业集团有限公司),规格5 ml/支,含银杏叶提取物 17.5 mg,总黄酮醇苷4.2 mg,银杏内酯0.70 mg。比卡鲁胺(爱必信生物科技有限公司,货号:ABS817935),雷帕霉素(大连美仑生物技术有限公司,货号:MB1197),Taselisib(美国MCE公司,货号:HY-13898),云烟过滤嘴香烟(红云红河烟草有限责任公司,焦油量10 mg/支、烟气烟碱量1.1 mg/支,烟气一氧化碳含量12 mg/支),脂多糖(LPS)(美国Sigma公司,货号:L2880),白介素6(IL-6)和白介素8(IL-8)酶联免疫吸附检测(ELISA)试剂盒(深圳市欣博盛生物科技有限公司),PI3Kp110α(货号:4249)、Akt(货号:4691)、p-Akt(货号:4060)、mTOR(货号:2983)、p-mTOR(货号:5536)、LC3A/B(货号:12741)均购自美国CST公司,CD68抗体(北京博奥森生物技术有限公司,货号:bs-0649R)。倒置显微镜(MI52-N,广东明美),超低温冰箱(705,美国THERMO),倒置荧光显微镜(DMIL LED,德国LEICA公司),酶联免疫检测仪(DG5033A,南京华东),冰冻切片机(CM1850 德国LAICA),全自动化学发光分析仪(Tanon-5200,上海天能),透射电镜(HT7700,日立)。
1.2 实验方法
1.2.1 COPD大鼠造模与结果判定 正常对照组于第1、14天向气管内注入0.9%氯化钠溶液(NS)100 µl/100 g,其余时间均进行正常饲养。其余各组采用香烟烟雾熏吸联合气管内注入LPS构建COPD大鼠模型[13],在造模的第1 、14 天将大鼠以10%水合氯醛(3 ml/kg)以腹腔注射麻醉后,将大鼠固定,暴露喉头,向大鼠气管内注入LPS 100 µl/100 g(1 mg/ml),完毕后将大鼠直立旋转10~20 s,使LPS均匀分布于肺部,于实验的第2~13 天、15~28 天,每天在自制烟熏箱(120 cm×80 cm×80 cm,含1个进烟孔,2个排烟孔)中对大鼠进行香烟烟雾暴露,持续吸入新鲜的香烟烟雾1 h/d,30 支/d,造模28 d结束;造模过程中,因麻醉意外和香烟烟雾熏吸导致正常对照组、GBE组、比卡鲁胺组、雷帕霉素组各死亡1只,COPD模型组和Taselisib组各死亡2只,造模结束后,每组大鼠随机处死2只进行肺组织病理检测,判断造模结果。实验28 d后,正常对照组大鼠进食、活动均正常,呼吸顺畅,大鼠肺泡壁完整、泡腔无扩大,支气管结构正常、形态清晰、纤毛排列整齐,血管腔无狭窄、血管壁无增厚,其余各造模组大鼠出现进食减少、蜷伏少动、毛发枯黄易脱落、气道有痰鸣音表现,肺组织病理表现为肺泡壁断裂融合形成肺大泡、肺气肿明显、气道管壁增厚、气道管腔狭窄、血管壁增厚、血管腔狭窄、炎性细胞浸润明显,判定造模成功。
1.2.2 用药方案 实验的第15 ~28 天,GBE组给予舒血宁注射液腹腔注射,用药量为0.4 ml·kg-1·d-1,其余各组均腹腔注射同等体积的NS做对照;于实验第29~42 天,采用由DMSO、聚乙二醇、吐温80、NS配制的混合溶剂溶解药剂,比卡鲁胺组按照1.0 mg·kg-1·d-1腹腔注射给药、雷帕霉素组按照0.5 mg·kg-1·d-1给药、Taselisib组按照1.5 mg·kg-1·d-1给药,其余各组均采用腹腔注射混合溶剂对照。
1.2.3 标本采集 全部实验结束后即第43 天,各组大鼠用10%水合氯醛(3 ml/kg)麻醉,腹主动脉采血5 ml/只,3 000 r/min(离心半径为9 cm)离心15 min,留取血清分装,于-80 ℃冰箱保存。提取大鼠原代肺泡巨噬细胞、留取大鼠肺泡灌洗液(BALF),随后剖取肺脏,取距离肺门3 mm处的右肺组织做连续切片,快速放入4%多聚甲醛溶液中,用于后续的病理检测。其余的右肺组织经干冰速冻后转移至-80 ℃冰箱保存,用于后续的蛋白与RNA提取。取左肺组织放入电镜固定液固定,用于透射电镜观察。
1.2.4 大鼠原代肺泡巨噬细胞分离纯化与BALF留取参照禹茜等[14]的方法,将麻醉后的大鼠用75%乙醇浸泡30 min,剪开颈部皮肤,分离气管,在环状软骨下用剪刀做T字形切口,将自制气管插管由切口处插入气管内,使用缝合线固定,取5 ml注射器去除针头,吸取含体积分数5%青霉素-链霉素-两性霉素B混合溶液的冷PBS缓冲液 3 ml,由气管插管口注入大鼠肺内,轻柔按摩2 min后回吸,重复5次,可回收BALF约10 ml,离心(4 000 r/min,离心20 min,离心半径为9 cm)后取上清液于-80 ℃冰箱保存,沉淀应用红细胞裂解液去除红细胞,用无血清RPMI 1640培养液重悬计数,接种入细胞培养瓶中,置于细胞培养箱中培养3 h后换液,用传统贴壁法进一步提纯细胞。
1.2.5 HE染色 采用4%多聚甲醛固定大鼠右肺组织48 h后,采用梯度乙醇脱水,二甲苯透明,石蜡包埋,冰冻后切片,切片厚度为3 µm,二甲苯脱蜡脱水,进行HE染色后使用中性树胶封固。使用倒置显微镜拍照,采用Image-Pro Plus 6.0图像分析软件进行分析测算。
肺泡病理改变:在每只大鼠的HE染色切片中选取5个不同视野,200倍镜下观察、记录、分析肺泡的病理改变。如下,(1)观察肺平均内衬间隔(MLI):以每个视野的正中为中心划“十”字线,计数经此十字线的肺泡间隔总数(Ns),计算十字线总长度(L),MLI=L/Ns,其值反映肺泡平均直径;(2)平均肺泡数(MAN):计数每个视野内的肺泡总数(Na),除以此视野的面积(TA),MAN=Na/TA(个/mm2),其值反映肺泡的密度;(3)平均肺泡面积(MAA):以HE染色阳性区域的面积为PA,MAA=(TA-PA)/Na(µm2)。气道重塑:显微镜下观察各组大鼠支气管的结构、形态、纤毛排列以及炎性细胞浸润情况。
1.2.6 ELISA检测 采用ELISA检测大鼠BALF与血清中IL-6、IL-8水平,具体操作按照试剂盒说明书进行。
1.2.7 原代肺泡巨噬细胞的免疫荧光鉴定 CD68抗体分布在细胞表面,在单核细胞的表面表达较少,当其向巨噬细胞转化后表达明显增加,CD68抗体是巨噬细胞谱系中高度特异性表达的蛋白质,常作为鉴定巨噬细胞的特异性标志物[15-16],纯化后的巨噬细胞使用胰蛋白酶消化后,重悬调整细胞浓度为2×106个/ml,将24孔板爬片置入24孔板中,巨噬细胞接种于细胞爬片上,放入细胞培养箱中培养4 h后取出,巨噬细胞已完全贴壁。先后予PBS缓冲液浸洗、4%多聚甲醛固定、0.5%Triton X-100室温通透、5%山羊血清37 ℃封闭、CD68抗体4 ℃孵育过夜、荧光羊抗兔二抗37 ℃孵育、DAPI染核、抗荧光淬灭剂封固,使用倒置荧光显微镜观察、拍照。
1.2.8 各组大鼠肺泡巨噬细胞数量的比较 由于各组大鼠间体质量存在一定差异,因此采用单位质量肺组织肺泡巨噬细胞的收集量(×106/g肺组织)来比较各组大鼠肺泡巨噬细胞数量差异,具体计算方法如下:大鼠肺泡灌洗收集到的肺泡巨噬细胞总数量与大鼠肺组织的质量之比。将各组大鼠肺泡巨噬细胞使用胰蛋白酶消化后,收集于15 ml离心管中离心(2 000 r/min,离心10 min,离心半径为6 cm),吸去上清,后各加入3 ml RPMI 1640培养液重悬,使用细胞计数板在显微镜下计算每只大鼠的肺泡巨噬细胞数量。
1.2.9 大鼠肺泡巨噬细胞的透射电镜观察 采用透射电镜观察大鼠肺泡巨噬细胞的超微结构,将大鼠的左肺组织取出后切成小块,快速放入新鲜的2.5%戊二醛固定液中,在固定液中使用锋利的刀片将肺组织切成 1 mm3大小,乙醇、丙酮脱水后丙酮、环氧树脂浸透,再进行包埋、聚合,超薄切片(厚度60 nm)。先后使用醋酸铀避光染色、枸橼酸铅避光染色,使用透射电镜观察巨噬细胞内结构并采集图像。
1.2.10 大鼠肺泡巨噬细胞中自噬相关蛋白表达水平测定及微管相关蛋白轻链3(LC3)-Ⅱ/LC3-Ⅰ比值计算 采用免疫印记法检测PI3Kp110α、Akt、p-Ak、mTOR、p-mTOR、LC3-Ⅱ、LC3-Ⅰ表达水平,将各组大鼠原代肺泡巨噬细胞从培养箱中取出,吸去培养液,使用PBS缓冲液清洗2遍后按照每1×106个细胞加入含有蛋白酶和磷酸酶抑制剂的裂解液200 µl,4 ℃充分裂解细胞,提取肺泡巨噬细胞总蛋白,用BCA试剂盒检测蛋白浓度,调整蛋白浓度使各组保持一致,取20 µg总蛋白进行上样,用SDS-PAGE电泳分离后,湿法转膜,5%脱脂奶粉室温封闭2 h,然后加入一抗 PI3 Kinase p110α、Akt、p-Ak、mTOR、p-mTOR、LC3A/B、β-Actin,稀释比均为1∶1 000,4 ℃过夜,PBST缓冲液洗涤3次,按照1∶10 000稀释辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗,与膜室温孵育1 h,用PBST缓冲液洗涤3次,将膜放置在暗室中,根据用量取ECL发光液进行显影,采用Image J图像分析软件统计各条带灰度值并计算各蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比值。
1.3 统计学处理 采用SPSS 17.0统计软件进行数据分析,计量资料以(±s)表示,数据符合正态分布并方差齐,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 六组大鼠肺泡病理改变 HE染色结果显示:正常对照组大鼠肺泡结构正常连续,肺泡壁完整,泡腔无扩大,肺泡数目较多;与正常对照组相比,COPD模型组大鼠肺泡结构杂乱,肺泡壁变薄断裂,肺泡腔扩大,肺泡间隔数量明显减少,出现较多肺大泡,肺气肿明显;GBE组及各抑制剂组大鼠肺泡损伤程度较COPD模型组有所减轻,肺泡结构基本正常,肺大泡形成较少,见图1。六组大鼠MLI、MAA、MAN比较,差异有统计学意义(P<0.05)。COPD模型组、GBE组、比卡鲁胺组、雷帕霉素组、Taselisib组MLI与MAA大于正常对照组,MAN小于正常对照组,差异有统计学意义(P<0.05);GBE组、比卡鲁胺组、雷帕霉素组、Taselisib组MLI与MAA小于COPD模型组,MAN大于COPD模型组,差异有统计学意义(P<0.05),见表1。
表1 各组大鼠MLI、MAN、MAA的比较(±s)Table 1 Comparison of mean linear intercept,mean alveolar area and mean alveolar number in rats of six groups
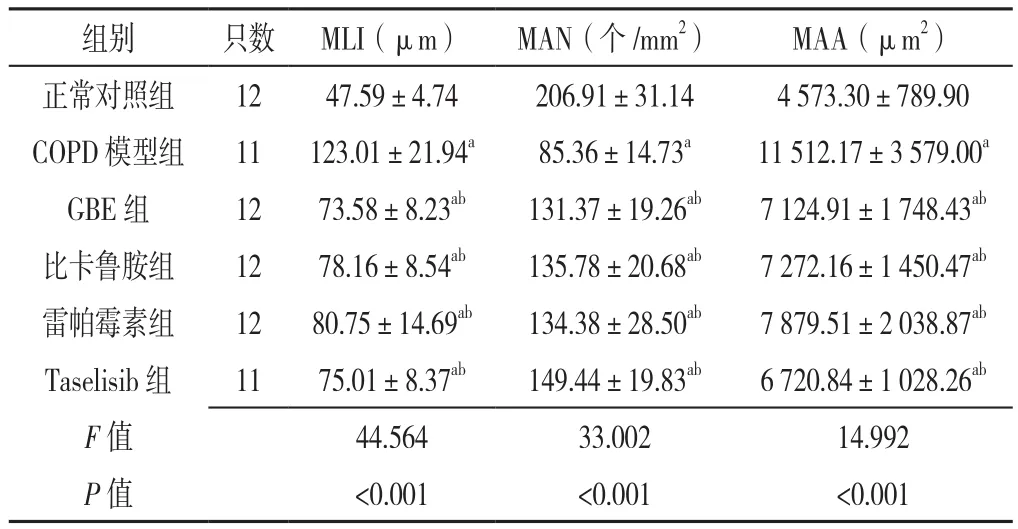
表1 各组大鼠MLI、MAN、MAA的比较(±s)Table 1 Comparison of mean linear intercept,mean alveolar area and mean alveolar number in rats of six groups
注:,COPD=慢性阻塞性肺疾病,GBE=银杏叶提取物,MLI=肺平均内衬间隔,MAN=平均肺泡数,MAA=平均肺泡面积;a表示与正常对照组比较P<0.05,b表示与COPD模型组比较P<0.05
组别 只数 MLI(µm) MAN(个/mm2) MAA(µm2)正常对照组 12 47.59±4.74 206.91±31.14 4 573.30±789.90 COPD模型组 11 123.01±21.94a 85.36±14.73a 11 512.17±3 579.00a GBE 组 12 73.58±8.23ab 131.37±19.26ab 7 124.91±1 748.43ab比卡鲁胺组 12 78.16±8.54ab 135.78±20.68ab 7 272.16±1 450.47ab雷帕霉素组 12 80.75±14.69ab 134.38±28.50ab 7 879.51±2 038.87ab Taselisib组 11 75.01±8.37ab 149.44±19.83ab 6 720.84±1 028.26ab F值 44.564 33.002 14.992 P值 <0.001 <0.001 <0.001
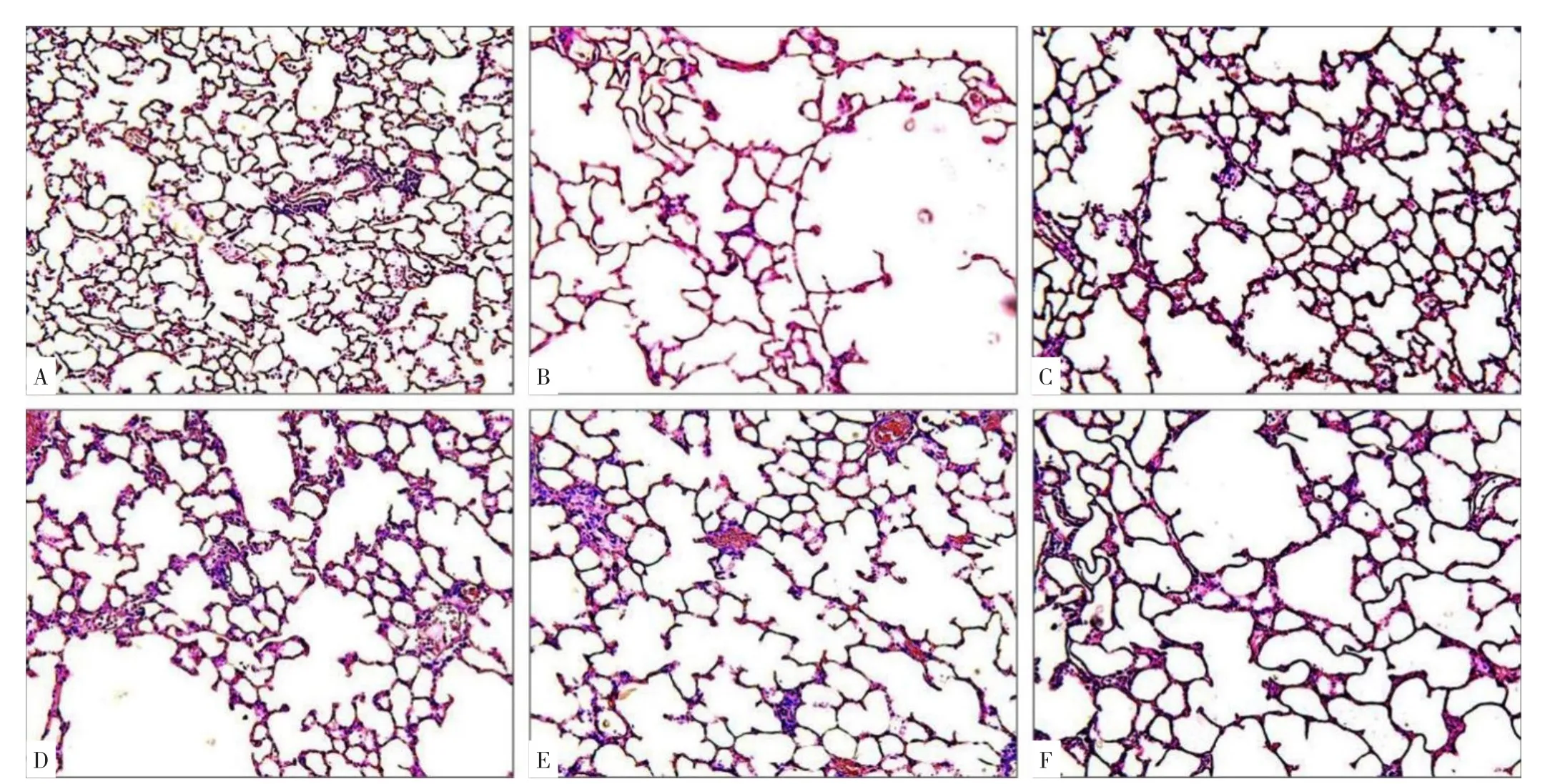
图1 各组大鼠肺泡病理改变(200×)Figure 1 Pathological changes of alveoli in rats of normal control,COPD model,GBE,bicalutamide,rapamycin and taselisib groups
2.2 六组大鼠气道重塑的比较 显微镜下观察,正常对照组支气管结构正常,形态清晰,纤毛排列整齐,气道纤毛柱状上皮细胞完整,无炎性细胞浸润;COPD模型组支气管平滑肌层增厚,部分肌层已经断裂,黏膜下及外膜见胶原纤维增生,管腔狭窄,气道黏膜上皮脱落、减少、紊乱,管壁及其周围有明显炎性细胞浸润;GBE组与各抑制剂组大鼠支气管壁结构基本完整,气道黏膜上皮结构较完整,纤毛排列相对COPD模型组整齐,支气管平滑肌层稍增厚,支气管管壁及其周围炎性细胞浸润较少,详见图2。
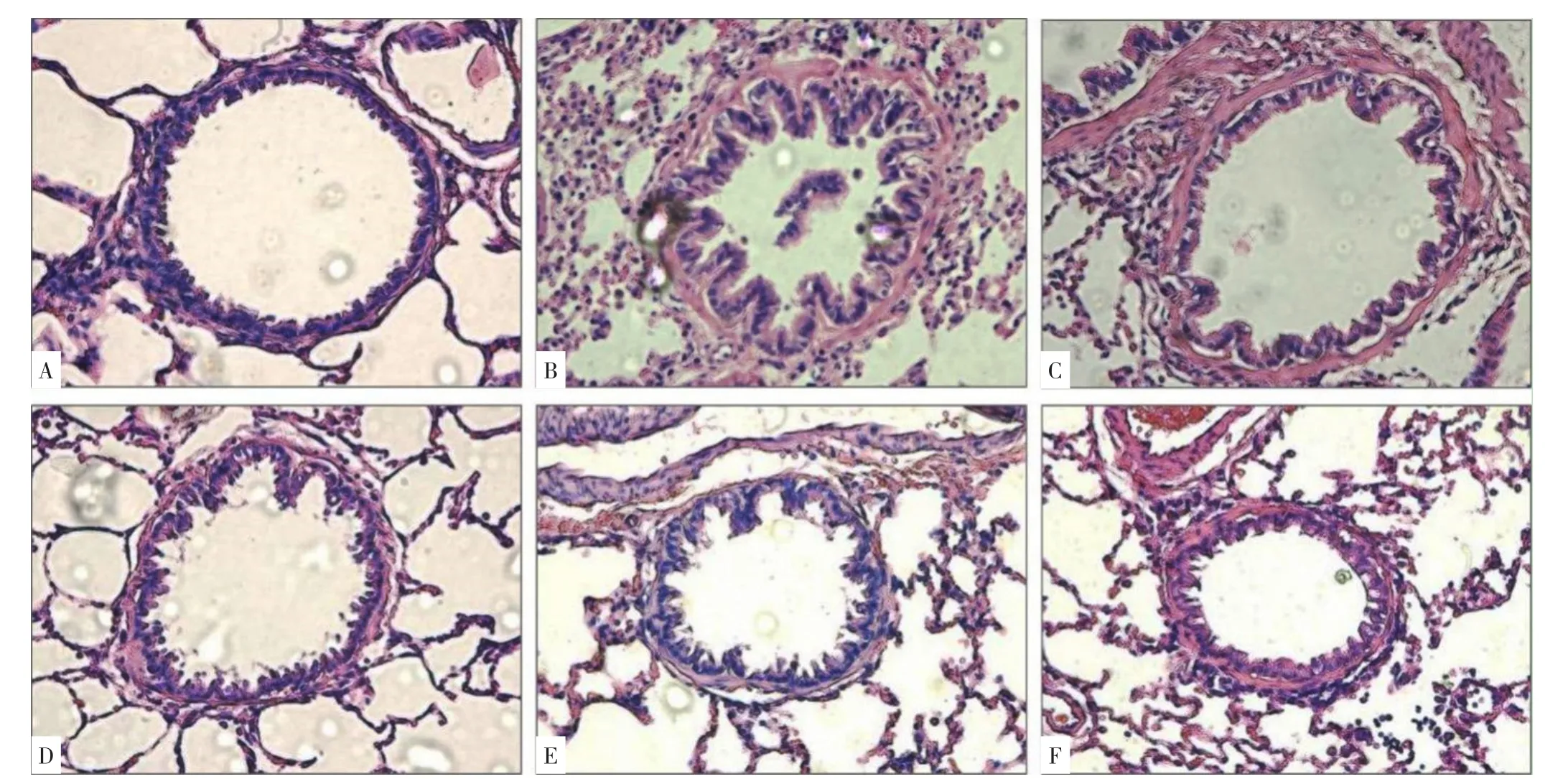
图2 各组大鼠气道重塑的比较(400×)Figure 2 Comparison of airway remodeling status in rats of normal control,COPD model,GBE,bicalutamide,rapamycin and taselisib groups
2.3 六组大鼠BALF中IL-6、IL-8水平比较 六组大鼠BALF中IL-6、IL-8水平比较,差异有统计学意义(P<0.05)。COPD模型组IL-6、IL-8水平高于其他各组,差异有统计学意义(P<0.05);GBE组IL-6高于正常对照组、比卡鲁胺组、Taselisib组,差异有统计学意义(P<0.05);GBE组IL-8水平高于正常对照组、比卡鲁胺组、雷帕霉素组和Taselisib组,差异有统计学意义(P<0.05),见表2。
表2 各组大鼠BALF中IL-6、IL-8水平的比较(±s,pg/ml)Table 2 Comparison of levels of IL-6 and IL-8 in alveolar lavage fluid in rats of six groups
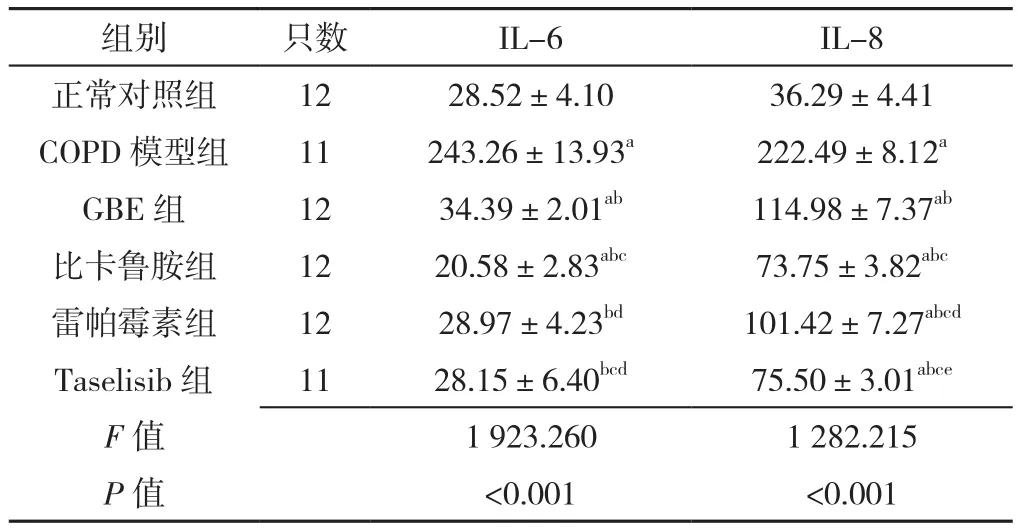
表2 各组大鼠BALF中IL-6、IL-8水平的比较(±s,pg/ml)Table 2 Comparison of levels of IL-6 and IL-8 in alveolar lavage fluid in rats of six groups
注:IL-6=白介素6,IL-8=白介素8;a表示与正常对照组比较P<0.05,b表示与COPD模型组比较P<0.05,c表示与GBE组相比P<0.05,d表示与比卡鲁胺组比较P<0.05,e表示与雷帕霉素组比较P<0.05
组别 只数 IL-6 IL-8正常对照组 12 28.52±4.10 36.29±4.41 COPD模型组 11 243.26±13.93a 222.49±8.12a GBE组 12 34.39±2.01ab 114.98±7.37ab比卡鲁胺组 12 20.58±2.83abc 73.75±3.82abc雷帕霉素组 12 28.97±4.23bd 101.42±7.27abcd Taselisib组 11 28.15±6.40bcd 75.50±3.01abce F值 1 923.260 1 282.215 P值 <0.001 <0.001
2.4 六组大鼠血清IL-6、IL-8水平比较 六组大鼠血清IL-6、IL-8水平比较,差异有统计学意义(P<0.05)。COPD模型组的IL-6、IL-8水平高于其他各组,差异有统计学意义(P<0.05),GBE组IL-6高于正常对照组、比卡鲁胺组、雷帕霉素组,差异有统计学意义(P<0.05),GBE组IL-8水平高于正常对照组、比卡鲁胺组和Taselisib组,差异有统计学意义(P<0.05),见表3。
表3 各组大鼠血清IL-6、IL-8水平比较(±s,pg/ml)Table 3 Comparison of serum levels of IL-6 and IL-8 in the rats of six groups
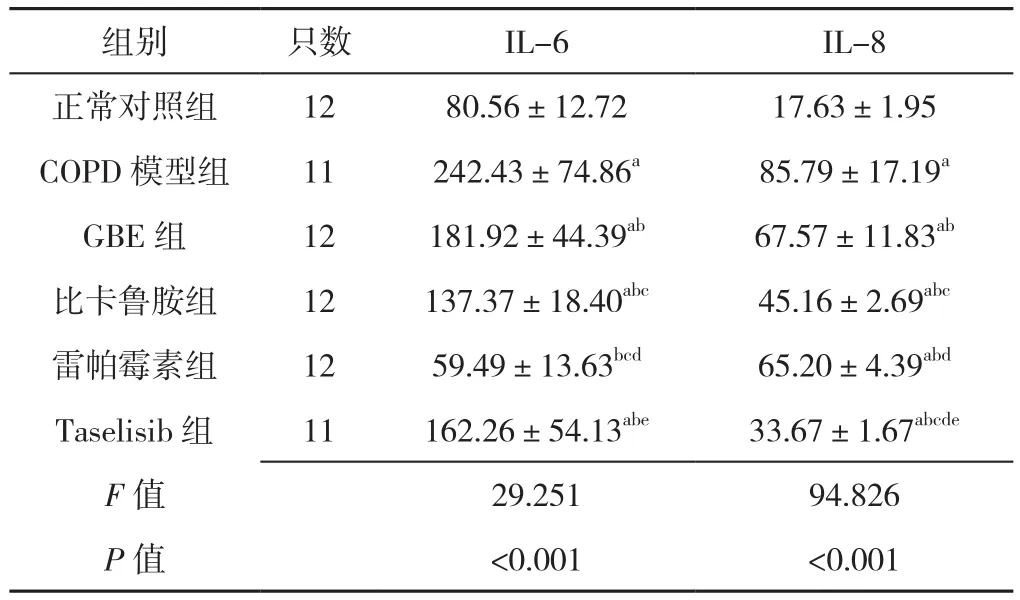
表3 各组大鼠血清IL-6、IL-8水平比较(±s,pg/ml)Table 3 Comparison of serum levels of IL-6 and IL-8 in the rats of six groups
注:a表示与正常对照组比较P<0.05,b表示与COPD模型组比较P<0.05,c表示与GBE组相比P<0.05,d表示与比卡鲁胺组比较P<0.05,e表示与雷帕霉素组比较P<0.05
组别 只数 IL-6 IL-8正常对照组 12 80.56±12.72 17.63±1.95 COPD模型组 11 242.43±74.86a 85.79±17.19a GBE 组 12 181.92±44.39ab 67.57±11.83ab比卡鲁胺组 12 137.37±18.40abc 45.16±2.69abc雷帕霉素组 12 59.49±13.63bcd 65.20±4.39abd Taselisib组 11 162.26±54.13abe 33.67±1.67abcde F值 29.251 94.826 P值 <0.001 <0.001
2.5 原代肺泡巨噬细胞的免疫荧光鉴定 细胞免疫荧光显示细胞呈特异性表面标志物CD68抗体表达阳性,表明肺泡原代巨噬细胞的提取、纯化成功,见图3。

图3 原代肺泡巨噬细胞的免疫荧光鉴定(200×)Figure 3 Primary alveolar macrophages identified by immunofluorescence staining
2.6 六组大鼠肺泡巨噬细胞数量的比较 六组巨噬细胞数量比较,差异有统计学意义(P<0.05);正常对照组巨噬细胞数量低于其他各组,COPD模型组巨噬细胞数量高于其他各组,差异有统计学意义(P<0.05),见表4。
表4 各组大鼠单位重量肺组织肺泡巨噬细胞数量的比较(±s,n=3)Table 4 Comparison of the number of alveolar macrophages per unit weight in lung tissues of rats in six groups
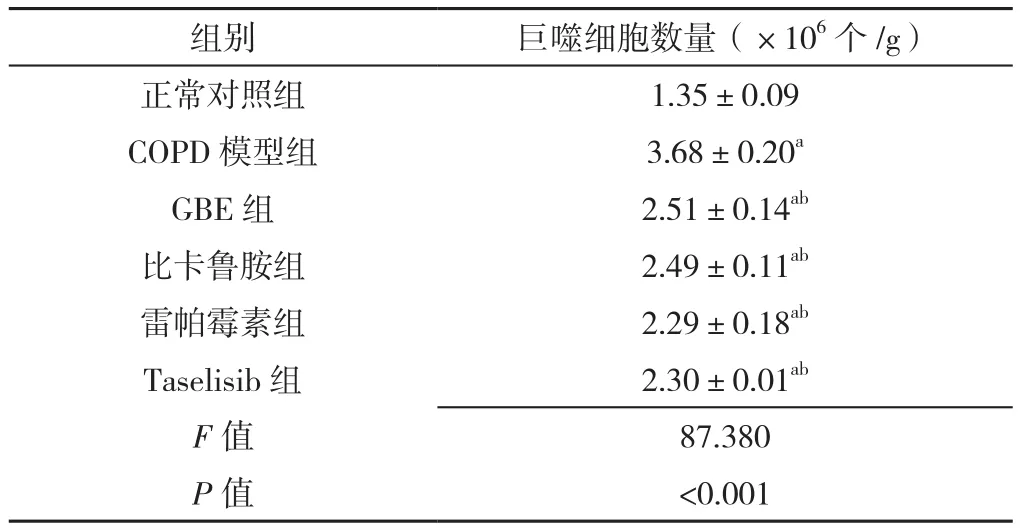
表4 各组大鼠单位重量肺组织肺泡巨噬细胞数量的比较(±s,n=3)Table 4 Comparison of the number of alveolar macrophages per unit weight in lung tissues of rats in six groups
注:a表示与正常对照组比较P<0.05,b表示与COPD模型组比较P<0.05
组别 巨噬细胞数量(×106个/g)正常对照组 1.35±0.09 COPD模型组 3.68±0.20a GBE组 2.51±0.14ab比卡鲁胺组 2.49±0.11ab雷帕霉素组 2.29±0.18ab Taselisib组 2.30±0.01ab F值 87.380 P值 <0.001
2.7 大鼠肺泡巨噬细胞透射电镜观察 电镜是观察细胞自噬的金标准,从透射电镜图片中可以看出,肺泡巨噬细胞位于肺的基底膜空腔内侧,巨噬细胞多呈圆形或椭圆形,表面有凸起,细胞浆内可见数量不等的初级和次级溶酶体或吞噬体。图4中绿色箭头指示初级溶酶体,内含未开始消化衰老的细胞器、线粒体、糖原等物质;当细胞内退变、崩解的某些细胞器或局部细胞质由双层膜加以包围后形成囊泡状小体,称为自噬体。当自噬体与初级溶酶体融合后会形成次级溶酶体,又称自噬溶酶体(蓝色箭头指示),并激活水解酶分解衰老的细胞器或过量积存的糖元等物质,以实现细胞本身的代谢需要和某些细胞器的更新。透射电镜结果显示正常对照组存在自噬,但自噬活动较弱,初级溶酶体与自噬溶酶体均较少;COPD模型组自噬作用较正常对照组增强,但自噬溶酶体较少,而初级溶酶体增多;GBE组与比卡鲁胺组、雷帕霉素组、Taselisib组的自噬溶酶体较COPD模型组增多,见图4。
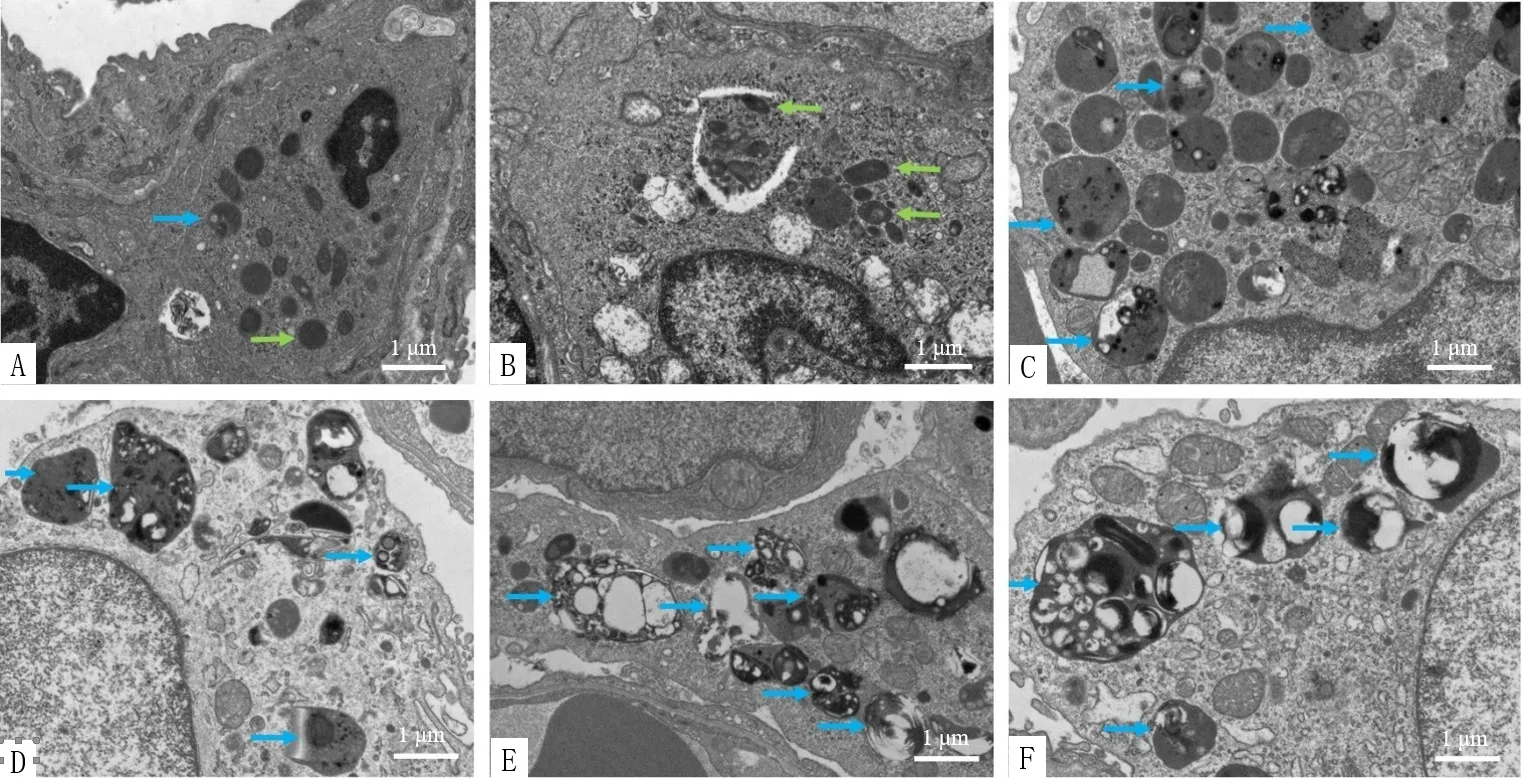
图4 各组肺泡巨噬细胞透射电镜图(7 000×)Figure 4 Transmission electron micrographs of alveolar macrophages in normal control,COPD model,GBE,bicalutamide,rapamycin and taselisib groups
2.8 六组大鼠肺泡巨噬细胞自噬相关蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比值比较 六组大鼠肺泡巨噬细胞PI3Kp110α、Akt、p-Akt、mTOR、p-mTOR表达水平及LC3-Ⅱ/LC3-Ⅰ比值比较,差异有统计学意义(P<0.05)。正常对照组的PI3Kp110α、Akt、p-Akt、mTOR、p-mTOR表达水平高于其他各组,LC3-Ⅱ/LC3-Ⅰ比值低于其他各组,差异有统计学意义(P<0.05)。COPD模型组PI3Kp110α、Akt、p-Akt、mTOR、p-mTOR表达水平高于GBE组、比卡鲁胺组、雷帕霉素组、Taselisib组,LC3-Ⅱ/LC3-Ⅰ比值低于GBE组、比卡鲁胺组、雷帕霉素组、Taselisib组,差异有统计学意义(P<0.05)。GBE组Akt、mTOR高于Taselisib组,p-mTOR高于雷帕霉素组和Taselisib组,差异有统计学意义(P<0.05),见表5、图5~7。
表5 各组大鼠肺泡巨噬细胞中自噬相关蛋白表达水平比较(±s,n=3)Table 5 Comparison of expression levels of autophagy-related proteins in alveolar macrophages of rats in six groups
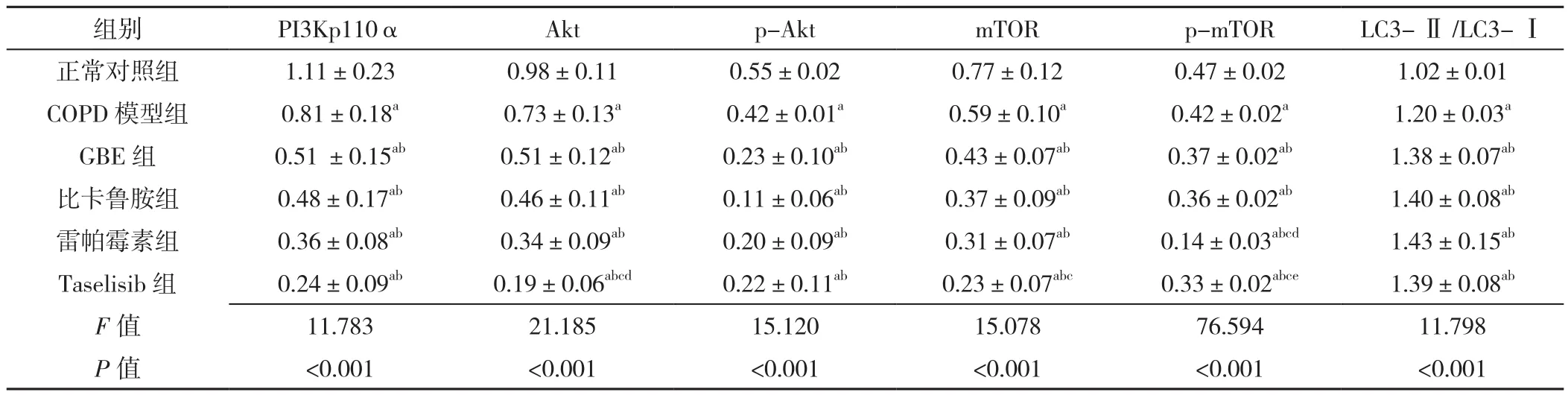
表5 各组大鼠肺泡巨噬细胞中自噬相关蛋白表达水平比较(±s,n=3)Table 5 Comparison of expression levels of autophagy-related proteins in alveolar macrophages of rats in six groups
注:a表示与正常对照组比较P<0.05,b表示与COPD模型组比较P<0.05,c表示与GBE组相比P<0.05,d表示与比卡鲁胺组比较P<0.05;e表示与雷帕霉素组比较P<0.05
组别 PI3Kp110α Akt p-Akt mTOR p-mTOR LC3-Ⅱ/LC3-Ⅰ正常对照组 1.11±0.23 0.98±0.11 0.55±0.02 0.77±0.12 0.47±0.02 1.02±0.01 COPD 模型组 0.81±0.18a 0.73±0.13a 0.42±0.01a 0.59±0.10a 0.42±0.02a 1.20±0.03a GBE 组 0.51 ±0.15ab 0.51±0.12ab 0.23±0.10ab 0.43±0.07ab 0.37±0.02ab 1.38±0.07ab比卡鲁胺组 0.48±0.17ab 0.46±0.11ab 0.11±0.06ab 0.37±0.09ab 0.36±0.02ab 1.40±0.08ab雷帕霉素组 0.36±0.08ab 0.34±0.09ab 0.20±0.09ab 0.31±0.07ab 0.14±0.03abcd 1.43±0.15ab Taselisib 组 0.24±0.09ab 0.19±0.06abcd 0.22±0.11ab 0.23±0.07abc 0.33±0.02abce 1.39±0.08ab F值 11.783 21.185 15.120 15.078 76.594 11.798 P值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
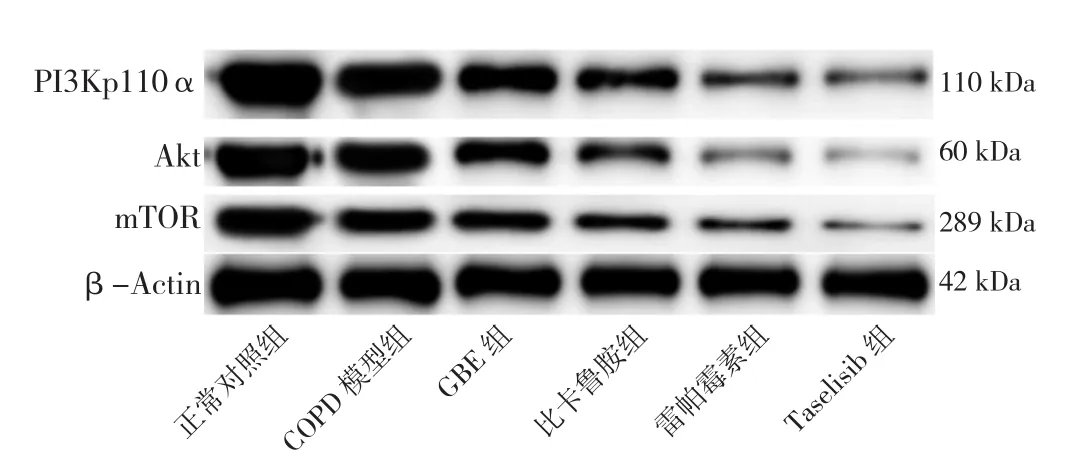
图5 各组大鼠肺泡巨噬细胞中PI3Kp110α、Akt、mTOR蛋白的表达Figure 5 Expression levels of PI3Kp110α,Akt and mTOR proteins in alveolar macrophages of rats in six groups
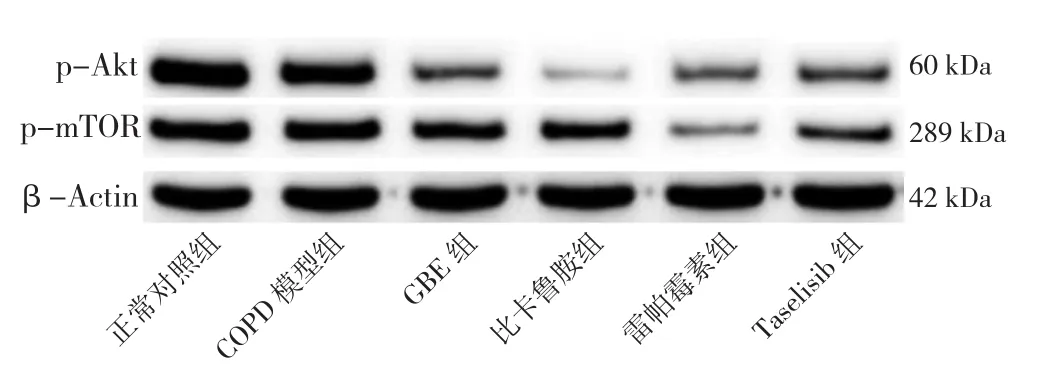
图6 各组大鼠肺泡巨噬细胞中p-Akt、p-mTOR蛋白的表达Figure 6 Expression levels of p-Akt and p-mTOR proteins in alveolar macrophages of rats in six groups
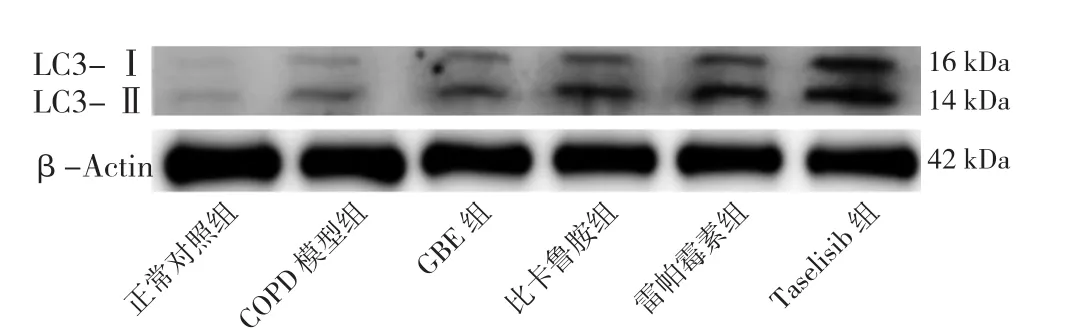
图7 各组大鼠肺泡巨噬细胞自噬相关蛋白的表达及LC3-Ⅱ/LC3-Ⅰ比值Figure 7 Expression levels of LC3I and LC3II proteins in alveolar macrophages of rats in six groups
3 讨论
COPD的发病机制主要包括炎性机制、氧化应激机制、免疫学机制、蛋白酶-抗蛋白酶失衡,而炎性机制是COPD的关键致病机制[17],肺泡巨噬细胞、中性粒细胞等免疫细胞在COPD的慢性炎性机制中发挥重要作用[18]。COPD患者气道、肺实质、BALF与痰液中巨噬细胞的数量明显增多,且在肺气肿肺泡壁破坏部位的浸润更加明显,而在肺实质中的巨噬细胞数量与肺气肿的严重程度呈正相关[19]。研究表明,肺泡巨噬细胞是导致COPD患者出现机体炎症的始动细胞,其能促进炎症趋化因子、中性粒细胞的释放,介导炎性反应,参与COPD炎症进展[20]。在本次研究中,COPD造模后的大鼠肺泡巨噬细胞数量较正常对照组显著增加,且肺气肿、气道重塑与肺泡壁破坏情况严重,大鼠气道与肺组织内炎症浸润明显,血清与BALF中炎性因子IL-6、IL-8水平较正常对照组显著升高,表明COPD造模成功;与COPD模型组比较,GBE组、比卡鲁胺组、雷帕霉素组、Taselisib组均能在一定程度上改善COPD大鼠肺气肿、肺泡壁破坏及气道重塑,并能降低血清与BALF中IL-6、IL-8的水平,考虑和GBE与各抑制剂组均能降低大鼠肺泡巨噬细胞数量、减轻巨噬细胞浸润有关。
自噬是广泛存在于真核细胞中的一种正常的生理降解机制,可主动清除细胞内多余、受损、衰老的蛋白质与细胞器以维持细胞稳态和细胞完整性,是维持细胞自身生存的关键细胞修复途径之一[21-22]。正常生理状态下细胞自噬处于较低水平,而在应激情况如营养缺乏、缺氧等条件下,可使细胞自噬作用增强[23],作为机体自我保护的一种重要机制,自噬参与多种疾病的病理、生理过程,影响疾病的发生、发展[24]。自噬在COPD的病理、生理过程中起关键性作用,既可以发挥保护作用,也可产生破坏性影响[25]。PI3K/Akt/mTOR信号通路已被证实是调节细胞自噬的主要通路[26],PI3K是一种广泛存在于胞质内的磷脂酰肌醇激酶,在炎性反应、信号传导等方面发挥重要作用,根据其序列同源性和底物特异性可分为Ⅰ、Ⅱ、Ⅲ3类,其中Ⅰ类PI3K可分为p110α催化亚基和p110β催化亚基[27],PI3K能够激活Akt参与下游信号因子的调控,Akt分子作为PI3K/Akt/mTOR信号通路中的关键分子,在促进细胞增殖、侵袭和转移,抑制细胞自噬和凋亡中发挥核心作用[28],磷酸化后的Akt会将信号传递给mTOR,并通过激活泛素蛋白酶体途径参与调节自噬相关基因与下游底物表达,从而起到抑制自噬的作用[29]。mTOR是细胞自噬的调控中心,同时也是细胞自噬的能量和营养状态的感受器,受包括PI3K/Akt等在内的多种信号通路的调节,在调节细胞自噬中发挥关键作用[30-31]。LC3是自噬过程中的一个标志性蛋白质,其表达的强度与自噬体数量呈正相关[32],自噬启动后LC3-Ⅰ开始向LC3-Ⅱ转化,LC3-Ⅱ被认为是代表自噬作用的标志性指标,其表达量的高低在一定程度上反应了自噬体的数量和自噬的程度[33],LC3-Ⅱ/LC3-Ⅰ比值与自噬小体的形成程度密切相关,是反映整个自噬水平的重要标志[34]。
本团队前期研究发现,GBE能降低COPD大鼠血清与BALF中IL-1、IL-8的水平,并能够抑制COPD大鼠肺组织中基质金属蛋白酶-9(MMP-9)的表达,从而发挥抑制COPD大鼠气道与全身炎性反应、肺组织重塑与肺纤维化的作用,但其具体机制尚不清楚[35-36]。Taselisib是一种有效的选择性PI3K抑制剂[37];比卡鲁胺作为Akt的抑制剂,能抑制小鼠RAW264.7巨噬细胞的Akt、mTOR蛋白的表达,增加LC3-Ⅱ蛋白表达[38];雷帕霉素是一种经典的自噬激动剂,通过抑制mTOR来激活自噬[39];因此,本次研究采用Taselisib、比卡鲁胺、雷帕霉素作为GBE能否通过调控PI3K/Akt/mTOR通路促进肺泡巨噬细胞自噬治疗COPD的对照药物。研究结果显示,与正常对照组相比,COPD模型组肺泡巨噬细胞中PI3Kp110α、Akt、p-Akt、mTOR、p-mTOR蛋白的表达水平下降,而LC3-Ⅱ/LC3-Ⅰ比值上升,说明在COPD大鼠的肺泡巨噬细胞中PI3K/Akt/mTOR信号通路被抑制,自噬水平升高,进而引起肺泡巨噬细胞自噬增强;给予GBE、Taselisib、比卡鲁胺、雷帕霉素干预后,与COPD模型组相比,大鼠肺泡巨噬细胞中的 PI3Kp110α、Akt、p-Akt、mTOR、p-mTOR蛋白表达水平进一步下降,LC3-Ⅱ/LC3-Ⅰ比值升高,巨噬细胞自噬作用增强,加速清除多余、受损、衰老的蛋白质与细胞器,保障巨噬细胞发挥正常的功能,抑制了COPD大鼠气道与肺实质内巨噬细胞的异常蓄积,进而减轻了巨噬细胞介导的炎性反应、肺泡破损与气道重塑。
电镜是观测细胞自噬的“金标准”,由本次研究中透射电镜结果可以看出正常对照组自噬溶酶体数量较少,自噬水平较低,COPD模型组溶酶体数量增多,自噬被激活,但以初级溶酶体增多为主,而自噬溶酶体较少,表明自噬体和初级溶酶体存在融合障碍,致使受损的细胞器、糖原等物质溶解受阻,异常堆积,进而影响正常的细胞代谢与细胞器的更新,致使肺泡巨噬细胞自噬功能受损。GBE组与各抑制剂组的自噬溶酶体较COPD模型组明显增多,能加速受损的细胞器、糖原的消化,促进细胞代谢与细胞器的更新,从而维持肺泡巨噬细胞发挥正常的自噬功能。研究发现,吸烟的COPD患者肺泡巨噬细胞中自噬体的数量明显增加,但由于存在自噬体运输至溶酶体的功能障碍,致使自噬活性减弱、肺泡巨噬细胞清除功能受损,导致COPD肺气肿的发生[7]。KONO等[40]研究发现,香烟烟雾可损伤巨噬细胞的自噬功能,造成巨噬细胞自噬体成熟缺陷和自噬体内蛋白质、细胞器等物质的异常积聚,本次研究结果与其一致。
巨噬细胞作为机体重要的免疫效应细胞,具有十分强大的吞噬和杀伤病原体的功能,在机体的抗感染免疫中发挥至关重要的作用[41]。研究表明,COPD患者的巨噬细胞吞噬功能低下,而香烟烟雾对巨噬细胞吞噬功能的损害更明显,可造成其吞噬能力显著下降[42],而维持巨噬细胞正常的自噬功能可以直接参与调控巨噬细胞的吞噬功能,从而使巨噬细胞能有效清除病原体[43]。在本研究中,使用GBE与比卡鲁胺、雷帕霉素、Taselisib干预后,PI3K/AKT/mTOR信号通路被抑制,自噬水平增强,促进了自噬体与溶酶体的结合,自噬溶酶体的数量明显增加,加速受损的细胞器、蛋白质等物质的消化,促进细胞代谢与细胞器的更新,使巨噬细胞的自噬活性增强,维持了巨噬细胞的正常的吞噬功能,使巨噬细胞能有效发挥其吞噬功能,清除COPD大鼠气道与血液中的病原菌,减轻气道与全身炎性反应。
综上所述,GBE能够通过调控PI3K/Akt/mTOR信号通路,促进肺泡巨噬细胞发挥正常自噬功能,起到治疗COPD的作用,为GBE在COPD治疗中的应用提供一定实验依据。本研究尚有不足之处,未设置相关蛋白分子的激动剂,部分指标影响机制相对复杂,仍需今后进一步深入研究。
作者贡献:郭栋伟负责实验设计、文章的构思与设计,并对文章负责;张鹏飞组织课题实施、控制实验质量,负责论文起草、论文修订与审校;任明君、廖丽君进行动物实验与细胞实验以及实验相关指标检测;黄茹妍、罗湘蓉负责论文检索与查重。
本文无利益冲突。
——雷帕霉素

