基于飞行时间质谱法的单核细胞增生李斯特氏菌定性质控样品研制
张雅伦,杨 帆,张 涛,张 瑞,李 献,周 巍,张 岩
(河北省食品检验研究院,河北省食品安全重点实验室,国家市场监督管理重点实验室(特殊食品监管技术),特殊食品安全与健康河北省工程研究中心,河北 石家庄 050071)
单核细胞增生李斯特氏菌(以下简称“单增李斯特菌”)是一种人畜共患病的病原菌,动物性食品是传播食源性人畜共患病病原菌的主要媒介,由该菌引起的疾病称为李斯特菌病[1-2]。有研究报道,生鲜畜禽肉中单增李斯特菌的检出率为10.9%~27.2%,显著高于熟肉制品(4.61%),被认为是该菌的主要来源[3]。由于单增李斯特菌可存在于食品加工处理各个环节的环境中,并在低温下仍能生长存活,使得该菌的控制具有一定的难度[4-5]。近年来有在乳制品、婴幼儿食品、冷饮、米面制品中检出单增李斯特菌的报道[6-9]。在过去的近30 年里,国际上多起暴发和散发的李斯特菌病病例被证实与热狗、意大利香肠、巴氏杀菌牛乳、沙拉、生食蔬菜、冰激凌、干酪及未煮熟的鱼等食品有关,该病临床表现多样化,如胃肠炎、脑膜炎、败血症、流产等,最易感染孕妇、婴儿及免疫力低下者[10-12]。食源性李斯特菌病致死率高达30%以上[13],单增李斯特菌被世界卫生组织列为20世纪90年代四大食品致病菌之一[14]。
目前食品中单增李斯特菌的检测主要以分离培养和生化鉴定为主,而传统的细菌培养和鉴定是一项既耗时又复杂的工作,由于某些生化试剂、血清等质量不稳定、特异性不好等因素,常给鉴定结果带来差异,这势必极大影响食品的安全管理和有效监测。快速、准确鉴定食源性微生物是食品微生物检验的一项基本要求。基质辅助激光解吸电离飞行时间质谱(以下简称飞行时间质谱)具有前处理简单和高通量的特点[15-16],可以实现对未知微生物的快速鉴定、分型、溯源等[17-18]。虽然单增李斯特菌可以使用飞行时间质谱快速鉴定[19-21],但质控样品仍缺失,严重限制了我国食品微生物质谱检测发展。
本研究通过真空冷冻干燥技术制备单增李斯特菌定性质控样品,并系统分析质控样品的均匀性和稳定性。通过优化冻干基质条件,得到制备质控样品的最佳条件。通过培养计数和飞行时间质谱技术,验证定性质控样品的均匀性和稳定性。旨在提高鉴定的准确性,减少我国各研究机构对单增李斯特氏菌国外质控样品的依赖,提升食品安全突发事件的处置能力和风险监测预警能力。
1 材料与方法
1.1 材料与试剂
单核细胞增生李斯特氏菌CMCC 54009 中国食品检验研究院。
乙醇(质谱纯)、甲酸(质谱纯)、乙腈(质谱纯)、蔗糖(相对分子质量40 000)、葡聚糖 天津科密欧化学试剂有限公司;1640细胞培养基 美国Sigma公司;质谱靶板基质液 德国Bruker公司。
1.2 仪器与设备
MS3振荡混匀器 美国IKA公司;BHC-300IIA/B3生物安全检验柜 苏州净化仪器设备有限公司;MIR-254恒温培养箱 美国Thermo公司;HVE-50灭菌器日本Hirayama公司;3K15冷冻离心机 德国Sigma公司;autoflex maX LIN飞行时间质谱仪 德国Bruker公司。
1.3 方法
1.3.1 冻干基质的筛选
质控样品的稳定性受保护剂种类、菌株的生理状态及其复水条件等因素影响,其中保护剂种类是影响质控样品稳定性最重要的因素。将单增李斯特菌按照不同冻干基质条件进行真空冷冻干燥后加入1 mL无菌水,使样品复水溶解,测定存活率,冻干存活率按下式计算。

选用基质种类分别为1640细胞培养基、蔗糖、葡聚糖、牛血清白蛋白(bovine serum albumin,BSA)、脱脂乳粉,按照不同比例配制不同基质进行研究。
1.3.1.1 脱脂乳粉和蔗糖
分别配制质量浓度为5、10、15 g/100 mL的脱脂乳粉,对应配制不同质量分数(5%、10%、15%、20%)的蔗糖为冻干基质,按照1.3.2节进行样品制备,并使用无菌生理盐水使其复溶,测定存活率,筛选冻干基质。
1.3.1.2 1640细胞培养基
选取1640细胞培养基作为基础原料,其他冻干基质为蔗糖、葡聚糖、BSA。蔗糖质量分数使用1.3.1.1节得到的结果,对葡聚糖(2%、4%、6%、8%、10%)和BSA(1%、3%、5%、10%)的比例进行研究,按照1.3.2节进行样品制备,并使用无菌生理盐水使其复溶,测定存活率,筛选冻干基质。
1.3.2 单增李斯特菌质控样品制备
将单增李斯特菌划线接种于PCA平板上,36 ℃培养24 h。用无菌棉签从平板上刮取菌苔混悬于冻干保护剂中,使用紫外分光光度计,测定波长为650 nm,调节菌浓度使OD650nm为2.3,使用微量移液器将100 μL菌悬液均匀滴入加有液氮的西林瓶中,放入真空冷冻干燥机中,预冻程序为-20 ℃、200 min,-40 ℃、200 min;冷冻干燥程序为-35 ℃、360 min,真空度130 mTorr;-30 ℃、360 min,真空度130 mTorr;-25 ℃、480 min,真空度130 mTorr;-20 ℃、480 min,真空度130 mTorr;-10 ℃、480 min,真空度130 mTorr。程序结束时保存为-20 ℃、真空度100 mTorr状态,制备质控样品。
1.3.3 单增李斯特菌质控样品均匀性验证
采用简单随机抽样方式,每个样品随机编号,抽取20 瓶样品,对质控样品进行定量检验,辅助验证均匀性。随机样品中分别加入1 mL无菌水,使样品复溶,使用加样系统在平板上均匀涂布,每个质控样品做2 个平行,放置于(36±1) ℃培养箱中培养24 h,测定单增李斯特菌数量。
1.3.4 单增李斯特菌质控样品稳定性验证
1.3.4.1 运输稳定性验证
将制备好的单增李斯特菌质控样品放置于37 ℃和25 ℃环境中,进行14 d的运输稳定性研究,分别在0、1、2、3、5、7、14 d进行验证,同时做3 次平行实验。通过单增李斯特菌数量变化验证样品在较高温度下的运输稳定性,确定能否作为质控样品进行实际发样运输。
1.3.4.2 贮藏稳定性验证
将质控样品放置于4 ℃和-20 ℃条件下,进行28 d的贮藏稳定性研究。稳定性检验的时间间隔可以按先密后疏的原则安排。分别在贮藏0、1、3、5、7、14、28 d进行验证,同时做3 次平行实验。通过复苏率验证样品在低温下的贮藏稳定性。
1.3.4.3 飞行时间质谱测定稳定性验证
分别将样品在37 ℃和-20 ℃环境中保存28 d后进行飞行时间质谱测定,导入BN软件进行分析整合,研究质控样品飞行时间质谱测定稳定性。
1.3.5 单增李斯特菌质控样品飞行时间质谱测定
将制备的质控样品进行飞行时间质谱测定时可以直接溶解使用,无需再次培养。
1.3.5.1 样品前处理
将密封的质控样品开启,将冻干菌球取出放入离心管内,加入100 μL灭菌水使其复溶,以12 500 r/min离心5 min,去除上清液,保留沉淀,重复进行3 次。
1.3.5.2 样品靶板制作
向沉淀中添加50 μL体积分数70%甲酸,充分裂解2 min,添加50 μL乙腈,充分溶解后,以12 500 r/min离心5 min,取1 μL上清液到靶板相应位置,静置,待溶液挥发完成,取1 μL质谱靶板基质液到同样位置,静置,待溶液挥发完成,进行飞行时间质谱测定。根据质谱仪得到单增李斯特菌的特征质谱图和蛋白指纹峰,进一步进行稳定性研究。
1.4 数据处理
使用SPSS软件,采用单因素方差分析方法对质控样品均匀性进行分析。
2 结果与分析
2.1 冻干基质的筛选结果
保护剂种类繁多,由于菌株本身特性不同导致保护剂种类和使用量会发生变化。
2.1.1 脱脂乳粉和蔗糖
由表1可知,5 g/100 mL脱脂乳粉、15%蔗糖保护剂的冻存效果最好,冻干存活率为93%。但在后续飞行时间质谱检测中,在m/z2 000~20 000出现了溶剂杂峰,影响了对目标菌的检测,因此不能用脱脂乳粉作保护剂。

表1 脱脂乳粉和蔗糖作为保护剂时单增李斯特菌的冻干存活率Table 1 Survival rate of freeze-dried Listeria monocytogenes with skim milk powder or sucrose as lyoprotectant%
2.1.2 1640 细胞培养基
因脱脂乳粉无法使用,选取1640细胞培养基作为基础原料。由表2可知,8%葡聚糖、5% BSA保护剂的冻存效果最好,冻干存活率为95%。但是加入BSA后,在后续飞行时间质谱检测中也在m/z2 000~20 000出现了溶剂杂峰,影响了对目标菌的检测,所以需要去除BSA。

表2 1640细胞培养基作为保护剂时单增李斯特菌的冻干存活率Table 2 Survival rate of freeze-dried Listeria monocytogenes using 1640 culture medium with glucan and BSA as lyoprotectant%
2.1.3 多次实验验证结果
得到筛选过后的冻干溶剂为1640细胞培养基,其中蔗糖质量分数为15%,葡聚糖质量分数为8%,进行重复验证。由表3可知,最高存活率为95%,且没有出现溶剂杂峰影响飞行时间质谱检验,所以可以作为冻干菌球的保护剂。
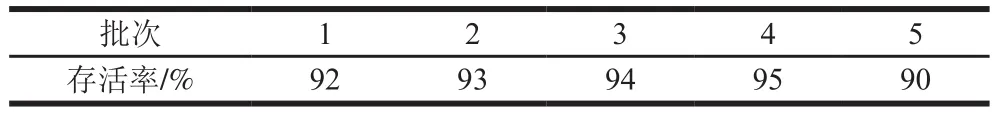
表3 筛选过后的1640细胞培养基作为保护剂时单增李斯特菌的冻干存活率Table 3 Survival rate of freeze-dried Listeria monocytogenes using 1640 culture medium with 15% sucrose and 8% glucan as lyoprotectant
2.2 单增李斯特菌质控样品均匀性验证结果
由表4可知,20 瓶单增李斯特菌质控样品计数结果较为统一,没有发生太大波动,说明样品均匀性良好。
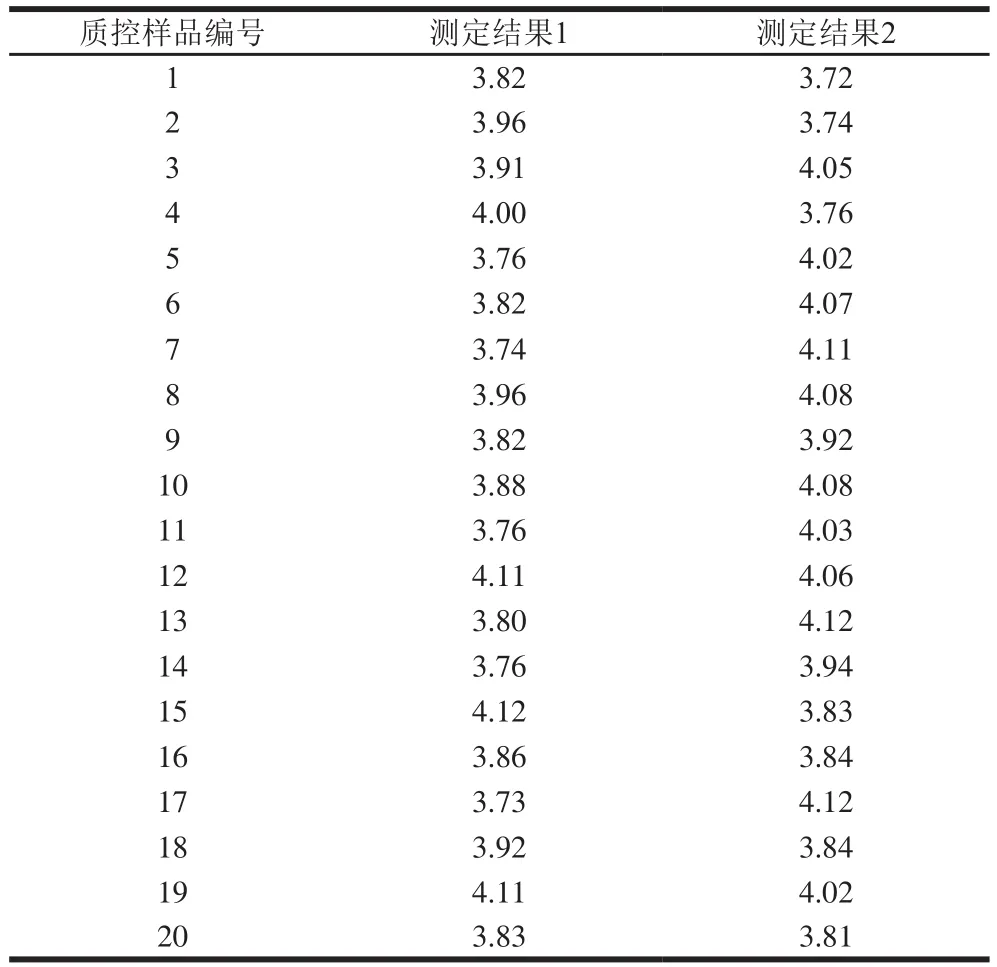
表4 20 瓶单增李斯特菌质控样品计数结果Table 4 Results of cell counting of 20 quality control samples of Listeria monocytogenes 107 CFU
使用SPSS软件,采用单因素方差分析方法,对样品的均匀性进行检验。通过分析F分布临界值表得知,FINV(0.05,19,20)临界值=2.137,由表5可知,根据SPSS软件计算的F=0.567<FINV(0.05,19,20)临界值,菌株计数稳定,侧面验证定性结果均一,表明该样品均匀性符合要求。
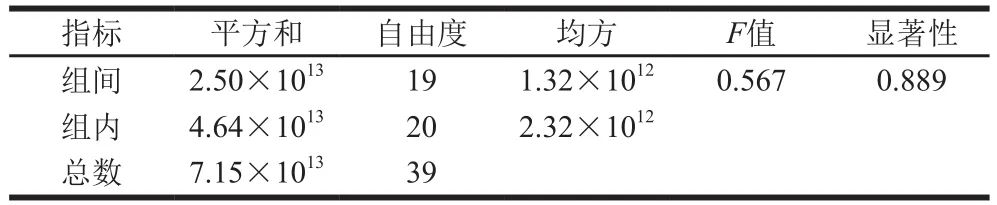
表5 样品的均匀性分析Table 5 Homogeneity analysis of samples
2.3 单增李斯特菌质控样品稳定性验证结果
2.3.1 运输稳定性验证结果
由表6可知,质控样品在37 ℃放置14 d后,单增李斯特菌计数仍维持在107CFU,在25 ℃环境下,质控样品计数较37 ℃更加稳定,证明质控样品运输稳定性良好。
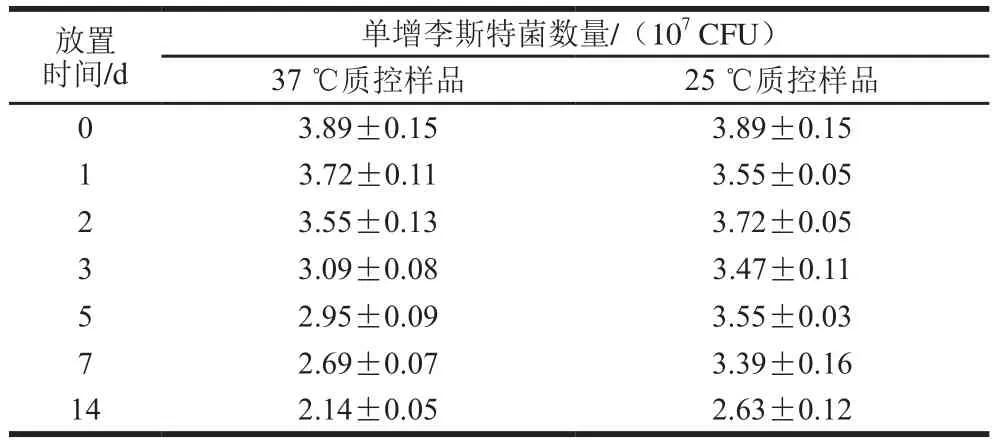
表6 质控样品模拟运输稳定性实验结果Table 6 Stability of quality control samples under simulated transportation conditions
2.3.2 贮藏稳定性验证结果
由表7可知,质控样品在-20 ℃放置28 d复苏率为101.5%,在4 ℃放置28 d复苏率为99.6%,说明单增李斯特菌质控样品贮藏稳定性良好。
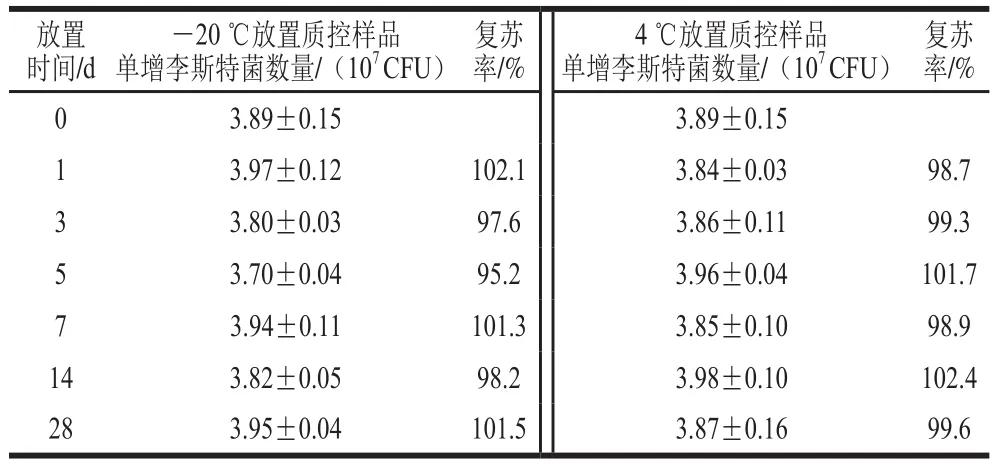
表7 质控样品贮藏稳定性实验结果Table 7 Storage stability of quality control samples
2.3.3 飞行时间质谱测定稳定性验证结果
由图1~2及表8可知,在不同温度条件下用飞行时间质谱检测单增李斯特菌质控样品,结果稳定,谱图一致,说明质控样品飞行时间质谱测定稳定性良好,可以作为阳性质控样品在飞行时间质谱检验中使用。

表8 -20 ℃和37 ℃条件下质控样品飞行时间质谱特征峰数据比较Table 8 Comparison of characteristic mass spectral peak data of quality control samples at -20 and 37 ℃
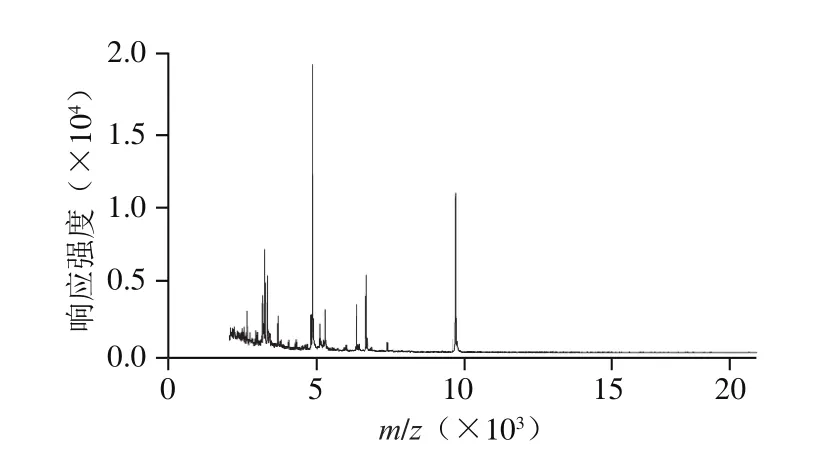
图1 质控样品在-20 ℃条件下的飞行时间质谱图Fig.1 Time-of-flight mass spectrum of quality control sample at -20 ℃

图2 质控样品在37 ℃条件下的飞行时间质谱图Fig.2 Time-of-flight mass spectrum of quality control sample at 37 ℃
3 结 论
目前食品检验研究多集中在致病菌方面,主流检测方式仍以生化鉴定为主,检验周期长、检测易受主观因素影响,导致污染控制问题无法有效控制。飞行时间质谱作为精准、高通量检测手段正在逐步应用于日常微生物检测[22-24]和临床检测应用[25-27],但因没有相应匹配的质控样品和数据库,严重制约了飞行时间质谱的发展[28-29]。
本研究通过优化冻干基质条件,成功研制出单核细胞增生李斯特氏菌飞行时间质谱法定性质控样品,并通过菌落计数方式辅助验证质控样品的均匀性和稳定性。结果表明:质控样品F=0.567,小于临界值,均匀性良好,保证了样品一致性;质控样品在37 ℃和25 ℃环境中能稳定保存,可以保证样品在运输过程中不会损坏;质控样品在4 ℃和-20 ℃环境中能稳定保存,说明样品能够实现长期贮藏;质控样品在37 ℃和-20 ℃环境中保存28 d后,飞行时间质谱检测结果一致,说明样品能够作为质控样品在飞行时间质谱检验中稳定使用,为推动飞行时间质谱技术的发展提供了技术保障。

