再代偿乙型肝炎肝硬化患者发生慢加急性肝衰竭的临床特点及预后分析
刘 磊, 梁 静, 徐佰国, 王 菲, 连 佳, 杨言开
1 天津医科大学三中心临床学院, 天津 300170; 2 天津市第三中心医院 消化(肝病)科, 天津市人工细胞重点实验室, 天津市肝胆疾病研究所, 卫生部人工细胞工程技术研究中心, 天津 300170
越来越多的证据表明,乙型肝炎肝硬化患者的肝纤维化是可逆的[1-2]。自从核苷(酸)类似物的出现,使得乙型肝炎患者的治疗得到了划时代的改变[3-6]。通过有效的抑制HBV复制减轻肝脏炎症,纤维化程度得到逆转,使得原先已经出现肝硬化失代偿期的患者肝功能得到一定程度的恢复,能够再达到失代偿之前的一种状态,就是所谓的再代偿。目前关于再代偿之后患者发生慢加急性肝衰竭(ACLF)的临床特点和预后情况的报道还较少。本研究对曾经有失代偿史的乙型肝炎肝硬化进行抗病毒治疗后再代偿的患者发生ACLF之后的临床特点以及预后报道如下。
1 资料与方法
1.1 研究对象 按照亚太肝病学会(APASL)关于ACLF的诊断标准[7],选取2013年9月—2021年9月于天津市第三中心医院住院治疗的HBV相关ACLF(HBV-ACLF)患者共452例进行筛选。其中乙型肝炎肝硬化有失代偿史,经过核苷(酸)类似物抗病毒治疗肝功能得到再代偿患者110例纳入再代偿组,再代偿的定义参照近期更新的Baveno Ⅶ共识当中提到的概念[8]。“再代偿” 需满足以下所有标准:肝硬化原发病因的清除/抑制/治疗(HCV消除,HBV持续抑制,酒精性肝硬化的持续戒酒);消除腹水(不使用利尿剂),肝性脑病(HE)(不使用乳果糖/利福昔明)和无复发性静脉曲张出血(至少12个月);肝合成功能持续正常(包括白蛋白、INR、胆红素)。选取同期既往无失代偿病史的代偿期乙型肝炎肝硬化患者70例作为对照组,筛选步骤见图1。排除标准:年龄<18岁,合并妊娠,单纯的慢性HBV感染无肝硬化,非HBV所致肝硬化,合并有严重的慢性肝外器官疾病,肝细胞癌或其他系统恶性疾病,同时合并HIV或HCV感染,90 d随访期内接受肝移植治疗者。
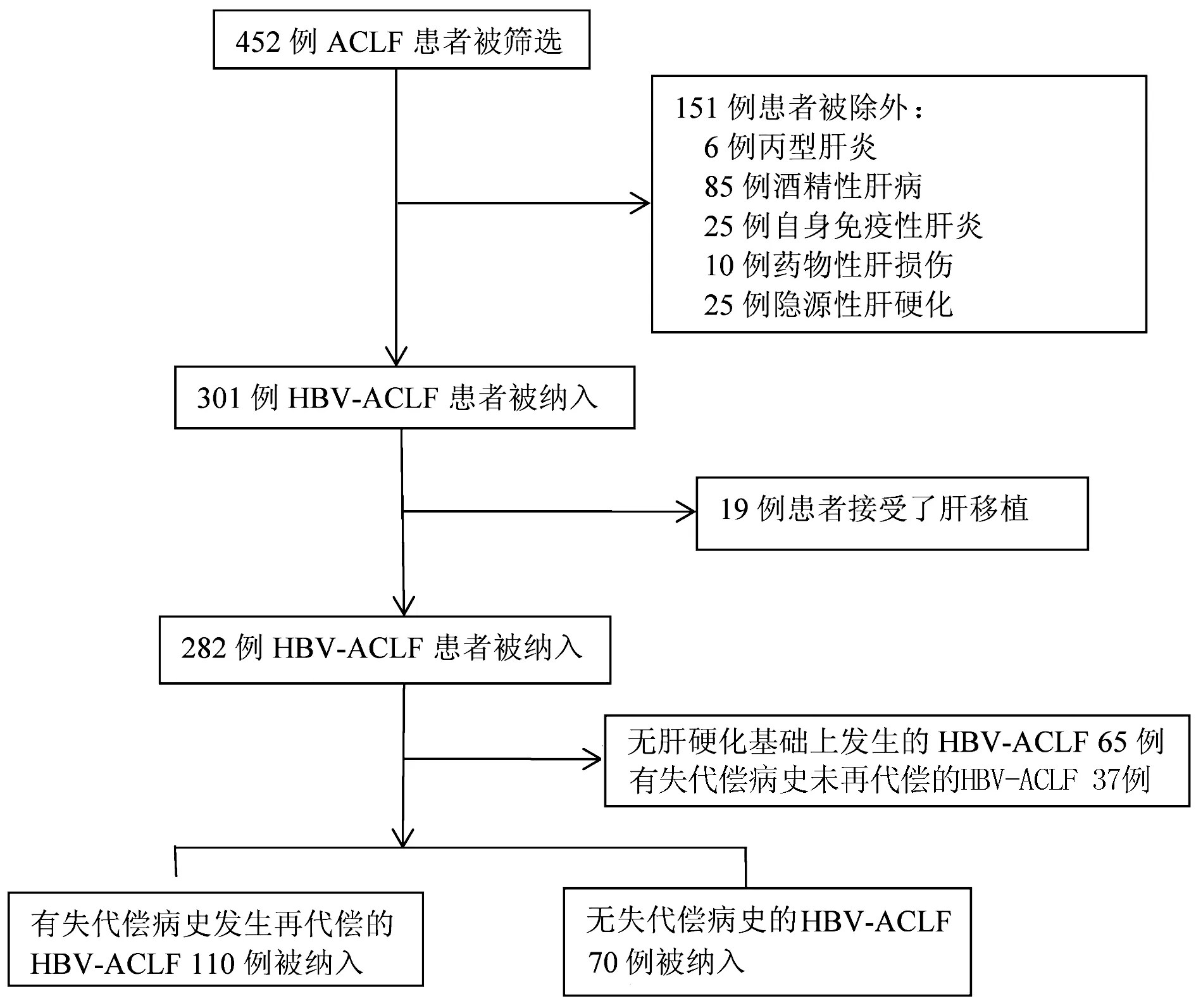
图1 HBV-ACLF入组流程图
1.2 研究方法
1.2.1 治疗方案 所有患者入院后均接受内科标准治疗,包括绝对卧床休息,能量和维生素的供给,静脉给予输注人血白蛋白及血浆等血制品,维持水电解质和酸碱平衡,预防和治疗并发症等。抗病毒治疗方案根据乙型肝炎防治指南(2010年版或2015年版)[9-10]制定抗病毒治疗策略。给予口服抗病毒药物治疗包括:拉米夫定、阿德福韦酯、替比夫定、恩替卡韦和替诺福韦酯等(单用或联合治疗);对于合并感染(细菌或真菌)的患者给予抗生素抗感染治疗;根据肝衰竭诊治指南(2012版)[11]必要时给予非生物型人工肝支持治疗。
1.2.2 观察指标 随访观察1年,记录各种临床指标、生化指标、凝血指标、感染指标及预后评分的最差值,记录90 d和1年的生存和死亡情况,计算病死率。
1.3 统计学方法 应用SPSS 23.0统计软件进行数据分析。计量资料以M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验;分类变量两组间比较应用χ2检验或Fisher精确检验。生存分析使用Kaplan-Meier方法,两组间比较采用Log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 入院前一般指标及诱因 乙型肝炎肝硬化再代偿组和对照组性别及年龄构成并无统计学差异(P值均>0.05)。诱因方面,两组诱因最多的均为HBV再激活,差异无统计学意义(P>0.05)。再代偿组诱因不明的患者所占比例较对照组高,差异有统计学意义(P<0.05)(表1)。
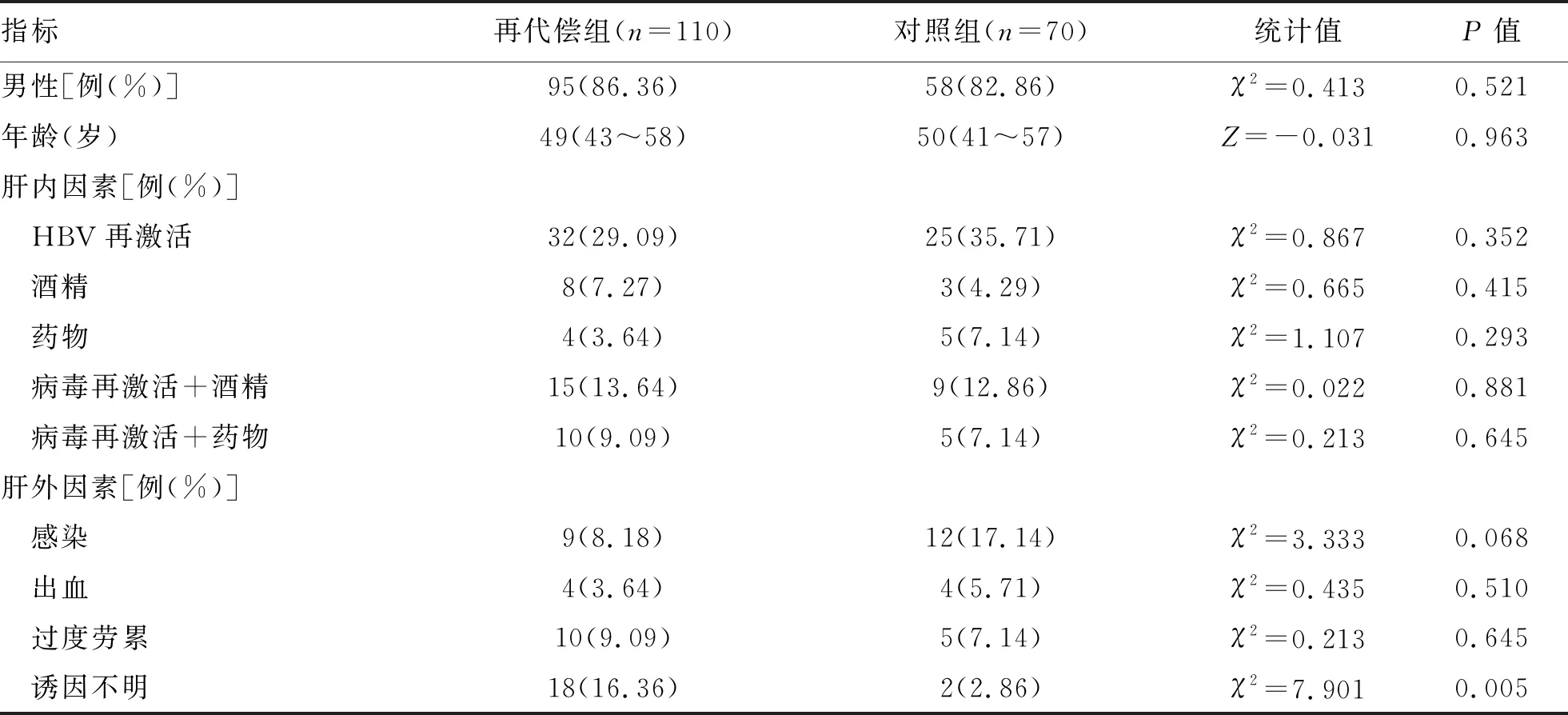
表1 乙型肝炎肝硬化再代偿组和对照组人口学资料及入院前诱因比较
2.2 入院后临床、生化、凝血、感染指标及预后评分 乙型肝炎肝硬化再代偿组和对照组入院后指标相比较,HE、食管静脉曲张破裂出血(EVB)、腹水发生率、ALT、AST、ALP、总蛋白(TP)、Alb、球蛋白(GLO)、TBil、胆碱酯酶(ChE)、凝血酶原活动度(PTA)、国际标准化比值(INR)、尿素氮(BUN)、血钾(K)、TG、Hb、WBC、中性粒细胞百分比(N%)及淋巴细胞百分比(L%)、PLT、血氨(NH3)、甲胎蛋白(AFP)、C反应蛋白(CRP)、乳酸(Lac)、HBV DNA阳性率、人工肝治疗率、CTP评分和MELD评分等差异均无统计学意义(P值均>0.05)。而肝肾综合征(HRS)、感染发生率、GGT、血肌酐(Cr)、血钠(Na)、空腹血糖(FBS)、TC、降钙素原(PCT)的差异有统计学意义(P值均<0.05)。将感染的具体部位分层分析后,再代偿组的呼吸道感染、原发性腹膜炎、肠道及皮肤软组织感染、泌尿道感染与对照组比较差异均无统计学意义(P值均>0.05)。两组90 d及1年病死率比较,差异均无统计学意义(P值均>0.05)(表2)。
2.3 生存分析 通过Kaplan-Meier生存分析比较,无论90 d还是1年,虽然再代偿组的生存曲线下降更快,但是经Log-rank检验,两组的生存时间差异无统计学意义(χ2值分别为2.680、2.074,P值分别为0.100、0.150)(图2、3)。
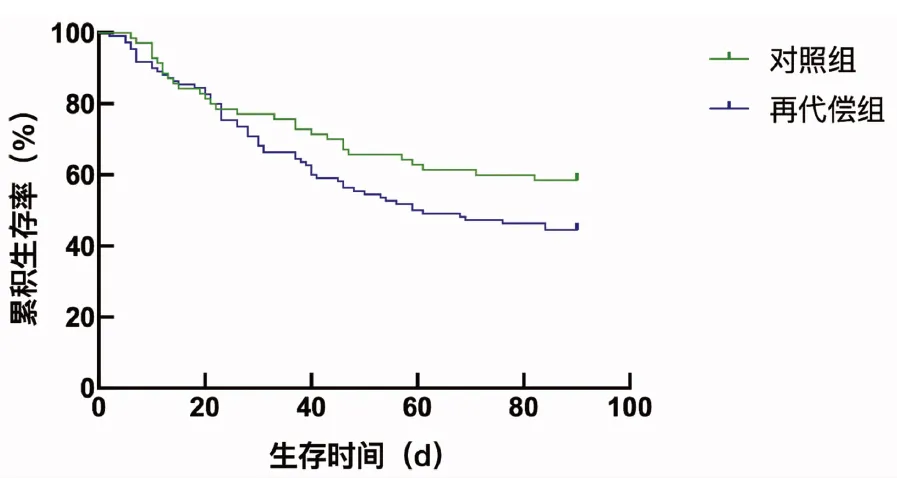
图2 再代偿组与对照组90 d生存曲线的比较
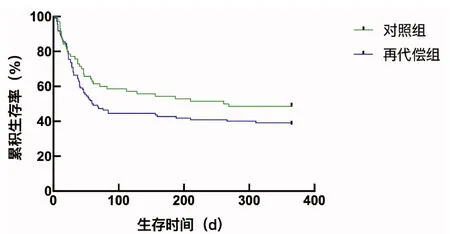
图3 再代偿组与对照组1年生存曲线的比较
3 讨论
核苷(酸)类似物的出现,使得肝纤维化能够通过抗病毒治疗得到逆转。2019年我国发布的《肝硬化诊治指南》[12]中提到了经抗病毒治疗后乙型肝炎肝硬化患者发生再代偿的概念,通过抗病毒治疗完全可以使得失代偿期肝硬化实现肝功能的再代偿。
无论再代偿组还是对照组,HBV再激活仍为发生ACLF的最主要诱发因素,这些病毒再激活的诱因主要是由于自行停用核苷(酸)类似物或者发生了核苷(酸)类似物耐药突变或者应用免疫抑制剂所致,同时还有一部分复合因素如病毒再激活+酒精和病毒再激活+药物,因此导致HBV DNA阳性率偏高(两组的HBV DNA阳性率较高,均超过了50%)。而非病毒因素包括酒精、药物、出血、感染及过度劳累等,均为次要诱发因素。这也是东西方基于不同病因基础发生ACLF的诱因特点。因为我国乃至亚洲地区ACLF大多发生在HBV感染的基础上,而欧美则以酒精性肝病和丙型肝炎为基础,酗酒和感染往往是主要的诱发因素[13]。既往研究[14-16]中发现很多ACLF的发生并无明确诱因,再代偿组患者往往病史较长,病情相对更为复杂,诱因也比较复杂,本研究中发现再代偿组诱因不明的占比较大。Yin等[16]也发现这些诱因不明的ACLF患者中常伴随全身炎症反应指标明显升高的状态。全身炎症反应在ACLF的发生发展中起到了非常重要的作用[17],因此寻找ACLF的诱发因素针对病因治疗,同时抑制全身过度的炎症反应是ACLF治疗的关键。
再代偿组患者的PCT及感染的发生率均高于对照组,提示再代偿患者由于经历了失代偿肝硬化,其免疫缺陷可能较代偿性肝硬化更为严重[18],故更易于发生继发感染,尤其易于发生肠道菌群移位。更为符合肝硬化相关免疫功能障碍(cirrhosis-associated immune dysfunction,CAID)的理念[19]。CAID是指发生在肝硬化患者当中的免疫缺陷和全身炎症反应,在代偿期肝硬化阶段,损伤相关分子模式占主导。随着肝硬化的进展,肝脏结构的进一步损坏,肝功能逐渐下降。当进入失代偿阶段,肠道细菌移位发生率增加,病原相关分子模式占据主导。免疫系统和全身炎症反应被激活,在长期的病原相关分子模式压力下,失代偿期肝硬化由“促炎”的免疫表型逐渐发展成“免疫缺陷”表型。由此推测再代偿患者曾经经历了失代偿,这种“免疫缺陷”可能并没有完全恢复。Thabut等[20]研究表明单纯的细菌感染与HBV-ACLF时发生的肾衰竭密切相关。因此,由于再代偿组这种更为明显的CAID更容易导致继发感染,从而解释了再代偿组的HRS发生率、Na和Cr更高的原因。已有研究[21]表明,ACLF继发感染后会对预后产生不良影响。本研究中虽然再代偿组的整体感染率高于对照组,但是经过不同感染部位分层后行亚组分析,再代偿组与对照组各亚组的感染率并无统计学差异,这也就解释了再代偿组的整体感染率虽然高于对照组,但是对于预后并没有产生明显影响。
肝硬化晚期和肝衰竭时,GGT可以不高甚至降低,可能与肝细胞合成GGT的能力丧失有关[22]。肝脏是糖类和脂类的重要代谢场所,血糖和胆固醇代谢紊乱都是反映肝脏储备功能下降的表现,本研究发现再代偿组的GGT、FBS及TC均低于对照组,说明虽然再代偿组患者肝功能在一定程度上得到了代偿,但是某些指标仍然存在差异,需要更大样本量的前瞻性研究进行验证。
既往文献[14]研究发现曾有失代偿史的ACLF患者的病死率反而明显低于既往无过失代偿的ACLF患者。其原因可能与各脏器对于打击的适应能力有关,既往有失代偿,再次出现急性失代偿后各脏器往往更能适应打击,更能适应这种全身的炎症反应[23]。本研究结果与之不同,经过抗病毒治疗再代偿的乙型肝炎肝硬化患者发生ACLF的生存时间与对照组相比并没有表现出差异。分析可能原因:首先,既往研究人群的主体主要是酒精性肝硬化和丙型肝炎肝硬化患者,并未进行戒酒及抗病毒治疗的人群,而本研究所涉及的人群主要是行核苷(酸)类似物进行抗病毒治疗的乙型肝炎肝硬化患者,证实了经过积极的抗病毒治疗,可以使已经失代偿的肝硬化得到再代偿,在某种程度上重新回到之前的代偿期肝硬化阶段所达到的肝脏储备能力;其次,是ACLF的诊断标准并不一致,既往研究按照欧洲肝病学会的诊断标准,其诊断标准过于严格,一旦诊断已经发生了脏器衰竭,不利于早期干预。而本研究采用APASL的诊断标准。更有利于早期诊断,争取了更尽早的治疗时机。
本研究是单中心、回顾性研究,有些资料不够齐整,而且病例数较少。笔者团队下一步准备进行多中心前瞻性的队列研究,并且扩大样本量,同时结合一些肝活检病理、肝静脉压力梯度以及代谢组学研究结果,来进一步验证本研究结论。
伦理学声明:本研究方案于2019年1月经由天津市第三中心医院伦理委员会审批,批号:IRB2018-029-02。经患者本人或其监护人同意,签署知情同意书。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:刘磊负责实施研究过程,采集整理数据,统计分析数据,设计论文框架,起草论文,修订论文;梁静负责设计研究方案,整理参考文献,终审论文;徐佰国、王菲、连佳负责采集整理数据;杨言开负责提供指导性支持。

