Ferrostatin-1通过抑制铁死亡延缓D-gal诱导的心肌细胞衰老的研究
熊喜成,王一平,王刚,张甜,包雅丽,迪娜·艾尼瓦尔,孙湛,2△
《中国心血管健康与疾病报告2020概要》表明,2018年心血管疾病死亡占我国城乡居民总死亡原因的首位[1]。随着老龄化的加剧,心血管疾病发生率明显增加[2]。基于Logistic 回归模型对心血管疾病风险的预测显示,随着年龄的增长,心血管疾病死亡风险迅速上升[3]。因此,以心脏衰老作为心血管疾病突破口具有重要意义。D-半乳糖(D-gal)是常用的模拟衰老药物。研究表明,D-gal可诱导细胞发生凋亡[4]、自噬[5]、炎症反应[6]。最近有研究发现,缓解铁死亡可能会部分逆转D-gal 诱导的听觉皮层神经变性[7],但D-gal诱导的心肌细胞衰老是否发生铁死亡尚不明确。Ferrostatin-1是一种铁死亡抑制剂,可抑制心肌细胞氧化应激损伤而发挥抗氧化功能[8]。研究表明Ferrostatin-1 可抑制心肌缺血再灌注损伤、心肌肥大、心力衰竭、心肌病等多种心血管疾病[9]。此外,炎症反应可以促进心肌衰老[10],而铁死亡与炎症反应密切相关,受外部微生物影响的细胞释放损伤相关的分子模式,细胞死亡被放大,并促进一系列与炎症相关的反应,使用铁死亡抑制剂Ferrostatin-1可以抑制感染性和无菌性炎症反应[11]。因此,推测Ferrostatin-1能够改善心肌衰老。本研究旨在探讨抑制铁死亡是否可延缓D-gal 诱导的心肌细胞衰老。
1 材料与方法
1.1 材料 H9C2心肌细胞(2-1,Procell CL-0089)购自武汉普诺赛生命科技有限公司。D-gal、β-半乳糖苷酶(β-GAL)活性检测试剂盒、还原型谷胱甘肽(GSH)含量检测试剂盒购自北京索莱宝科技有限公司;噻唑蓝(MTT)、二甲基亚砜(DMSO)购自广州赛国生物科技有限公司;Ferrostatin-1购自美国Sigma公司;兔抗鼠溶质载体家族7成员11(SLC7A11)、谷胱甘肽过氧化物酶4(GPx4)单克隆抗体购自英国Abcam公司;兔抗鼠P53、GAPDH 多克隆抗体及山羊抗兔二抗购自武汉三鹰公司;培养基、血清、1%青霉素和链霉素双抗、PBS均购自以色列Biological Industries 公司;活性氧(ROS)测试盒、丙二醛(MDA)测定试剂盒均购自南京建成生物工程研究所。细胞培养箱、酶标仪购自美国Thermo Scientific 公司;倒置显微镜购自日本Nikon公司;荧光倒置显微镜购自德国Leica公司;化学发光成像系统FluorChem E购自美国ProteinSimple公司;超声破细胞粉碎机购自宁波新艺超声设备有限公司。
1.2 方法
1.2.1 MTT法检测细胞活力 将H9C2心肌细胞种植培养于96 孔板中,每孔铺板细胞为5 000 个。使用0、5、10、20、40、80、100 g/L的D-gal处理细胞24 h,诱导H9C2心肌细胞损伤,制备心脏衰老模型。弃去培养液,96孔板每孔加入90 μL不含血清的培养基和10 μL MTT 溶液(5 g/L,即0.5%MTT),培养箱孵育4 h后弃去培养基,每孔加入100 μL二甲基亚砜于37 ℃温箱孵育10 min 后用490 nm 酶标仪检测光密度(OD)值,确定后续实验采用的D-gal质量浓度。
1.2.2 细胞培养及分组 H9C2细胞复苏后,在装有完全培养基(10%胎牛血清、1%青霉素和链霉素双抗和89%高糖DMEM)的培养瓶中于37 ℃含5%CO2的培养箱中培养。取对数生长期的H9C2心肌细胞,Control组完全培养基处理24 h,Dgal组用20 g/L D-gal(D-gal溶于完全培养基中)处理24 h;Fer-1组在应用20 g/L D-gal的基础上再用10 μmol/L Ferrostatin-1处理24 h。分组后检测各组细胞活力,方法同1.2.1。
1.2.3 DCFH-DA 法检测细胞内ROS 水平 各组H9C2 细胞以5×104个/孔种植于六孔板,经过相应处理后弃培养基,加入含DCFH-DA探针的无血清培养基(DCFH-DA为5 μmol/L,稀释于无血清培养基)后37 ℃孵育细胞20 min,吸去培养基,PBS洗涤2次后加入1 mL PBS于荧光倒置显微镜下观察荧光强度。
1.2.4 微板法检测细胞内GSH含量 收集不少于1×106个细胞,首先用PBS 清洗细胞2 次(PBS 重悬细胞,600 r/min 离心10 min),加入试剂一重悬细胞,反复冻融2~3 次,8 000 r/min离心10 min,收集上清液,按试剂盒说明书操作后于412 nm波长处检测OD 值,根据标曲线计算出样本浓度。按细胞数量计算GSH含量(μg/106cell)=样本浓度÷细胞数量。
1.2.5 硫代巴比妥酸(TBA)法检测细胞内MDA 含量 超声破碎的细胞样本放置测定管中,与空白管、标准管在95 ℃水浴40 min后取出冷却,然后3 500~4 000 r/min离心10 min,取200 μL 上清液于96 孔板,532 nm 处测各管OD 值。MDA 含量=(测定OD 值-空白OD 值)÷(标准OD 值-空白OD 值)×标准品浓度÷待测样本蛋白浓度。
1.2.6 Western blot 检测细胞内SLC7A11、GPx4、P53 蛋白表达 加蛋白酶抑制剂和裂解液以1∶100 的比例裂解细胞,BCA 检测细胞蛋白水平。以1 g/L 的蛋白电泳及转膜,5%的BSA 常温封闭2 h,4 ℃一抗SLC7A11(1∶10 000)、GPx4(1∶10 000)、P53(1∶3 000)、GAPDH(1∶5 000)孵育条带过夜。第2 天TBST 洗膜3 次,每次10 min,二抗(1∶3 000)常温孵育1 h,TBST洗膜3次(10 min/次),ECL显色。通过Image J软件分析各个条带吸光度后进行相对定量。
1.2.7 微量法检测细胞内β-GAL 活性 收集细胞后弃上清液,按照每5×106个细胞加入1 mL提取液,超声波破碎细胞(冰浴,功率200 W,超声3 s,间隔10 s,重复30次),15 000 r/min,4 ℃,离心20 min,取上清液后酶标仪检测OD值。按细胞数量计算β-GAL 活力(U/104cell)=(y×V反总)÷(500×V样÷V样总)÷T=0.028×y(y:样本生成的产物量;V反总:反应体系总体积;V样:加入反应体系中样本体积;V样总:加入提取液体积;T:反应时间)。
1.3 统计学方法 采用SPSS 23.0软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。以P<0.05 为差异有统计学意义。
2 结果
2.1 D-gal处理对H9C2细胞活力的影响 0、5、10、20、40、80、100 g/L D-gal 处理细胞活力(%)分别为100.00、82.36±2.44、79.09±1.34、72.92±1.61、56.37±0.89、16.37±0.46、5.19±0.75,细胞活力随D-gal质量浓度升高而降低(n=3,F=2 215.514,P<0.05)。20 g/L D-gal 可使细胞活力降低至70%左右,D-gal 质量浓度≥40 g/L 时,细胞活力明显下降,后续实验采用20 g/L D-gal作用24 h处理细胞。
2.2 Ferrostatin-1 对D-gal 诱导的心肌细胞活力影响 Control 组、D-gal 组和Fer-1 组的细胞活力(%)分别为100.00、74.06±2.17、84.29±1.85,组间比较差异有统计学意义(n=4,F=251.415,P<0.05)。与Control 组比较,D-gal 组的细胞活力降低;与D-gal组相比,Fer-1组的细胞活力增加(P<0.05)。
2.3 D-gal和Ferrostatin-1对心肌细胞内ROS、MDA和GSH 的影响 与Control 组相比,D-gal 组ROS、MDA 含量升高,GSH 含量降低(P<0.05);与D-gal组相比,Fer-1 组ROS、MDA 含量降低,GSH 含量升高(P<0.05),见图1、表1。
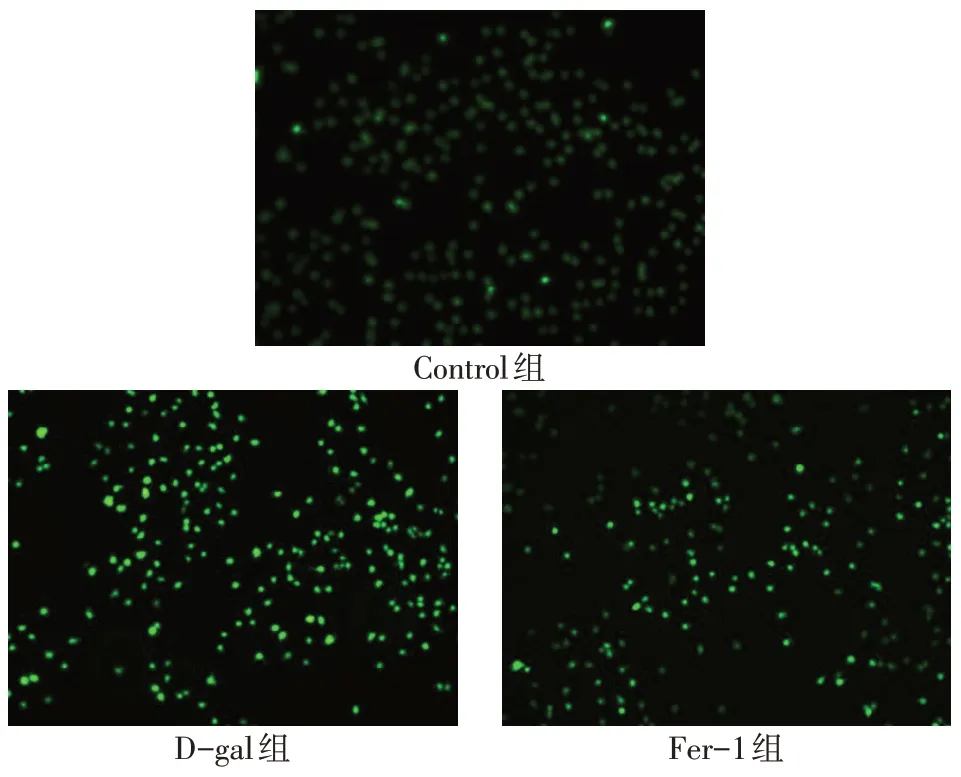
Fig.1 The effect of D-gal and Fer-1 on ROS of H9C2 cells(×100)图1 D-gal和Fer-1对H9C2细胞内ROS的影响(×100)
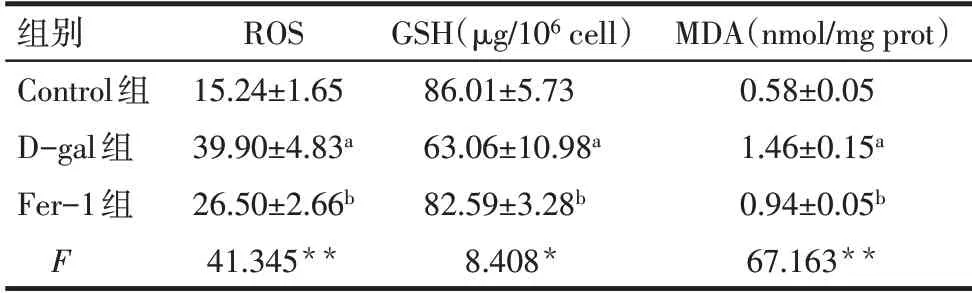
Tab.1 Comparison of ROS,GSH and MDA contents between the three groups表1 各组ROS、GSH、MDA含量比较(n=3,±s)
Tab.1 Comparison of ROS,GSH and MDA contents between the three groups表1 各组ROS、GSH、MDA含量比较(n=3,±s)
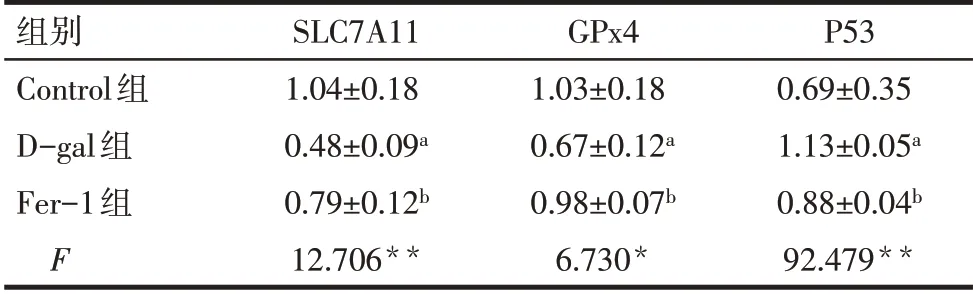
*P<0.05;**P<0.01;a 与Control 组比较;b 与D-gal 组比较,P<0.05;表2同。
组别Control组D-gal组Fer-1组F ROS 15.24±1.65 39.90±4.83a 26.50±2.66b 41.345**GSH(μg/106 cell)86.01±5.73 63.06±10.98a 82.59±3.28b 8.408*MDA(nmol/mg prot)0.58±0.05 1.46±0.15a 0.94±0.05b 67.163**
2.4 D-gal 和Ferrostatin-1 对心肌细胞内SLC7A11、P53、GPx4 蛋白水平的影响 相比Control 组,D-gal组SLC7A11、GPx4蛋白表达水平降低,P53蛋白表达水平升高;与D-gal 组相比,Fer-1 组的SLC7A11、GPx4 蛋白表达水平升高,P53 蛋白表达水平降低(P<0.05),见图2、表2。
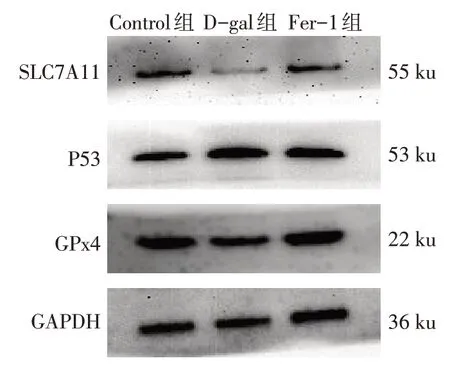
Fig.2 The effects of D-gal and Fer-1 on protein expression levels ofSLC7A11,GPx4 and P53 in H9C2 cells图2 D-gal和Fer-1对H9C2细胞内P53、SLC7A11、GPx4蛋白表达的影响
2.5 D-gal 和Ferrostatin-1 对心肌细胞中β-GAL 活性影响 Control组、D-gal组和Fer-1组的β-GAL活性(U/104cell)分别为0.78±0.01、0.98±0.01 和0.90±0.01,组间比较差异有统计学意义(n=3,F=460.667,P<0.05)。与Control 组相比,D-gal 组β-GAL 活性增强;与D-gal 组相比,Fer-1 组中β-GAL 活性减弱(P<0.05)。
Tab.2 Comparison of protein expression levels of P53,SLC7A11 and GPx4 between the three groups表2 各组的P53、SLC7A11、GPx4蛋白表达水平比较(n=3,±s)
Tab.2 Comparison of protein expression levels of P53,SLC7A11 and GPx4 between the three groups表2 各组的P53、SLC7A11、GPx4蛋白表达水平比较(n=3,±s)
组别Control组D-gal组Fer-1组F SLC7A11 1.04±0.18 0.48±0.09a 0.79±0.12b 12.706**GPx4 1.03±0.18 0.67±0.12a 0.98±0.07b 6.730*P53 0.69±0.35 1.13±0.05a 0.88±0.04b 92.479**
3 讨论
氧化应激损伤被认为是心肌衰老过程中的重要机制。细胞发生氧化应激损伤时,细胞内产生大量的ROS和脂质过氧化物破坏线粒体DNA,损伤的线粒体和线粒体功能障碍加速心肌细胞衰老[12]。另一方面,心肌细胞内过度的ROS可以阻断自噬,导致细胞内有缺陷的线粒体和脂褐素累积[13],自噬减少会加速心肌细胞衰老过程,增强的自噬可以减少心肌细胞衰老并延长寿命[14]。心肌细胞衰老是年龄相关性心血管疾病重要危险因素[15]。人体衰老过程中,心肌肥厚、进行性心肌纤维化、左心室壁增厚、心脏收缩和舒张异常、心脏重塑等因素导致心功能下降[16]。在心力衰竭、心肌肥厚和动脉粥样硬化等心血管疾病中,心肌细胞衰老呈现增加趋势[17-18]。通过延缓心肌细胞衰老来达到改善心血管疾病的目的具有重要意义。
D-gal是一种常用的诱导心肌细胞衰老的药物。D-gal 既能通过增加心肌细胞内氧化应激水平和破坏线粒体完整性加速心肌细胞衰老[19],也能通过氧化应激诱导的凋亡途径和促炎作用导致心肌细胞发生损伤。本研究通过给予不同剂量的D-gal 作用24 h,筛选出20 g/L D-gal 诱导心肌衰老模型,结果表明,D-gal 作用H9C2 细胞24 h 后,H9C2 细胞出现氧化应激损伤,表现为细胞活力降低,ROS 和MDA产生增加。β-GAL活性和P53水平可间接反映细胞衰老状态,P53 的激活会导致线粒体损伤[20]。本研究中,D-gal作用H9C2细胞24 h后,H9C2细胞内β-GAL活性增强和P53蛋白表达水平增加,提示D-gal诱导的心肌细胞衰老模型构建成功。
铁死亡是一种细胞内ROS 诱导的、细胞膜上磷脂成分发生过氧化反应从而破坏细胞膜最终导致细胞死亡的一种新型细胞死亡形式,这一概念首先由Dixon 等[21]提出。铁死亡在生物化学上主要表现为脂质过氧化物堆积及抗过氧化物质减少,如ROS 产生增加和GSH、GPx4 减少等[22]。GPx4 以GSH 为底物使脂质过氧化中间体脂质氢过氧化物转化为脂质醇,从而抑制过氧化物的堆积。研究表明,GSH减少引起的脂质过氧化可以导致铁死亡,GPx4和GSH在脂质过氧化和铁死亡中发挥重要作用[23-24]。SLC7A11是胱氨酸/谷氨酸转运体中的轻链,主要发挥转运胱氨酸的作用,进入胞内的胱氨酸通过一系列反应合成GSH,受SLC7A11 调控的GPx4 以GSH为底物清除过氧化物从而影响细胞铁死亡的进程,研究表明Ferrostatin-1 通过促进支气管上皮细胞中SLC7A11 的表达和增强GPx4 的活性从而抑制铁死亡的发生[25]。因此,SLC7A11和GPx4可以作为铁死亡蛋白标志物。本研究中D-gal 的应用使心肌细胞中GSH含量减少,ROS和MDA产生增多,SLC7A11、GPx4表达降低,表明D-gal可以诱导H9C2心肌细胞发生铁死亡。通过使用Ferrostatin-1 对H9C2 细胞处理进一步探索D-gal 诱导的铁死亡及心肌细胞衰老机制。研究结果显示,Ferrostatin-1 可以增强因D-gal而降低的细胞活力,增加细胞内GSH的含量和SLC7A11、GPx4蛋白水平,减少ROS和MDA的含量。已有研究显示,D-gal 可以诱导PC12 神经细胞发生铁死亡,而铁螯合剂DFO 可以抑制D-gal 诱导的铁死亡和延缓神经退行性改变[7],与本研究D-gal诱导H9C2心肌细胞发生铁死亡结果相似。
抑制铁死亡可作为抗衰老治疗靶点[26]。既往研究表明,GSH 耗竭和铁死亡诱导剂Erastin 可阻止视网膜色素上皮细胞生长并诱导细胞早衰[23],通过抑制脂质过氧化或限制铁潴留来阻断铁死亡,可以减轻与年龄相关的肠细胞死亡,延长秀丽隐杆线虫的寿命[27]。铁死亡已被发现参与与年龄相关的心血管疾病、神经退行性疾病[28],而SLC7A11 过表达可以逆转肺成纤维细胞衰老相关表型[29]。本研究发现,铁死亡抑制剂Ferrostatin-1 可以降低因D-gal 而增强的β-GAL活性和P53蛋白水平,表明Ferrostatin-1可以延缓D-gal诱导的H9C2细胞衰老。
综上,本研究表明铁死亡参与了D-gal 诱导的H9C2 细胞衰老,而Ferrostatin-1 可以抑制铁死亡从而延缓D-gal 诱导的H9C2细胞衰老,本研究为心肌衰老机制及治疗提供了另一视角。

