丹酚酸A联用氧化槐定碱抑制宫颈上皮内瘤变细胞的作用机制*
冷雪娇,阚宏飞,吴沁航,李存玉,郑云枫,彭国平
(南京中医药大学药学院,江苏 南京 210023)
宫颈癌是女性常见恶性肿瘤,是威胁女性健康的主要疾病之一[1]。造成宫颈癌的因素多种多样,但最为主要的原因是人乳头瘤病毒(HPV)感染,从HPV感染发展为宫颈癌需要几年至数十年时间,在此过程中会发生宫颈上皮内瘤变(CIN),相当于 “癌前”阶段[2-3],此阶段是预防宫颈癌发生的重要窗口期。目前,对CIN1患者的治疗方法是定期检查和随访,对CIN2、CIN3患者的治疗方法是采用冷刀锥切术或环形电切术。然而,手术治疗会对人体造成永久性损伤[4-5],导致长期生殖系统疾病[6]。药物治疗CIN可避免手术治疗引起的不良反应,防止宫颈癌的发生。因此,研究治疗CIN的药物具有十分重要的意义。
丹参具有多种药理作用,包括抗氧化、抗炎、抗菌、抗肿瘤和脑血管保护作用[7-8]。丹酚酸是丹参中最重要的生物活性成分之一。丹酚酸A(SAA)是丹参的亲水性成分之一,具有多种药理活性,包括抗炎[9]、抗氧化[10]、心脏保护[11]、抗病毒和抗肿瘤(包括抑制宫颈癌细胞)作用[12-14]。氧化槐定碱(OSR)是从苦豆子中提取的生物碱,已被证明对缺血性脑损伤具有保护作用[15]。此外,OSR还具有多种药理活性,包括抗炎[16]、抗氧化应激[17]、抗病毒和抗肿瘤作用[18-19]。
有研究发现,SAA、OSR联合用药可协同抑制CIN细胞(H8细胞),其最佳联合用药比为1∶2,联合用药指数(CI)值为0.59,SAA、OSR对H8细胞的半数抑制浓度分别为(1.87±0.37)μmol/L和(3.73±0.74)μmol/L[20]。本研究选择2 μmol/L SAA、4 μmol/L OSR、2 μmol/L SAA 联合 4 μmol/L OSR处理H8细胞,通过Hochest33342染色实验、细胞周期测定、蛋白免疫印迹法实验研究了SAA、OSR联合用药对H8细胞的协同作用机制,以期为SAA、OSR联合治疗宫颈癌前病变提供理论依据。
1 材料与方法
1.1材料
1.1.1试剂 SAA(批号Z23D10X106625)、OSR(批号 Y06S10W97027)均购自上海源叶生物科技有限公司,H8细胞由中国科学院协和医科大学基础医学研究所提供,RPMI-1640培养基(批号 8121105)购自HyClone中国公司,胎牛血清(批号42G9285K)、0.25%乙二胺四乙酸胰酶(批号2186974)、磷酸盐缓冲液(PBS,批号8121037)、双抗(批号2199843)均购自美国Gibco公司,二甲基亚砜(批号RNBJ6688)购自美国Sigma公司,Hochest33342(批号40731ES10)购自上海翊圣生物科技有限公司,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法凝胶制备试剂盒(批号AR0138)、电泳缓冲液(批号AR1146)、转膜缓冲液(批号AR1151)、RIPA 裂解液(批号 AR0105)、蛋白酶抑制剂(批号AR1182)、BCA蛋白定量试剂盒(批号AR0146)、蛋白上样缓冲液(批号AR1112)、彩色预染蛋白Marker (批号AR1113)、洗涤缓冲液TBST (批号AR0195-10)、电化学发光试剂(ECL,批号AR1196)均购自武汉博士德生物工程有限公司,细胞周期蛋白B1(CyclinB1)抗体(批号A00745-1)、细胞周期蛋白依赖性激酶-1(CDK1)抗体(批号BA0027-2)、B细胞淋巴相关X蛋白(Bax)抗体(批号A00183)、B细胞淋巴瘤-2(Bcl-2)抗体(批号A00040-2)、切割型半胱氨酸天冬氨酸蛋白水解酶-3(Cleaved Caspase-3)抗体(批号BM3937)、β-肌动蛋白(β-actin)抗体(批号BM0627)均购自武汉博士德生物工程有限公司。
1.1.2仪器 HERAcell 150i型细胞培养孵箱购自美国Thermo公司,TS2-S-SM型倒置生物显微镜购自尼康(Nikon)中国有限公司,LDZ5型台式离心机购自北京雷勃尔离心机有限公司,SW-CJ-2FD型双人单面净化工作台购自苏州净化设备有限公司,DYY-6C型电泳仪购自北京六一生物科技有限公司,灌胶、垂直电泳、转印装置、Tanon5200型全自动化学发光成像分析系统均购自上海天能科技有限公司,DMI3000B型倒置荧光显微镜购自德国徕卡(Leica)公司。
1.2方法
1.2.1细胞培养 H8细胞培养于含有10%胎牛血清、1%双抗的RPMI-1640培养液中,置于37 ℃、5%二氧化碳细胞培养箱中培养。
1.2.2细胞形态观察 将H8细胞制成单细胞悬液,按2×105个/mL接种于6孔板,每孔1 mL,置于37 ℃、5% 二氧化碳培养箱中培养24 h,给药处理后直接放于倒置显微镜下观察H8细胞形态及生长情况并拍照。
1.2.3Hochest33342染色法观察细胞凋亡 H8细胞用胰蛋白酶消化后离心收集细胞,计数,以2×105个/孔接入6孔板中孵育 24 h后换液。SAA、OSR及其联合用药3个处理组和对照组分别继续培养24 h,经处理后弃培养基,用无菌的PBS清洗2~3次。每孔添加1 mL Hochest33342染液,避光孵育20~30 min,用无菌的PBS清洗2~3次,荧光显微镜观察细胞形态和染色情况,并拍照。Hochest33342能穿透细胞膜进入正常细胞和凋亡细胞,并能与细胞DNA结合。Hochest33342与细胞DNA结合染色后活细胞呈深蓝色,正常凋亡细胞呈亮蓝色[21-22]。
1.2.4细胞周期测定 以4×105个/孔接种于6孔板,对照组和3个处理组细胞黏附后用药物处理24 h。胰蛋白酶消化后收集细胞,1 000 r/min离心5 min后用4 ℃预冷PBS清洗,吸尽上清液后用75%预冷乙醇与细胞混合,斡旋振荡后置于4 ℃下冰箱固定过夜,1 000 r/min离心5 min后用预冷PBS清洗,离心,弃上清液,向细胞悬浮液中加入0.5 mL含有RNA酶A的碘化丙啶染色液。所有样品在37 ℃下避光孵育30 min,使用流式细胞仪进行分析。使用Kaluza Analysis软件对数据进行分析。细胞周期分为有丝分裂期(M期)和细胞间期,细胞间期又分为休眠期(G0期)、DNA合成前期(G1期)、DNA合成期(S期)和DNA合成后期(G2期),整个细胞周期可表示为G1期→S期→G2期→M期[23-24]。细胞DNA周期检测可测定细胞各时期状况,进而反映细胞增殖情况[25]。
1.2.5蛋白免疫印迹法检测蛋白表达 以4×105个/孔接种于6孔板,对照组和3个处理组细胞黏附后用药物处理24 h。胰蛋白酶消化后收集细胞提取蛋白质,用BCA试剂盒测定蛋白质浓度,蛋白样品用5%分离胶,12%浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法电泳,然后转移至硝酸纤维素膜(0.22 μm)上,5%脱脂牛奶封闭2 h,加入一抗,含吐温-20的PBS(PBST)洗膜后加入二抗,室温孵育1.5 h,再用PBST洗膜3次,每次15 min,ECL工作液于印迹膜上30~60 s,吸干发光液,置印迹膜于成像分析仪自动成像,应用ImageJ软件分析蛋白条带灰度值及蛋白条带,以β-actin为内参。
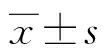
2 结 果
2.1各组H8细胞形态比较 与对照组比较,各处理组H8细胞形态均变小、变圆,且黏附力均下降。联合用药组H8细胞24 h后细胞形态更小、更圆,且黏附力更差,细胞几乎快脱落。SAA、OSR联合用药对H8细胞形态改变具有协同增效作用。见图1。
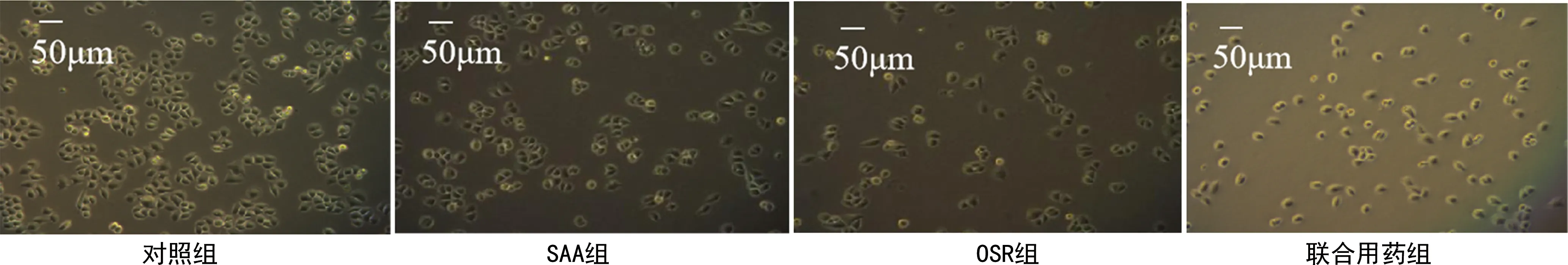
图1 各组H8细胞形态比较(显微镜,200×)
2.2各组H8细胞凋亡情况比较 与对照组比较,处理组H8细胞亮蓝色细胞数量均明显增加,联合用药组H8细胞亮蓝色细胞数量明显高于SAA组和OSR组,说明SAA、OSR联合用药可协同促进H8细胞凋亡。见图2。
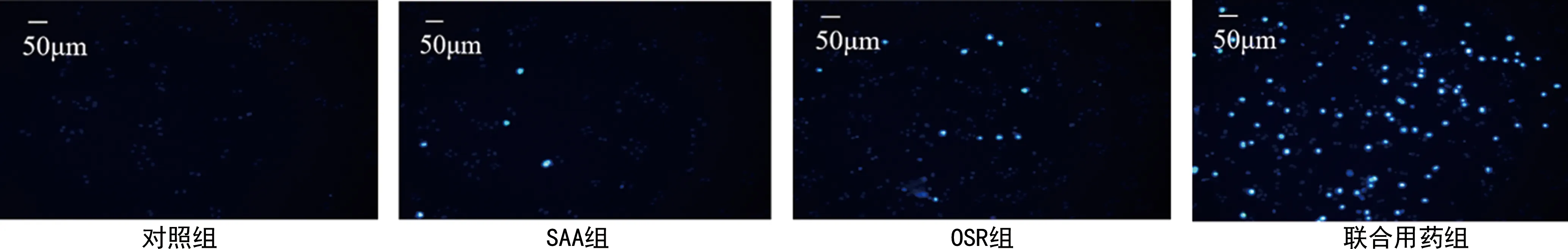
图2 各组H8细胞凋亡情况比较(Hochest33342染色法,100×)
2.3各组H8细胞周期比较 与对照组比较,OSR组、联合用药组H8细胞处理24 h后G2期细胞数量明显增加,G1期细胞数量明显减少,表示H8细胞被阻滞在G2/M期。SAA对H8细胞周期调控无明显影响,但可协同OSR调控H8细胞周期。联合用药组H8细胞G2期细胞增加和G1期细胞减少较SAA组和OSR组更为显著,表明SAA、OSR可协同调控H8细胞周期,将H8细胞阻滞在G2/M期。见图3。
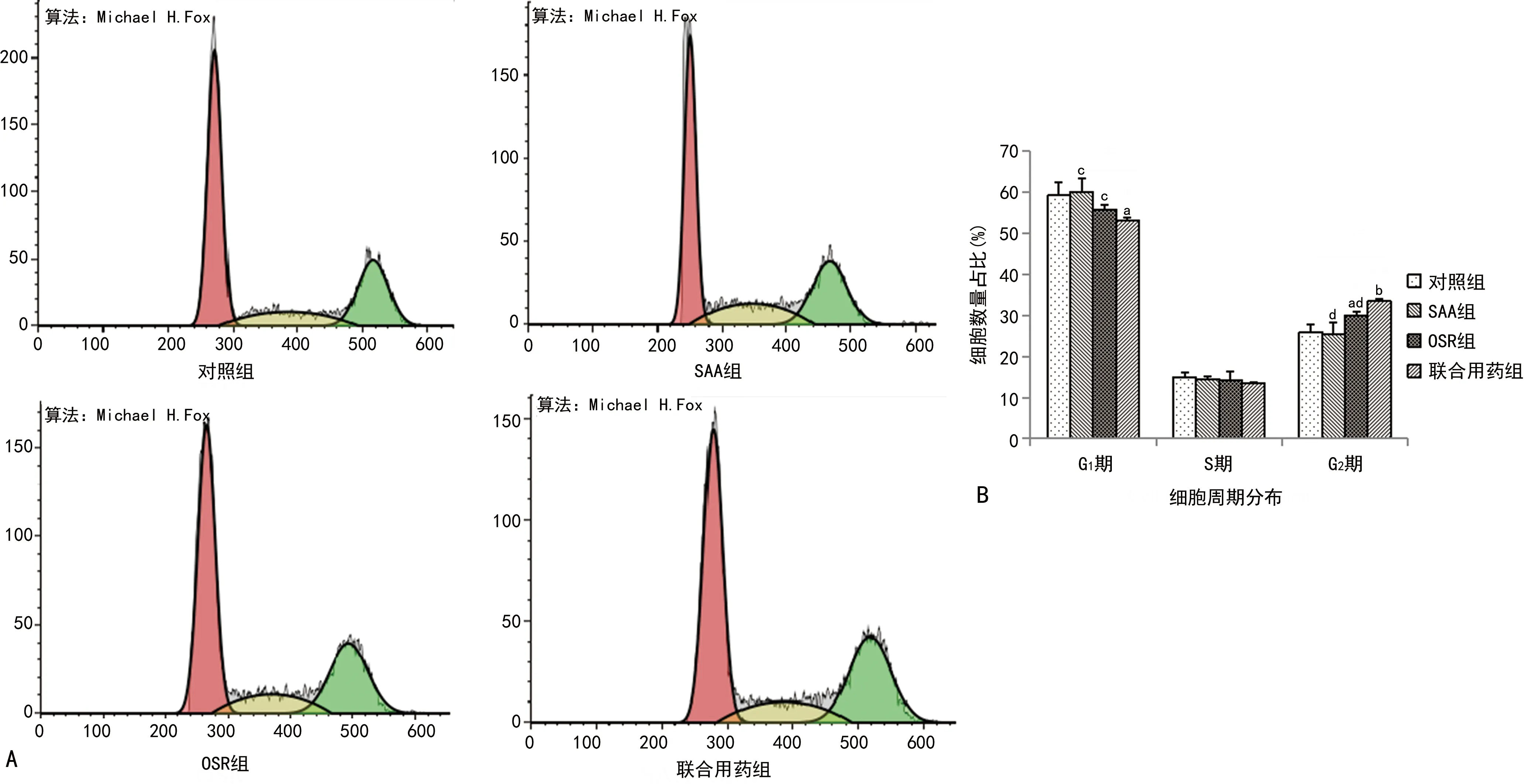
注:A.各组H8细胞周期图;B. 各组H8细胞各周期的细胞数量占比比较;与对照组比较,aP<0.05,bP<0.01;与联合用药组比较,cP<0.05,dP<0.01。
2.4各组H8细胞中Bcl-2、Bax、Cleaved Caspase-3蛋白表达比较 与对照组比较,SAA、OSR均可下调H8细胞中Bcl-2蛋白表达,上调Bax、Cleaved Caspase-3蛋白表达。SAA、OSR联合用药导致Bcl-2蛋白表达明显降低,与SAA组、OSR组比较,分别降低27%和49%。表明SAA、OSR联合用药可抑制Bcl-2蛋白表达,促进Bax、Cleaved Caspase-3蛋白表达,进而促进H8细胞凋亡。见图4。
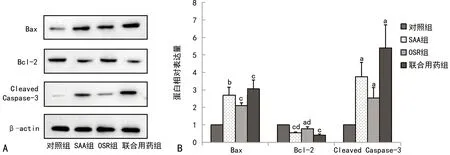
注:A.各组H8细胞中Bcl-2、Bax、Cleaved Caspase-3蛋白表达蛋白免疫印迹法实验结果;B. 各组H8细胞中Bcl-2、Bax、Cleaved Caspase-3蛋白表达比较;与对照组比较,aP<0.05,bP<0.01,cP<0.001;与联合用药组比较,dP<0.05。
3 讨 论
造成CIN和宫颈癌发生的因素多种多样,但最为主要的发病原因为HPV感染[2-3]。HPV被大量复制扩散后部分HPV-DNA整合入宿主染色体内,诱发基因突变,激活病毒癌基因,造成癌蛋白过度表达,干扰正常细胞周期,抑制细胞凋亡,破坏机体免疫,使病毒长期持续感染,发生宫颈上皮细胞不典型增生,产生CIN,继续发展则造成宫颈癌变[26]。及时治疗CIN能预防宫颈癌的发生,然而,目前治疗CIN的主要方法依然为手术治疗,有学者开展的治疗CIN药物的研究发现,SAA、OSR可抑制H8细胞,且二者对其具有协同增效的抑制作用[20]。为探索SAA、OSR联合用药的作用机制,本研究对SAA、OSR及其联合用药开展了研究,结果显示,SAA、OSR联合用药可通过调节H8细胞周期,将H8细胞阻滞在G2/M期,阻止细胞进入有丝分裂,抑制细胞增殖,且SAA、OSR联合用药对H8细胞周期的调节作用明显优于单一药物,表明SAA、OSR联合用药对H8细胞周期具有协同调节作用。
SAA、OSR可协同促进H8细胞凋亡,但其共同促进细胞凋亡的原因尚不清楚。线粒体是细胞凋亡发生的主要场所,线粒体能通过释放各种刺激信号调节 Bcl-2 蛋白(抗凋亡蛋白)促使 Bax 蛋白(促凋亡蛋白)表达诱导细胞凋亡[27]。Caspase-3是Caspase蛋白家族成员之一,可激活凋亡信号的传递,是促进细胞凋亡的关键蛋白[27-28]。活化后的Caspase-3(Cleaved Caspase-3)能破坏细胞正常功能,从而促进细胞凋亡[29]。本研究结果显示,SAA、OSR均能通过下调Bcl-2蛋白表达,上调Bax、Cleaved Caspase-3蛋白表达,进而促进H8细胞凋亡,与单独用药比较,SAA、OSR联合用药对H8细胞Bcl-2蛋白表达的抑制作用更为显著。因此,SAA、OSR联合用药可通过线粒体途径协同促进H8细胞凋亡。
综上所述,SAA、OSR联合用药可通过协同调节H8细胞周期,将细胞阻滞在G2/M期,抑制H8细胞增殖,通过下调Bcl-2蛋白表达,上调Bax、Cleaved Caspase-3蛋白表达促进H8细胞凋亡。

