两种非酿酒酵母与米曲霉互作特性研究
汪继伟,阎春悦,马春蕾,常 煦,李志军,陈 雄,李 欣,
(1.工业发酵省部共建协同创新中心,发酵工程教育部重点实验室,湖北工业大学生物工程与食品学院,湖北武汉 430068;2.安琪酵母股份有限公司,湖北宜昌 443000)
白酒酿造中的酵母菌主要有酿酒酵母和产酯酵母等[1],酿酒酵母主要提供酒化作用,通过无氧呼吸产生乙醇[2-3];产酯酵母利用乙醇、糖、醛、酸和盐类等其他代谢产物生成白酒中的重要呈香物质酯类,因此产酯酵母是影响白酒风味的重要菌种,利用产酯酵母可提高白酒挥发性香味物质含量[4-6]。产酯酵母类群较多,目前在在酿造行业中应用的有数十种,研究较多的产酯酵母有东方伊萨酵母(Issatchenkia orientalis)和扣囊复膜酵母(Saccharomycopsis fibuligera)等[7-10]。Ma等[11]对酿酒酵母、扣囊复膜酵母和乳酸菌的不同组合的研究发现,扣囊复膜酵母具有较好的产α-淀粉酶和葡萄糖淀粉酶能力,将淀粉转化为可溶性糖的能力优于其他酵母菌,并对挥发性化合物的产生具有积极影响。生物强化接种扣囊复膜酵母和酿酒酵母用于小曲酒发酵,乙醇和酯含量分别提高了42.5%和11.8%,醛酮和杂环化合物含量分别降低了73.7%和77.1%[12]。东方伊萨酵母是白云边发酵过程中的优势酵母之一,将该酵母菌用于强化曲制备可使正丙醇含量降低27.4%,出酒率提高22.9%[13]。白酒发酵中费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)作为优势菌株被发现[14-15],但目前对其的研究还较少,该酵母具有一定的产香、产酯能力,同时液态培养具有较好的产乙酸乙酯能力[16]。葡萄牙棒孢酵母(Clavispora lusitaniae)是一种产酯酵母,在酒类和调味品酿造工业中应用广泛[17],黎源等[18]研究发现其在优化条件下最高可达到3.56 g/L的产酯量。使用C. lusitaniae对大曲强化,己酸乙酯含量显著增加,在发酵后期,强化大曲的酯含量高于未强化的大曲[19]。C. lusitaniae可以产生许多对高品质白酒至关重要的风味化合物,在改善白酒风味和品质方面具有潜在的应用价值[20]。然而,这两种酵母与霉菌的互作关系还不清晰。
鉴于米曲霉在白酒酿造中存在广泛且具有强大的α-淀粉酶酶活力[21],故选择米曲霉作为混菌发酵过程的丝状真菌。本文对费比恩塞伯林德纳氏酵母HY-11和葡萄牙棒孢酵母HY-21两种酵母在固态发酵条件下进行酵母菌单菌发酵和与米曲霉M-08混菌发酵研究,分析了不同体系产风味、酶系和其他代谢物的特点,为提高酵母菌风味代谢,纯种产酯酵母菌应用于白酒酿造提供理论基础。
1 材料与方法
1.1 材料与仪器
费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)HY-11、葡萄牙棒孢酵母(Clavispora lusitaniae)HY-21、米曲霉(Aspergillus oryzae)M-08 均来自本实验室保藏菌株,三株菌株来源于安琪酵母股份有限公司所提供的酿造酒曲,经分离、纯化和鉴定而获得;酵母粉 安琪酵母股份有限公司;琼脂粉 武汉市华顺生物技术有限公司;马铃薯葡萄糖琼脂(PDA)培养基 青岛高科技工业园海博生物技术有限公司;α-乙酸萘酯、吡啶 上海阿拉丁生化科技股份有限公司;固兰B、α-萘酚、碘化钾 上海麦克林生化科技有限公司;蛋白胨、葡萄糖、氢氧化钠、Na2HPO4·12H2O、可溶性淀粉、NaH2PO4·2H2O、浓盐酸、I2、甲酸、叔戊醇、无水硫酸钠 国药集团化学试剂有限公司;甲醇 赛默飞世尔科技(中国)有限公司;氯仿北京兰杰柯科技有限公司;碳酸氢钠 广州飞扬生物工程有限公司。
S-10生物传感器分析仪 深圳市西尔曼科技有限公司;V-1300分光光度计 上海美析仪器有限公司;804R台式高速离心机 Eppendoff公司;HNY-211B恒温培养振荡器 天津市欧诺仪器仪表有限公司;SPX-150D型恒温生化培养箱、YXQ-75S11立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;PE-28 pH计 梅特勒-托利多仪器(上海)有限公司;NH-2数显恒温水浴锅 常州国华电器有限公司;SPME Fiber Assembly Divinylbenzene/Carboxyl/Polydimethylsiloxane(DVB/CAR/PDMS)萃取头Supelco公司;7890B气相色谱仪、DB-WAX毛细管色谱柱(60 m×0.32 mm,0.5 μm)、DB-5毛细管色谱柱(30 m×0.23 mm,0.25 μm) 安捷伦公司。
1.2 实验方法
1.2.1 原料处理方法 称取30 g高粱放置于已称重标记的250 mL三角瓶中,加入去离子水清洗一遍后沥干水分。再加入30 mL去离子水,包好三角瓶等待灭菌。灭菌条件为121 ℃,20 min。一次灭菌完成,冷却至室温后,加入10 mL去离子水,并搅拌均匀,进行第二次灭菌,灭菌完成冷却后次日接种。每瓶培养基重量约为68.0±0.3 g,其含水量可控制在58.5%±0.1%。
1.2.2 种子制备 酵母菌和霉菌种子培养方法均采用固体斜面培养法,酵母菌使用YEPD琼脂培养基,霉菌为PDA培养基。酵母菌生长时间为1 d,霉菌的培养时间为5 d。培养好的种子加入40 mL无菌水,振荡,制成种子菌悬液。
1.2.3 发酵方案 实验方案和接种量见表1。接种完成后,用已灭菌竹签搅拌均匀。用手展开纱布盖住瓶口,再盖上报纸后用线缠绕好瓶口。称重后,放置于30 ℃恒温培养箱静置培养,每隔4 d补水至原重并搅拌均匀。发酵周期15 d,每组实验重复三次。

表1 发酵方案和接种量Table 1 Fermentation scheme and inoculation amount
1.2.4 样品采集 于发酵0、2、4、6、9、12和15 d取样,每次取一整瓶。在无菌操作台中打开瓶子,称取三角瓶和瓶内固体总质量后加入100 mL无菌水,用已灭菌竹签搅拌均匀并重新包好三角瓶。置于30 ℃,200 r/min恒温培养振荡器中,振荡45 min。于无菌操作台中,取1 mL混匀的样品待测液用于稀释涂布(当天进行)。取45 mL样品待测液于50 mL离心管中,9000 r/min离心5 min,收集上清液用于其他指标的检测。风味物质、乙醇、还原糖、有机酸和氨基酸样品储存于-20 ℃冰箱中;酯化酶、糖化酶和α-淀粉酶样品当天检测。
1.3 检测方法
1.3.1 感官评价 感官评定由湖北工业大学12名感官评估师(男6名,女6名,年龄20~40岁)评定。感官评价员按照ISO 8586:2012标准,在室温(25±2 ℃)的感官室进行训练,并且都有一年以上的感官评价经验。对风味特征的感官评定描述术语由评价员在评估一些样品和参照资料后共同提供[22-23]。样品(样本供应温度30 ℃±2 ℃)搅拌均匀后进行评估,以评价员共同描述部分作为风味评价的结果。
1.3.2 挥发性风味物质检测 取5 mL上清液样品,加入装有1.5 g NaCl、10 μL 1.98 g/L的4-甲基-2-戊醇(内标)和转子的顶空钳口样品瓶中,用于风味物质测定。顶空固相微萃取,萃取头选用白酒风味分析一般选用的50/30 μm DVB/CAR/PDMS纤维萃取头。固相微萃取头在气相色谱进样口老化0.5 h,250 ℃(首次使用萃取头)。将顶空钳口样品瓶于50 ℃磁力搅拌器上加热平衡30 min后,将萃取头插入样品瓶顶空部分,萃取纤维距液面2 mm左右,50 ℃萃取30 min。将萃取头插入气相色谱仪(GC)进样口,进样口温度250 ℃解吸5 min,进行GC分析。
色谱柱:安捷伦DB-WAX毛细管色谱柱(60 m×0.32 mm,0.5 μm);升温程序:40℃保持5 min,以5 ℃/min升至240 ℃,保留8 min;载气(N2)流速25 mL/min;检测器温度300 ℃。
1.3.3 微生物计数方法 使用稀释涂布法进行微生物计数,将涂布好的平板倒置放于30 ℃恒温培养箱静置培养2 d后进行计数。每个稀释梯度涂三个平板,菌落数取平均值。
1.3.4 乙醇和还原糖的检测 乙醇含量通过生物传感器分析仪S-10进行测定。
还原糖含量使用3,5-二硝基水杨酸法(3,5-dinitrosalicyic acid,DNS)进行测定[24]。以还原糖含量(g/L)为横坐标,吸光值(OD540)为纵坐标绘制标准曲线,标准曲线方程为y=1.808x-0.0888,其中R2=0.9997。
1.3.5 有机酸检测 有机酸的检测方法参考刘翠翠[25],在样品处理方法中略微修改。样品处理:取400 μL上清液于2 mL离心管中,加入1.6 mL的甲醇(沉降蛋白),振荡混匀后12000 r/min离心5 min。将上清液通过0.22 μm滤膜过滤后,取550 μL上清液到2 mL离心管中并加入400 μL内标(0.04%叔戊醇,溶剂为65%乙醇溶液),再加入50 μL甲酸进行活化,振荡均匀后在-20 ℃条件下保存待测。
乳酸含量的检测使用生物传感器分析仪S-10进行测定。
1.3.6 游离氨基酸检测 检测参考Reddy等[26]方法并稍作改动。取500 μL上清液到试管中,加入45 μL 7 moL/L的NaOH溶液,再加入500 μL的无水乙醇与吡啶(v:v=4:1)混合液,振荡均匀。加入100 μL氯甲酸乙酯(ECF),超声波处理1 min,再加100 μL的ECF,超声波处理1 min后,加入500 μL含1%ECF和10%内标(0.2%乙酸苯乙酯,氯仿作为溶剂)的氯仿溶液及200 μL饱和碳酸氢钠溶液,剧烈振荡处理1 min。将试管中液体转移到2 mL离心管中,3000 r/min离心5 min。取下层液体至已添加无水硫酸钠的2 mL离心管中,3000 r/min离心1 min。将离心后的上部分液体转移至棕色气相瓶中,旋紧瓶盖并用封口膜封好瓶盖部分,保存在-20 ℃条件下用于气相色谱检测。
色谱柱:安捷伦DB-5毛细管色谱柱(30 m×0.23 mm,0.25 μm);升温程序:70 ℃保持5 min,以5 ℃/min升至280 ℃,保留5 min;载气(N2)流速25 mL/min;检测器温度300 ℃;进样口温度280 ℃。
1.3.7 糖化酶活力测定 葡萄糖淀粉酶(糖化酶)酶活力的测定方法参考Chen等[27]略微修改。移取0.5 mL处理后的样品,加入0.5 mL的10 g/L可溶性淀粉溶液,置于40 ℃水浴锅保温5 min,取出后加入0.5 mL的DNS试剂放入沸水浴中处理5 min,冷却后加入4 mL去离子水。以水代替样品,其他操作与测试样品相同,用于调零,于540 nm波长处比色并记录示数。以葡萄糖浓度(g/L)为横坐标,吸光值为纵坐标绘制标准曲线,标准曲线方程为y=1.1745x+0.071,其中R2=0.999。一单位葡萄糖淀粉酶活性定义为在测定条件下每小时释放出1 mg还原糖的酶量。
1.3.8α-淀粉酶活力测定α-淀粉酶酶活力的测定方法参考Xiao等[28],并在其基础上稍作改进。取处理好的样品0.4 mL,加入0.4 mL的2 g/L可溶性淀粉溶液,于50 ℃孵育30 min后,加入0.2 mL 1 mol/L的HCl终止酶反应。再加入1 mL的碘试剂,显色后,加入5 mL去离子水,于580 nm波长处比色。用水代替样品,其它操作与测试样品相同,作为空白调零。以淀粉含量(μg)为横坐标,吸光值为纵坐标绘制标准曲线,标准曲线方程为y=0.0022x-0.0211,其中R2=0.9996。酶活力定义为,在50 ℃、pH7.0条件下平均每分钟1 μg碘结合淀粉物质的消失量即为一个酶活力单位。
1.3.9 酯化酶活力测定 酯化酶活力测定方法参考潘名志[29]并稍作改进。取上清液样品0.5 mL,加入pH为6.0的0.1 mol/L磷酸缓冲液3.0 mL和底物2.5 mmol/L的α-乙酸萘酯溶液0.1 mL,置于37 ℃水浴锅中反应15 min,取出后加入0.8%的固兰B溶液0.4 mL,于37 ℃保温10 min后取出。以去离子水代替样品,其他与测试样品相同,作为空白调零。在528 nm吸收波长处比色,测其光密度。以α-萘酚浓度(mmol/L)为横坐标,吸光值为纵坐标绘制标准曲线,标准曲线方程为y=0.5376x-0.0471,其中R2=0.9998。酶活力定义为在37 ℃,15 min水解α-乙酸萘酯产生1.0 mmoLα-萘酚所需的酶量为一个酶活力单位。
1.4 数据处理
所有实验重复三次,挥发性风味物质、有机酸和氨基酸均采用内标法进行半定量分析,通过与标准品保留时间的对比进行定性分析。使用SPSS软件对数据进行分析,使用Origin 9和Excel 2010进行图像的绘制。
2 结果与分析
2.1 单一酵母菌发酵和混菌发酵感官评价
固态单一菌株发酵费比恩塞伯林德纳氏酵母HY-11(F1)和葡萄牙棒孢酵母HY-21(F2)两发酵方案在整个发酵过程中,感官评价整体风味较差,产生风味较淡,无酒味。如表2所示,F1方案在发酵前期(1~5 d)感官评定只具有蒸煮高粱味;发酵中期(6~10 d),具有淡果香和甜味;发酵后期(11~15 d)果香味消失。F2发酵2 d具有高粱味和甜味,4~9 d具有淡果香和甜味,后期主要表现为淡的酸味。
费比恩塞伯林德纳氏酵母HY-11和葡萄牙棒孢酵母HY-21分别同米曲霉M-08混菌发酵,即F4和F5方案,与单一酵母菌发酵相比感官风味较好,风味提升明显。如表2所示,F4方案在发酵6 d时风味最好,风味特点为超浓哈密瓜香、酒香和酯香味。F4在发酵4~6 d时的酒香味较突出,嗅评风味最浓厚,随着发酵的进行风味开始变淡。F5方案虽然在发酵4~9 d期间具有酒香风味,但整体风味欠佳,酱香和咸味太重。故而F5在发酵15 d时的风味最佳,具有酱香、果香和哈密瓜香,但是缺乏酒香味。

表2 单一酵母菌发酵和混菌发酵感官评定Table 2 Sensory evaluation of single yeast fermentation and mixed fermentation
加入米曲霉M-08进行混菌发酵,不仅使得风味更佳浓厚,感官风味更好,也使得酒香味实现从无到有,这说明米曲霉M-08的加入促进了酵母菌挥发性风味代谢物的产生,两菌株之间具有较好相互作用。
2.2 单一酵母菌发酵和混菌发酵挥发性风味物质分析
挥发性风味物质的种类和含量如表3所示,F4和F5方案的风味物质种类最多(9种),F1方案种类较少(8种),F2最少(2种)。酵母菌单一菌株发酵即F1和F2,风味物质总量较低,最高含量分别为3.68和2.17 μg/g,较低的风味物质含量与嗅评结果风味较淡相一致。而加入米曲霉M-08进行混菌发酵的F4和F5方案,风味物质的总含量有大幅度提升,最高含量分别达到1408.97和257.77 μg/g。费比恩塞伯林德纳氏酵母HY-11单菌与混菌发酵相比,混菌发酵缺少了癸酸乙酯、月桂酸乙酯和4-乙基愈创木酚,产生了新的代谢产物乙酸乙酯、乙酸异戊酯、异丁醇和2,3-丁二醇。葡萄牙棒孢酵母HY-21单一菌株发酵仅有苯乙醇一种风味物质产生,但与米曲霉M-08混菌发酵则产生了8种(乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、异丁醇、异戊醇、2,3-丁二醇、苯甲醛和乙偶姻)新的产物。分析单一酵母菌和混菌发酵的风味物质变化可知,米曲霉M-08的加入改变了酵母菌代谢风味物质特征,从而导致整个发酵体系风味特征的变化。

表3 挥发性风味物质及其含量Table 3 Volatile flavor compounds and their contents
F4在发酵6 d时具有超浓的哈密瓜香、酒香和酯香味,酯类物质中水果味的乙酸乙酯和热带水果味的乙酸苯乙酯[30]含量较高,分别达到了841.68和344.87 μg/g。F5在发酵15 d时产生大量的乙酸乙酯和玫瑰花香味的苯乙醇,其含量分别达到148.11和50.77 μg/g,此时为果香和哈密瓜香。由此可知,费比恩塞伯林德纳氏酵母HY-11具有更强的产酯能力,而葡萄牙棒孢酵母HY-21的产醇能力更好,两菌株在同米曲霉的混菌发酵中都具有很好的产香能力,但F4方案风味更好。
2.3 单一酵母菌发酵和混菌发酵酵母菌生长分析
如图1A所示,发酵前2 d酵母菌单菌发酵pH呈上升趋势而与米曲霉M-08混菌发酵前期pH则呈降低趋势,这说明M-08对发酵过程中pH的变化有较大影响。体系中加入米曲霉M-08,会大幅度降低体系的pH。
发酵过程中酵母菌生物量变化如图1B所示,整个发酵过程中F1和F2方案生物量波动较小,F4和F5方案生物量变化较大。F1方案整体生物量较低,且仅在发酵前2 d呈升高趋势,发酵2 d生物量为2.75×108CFU/g,之后其生物量基本一直维持不变。F2在发酵过程中生物量在4 d时最高,为6.87×108CFU/g,12 d降低到4.81×108CFU/g,随后便开始二次生长,发酵15 d达到6.06×108CFU/g。F4方案发酵前4 d酵母菌生物量呈直线增加,4 d生物量为9.85×108CFU/g,随后开始降低,6 d时出现二次生长现象,并且在发酵12 d时生物量达到最高

图1 发酵过程中pH和酵母菌生物量Fig.1 pH and yeast biomass during fermentation
1.64×109CFU/g,随后略有降低。F5的生物量在所有方案中变化最大,其生物量最高值出现在2 d时为1.35×109CFU/g,而在发酵后期,该方案的酵母菌生物量很低,12 d时的生物量最低,为7.92×106CFU/g,随后出现二次生长。费比恩塞伯林德纳氏酵母HY-11和葡萄牙棒孢酵母HY-21分别同米曲霉M-08混菌发酵,生物量同单菌发酵相比有了大幅度的提升,分别提升了496.36%和96.51%,这说明两株酵母菌都为霉菌依赖型酵母。且F4生物量一直高于F1,说明在该发酵体系中米曲霉M-08对酵母菌具有完全的促进作用。F5仅在发酵前4 d生物量比F2高,发酵6 d后生物量较低,说明仅在发酵前期米曲霉M-08与葡萄牙棒孢酵母HY-21有较好的相互作用。
发酵6 d后F4风味物质开始大幅降低,此时生物量却很高,说明后期生物量太高会影响风味物质的合成,并且会消耗风味物质。F4二次生长发生在6 d时,此时的风味物质含量最高;F5在发酵12 d出现二次生长,15 d风味物质含量达到最高。因此可发现,风味最佳,挥发性风味物质最高的时期,往往出现在二次生长时,或者二次生长后,且生物量不宜过高。
2.4 单一酵母菌发酵和混菌发酵乙醇和还原糖含量比较
酵母菌通过无氧呼吸产生乙醇,四个方案中酵母菌产生乙醇含量如图2A所示。F1和F2方案基本无乙醇产生,在整个发酵周期内乙醇产量基本趋近于零。当两株酵母菌分别同米曲霉M-08混菌发酵后,乙醇产量明显提升,这说明米曲霉M-08的加入促进了酵母菌乙醇的产生。F4方案在发酵4 d时乙醇的含量达到最高值6.57 mg/g,4 d后其乙醇含量开始降低,15 d时乙醇含量仅为0.11 mg/g。F5方案发酵6 d时乙醇含量增加到29.81 mg/g,随后开始降低,但是降低幅度较小,发酵后期该方案的乙醇含量最高,15 d时的含量仍旧维持在17.99 mg/g。混菌发酵两方案的还原糖含量远高于单一酵母菌发酵,这说明添加米曲霉M-08可以大幅度提高体系中还原糖的含量(图2B)。由于F1和F2方案的还原糖含量太低,所以无溢流代谢产物乙醇的生成。F4发酵后期还原糖水平低,造成乙醇几乎完全被消耗利用;而F5方案6 d后还原糖水平较高,故乙醇未被完全消耗殆尽,仍旧可以维持在较高水平。相比于费比恩塞伯林德纳氏酵母HY-11,葡萄牙棒孢酵母HY-21有更好的乙醇产生能力。
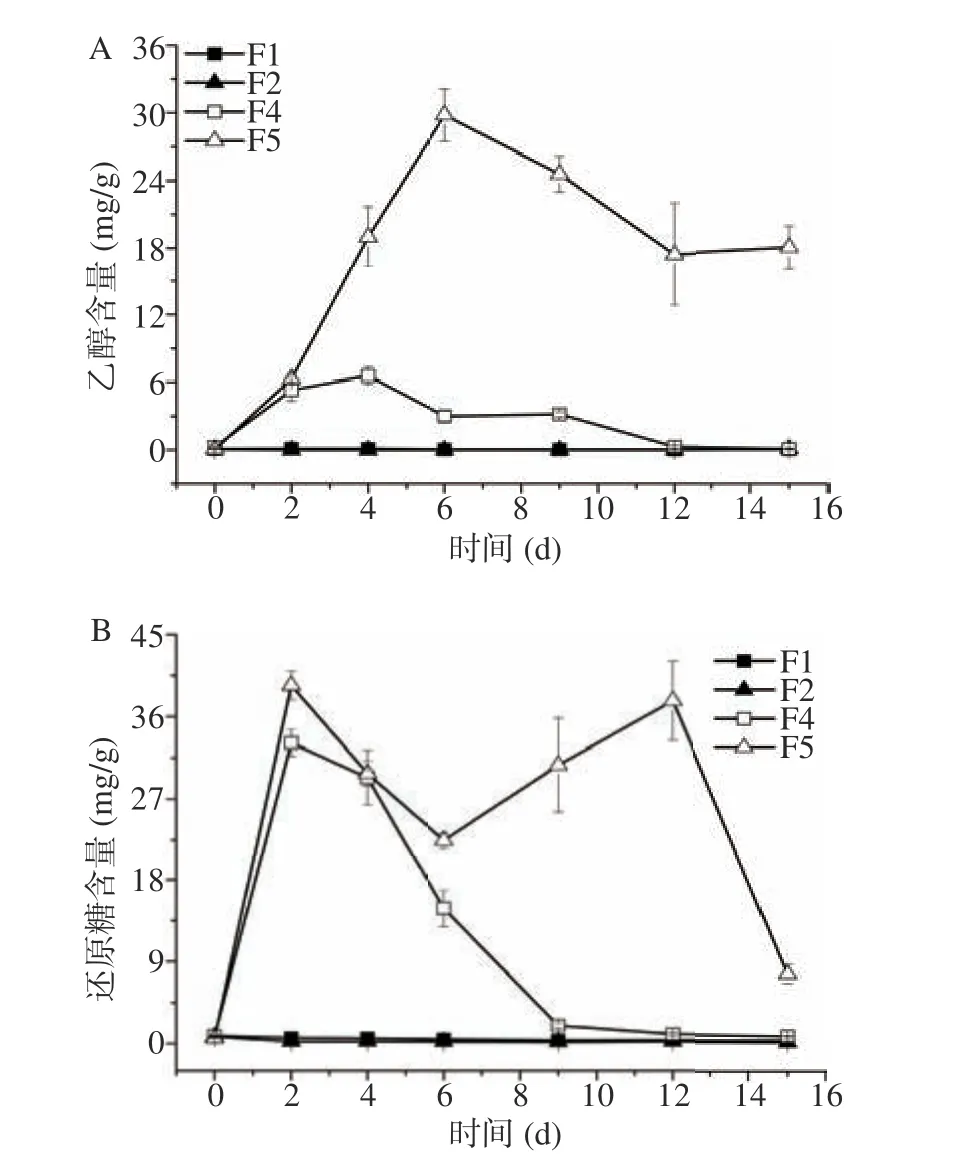
图2 发酵过程中乙醇和还原糖含量Fig.2 Contents of ethanol and reducing sugar during fermentation
2.5 单一酵母菌发酵和混菌发酵有机酸和氨基酸含量分析
有机酸可以作为风味物质的前体物质,从而影响体系中风味物质的合成[31]。对单一酵母菌发酵和混菌发酵的四种方案进行胞外有机酸代谢分析,如图3所示。单一酵母菌发酵的有机酸组成较单一,在F1方案中仅检测到乙酸和异戊酸,F2中只检测到异戊酸。F1发酵4 d乙酸含量最高为0.074 mg/g,两方案产生异戊酸的含量则很低。混菌发酵两方案有机酸合成较多,在种类和数量上都高于单菌发酵。F4方案有4种有机酸生成,异丁酸、丁酸和乳酸占主体,最高含量分别为0.33、0.11和0.13 mg/g。F5整个发酵周期内可检测到5种有机酸,其中异丁酸和丁酸含量较高,最高含量分别为0.72和1.07 mg/g。与单菌发酵相比,混菌发酵体系中有机酸的组分发生改变,通过结合代谢反应合成新的有机酸,并促进了有机酸的消耗(乙酸、异戊酸)。混菌体系有机酸组分的改变,促进了体系中新的风味物质的代谢(异丁醇),并且使更多乙酸酯类和异戊酸等挥发性风味物质生成。
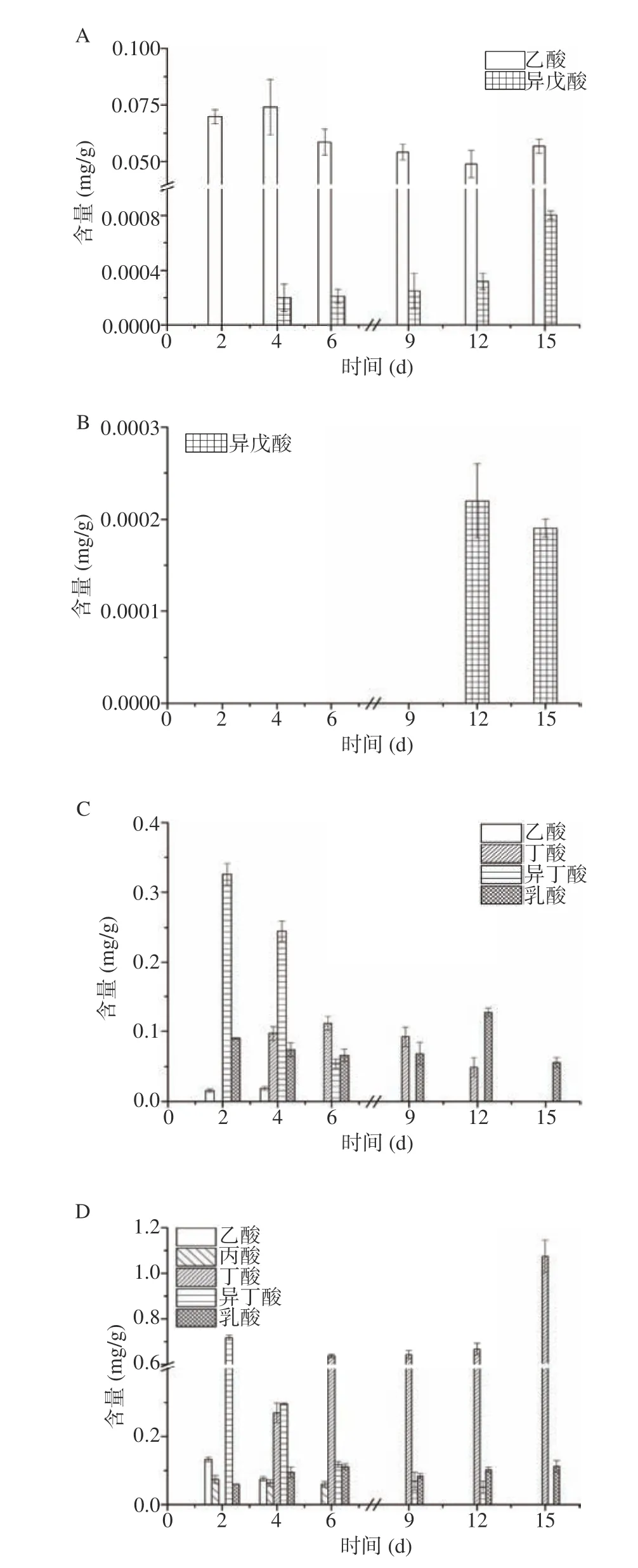
图3 发酵过程中有机酸含量Fig.3 Organic acid content in fermentation process
氨基酸作为风味物质的前体物质,其种类和含量与酵母菌代谢产生风味物质有密切的关系[32]。如图4所示,单一菌株发酵产生氨基酸的种类较单一或者不能向胞外分泌氨基酸,而丰富发酵体系菌株即添加米曲霉M-08可以有效提高体系中游离氨基酸的含量和种类。费比恩塞伯林德纳氏酵母HY-11单菌发酵未检测到游离氨基酸,葡萄牙棒孢酵母HY-21整个发酵过程中也仅检测到天冬氨酸,所以体系中氨基酸的不足是导致单一酵母菌发酵风味物质产生不足的重要原因之一。F4体系中氨基酸含量相对较低,但其风味物质生成量和生物量较高(6 d),所以推测大部分的氨基酸被用于菌体生长和合成风味物质。F5体系氨基酸较丰富,种类和含量都较高,但该体系的总风味物质生成量较F4低。联系生物量分析发现,发酵6 d时的酵母菌生物量较低,所以导致体系中氨基酸积累,风味物质合成受到影响。米曲霉M-08与酵母菌有较好的相互作用,共同培养具有良好的氨基酸代谢能力,体系中加入米曲霉M-08,可以有效提升体系的挥发性风味物质含量。
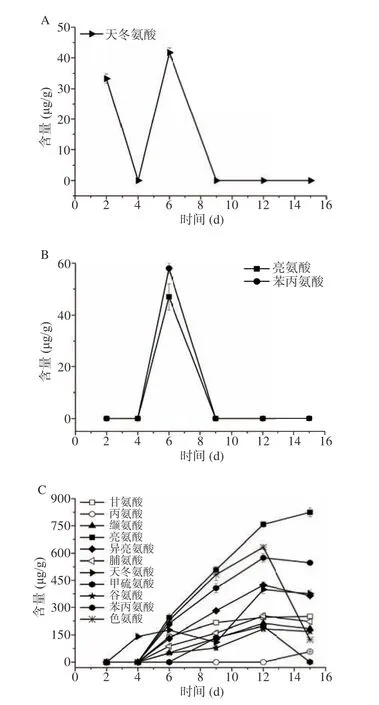
图4 发酵过程中氨基酸含量Fig.4 Amino acid content during fermentation
2.6 单菌发酵和混菌发酵酶活力分析
对发酵过程中的糖化酶、α-淀粉酶和酯化酶进行监测,结果如图5所示。两株酵母菌进行单菌发酵,体系的糖化酶和α-淀粉酶活力较低,所以两株酵母菌水解淀粉成为可发酵糖的能力差,体系还原糖水平低,无法为菌体的生长提供足够的碳源。米曲霉M-08产生糖化酶和α-淀粉酶能力较强,其最高酶活力分别可达到4887.91和69437.64 U/g。两酵母菌分别与米曲霉M-08进行混菌发酵,糖化酶和α-淀粉酶活力与酵母菌单菌发酵相比有不同程度的提高。混菌发酵F4方案糖化酶的酶活力在发酵第4 d时达到最高371.65 U/g,F5则在第2 d达到最酶活力455.07 U/g,而单菌发酵F1和F2的糖化酶活力最高分别为4.43和14.37 U/g。但混菌发酵方案糖化酶活力比米曲霉M-08单菌发酵的酶活力低,这说明酵母菌会影响M-08产糖化酶的能力。F4和F5体系的α-淀粉酶活力最高值分别为2586.47和3289.12 U/g,而F1和F2整个发酵过程中的α-淀粉酶最高酶活力仅为36.27和30.25 U/g。在混菌发酵时酶活力远低于米曲霉M-08发酵时 α -淀粉酶活力,表明霉菌在一定程度上会受到酵母菌的抑制。混菌发酵体系较高的糖化酶和α-淀粉酶酶活力,使得淀粉水解,从而提高还原糖水平,促进酵母菌生长。分析酯化酶酶活力变化情况发现,米曲霉M-08的加入能够提高体系中酯化酶酶活力,这种作用尤其对葡萄牙棒孢酵母HY-21更明显,对费比恩塞伯林德纳氏酵母HY-11也有一定的提升作用,从而大大提升体系风味物质含量。
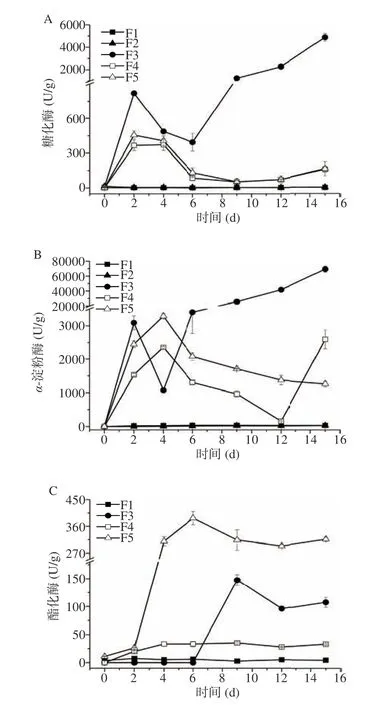
图5 发酵过程中酶活力变化Fig.5 Changes of enzyme activity during fermentation
费比恩塞伯林德纳氏酵母HY-11同米曲霉M-08混菌发酵,发酵体系的α-淀粉酶、糖化酶和酯化酶与酵母菌的单一菌株发酵相比都有极大幅度提升,分别提升了70.31倍、82.89倍和3.69倍。葡萄牙棒孢酵母HY-21与米曲霉M-08混菌发酵比HY-21单一菌株发酵α-淀粉酶和糖化酶酶活力分别提高107.73倍和30.67倍,酯化酶从单一菌株发酵的未检测到提升到387.82 U/g。说明这两株酵母菌对米曲霉M-08具有依赖作用,为霉菌依赖型酵母菌,与米曲霉M-08共培养能够促进体系酶活力的提升,从而促进酵母菌的生长和风味物质的代谢。
3 结论
费比恩塞伯林德纳氏酵母HY-11和葡萄牙棒孢酵母HY-21为霉菌依赖型酵母,通过同步糖化发酵方式,与米曲霉M-08混菌发酵,可以极大促进酵母菌的生长和风味物质的产生。费比恩塞伯林德纳氏酵母HY-11与米曲霉M-08混菌发酵风味较好,与单一酵母菌发酵相比,挥发性风味物质含量更高,并且风味代谢物组分发生变化,发酵6 d具有超浓哈密瓜香、酒香和酯香味。费比恩塞伯林德纳氏酵母HY-11具优秀的产酯能力,产生乙酸乙酯、乙酸苯乙酯和乙酸异戊酯的含量分别为903.48、344.87和
198.61 μg/g。葡萄牙棒孢酵母HY-21具有更好的产醇能力,其乙醇、苯乙醇和异戊醇的最高产生量分别为29.81 mg/g、50.77和42.94 μg/g。与单菌发酵相比,混菌发酵体系中有机酸的组分发生改变,通过结合代谢反应合成新的有机酸,并促进了有机酸的消耗(乙酸、异戊酸)。米曲霉M-08与酵母菌有较好的相互作用,混菌发酵可提升体系游离氨基酸水平,因而体系中加入米曲霉M-08,能有效提升体系的挥发性风味物质含量。两株酵母菌单菌发酵的产酶能力不足,无法为菌体生长提供足够碳源,导致风味代谢物含量低。利用米曲霉M-08的产酶优势,采用同步糖化发酵方式,能够有效提升体系的酶活力,促进挥发性风味物质的代谢。本研究结果为米曲霉M-08与霉菌依赖型酵母在共培养发酵中的相互作用提供了理论依据,为费比恩塞伯林德纳氏酵母HY-11和葡萄牙棒孢酵母HY-21应用于白酒酿造奠定基础。

