抗氧化乳酸菌的筛选及其对小肠上皮细胞氧化损伤的保护作用
王小鹏,崔文明,王子卓越,杨文月,黄宇琪,李静蕊,陈水燕,郭培培,赵改名, ,闫 爽,
(1.河南农业大学食品科学技术学院,河南郑州 450002;2.河南农业大学机电工程学院,河南郑州 450002;3.河南花花牛乳业集团股份有限公司乳工程研究院,河南郑州 450064)
正常代谢产生的适量活性氧分子(reactive oxygen species,ROS)发挥着细胞内信息传递、生化反应调节等重要作用[1],但衰老、虚弱、肥胖等生理病理因素都会加速体内ROS的产生[2],过量的ROS会破坏机体氧化和抗氧化平衡,造成氧化应激,损伤生物体的蛋白质、脂类及核酸等成分,引发高血压、糖尿病、动脉粥状硬化等疾病[3-4]。生物体具有抗氧化酶类和非酶分子组成的防御修复系统,如细胞可产生超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)来抵御ROS的损伤[5]。然而,当体内ROS积累过高时,内源性抗氧化系统无法消除活性氧自由基对人体的伤害,补充外源性抗氧化剂成为应对氧化应激的有效方式。正丁基羟基茴香醚和正丁基羟基甲苯等合成抗氧化剂能够有效减轻氧化损伤,但由于对肝脏有损害并存在致癌风险,其安全性受到质疑[6]。
乳酸菌具有抗氧化特性,能够减轻氧化应激对生物体的影响[7]。Song等[8]从泡菜中分离到一株短乳杆菌B13-2,其具有较高的DPPH和ABTS+自由基清除能力以及脂质过氧化抑制活性,经85 ℃、30 min热处理后,菌体仍具有抗氧化活性。Zhang等[9]研究了植物乳杆菌J26发酵对蓝莓汁抗氧化能力的影响,结果表明发酵蓝莓汁的DPPH自由基、羟自由基和超氧阴离子自由基清除能力显著增强,与抗氧化性密切相关的酚类物质、花色苷含量明显升高。动物实验和临床研究也表明,乳酸菌能够缓解生物体的氧化应激状态,乳双歧杆菌HN019能够改善健康个体和代谢综合征患者的炎症和氧化应激指标,且对健康受试者显示出特定的抗氧化防御作用[10]。乳酸菌作为生物抗氧化剂,正在受到更多的研究和关注。
基于产业需求,众多研究关注了抗氧化乳酸菌的筛选和体外抗氧化指标测定[6,11],乳酸菌对正常肠道细胞氧化损伤的修复作用及细胞中抗氧化酶活性的影响还鲜见报道。目前,不良饮食习惯、焦虑等社会环境因素对人们肠道健康造成极大影响,其中氧化损伤是重要方面。小肠黏膜上皮细胞(IEC-6)保留了小肠上皮干细胞未分化的特性,在组织学和免疫学方面与增殖性隐窝细胞无明显差别,而且在合适条件下,能分化为成熟的肠细胞,是研究外源性物质对小肠作用效果的良好模型[12]。相对于HT-29和Caco-2等结肠癌细胞系,IEC-6细胞更适合研究乳酸菌菌株对小肠功能的影响作用。
本研究通过体外抗氧化实验,从长寿老人肠道菌群中筛选出3株高抗氧化活性乳酸菌菌株,分析其对小肠上皮细胞(IEC-6)的细胞黏附能力并通过H2O2诱导构建细胞氧化损伤模型,探索菌株对IEC-6细胞氧化损伤的修复作用,以及对细胞中GSHPx、SOD、CAT等抗氧化酶活性和MDA(malondialdehyde)生成量的影响,为潜在功能性食品添加剂或食品配料开发提供理论参考。
1 材料与方法
1.1 材料与仪器
乳酸菌菌株 分离自河南省周口市夏邑县长寿老人粪便;大鼠小肠上皮细胞(IEC-6,CRL-1592TM)美国ATCC公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶试剂盒(glu-tathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)试剂盒、总抗氧化能力试剂盒(total antioxidant capacity,T-AOC)、丙二醛试剂盒(malonaldehyde,MDA) 南京建成生物工程研究所;溶菌酶(>20 kU/mg) 上海碧云天生物技术有限公司;CCK-8试剂盒 日本Dojindo公司;过氧化氢、邻苯三酚、邻二氮杂菲、铁氰化钾等生化试剂 阿拉丁试剂(上海)有限公司。
Biometra T-Gradient梯度PCR仪 德国Biometra公司;EC3 310凝胶成像系统 美国UVP公司;UV2600紫外分光光度计 岛津企业管理(中国)有限公司;HVE-50自动高压灭菌器 日本Hirayama公司;SW-CJ-2FD超洁净工作台 江苏苏净集团公司;Thermo 371 CO2培养箱 美国Thermo公司;VCX750超声破碎仪 美国Sonics Materials公司。
1.2 实验方法
1.2.1 菌株的培养及菌体裂解液的制备 取出冻存于甘油管(-80 ℃)中的36株乳酸菌菌株,接种至MRS液体培养基中,传代3次。菌株按照2%接种量在MRS液体培养基中,置于厌氧培养箱37 ℃静置培养18 h后,利用平板涂布计数法计算活菌数,4000×g离心5 min,菌体细胞重悬于无菌PBS缓冲液中,调整细菌浓度为1×109CFU/mL,该菌悬液用于后续研究。
待测菌株菌悬液(1×109CFU/mL)中加入溶菌酶(1 mg/mL),37 ℃培养30 min,冰浴条件下超声破碎(250 W,超声5 s,间隔10 s,共10 min),8000×g离心10 min,收集上清液,0.22 μm微孔滤膜过滤,得到菌株裂解液。
1.2.2 菌株的过氧化氢耐受能力分析 菌株过氧化氢耐受能力分析参照Das等[13]的方法,待测菌株按照1%接种量分别接种于H2O2浓度为0.8 mmol/L的MRS液体培养基和不含H2O2的MRS液体培养基中,37 ℃厌氧培养8 h,600 nm波长下测定培养液吸光度值,以不含H2O2的样品作为空白。
1.2.3 DPPH自由基清除能力分析 取2 mL的DPPH-无水乙醇溶液(400 μmol /L),加入2 mL待测菌株混匀,室温避光静置30 min,8000×g离心10 min,测定上清液在517 nm的吸光度值[14]。DPPH自由基清除率计算公式为:

式中:A0为等体积无水乙醇代替样品的吸光度值;A1为实验组吸光度值;A2为等体积无水乙醇代替DPPH乙醇溶液的吸光度值。
1.2.4 羟自由基清除能力分析 将1 mL邻二氮杂菲(2.5 mmol/L)、1 mL的PBS(pH7.4)、0.5 mL待测菌株混合均匀,随后加入1 mL的FeSO4溶液(2.5 mmol/L)和0.5 mL的H2O2(20 mmol/L),37 ℃水浴1 h,检测其在536 nm波长处的吸光度值[15]。羟自由基清除率计算公式为:
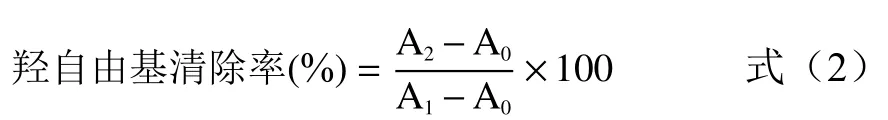
式中:A0为等体积水代替样品的吸光度值;A1为等体积水分别代替样品和H2O2的吸光度值;A2为含样品和H2O2的吸光度值。
1.2.5 超氧阴离子自由基清除能力分析 取3.4 mL Tris-HCl溶液(50 mmol/L,pH8.2)、0.5 mL邻苯三酚溶液(50 mmol/L),加入1 mL待测菌株,混合均匀后放入25 ℃的培养箱反应4 min,随后加入0.1 mL的HCl溶液(8 mol/L)终止反应,测定其在320 nm的吸光值[2]。超氧阴离子自由基清除率计算公式为:

式中:A0为等体积水代替样品的吸光度值;A1为实验组吸光度值。
1.2.6 细胞培养 IEC-6细胞培养于含10%的胎牛血清、90% DMEM(4 mmol/L的L-谷氨酰胺、1 mmol/L的丙酮酸钠、4.5 g/L的葡萄糖)和100 U/L牛胰岛素的培养液中。培养温度为37 ℃,CO2浓度为5%,隔天换液1次,培养瓶中细胞密度达到80%~90%时传代,第15~20代对数期生长细胞用于本研究。
1.2.7 细胞黏附能力分析 细胞黏附实验参照Song等[8]的方法。IEC-6细胞以每孔6×105个的浓度接种于96孔板中,完全培养液调整细胞密度至6×103/孔,贴壁24 h后再无血清培养12 h使细胞同步于G0期,吸出无血清培养液,PBS洗涤,加入100 μL待测菌株(109CFU/mL),37 ℃培养2 h,PBS洗涤去除未黏附细菌,随后加入Triton X-100,使黏附细菌从细胞脱落,初始细菌数及黏附细菌数统计均采用平板涂布计数。细胞黏附率公式如下:

式中:A0为初始细菌数量;A1为黏附细菌数量。
1.2.8 细胞氧化损伤模型建立 细胞氧化损伤模型参照朱静静等[16]的方法建立并根据预实验结果稍作修改。96孔板上调整IEC-6细胞细胞密度至6×103/孔,贴壁24 h后再无血清培养12 h使细胞同步于G0期,吸出无血清培养液,PBS洗涤,加入200 μL不同浓度(0、50、75、100、125、150 μmol/L)的H2O237 ℃培养4 h后,吸去H2O2,PBS洗涤。随后采用CCK-8试剂盒测定细胞存活率,即向每孔加入含10 μL CCK-8溶液的无血清培养液110 μL,37 ºC孵育90 min,测定各孔OD值(检测波长450 nm)。CCK-8试剂盒方法测定细胞存活率的计算公式如下:
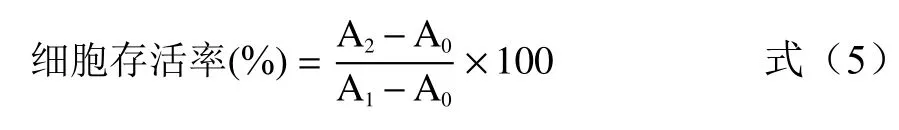
式中:A0为无细胞培养基的吸光度值;A1为正常培养组的吸光度值;A2为H2O2处理组的吸光度值。
1.2.9 细胞存活率、丙二醛含量及抗氧化酶活力分析 IEC-6细胞以2×105/孔接种于6孔板中,无血清培养基使细胞同步于G0期,PBS洗涤后加入2 mL含有菌株裂解液的培养基(菌株的无细胞裂解液和完全培养基以1:1混合),37 ℃培养24 h。PBS洗涤,100 μmol/L的H2O2处理4 h。随后进行细胞存活率、丙二醛含量及抗氧化酶活力的分析。其中,细胞存活率采用CCK-8试剂盒测定细胞存活率,具体方法同1.2.8;丙二醛含量及抗氧化酶活力分析参照Liu等的方法并稍作改动[2],即每孔中加入1 mL 1%的Triton-X-100,冰上裂解10 min,离心后取上清液(8000×g,5 min),根据试剂盒方法测定不同处理组的GSH-Px、T-SOD、CAT活性,T-AOC值及MDA含量。
具体分组和实验处理如下:空白组不添加菌株裂解液,不经H2O2损伤处理;损伤组不添加菌株裂解液,经H2O2损伤处理;实验组添加菌株裂解液,经H2O2损伤处理。
1.3 数据处理
实验数据以“均值±标准偏差”的形式表示,并采用SPSS 26.0进行统计学分析,采用单因素方差分析进行组间比较,显著水平设为P<0.05。
2 结果与分析
2.1 菌株H2O2耐受能力
H2O2是一种长效氧化剂,可通过直接氧化损伤或作为羟自由基的前体物质,加速细胞衰老过程甚至杀死细胞[17]。抗氧化菌株能够抵御一定程度H2O2造成的氧化损伤,同等培养条件下,菌株抗氧化能力越强,菌株生长受H2O2影响越小。一定浓度范围内,培养液中细菌浓度与液体光密度(OD值)成正比,因此可以利用菌液的OD600值来分析菌株生长情况[18]。
36株分离菌株的H2O2耐受能力如表1所示。空白组各菌株的OD600为2.34~2.76,不同菌株生长情况有差异;实验组各菌株经0.8 mmol/L H2O2共培养8 h后,OD600为0.36~1.27,所有菌株生长都受到一定程度抑制,但不同菌株对H2O2胁迫的抗性不同。高抗氧化菌株经0.8 mmol/L H2O2处理8 h后,菌株对氧化损伤抗性较高,OD600通常大于1.0[13],本研究初筛实验组OD600>1.0的16株菌株用于后续抗氧化实验。

表1 分离菌株的H2O2(0.8 mmol/L)耐受能力Table 1 Tolerance of H2O2 (0.8 mmol/L) of the isolated strains
2.2 菌株的DPPH自由基清除能力
DPPH自由基性状稳定,是一种常见的抗氧化效果评价方法,可用于筛查乳酸菌的抗氧化活性[19]。由表2可知,16株乳酸菌都有一定的DPPH自由基清除能力(16.28%~57.16%),不同菌株清除DPPH自由基能力有较大差异,HN-04、HN-05、HN-15的DPPH自由基清除能力较强,分别为54.31%、57.16%和52.81%。乳酸菌的DPPH自由基清除能力与其分泌到菌体表面和代谢产物中的胞外多糖有关,这些多糖类物质通过氢原子和电子转移,中和DPPH自由基[20]。王英等[21]从传统发酵蔬菜中分离出29株乳酸菌,除发酵乳杆菌P13(DPPH自由基清除率为73.02%)外,其余菌株的DPPH自由基清除率在10.81%~62.68%之间,结果与本研究基本一致。

表2 分离菌株的DPPH自由基清除能力Table 2 DPPH radical scavenging ability of the isolated strains
2.3 菌株的羟自由基清除能力
羟自由基清除剂可猝灭体系中强氧化性的羟自由基,保护生物分子免受氧化损伤影响。乳酸菌菌体表面存在Fe2+和Cu2+等过渡金属离子的螯合物质,能够抑制芬顿反应(Fenton reaction),防止羟自由基的生成[22]。如表3所示,16株乳酸菌均具有一定的羟自由基清除能力(18.03%~52.38%),不同菌株清除羟自由基能力有较大差异,其中HN-04、HN-05、HN-15的羟自由基清除能力较强,分别为48.10%、52.38%、47.44%。张俊等[23]从甘南传统牦牛发酵酸奶中筛选出6株乳酸菌,菌株的羟自由基清除率为14.03%~36.92%,略低于本研究数据,这可能是由于菌株的羟自由基清除能力和菌株自身特性有关。

表3 分离菌株的羟自由基清除能力Table 3 Hydroxyl radical scavenging ability of the isolated strains
2.4 菌株的超氧阴离子自由基清除能力
超氧阴离子自由基和羟基结合后,会破坏细胞DNA,引起脂质过氧化,对细胞和生物体造成损伤[24]。由表4可知,16株乳酸菌均具有一定的超氧阴离子自由基清除活性(12.98%~43.31%),不同菌株的超氧阴离子自由基清除能力不同,其中HN-04、HN-05、HN-15超氧阴离子自由基清除率较高,分别为42.06%、43.31%、37.11%。乳酸菌清除超氧阴离子自由基的能力,与其代谢产生的超氧化物歧化酶、过氧化氢酶等抗氧化酶类有关[6]。李颖等[25]发现7株人源植物乳杆菌的超氧阴离子自由基清除能力为49.99%~54.04%,与本文研究结果接近。
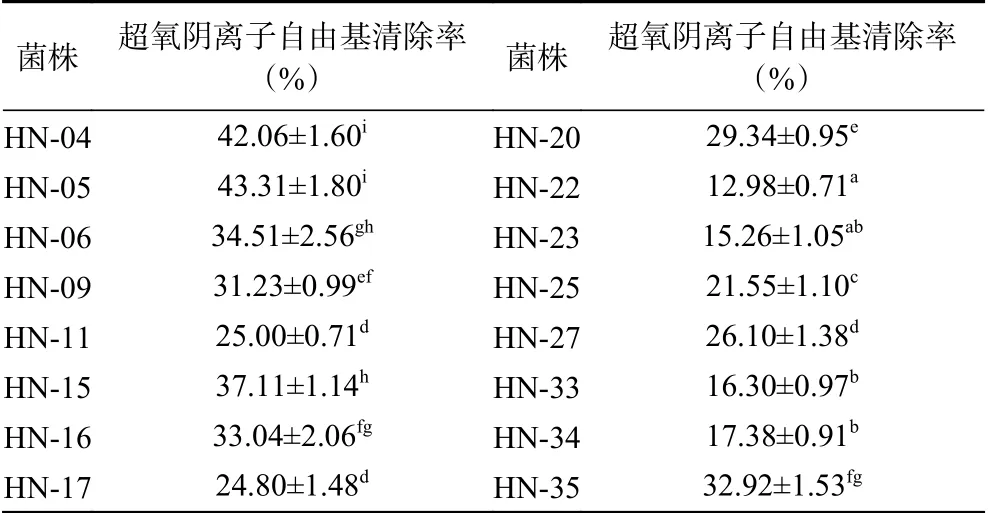
表4 分离菌株的超氧阴离子自由基清除能力Table 4 Superoxide anion radical scavenging ability of the isolated strains
综合菌株的DPPH自由基、羟自由基、超氧阴离子自由基清除能力分析结果,选择抗氧化性较强的HN-04、HN-05、HN-15进行下一步分析。
2.5 菌株的细胞黏附能力
乳酸菌对小肠上皮细胞的黏附是发挥其肠道定殖、抗菌、抗氧化等益生作用的前提条件。乳酸菌通过表面特异性识别分子和宿主靶细胞表面的相应受体,在空间结构上相互匹配并结合。乳酸菌的黏附能力除与菌体和细胞直接相关外,也受外界温度、酸碱度、离子强度等因素的影响[26]。
分离菌株对IEC-6细胞黏附作用如表5所示,HN-04、HN-05、HN-15菌株的初始细菌数分别为9.08、9.07和9.15(lg CFU/mL),和IEC-6细胞共培养孵育2 h后,3株菌的细胞黏附率分别为6.77%、6.92%和5.82%,HN-04和HN-05菌株的细胞黏附率显著高于HN-15菌株(P<0.05)。报道显示,乳酸菌的细胞黏附率一般在2%~10%之间,不同菌株的细胞黏附率不同,明串珠菌H40、植物乳杆菌SY11和短乳杆菌KU15153对结肠癌细胞HT-29的黏附率分别为2.86%、7.20%和8.91%[27-28],本研究数据与文献报道基本一致。
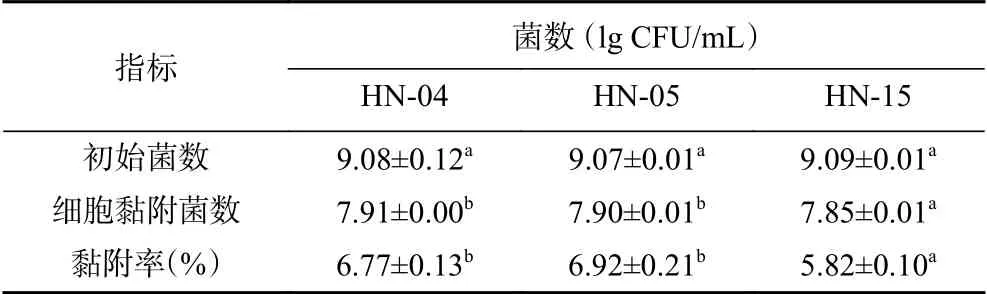
表5 分离菌株的IEC-6细胞黏附能力Table 5 Adhesion ability to IEC-6 cells of the isolated strains
2.6 H2O2氧化损伤模型建立及菌株对IEC-6细胞存活率的影响
H2O2可以通过芬顿反应、自动氧化等途径转变为羟基自由基,造成细胞的氧化损伤,直观反映氧化还原环境失衡对细胞活性的影响,因此,可利用H2O2建立IEC-6细胞氧化损伤模型[29]。如图1a所示,IEC-6细胞存活率随着H2O2浓度的增加而降低,当H2O2浓度小于100 μmol/L时,其对IEC-6细胞损伤不明显,细胞存活率仍大于80%;随着H2O2浓度升高,细胞存活率快速下降,当H2O2浓度为150 μmol/L时,细胞存活率仅为48.65%。为防止H2O2浓度太高导致IEC-6细胞损伤难以恢复,选取100 μmol/L的H2O2用于建立细胞氧化损伤模型。
乳酸菌能够降低氧化剂或外源真菌毒素对细胞的毒性,提升细胞存活率,预防或修复细胞损伤[30]。由图1b可知,HN-04、HN-05、HN-15菌株裂解液共培养24 h后,IEC-6细胞存活率分别提升了7.24%、11.19%和5.31%,表明3株乳酸菌对H2O2诱导的IEC-6细胞损伤有一定的预防作用。Németh等[31]发现植物乳杆菌2142无论是预防处理还是共培养保护,都能够显著降低H2O2氧化损伤导致的Caco-2细胞凋亡。乳酸菌可以调节相关基因的表达缓解氧化损伤,例如Hou等[32]通过转录组学分析发现,乳酸菌能够下调细胞中氧化应激相关基因(TNF、NUAK2、FBN2)表达、抑制免疫应答和凋亡相关信号通路中基因(Jak-STAT、MAPK)的表达,减轻细胞的氧化应激损伤。
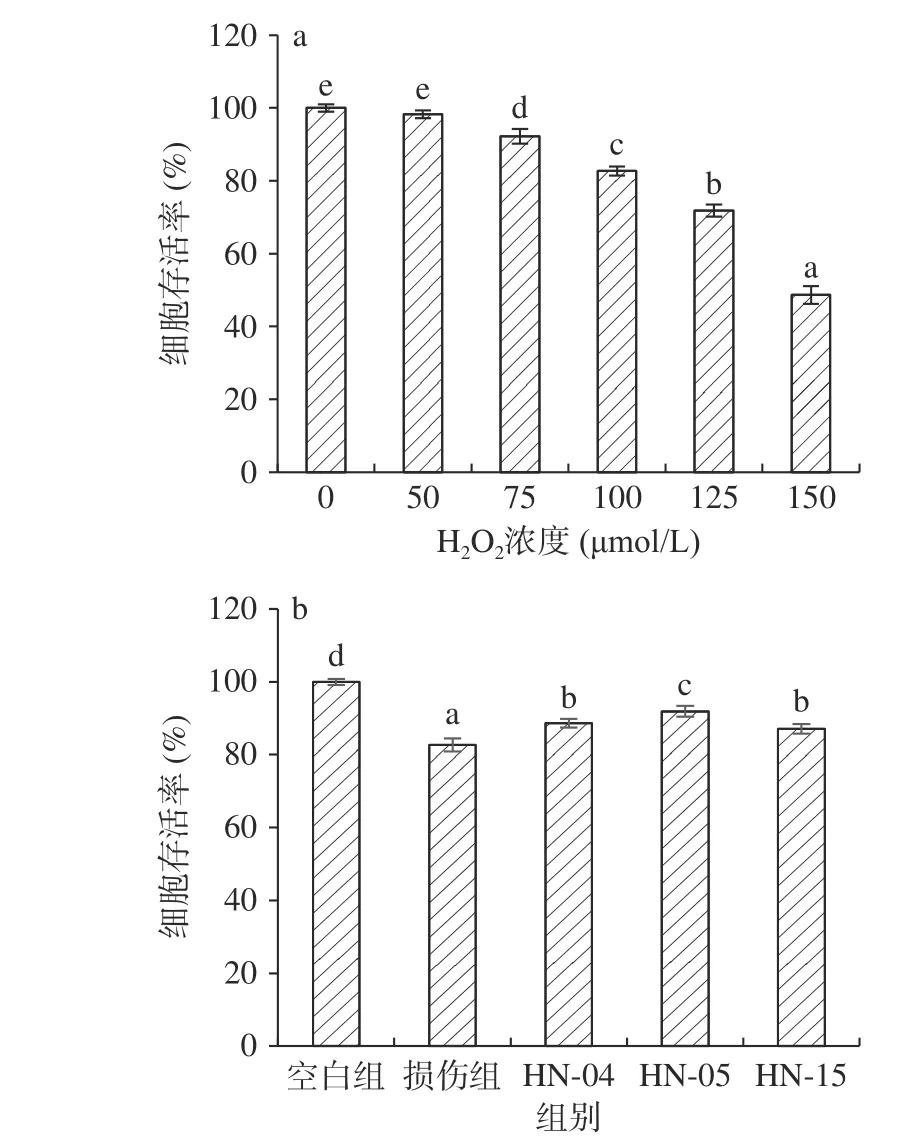
图1 H2O2浓度(a)和菌株裂解液(b)对IEC-6细胞存活率影响Fig.1 Effects of the H2O2 concentration (a) and the three strains (b) on the viability of the IEC-6 cells
2.7 菌株对IEC-6细胞中丙二醛含量的影响
丙二醛(MDA)是脂质过氧化的中间产物,可与生物大分子发生反应,产生细胞毒性和遗传毒性,常被作为反映机体氧化损伤的指标[22]。细胞内的MDA由细胞膜磷脂中的脂肪酰基过氧化物分解产生,是前列腺素合成中环氧合酶反应的产物,MDA作为氧化应激过程中的脂质过氧化物,可引起组织细胞损伤,其含量常用来评估氧化应激的程度[33]。由图2可知,H2O2氧化损伤导致IEC-6细胞内MDA含量显著上升,乳酸菌预处理可显著降低MDA含量(P<0.05)。相对于损伤组,HN-04、HN-05、HN-15菌株处理组细胞中的MDA含量分别降低了29.12%、48.80%和20.98%。乳酸菌预处理能够降低氧化损伤模型细胞内的MDA含量,表明3种乳酸菌能减轻H2O2引发的脂质氧化作用,对抗氧化应激损伤。

图2 乳酸菌对H2O2诱导损伤的IEC-6细胞中MDA含量的影响Fig.2 Effects of the three strains on MDA content in IEC-6 cells under oxidative stress induced by H2O2
2.8 菌株对IEC-6细胞中抗氧化酶活性的影响
SOD、CAT和GSH-Px等抗氧化酶类在机体抵御活性氧损伤中起着重要作用,抗氧化酶能够迅速催化抗氧化反应,抵御氧化应激刺激,避免组织和细胞遭受过氧化物损害[34]。
由表6可知,H2O2处理后,IEC-6细胞内抗氧化酶系活性显著降低(P<0.05),3株乳酸菌预处理能够缓解抗氧化物酶系活力的下降趋势。氧化损伤使IEC-6细胞中的GSH-Px、T-SOD、CAT活性和T-AOC值分别降低32.53%、54.06%、56.89%和60.91%;相对于损伤组,乳酸菌HN-04、HN-05、HN-15预处理可使细胞中GSH-Px、T-SOD、CAT和T-AOC值分别增加12.03%~32.39%、21.20%~47.42%、36.10%~87.14%和23.55%~48.69%。一些研究关注了乳酸菌对细胞内抗氧化酶活性的影响,植物乳杆菌Y16发酵产物能够提升氧化损伤HepG2细胞株中的SOD、GSH-Px、CAT酶活性,提高细胞存活率[30]。植物乳杆菌C88、干酪乳杆菌Zhang能够增强受试动物血清中的SOD、GSH-Px、CAT酶活性,减轻氧化应激对机体的损伤[22,35]。SOD、CAT和GSHPx是机体防御和消除DPPH自由基、羟自由基和超氧阴离子自由基的重要屏障,T-AOC反映了机体非酶抗氧化防御体系能力,3株乳酸菌能够提升氧化模型细胞中的抗氧化酶活性和T-AOC值,这一结果和3株乳酸菌的自由基清除效果一致。
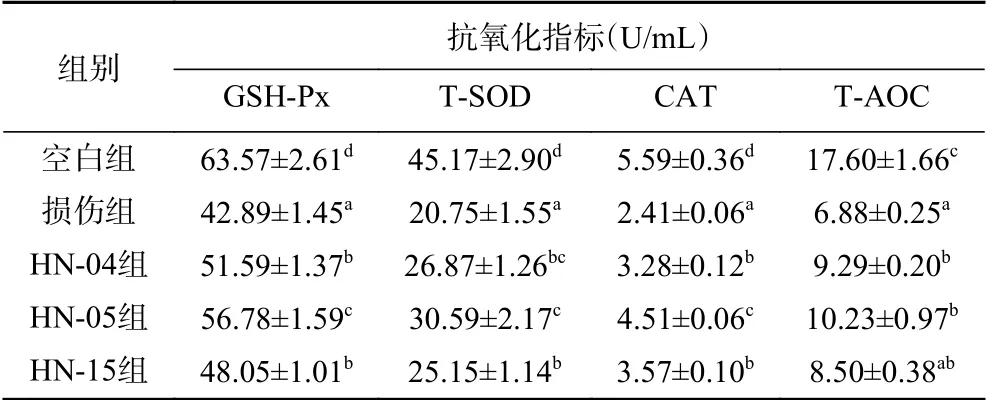
表6 乳酸菌对H2O2诱导损伤的IEC-6细胞抗氧化酶活性的影响Table 6 Effects of the three strains on antioxidant enzyme activities in IEC-6 cells under oxidative stress induced by H2O2
3 结论
通过H2O2初筛及DPPH自由基、羟自由基和超氧阴离子自由基清除能力分析,从河南夏邑长寿老人肠道中筛选得到具备抗氧化活性的发酵乳杆菌HN-04、植物乳杆菌HN-05、动物双歧杆菌HN-15。3株菌作用于H2O2诱导的IEC-6细胞损伤模型后,均能够提高氧化损伤细胞的存活率,增强细胞内谷胱甘肽过氧化物酶(12.03%~32.39%)、超氧化物歧化酶(21.20%~47.42%)、过氧化氢酶活性(36.10%~87.14%)和总抗氧化能力(23.55%~48.69%),降低丙二醛含量(20.98%~48.80%)。所筛选的3株乳酸菌可作为潜在的天然抗氧化剂应用于功能性食品开发。

