外泌体非编码RNA在肿瘤化疗耐药中作用的研究进展
付岩松,董博南 ,耿淑慧 ,孟祥宁 ,朱 静,*
(1.哈尔滨医科大学医学遗传学研究室,黑龙江 哈尔滨 150081;2.哈尔滨医科大学中国遗传资源保护与疾病防控教育部重点实验室,黑龙江 哈尔滨 150081)
癌症是最凶险的疾病之一,每年威胁着全世界数千万人的健康,在过去十几年中持续进展。近些年由于人口老龄化、工业化、城镇化的进程逐渐加快,加上慢性感染、不健康生活方式、环境暴露等原因,癌症发病率不断上升。目前对于癌症的治疗主要包括手术、放化疗和免疫疗法等。肿瘤化疗耐药性分为原发性耐药和获得性耐药,原发性耐药是指初始治疗就出现癌症逃避。临床上,指在开始治疗后肿瘤没有缩小的无反应者,被认为是由于预先存在的基因突变或未经治疗的肿瘤内耐药细胞状态引起的内在耐药性,或细胞快速适应治疗的能力,即适应性抵抗。获得性耐药指最初对治疗有反应的肿瘤在进行长期治疗后出现的耐药性,也就是说肿瘤经抗肿瘤化疗药治疗缓解后,由于某些肿瘤细胞基因产生变异,对该抗癌药不再敏感的特性。肿瘤耐药是肿瘤化疗治疗中的一个重大挑战。肿瘤耐药新机制、耐药标志物以及逆转耐药新靶点和新方法的研究是提高肿瘤治疗疗效的关键。
外泌体是多泡体(multivesicular bodis,MVBs)与细胞膜融合后释放的纳米级细胞外囊泡,粒径范围为30~150 nm。外泌体由脂质双层膜和原始细胞的众多分子组成,存在于血液、尿液、腹水和羊水等体液中。液体活检是指一种新型无创性的以血液为主的体液标本中对细胞及核酸的检测方式,这种检测能提供预后以及对肿瘤治疗方案的应答性等信息,目前,在癌症患者的外周血中,对循环游离核酸(circulating free DNA,cfDNA)、循环游离微小核糖核酸(circulating free microRNA,cf-miRNA)和外泌体的检测,成为了主要的液体活检方法[1]。肿瘤细胞产生的外泌体可以被受体细胞吸收,参与肿瘤微环境(tumor microenvironment,TME)中肿瘤细胞与其他基质细胞间的相互作用过程,包括成纤维细胞、内皮细胞和免疫细胞。肿瘤来源的外泌体含有大量的核糖核酸,目前发现的比较重要的成分是微小RNA(microRNA,miRNA)、长链非编码RNA(long non-coding RNA,lncRNA)和环状RNA(circular RNA,circRNA)等非编码RNA(non-coding RNAs,ncRNA)。这些ncRNA通过参与受体细胞中的相关信号通路,异常调节上皮细胞间质转化(epithelial-mesenchymal transition,EMT)和血管生成相关分子的表达。一方面,这些被包装进外泌体的RNA可以破坏次级器官和组织部位的微环境,促进非恶性组织表现出逐渐增加的致瘤异质性,并促进转移前微环境的形成。另一方面,免疫细胞来源的外泌体RNA 在免疫应答中发挥作用,它们对T 细胞、B细胞和其他免疫细胞的组成和激活有一定的影响,由于免疫调节作用的复杂性,肿瘤细胞与免疫细胞之间会发生激烈的对抗,使得肿瘤细胞最终可能会获得治疗耐药性[2]。外泌体是ncRNA的天然载体,具有体外和体内相容性,其运输ncRNA进入细胞可调节耐药。由于外泌体特殊的膜结构能够保护其内部的RNA 免受酶的降解,因此,外泌体中各类RNA 的含量相对于体液RNA 来说更为稳定。来源于外泌体的ncRNA,称之为外泌体ncRNA。外泌体ncRNA通过参与药物外排、调节信号通路和修饰肿瘤微环境来影响耐药。本文就外泌体miRNA、外泌体lncRNA以及外泌体circRNA等在不同肿瘤和不同耐药反应中的作用、耐药相关机制以及潜在的临床应用展开综述。
1 外泌体miRNA介导肿瘤细胞耐药
miRNAs 是一种约19~24 个核苷酸的非编码小RNA,在基因转录后调控中发挥重要作用。miRNA通过与靶基因mRNA的3′非翻译区(3′-untranslated regions,3′-UTR)互补序列相互结合,降解mRNA或抑制mRNA翻译。miRNA介导的基因表达对细胞应对环境应激的反应至关重要,如饥饿、缺氧、药物处理、氧化应激和DNA 损伤,所以miRNA 表达失调与癌症的发生、进展和转移密切相关[3]。研究证明miRNA 可以被外泌体包裹,其进入外泌体的机制目前有4 种:①中性鞘磷脂酶-2(nSMase2)依赖性途径;②苏素化核不均一核糖核蛋白(hnRNPs)依赖性途径;③miRNA序列3′末端依赖性途径;④miRNA诱导的沉默复合体(miRISC)相关途径[4]。Kosaka 等[4]发现miRNA的分泌是由神经酰胺生物合成紧密调节的,包裹在外泌体中的细胞外miRNA 可以被输送到受体细胞中,作为具有生理功能的分子,通过与细胞内miRNA相同的机制发挥基因沉默作用。目前报道的外泌体miRNA参与介导的肿瘤化疗耐药主要见于细胞毒类药物,比如作用于DNA化学结构的顺铂、奥沙利铂、替莫唑胺,影响核酸形成的5-氟尿嘧啶(5-FU)、吉西他滨,作用于有丝分裂M期干扰微管蛋白合成的紫杉醇以及作用于核酸转录的阿霉素等。
1.1 外泌体miRNA与顺铂耐药
癌症相关成纤维细胞(cancer-associated fibroblasts,CAFs)是位于肿瘤块内或附近的成纤维细胞,是肿瘤基质的重要细胞成分,在肿瘤微环境中发挥重要作用。顺铂是多种肿瘤化疗的核心或一线药物,但顺铂耐药是其化疗治疗中面临的主要挑战。Qin等[5]对头颈癌(head and neck cancer,HNC)顺铂耐药进行研究,发现CAFs 以及CAF 来源的外泌体在调控顺铂耐药中发挥重要作用。在hnRNPA1 蛋白等介导下,miR-196a 包装到CAFs 外泌体。CAFs 外泌体可以转移miR-196a 到受体HNC 细胞,赋予其化疗耐药性和侵袭性。外泌体miR-196a 通过靶向HNC 微环境中的CDKN1B和ING5促进细胞增殖和抑制细胞凋亡。而从CAFs中去除外泌体miR-196a则可以恢复HNC细胞对顺铂的应答。此外临床样本中血浆外泌体miR-196a 与较差的总生存率和药物敏感性相关。因此,外泌体miR-196a 可能成为HNC顺铂耐药的预后因子和潜在治疗靶点。而在非小细胞肺癌(non-small cell lung cancer,NSCLC)中,Zhang 等[6]则发现NSCLC 来源的CAFs 细胞通过转移外泌体miRNA-130a 到受体NSCLC细胞,使其发生顺铂耐药。
1.2 外泌体miRNA与奥沙利铂耐药
基于奥沙利铂药物的联合化疗是治疗晚期结直肠癌(colorectal cancer,CRC)等恶性肿瘤的一线化疗方案。Liu 等[7]发现人正常结直肠黏膜细胞的外泌体可以有效地将miR-128-3p包裹,并将miR-128-3p传递到奥沙利铂耐药细胞中,提高CRC 细胞对奥沙利铂的应答。miR-128-3p 的过表达上调E-钙黏蛋白水平,并通过抑制Bmi1表达,抑制耐药细胞EMT;同时通过抑制药物转运体MRP5的表达,降低奥沙利铂的外排,提高CRC 细胞对奥沙利铂的敏感性,miR-128-3p 可能是奥沙利铂基础化疗的一个有前景的诊断和预后标志物。而在CRC奥沙利铂化疗耐药性的另一项研究则发现,CRC细胞分泌外泌体miR-208b,传递到T细胞,靶向调控程序性细胞死亡因子4(programmed cell death factor 4,PDCD4)基因,促进了调控性T细胞(regulatory T cells,Tregs)的扩增,进一步促进了肿瘤的增殖和奥沙利铂的耐药。所以外泌体miR-208b 可能是CRC对奥沙利铂药物反应的预测性标志物,也是CRC免疫治疗的新靶点[8]。
1.3 外泌体miRNA与阿霉素耐药
阿霉素是一种蒽环类抗生素,通过抑制细胞分裂和诱导细胞凋亡来发挥抗癌作用,抗瘤谱较广,用于治疗血液系统肿瘤和多种实体肿瘤。BLID基因是一种新的肿瘤抑制基因,Liu等[9]证实人胃癌细胞SGC7901/ADR细胞释放的外泌体miR-501被受体细胞吸收之后,通过下调BLID 蛋白和失活下游的caspase-9/-3 蛋白来抑制凋亡,以增强受体细胞对阿霉素的耐药性。并且BLID 下调导致了Akt 的磷酸化,增强细胞的增殖、迁移和侵袭等能力,从而参与调控了细胞的恶性表型。
1.4 外泌体miRNA与替莫唑胺耐药
胶质母细胞瘤(glioblastoma,GBM)是成人最常见也是侵袭性最高的原发性恶性脑肿瘤之一,初次诊断后半数生存期很低。替莫唑胺(temozolomide,TMZ)是一种口服烷基化剂,目前作为一种有效的一线化疗药物广泛应用于GBM 患者的治疗。Yin 等[10]发现来自胶质母细胞瘤患者的循环外泌体中的miR-1238 比健康人循环外泌体中高度富集,外泌体miR-1238 转入受体细胞后,可诱导替莫唑胺敏感细胞中miR-1238 表达水平上调,通过EGFR-PI3K-Akt-mTOR 通路的激活在体外和体内引起替莫唑胺敏感细胞的部分耐药性。
1.5 外泌体miRNA与5-FU耐药
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌,5-FU 是治疗HCC 常用的化疗药物之一,由于肝癌的高复发率和对抗癌药物的耐药,其治疗效果非常低,发病率和死亡率很高。研究发现肝癌细胞长期暴露5-FU 药物后可上调miR-32-5p的水平,上调后的miR-32-5p被包入外泌体,然后转移到药物敏感细胞,敏感细胞接收miR-32-5p 后,miR-32-5P 直接靶向PTEN并激活PI3K/Akt 通路,并通过血管生成和EMT导致肝细胞癌多药耐药[11]。
1.6 外泌体miRNA与紫杉醇耐药
研究发现,miR-155-5p 在胃癌MGC-803 耐紫杉醇细胞中的表达水平显著升高,miR-155-5p的下调可以逆转胃癌MGC-803耐药细胞的EMT和化疗耐药表型,miR-155-5p通过外泌体从紫杉醇耐药的胃癌细胞向敏感的癌细胞传递,其通过抑制GATA3和TP53INP1基因的表达,诱导了EMT 和化疗耐药表型。因此,靶向miR-155-5p 可能是克服紫杉醇耐药胃癌的新策略[12]。
1.7 外泌体miRNA与吉西他滨耐药
胰腺癌是一种高度侵袭性致死肿瘤,5 年生存率很低。20多年来,吉西他滨(gemcitabine,GEM)一直是胰腺癌治疗的标准药物,但作为一种单一药物,GEM 并不能完全治愈胰腺癌,常需与其他药物进行联合治疗。Fang 等[13]证明了CAFs 对GEM具有内在的抗性,并且CAFs 通过分泌外泌体引起胰腺癌细胞对GEM的抗性。来自CAFs的外泌体miR-106b被邻近的癌细胞摄取,导致癌细胞中miR-106b 水平的增加,并且显著抑制肿瘤抑制基因TP53INP1的表达,促进胰腺癌细胞生存和GEM 耐药性。阻断外泌体分泌或抑制miR-106b 水平可以逆转化疗耐药性。因此,抑制CAFs衍生的外泌体miR-106b的转移可能是克服胰腺癌对GEM耐药性的有效策略。
1.8 外泌体miRNA与卡铂耐药
卡铂为基础的化疗是卵巢癌(ovarian cancer,OVCA)患者的标准治疗方案,单药或与紫杉醇联用均可。Alharbi等[14]研究了miRNA 在异质性卵巢癌细胞耐药及其衍生的外泌体中的作用,发现miR-21-3p、miR-21-5p和miR-891-5p在细胞中均可以促进OVCA 对卡铂的耐药;在机制上,miR-21-5p 通过激活糖酵解,增加ATP结合盒家族药物转运体ABCB6和谷胱甘肽合成酶GSHB 的表达,而miR-21-5p 和miR-891-5p 是通过参与DNA修复机制的蛋白的表达,如核仁素NUCL、XRCC5 和TPD53等。此外,他们发现这3 种microRNA 在外泌体中显著富集,OVCA经卡铂治疗后复发性患者的血浆外泌体miR-891-5p含量水平高于无复发患者,提示miR-891-5P 有可能成为卵巢癌患者的血浆标志物,作为OCVA对卡铂的耐药指标。
1.9 外泌体miRNA与甲氨蝶呤耐药
结肠癌(colon cancer,CC)是癌症相关死亡的第二大常见原因,是由肠上皮内的局部腺瘤引起的侵袭性恶性肿瘤,并可能转移到肝脏等器官。甲氨蝶呤(methotrexate,MTX)是一种具有高细胞毒性的叶酸类似物,目前包括MTX在内的联合疗法用于治疗多种肿瘤类型,包括乳腺癌、膀胱癌和头颈癌、成骨肉瘤和白血病。然而,MTX在大多数结肠癌中产生的耐药限制了治疗的有效性。miR-24-3p在许多癌症中被认为是化疗耐药的关键启动子[15-20]。最近一项研究发现结肠癌标志物CDX2是miR-24-3p 的下游靶基因,miR-24-3p 可以下调CDX2,CDX2又可以正调控膜铁转运辅助蛋白HEPH的表达,提高细胞活力和细胞克隆形成的能力,促进结肠癌细胞对甲氨蝶呤的耐药。此外,研究发现miR-24-3p 可以通过外泌体从CAFs 直接转移到结肠癌细胞中,导致结肠癌细胞中CDX2 和HEPH 的表达显著降低,促进了受体结肠癌细胞的耐药性[21]。
1.10 外泌体miRNA与R-CHOP耐药
弥漫大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是最常见的B细胞淋巴瘤亚型,R-CHOP是DLBCL患者的标准治疗方法,包括利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松。有研究发现与R-CHOP 应答性DLBCL 患者相比,低应答以及复发患者的外泌体浓度升高,并且外泌体内miR-155表达上调。然而,与应答性患者的血浆相比,低应答以及复发患者中未观察到miR-155的表达有显著差异,这提示外泌体内miR-155可能是比循环miR-155更有价值的生物标志物,同时提示miR-155的表达丰度对R-CHOP治疗反应不佳和不良预后有重要预测作用[22]。
2 外泌体lncRNA介导肿瘤细胞耐药
lncRNA 是长度超过200 个核苷酸的非蛋白编码RNA 转录本,根据lncRNA 在人类基因组中的位置和特征,可以将其分为5 类:顺义lncRNA、反义lncRNA、双向lncRNA、内含子lncRNA和基因间lncRNA。lncRNA对所有已知的细胞过程发挥多种类型的调节功能,包括与DNA、RNA或蛋白质相互作用形成复合物,调控靶基因的表达,越来越多的证据表明lncRNA在癌症发展中的作用,并通过多种机制与转移、复发、预后和化疗耐药密切相关。lncRNA 可以借助RNA 结合蛋白等进入外泌体,发挥生物学功能。核不均一核糖核蛋白hnRNPA2B1 是一种RNA结合蛋白,在mRNA的成熟、运输和代谢以及长链非编码RNA 的基因调控等许多生物学过程中发挥重要作用。hnRNPA2B1 能结合lncRNA 5′端特异种子序列(GGAG)参与lncRNA 包埋进外泌体[23]。目前研究显示,lncRNA AGAP2-AS1、lncRNA LNMAT2、lncRNA H19 都是 5′端序列通过与hnRNPA2B1结合进入到外泌体中[24]。目前报道的外泌体lncRNA参与介导的肿瘤化疗耐药与microRNA 一样也是主要见于细胞毒类药物,比如作用于DNA化学结构的顺铂、奥沙利铂、替莫唑胺,影响核酸形成的5-FU以及作用于核酸转录的阿霉素等。
2.1 外泌体lncRNA与奥沙利铂耐药
Ren 等[25]在体外和体内实验中发现lncRNA H19 可以增强CRC 细胞的干细胞性和奥沙利铂耐药性,CAFs 的H19 表达水平明显高于NFs,并且CAFs可以将lncRNA H19转移到邻近的CRC 细胞,此外,CAFs 通过分泌含H19 的外泌体激活CRC 细胞的Wnt/β-catenin 信号通路促进CRC 细胞的干细胞性,导致了CRC细胞对奥沙利铂的耐药性。Hui等[26]研究表明,PGM5反义lncRNA 1(PGM5-AS1)在结肠癌中的低表达是由转录抑制剂GFI1B 诱导的,PGM5-AS1 可抑制结肠癌细胞的增殖、迁移和获得性奥沙利铂耐受,其机制一是PGM5-AS1通过招募SRSF3激活可变剪接,下调PAEP 表达,二是PGM5-AS1 也可以通过对hsa-miR-423-5p发挥海绵吸附功能上调NME1的表达。外泌体越来越多地用于药物或功能性核酸的传递,从而提高了癌症治疗的有效性,他们发现利用外泌体包裹奥沙利铂给药并同时包裹PGM5-AS1可逆转受体细胞耐药性。
2.2 外泌体lncRNA与替莫唑胺耐药
GBM几乎对目前所有的治疗方案都产生耐药性,包括化疗药物替莫唑胺、顺铂、依托泊苷等。Li等[27]发现外泌体传递的lnc-TALC 可以重塑GBM 微环境并促进GBM 对TMZ 的耐药。lnc-TALC 可以进入外泌体并传递到肿瘤相关巨噬细胞(tumor-associated macrophages,TAM),促进小胶质细胞的M2极化。这种M2 极化与补体成分C5/C5a 的分泌有关,在lnc-TALC 的下游,补体与ENO1结合,促进p38 MAPK 的磷酸化。此外,C5 促进了TMZ 诱导的DNA 损伤的修复,导致化疗耐药,靶向C5a的免疫治疗或许可以逆转lnc-TALC介导的TMZ耐药。这表明lnc-talc 介导的GBM 细胞与小胶质细胞之间的交叉性可以减弱化疗疗效,并为克服GBM 中TMZ 耐药性提供了潜在的联合治疗策略。Zhang等[28]研究发现SBF2-AS1在TMZ耐药GBM细胞和组织中表达上调,过表达SBF2-AS1可促进GBM细胞对TMZ的耐药,抑制SBF2-AS1可使GBM耐药细胞对TMZ敏感。研究发现,转录因子ZEB1直接与SBF2-AS1启动子区结合,调控SBF2-AS1 水平,并影响GBM 细胞TMZ 耐药。SBF2-AS1 作为miR-151a-3p 的ceRNA,导致其内源性靶点X射线修复交叉互补4(XRCC4)的抑制解除,从而增强GBM 细胞中DSB 的修复。替莫唑胺耐药GBM 细胞的外泌体具有高水平的SBF2-AS1,并传播对化学敏感性的GBM细胞传播TMZ耐药性。临床上,血清外泌体中lncSBF2-AS1的高水平与GBM患者对TMZ 治疗的不良反应有关。总的来说,GBM 细胞通过分泌富含lncSBF2-AS1的外泌体重塑肿瘤微环境,促进肿瘤化疗耐药性。因此,人血清中的外泌体lncSBF2-AS1可能作为治疗难治性GBM的一个潜在的诊断标志物。
2.3 外泌体lncRNA与5-FU耐药
在Mao 等[29]的研究中测定了来自肺癌细胞的富含FOXD3-AS1的外泌体对肺癌细胞增殖、侵袭和5-FU耐药的影响。在线生物信息学数据库分析显示FOXD3-AS1 在肺癌进展中表达上调。实时荧光定量PCR 结果证实FOXD3-AS1 在肺癌组织和细胞系中表达上调,并且FOXD3-AS1 在肺癌细胞来源的外泌体中大量富集。此外,FOXD3-AS1与ELAVL1蛋白可以互相结合并上调其表达,肺癌细胞来源的外泌体可以促进A549细胞的增殖和侵袭,抑制5-FU 引起的凋亡,在外泌体培养的A549细胞中转染si-FOXD3-AS1或si-ELAVL1可以逆转这些作用。机制研究发现,肺癌细胞来源的外泌体激活PI3K/Akt 通路,转染si-FOXD3-AS1 或使用PI3K 抑制剂LY294002 处理可逆转外泌体诱导的PI3K/Akt轴的激活。总之,他们的研究揭示了肺癌细胞来源的外泌体FOXD3-AS1 上调ELAVL1 的表达并激活PI3K/Akt 通路促进肺癌进展以及对于5-FU 的耐药性,为肺癌的治疗提供了一种新的策略。
2.4 外泌体lncRNA与阿霉素耐药
H19不仅可以调控结直肠癌对奥沙利铂的耐药性,也被报道可以参与乳腺癌细胞对阿霉素的耐药性。乳腺癌是女性最常见的恶性肿瘤。手术切除、放射治疗和化疗已被确立为乳腺癌患者的三种主要治疗方式。阿霉素已被广泛接受为治疗乳腺癌的一线药物,然而,耐药性的迅速发展从本质上削弱了抗癌药物的疗效。Wang等[30]发现与相应的亲本细胞相比,阿霉素耐药乳腺癌细胞中H19 表达增加。抑制H19 可通过降低细胞活力、降低集落形成能力和诱导细胞凋亡,从而显著降低DOX 耐药性。此外,细胞外的H19 可以通过进入外泌体转移到敏感细胞,用来自耐药细胞的外泌体处理敏感细胞增加了DOX的耐药性。他们的研究发现H19可以通过外泌体传递到敏感细胞,导致DOX耐药性的传递,强调了外泌体H19作为分子治疗靶点降低DOX耐药性的潜力。
2.5 外泌体lncRNA与顺铂耐药
Xin 等[31]发现LncRNA CRNDE 在胃癌患者的癌组织和肿瘤相关巨噬细胞中上调。体外实验表明,CRNDE富集于M2极化的巨噬细胞来源的外泌体(M2-exo),并通过外泌体从M2巨噬细胞转移到GC 细胞。沉默M2-exo 中的CRNDE 可以逆转M2-exo对顺铂处理的GC细胞增殖和CDDP处理的裸鼠同种移植瘤生长的促进作用。机制上,CRNDE 促进神经前体细胞表达发育下调蛋白4-1(NEDD4-1)介导的磷酸酶和紧张素同源物(PTEN)泛素化。沉默M2-exo 中的CRNDE 可以增强M2-exo 处理的GC 细胞对顺铂的敏感性,而PTEN 敲除则降低了这种敏感性。综上所述,这些数据揭示了CRNDE在GC细胞顺铂耐药中的重要作用,并提示CRNDE在GC细胞中的上调可能归因于TAM来源的外泌体的转移。
3 外泌体circRNA介导肿瘤细胞耐药
circRNAs是一类非编码的长链环形RNA分子,在真核转录组中具有高度的组织特异性表达,无5′-3′极性,也不包含polyA 尾巴,不易被RNA 外切酶或RNase R 降解,具有相对稳定的闭合环状框架。环状RNA主要由外显子组成,这些外显子主要存在于细胞质中,并可能具有microRNA 反应元件,它们通过与microRNA 或其他分子结合,在转录或转录后水平介导基因表达[32]。Li等[33]首次证明了外泌体中存在大量circRNA,发现血清外circRNA 可以区分癌症患者和健康对照者,并具有作为癌症诊断的循环生物标志物的潜力。外泌体circRNA 的组成可能受供体细胞中相关miRNA水平的变化所调节,随后这种分子信息被转移到受体细胞,从而引发功能性反应,并诱导一系列表型变化,甚至调节器官功能。研究发现一些环状RNA可以在血清、尿液和肿瘤来源的外泌体中检测到,并参与细胞生长、血管生成、肿瘤耐药、EMT和靶向治疗的过程[34]。
3.1 外泌体circRNA参与顺铂耐药
上皮性卵巢癌(epithelial ovarian cancer,EOC)是女性癌症死亡的主要原因之一,也是最致命的妇科癌症。EOC通常在晚期被诊断,此时肿瘤已遍布腹腔,耽误了减瘤手术的最佳时机。EOC是最具化学反应性的肿瘤之一,对顺铂和卡铂的治疗均有良好的反应[35]。Luo 等[36]研究发现在EOC 患者中,尤其是在顺铂耐药的上皮性卵巢癌患者中,血清循环型外泌体circFoxp1 表达量显著增加。circFoxp1 通过miR-22 和miR-150-3p正向调节CEBPG和FMNL3的表达,在EOC细胞中产生顺铂抗性。
3.2 外泌体circRNA参与奥沙利铂耐药
除了外泌体miRNA影响了胃癌对奥沙利铂的耐药性,外泌体circRNA参与奥沙利铂耐药也有报道。Zhong等[37]研究揭示了胃癌细胞circ_0032821 通过充当SOX9 的内源竞争RNA(competing endogenous RNAs,ceRNA)来海绵吸附 miR-515-5p,增强SOX9 的表达,从而增强胃癌细胞对奥沙利铂的抗性,并且验证了来自奥沙利铂抗性胃癌细胞的外泌体可以通过转移circ_0032821而赋予敏感胃癌细胞奥沙利铂抗性。
3.3 外泌体circRNA参与硼替佐米耐药
多发性骨髓瘤(multiple myeloma,MM)通常被认为是不可治愈的,但在过去15年患者总生存率有显著改善。硼替佐米是一种新型蛋白酶体抑制剂,可以通过调节bcl-2、caspase-9 和caspase-3诱导多发性骨髓瘤细胞死亡,而骨髓间充质干细胞衍生的外泌体抑制硼替佐米的功能,导致骨髓瘤细胞产生耐药性。Luo等[38]发现耐药患者循环外泌体中circMYC的表达明显高于非耐药患者,并且恶性血液病患者的循环环状circMYC 表达上调,与硼替佐米反应和复发相关,表明外泌体circMYC 作为恶性血液病诊断和预后的生物标志物具有很大的潜力。
3.4 外泌体circRNA参与阿霉素耐药
骨肉瘤(osteosarcoma,OS)是儿童和青少年最常见的原发性骨癌,在成人中第三常见,目前骨肉瘤的治疗方案是手术和基于阿霉素的化疗。Zhu等[39]发现circPVT1在OS细胞系中相对于hFOB 1.19表达上调,尤其是在多药耐药OS细胞系中表达显著升高,敲除circPVT1 的表达可以部分逆转OS 细胞对阿霉素和顺铂的耐药性,circPVT1表达升高与晚期骨肉瘤、化疗耐药和肺转移明显相关。此外,K-M生存分析表明,高表达circPVT1的患者比低表达circPVT1 的患者有更短的总生存期。circPVT1可能作为相关miRNA海绵促进ABCB1的表达,circPVT1基因敲低可以通过降低ABCB1的表达。多药耐药相关基因ABCB1(MDR1)的高表达可通过P-gp 蛋白泵出细胞内药物,促进化疗耐药[40]。因此,circPVT1 在组织和血清中表达上调,与不良预后相关,是良好的诊断OS的生物标志物。
综上所述,在不同的化疗药物作用下,在不同肿瘤背景中,miRNA、lncRNA以及circRNA等ncRNA在细胞或组织外泌体中表达上调,通过作用于下游分子靶标,直接或间接调控靶基因表达,影响了细胞耐药性,将目前报道的部分肿瘤化疗耐药相关外泌体ncRNA 及其表达情况和作用机制总结为表1。在肿瘤耐药细胞中,一些ncRNA 的转录水平升高,表达量上调,这些ncRNA 被外泌体包裹,之后通过胞吐作用分泌到细胞外,又被受体细胞摄取。进入受体细胞后,它们可以通过激活PI3K/Akt通路,导致血管生成和EMT促进细胞耐药;也可以通过激活糖酵解和增加DNA修复途径促进耐药;或者抑制凋亡途径的执行分子bax 和caspase-3/-9 等促进癌细胞的存活,促进细胞耐药;又或者通过直接促进耐药相关基因的表达,激活转运蛋白将药物泵出细胞外,导致细胞耐药。我们将耐药细胞的外泌体ncRNA促进敏感细胞的耐药性的部分机制总结成图1。
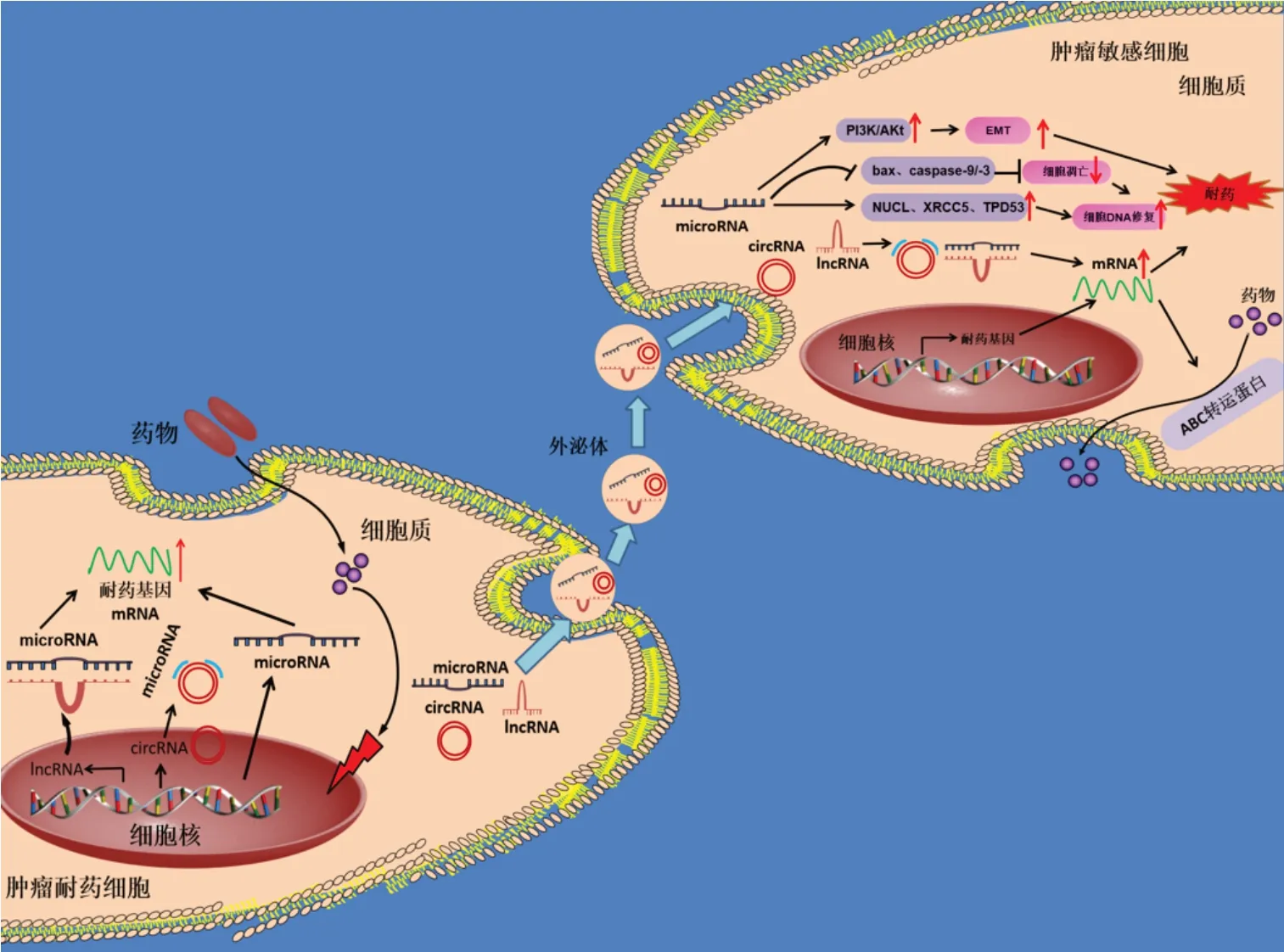
图1 耐药细胞的外泌体运送ncRNA促进敏感细胞的耐药性

表1 肿瘤化疗耐药相关外泌体ncRNA及其表达情况和作用靶点
4 结论与展望
几乎所有体液中都有外泌体,越来越多的证据表明,外泌体在肿瘤发生、转移和耐药中发挥关键作用。外泌体的分泌是一种结构性现象,涉及生理和病理过程,其释放受到一些Rab家族蛋白的调控,包括Rab27a 和Rab27b。外泌体通过供体细胞的胞吐作用,被靶细胞摄取,可以在局部和远端细胞间传递生物信号。目前,我们可以利用外泌体作为生物标志物、疫苗和药物载体,并对它们进行合理的修饰进行治疗干预。外泌体的变化和外泌体内容物的异常表达可以反映机体的病理状态,很多研究已经表明外泌体和外泌体内容物可以作为新型的癌症生物标志物。此外,外泌体ncRNA在肿瘤耐药中的作用也已逐渐被揭示。外泌体作为天然载体,能够携带和转移参与耐药的ncRNA和蛋白质。本文综述了外泌体ncRNA在增加肿瘤药物外排、改变药物靶点、激活信号通路和调节EMT 中的生物学功能,还讨论了外泌体ncRNA 作为生物标志物的潜在治疗价值。在不同的癌症中,ncRNA 通过不同的途径来调节肿瘤耐药性。但是到目前为止,外泌体ncRNA与肿瘤耐药的研究主要停留在体外水平,并未有临床病例的相关研究报道,将细胞水平的实验结果转化为临床试验仍然是最困难的挑战。一方面,使用外泌体治疗的前景主要包括控制细胞外信息的交换和药物的靶向递送,仍然需要做更多更深入的研究来揭示外泌体ncRNA分泌和传递的具体机制;另一方面,外泌体的输送效率也需要进一步提高。随着外泌体ncRNA 调控各种肿瘤耐药机制研究的深入,我们相信未来将在肿瘤预后判断、肿瘤治疗监测和靶向治疗等方面取得令人满意的进展。

