基于高通量测序技术分析南方清香型白酒大曲的微生物多样性
凌 荔,方尚玲,牟飞燕,董孝元,陈茂彬,李 良
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068;2.黄鹤楼酒业有限公司,湖北武汉 430068)
白酒作为中国古老且具有特色的酒类之一而闻名于世界,是以粮食谷物为原料,以大曲、小曲或麸曲及酒母等为糖化发酵剂,经蒸煮、糖化、发酵、蒸馏而制成的蒸馏酒。中国白酒可以分为清香型白酒、浓香型白酒、酱香型白酒和米香型白酒4 个基本香型,在此基础上出现了芝麻香型、凤香型、兼香型、馫香型等多种衍生香型白酒。清香型白酒所用的酒曲为中低温酒曲,是以大麦与豌豆为主要原料,制曲温度为45~50 ℃,适合各类微生物生长繁殖,许多微生物的发酵代谢产物酸类、醛类、酯类等影响酒质及风味。
酒曲的分析一直在进步,对于酒曲微生物组成不再局限于传统筛选分离,近年来高通量测序技术(HTS)作为新一代测序方法可以一次性对几百万到十几亿的DNA 分子进行分析和测序,对复杂菌种样品进行深度测序,其通量高、成本低、准确率高。雷振河[1]应用高通量测序技术对清香型白酒酿造用的大曲和酒醅进行分析,大曲中的优势原核微生物有厚壁菌门、变形菌门、放线菌门、酸杆菌门,优势真核微生物有曲霉菌属、热子囊菌属、根霉菌属、嗜热真菌属、假丝酵母;罗爱国等[2]利用高通量测序技术对清香型白酒酒糟中微生物进行研究,从门与属水平分别找出了细菌和真菌的优势菌属。
大曲中的微生物群受制曲自然环境条件影响很大,南北方清香型白酒大曲由于气候、温度、湿度等的差别,为清香型白酒大曲带来了特殊的微生物群,进而有不同的发酵代谢产物,使南北方清香型白酒在风味上有很大差别。本研究分析了清香白酒大曲中的特色微生物,对发酵过程中的各类功能菌进行深入挖掘,旨在为后续优质清香型白酒大曲复配提供一定的研究基础。
1 材料与方法
1.1 材料、试剂及仪器
材料:清香白酒型大曲,采自湖北某酒厂与山西某酒厂;中高温及高温大曲,采自湖北某酒厂。本实验用曲均为成品曲。
试剂及耗材:FastDNA® Spin Kit for Soil(DNA 抽提试剂盒);NEXTFLEX Rapid DNA-Seq Kit(建库试剂盒);MiSeq Reagent Kit(测序试剂盒)。
仪器设备:高速台式冷冻离心机,德国,Eppendorf 公司;超微量分光光度计,美国,Thermo Fisher Scientific 公司;酶标仪,美国,Biotek 公司;粉碎研磨仪,中国,上海万柏生物科技有限公司;微型荧光计,美国,Promega 公司;电泳仪,中国,北京市六一仪器厂;PCR仪,美国,ABI公司。
1.2 实验方法
1.2.1 样品处理及标记
将全国各酒厂收集用于实际酿酒的成品曲块用粉碎机粉碎成小块,湖北清香曲标记为QX1,山西清香曲标记为QX2,中高温曲标记为ZGW,高温曲标记为GW,每个样品取3 个重复,放入-80 ℃超低温冰箱中保藏以待用。
1.2.2 检测分析
用FastDNA® Spin Kit for Soil 试剂盒提取总DNA,使用1 %琼脂糖凝胶电泳检测,进行PCR 产物纯化、鉴定及定量,送上海美吉生物医药科技有限公司,进行ITS1区、16S rDNA高通量测序。利用Illumina 公 司 的Miseq PE300/NovaSeq PE250 平 台进行测序,使用fastp[3](https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使 用FLASH[4](http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件进行拼接。
2 结果与分析
2.1 不同温度大曲微生物多样性
2.1.1 细菌多样性分析
使用UPARSE 软件[5](http://drive5.com/uparse/,version 7.1),根据97 %[5-6]的相似度对序列进行OTU 聚类,选出与OTU 代表序列相似性在97%以上的序列,生成OTU表格。
经分析清香型大曲样品共得到60718 条有效序列,通过聚类得到236 个OTU;中高温大曲样品共得到75628 条有效序列,通过聚类得到181 个OTU;高温大曲样品共得到57719 条有效序列,通过聚类得到120 个OTU。物种分布如图1 不同温度大曲样细菌Venn图所示。由图1可知,清香型大曲样品特有OTU 为171 个,中高温大曲样品特有OTU 为84 个,高温大曲样品特有OTU 为38 个,共有OTU 为40 个。根据两不同大曲样品共有OTU数量比较可知中高温大曲与高温大曲相近程度更高。
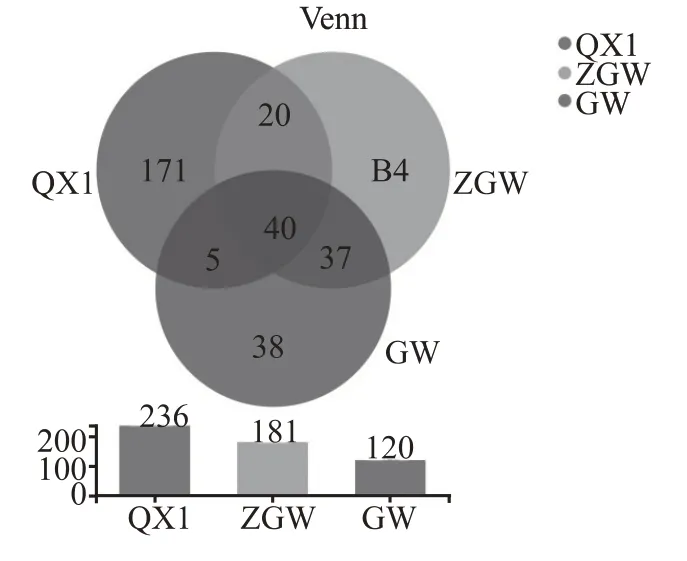
图1 不同温度大曲样细菌Venn图
Alpha 多样性是指一个特定区域或生态系统内的多样性,是反映丰富度和均匀度的综合指标。群落丰富度(Community richness)的指数主要包括Chao 指数和ACE 指数。Chao 指数在生态学中常用来估计物种总数,指数越大,表明群落的丰富度越高;ACE 指数是用来估计群落中含有OTU 数目的指数群落多样性,ACE 指数越大,表明群落的丰富度越高。群落多样性(Community diversity)的指数包括Shannon 指数和Simpson 指数。Shannon 指数表示群落的丰富度和均匀度,Shannon 指数值越高,表明群落的多样性越高;Simpson指数用来估算样品中微生物的多样性,Simpson 指数值越大,说明群落多样性越低。还有测序深度指数Observed spieces 代表OTUs 的直观数量统计,coverage 指数表示计算加入丰度为1 的OTUs 数目,加入低丰度影响。不同温度大曲细菌Alpha 多样性结果见表1。由表1 可知,清香型大曲细菌物种多样性和物种丰富度均为最高,其次是中高温大曲,高温大曲相对来说最低。
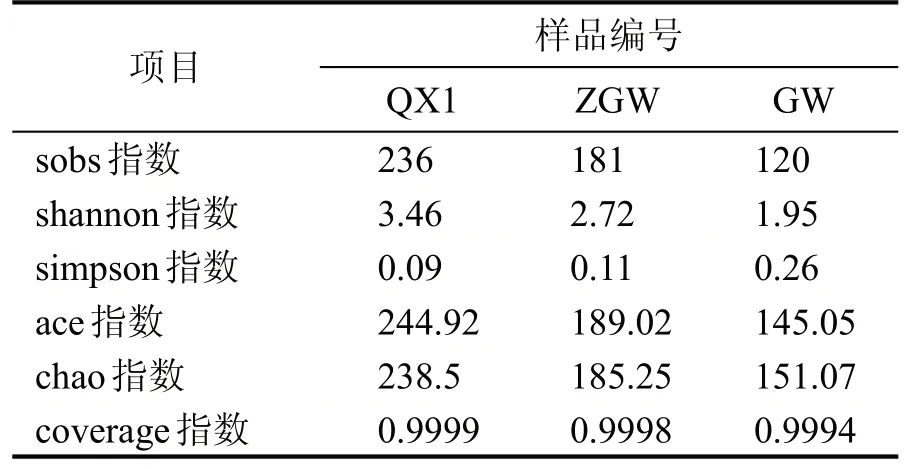
表1 不同温度大曲样细菌Alpha多样性指数表
2.1.2 细菌群落结构差异性分析
在门水平上分析不同温度大曲样品细菌群落结构差异,在图2 微生物群落柱形图中,将排前23的菌门进行对比,其余归于others。由图2(a)可知,清香型白酒大曲的优势菌门为厚壁菌门(Firmicutes)与变形菌门(Proteobacteria),中高温大曲的优势菌门为厚壁菌门(Firmicutes),放线菌门(Actinobacteriota)较清香型白酒大曲多,高温大曲的优势菌门为放线菌门(Actinobacteriota) 。这与大曲制作工艺温度有关,随着制曲温度升高,杆菌数量明显减少,高温放线菌占据优势,发酵产生吡嗪类物质、酚类物质等,使酱香型大曲有豆豉味、焦香味等特殊风味。
在属水平上分析不同温度大曲样品细菌群落结构差异,共鉴定出50 个属类细菌。Heatmap(热图)可以用颜色变化反映二维矩阵或表格中的数据信息,可将高丰度和低丰度的物种分块聚集,通过颜色梯度及相似程度反映多个样品在各分类水平上群落组成的相似性和差异性。曲样heatmap(热图)如图2(b)所示,红色色块越深表示该属类细菌数量越多,蓝色则相反。由图2 可知,清香型白酒大曲微生物群落丰富度明显高于中高温大曲和高温大曲,根据微生物群落多样性聚类分析,清香型白酒大曲与中高温大曲相似度更高。清香型白酒大曲以芽孢杆菌属(Bacillus)为优势菌群,其次以魏斯氏菌属(Weissella)、片球菌属(Pediococcus)及其他乳酸菌(Lactobacillus)为主要菌群;中高温大曲以魏斯氏菌属(Weissella)为优势菌群,其次以葡萄球菌(Staphylococcus)、其他乳酸菌(Lactobacillus)、假单胞菌属(Pseudomonas)为主要菌群;高温大曲以糖多胞菌属(Saccharopolyspora)为优势菌群,其次以假诺卡氏菌科(Pseudonocardiaceae)、高温放线菌属(Kroppenstedtia)、葡萄球菌(Staphylococcus)为主要菌群。

图2 不同香型大曲样细菌群落分析图
在传统制曲过程中,由于生产工艺、生产条件的不同,大曲中微生物菌群有很大不同。温度在30 ℃左右,适合大部分中温微生物生长,制曲温度达到55~60 ℃时,大部分无芽孢菌类被淘汰,此时的细菌以芽孢杆菌类如地衣型芽孢杆菌、嗜热芽孢杆菌、枯草芽孢杆菌等与糖高温放线菌、双栖高温放线菌等高温放线菌构成主要的微生物群。大曲在制曲过程中都会有微生物群落变化,与环境、水分、温度、pH值等因素息息相关。
2.1.3 真菌多样性分析
对所有样品进行有效序列97%的一致性OTU聚类分析,ITS1区高通量测序结果经过滤和有效拼接后,清香型大曲样品共得到60718 条有效序列,聚类得到30 个OTU,中高温大曲样品共得到75628条有效序列,聚类得到69 个OTU,高温大曲样品共得到57719条有效序列,聚类得到29个OTU。物种分布如图3 所示。由图3 可知,清香型大曲样品特有OTU 为15 个,中高温大曲样品特有OTU 为39个,高温大曲样品特有OTU 为5 个,共有OTU 为9个。从两不同大曲样品共有OTU 数量比较可知中高温大曲与高温大曲相近程度更高。根据表2 真菌Alpha 多样性指数表可看出清香型白酒大曲的真菌群落多样性最高,中高温大曲的真菌群落丰富度最高。
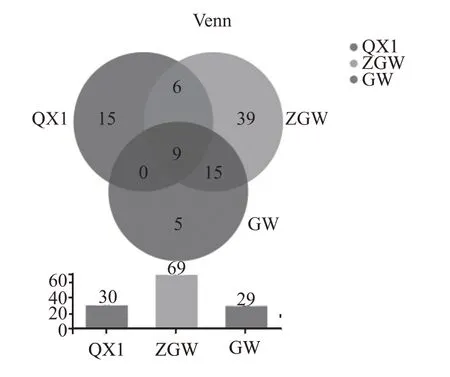
图3 不同香型大曲样真菌Venn图
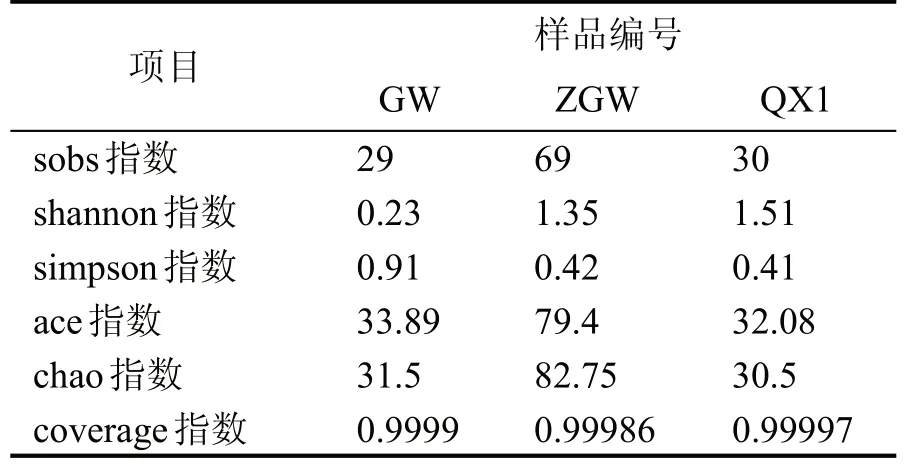
表2 不同香型大曲样真菌Alpha多样性指数表
2.1.4 真菌群落结构差异性分析
在纲水平上分析不同温度大曲样品真菌群落结构差异,Circos 图中可反映每个(或组)样本中优势物种分布比例,以及各优势物种在不同样本(分组)中分布比例。小半圆(左半圈)表示样本中物种组成情况,外层彩带的颜色代表分组来源,内层彩带的颜色代表物种,长度代表该物种在对应样本中的相对丰度;大半圆(右半圈)表示该分类学水平下物种在不同样本中的分布比例情况,外层彩带代表物种,内层彩带颜色代表不同分组,长度代表该样本在某一物种中的分布比例。由图4(a)可知,高温大曲与中高温大曲的优势菌种为散囊菌纲(Eurotiomycetes),清香型白酒大曲的优势菌种为酵母纲(Saccharomycetes),中高温大曲仅占约15 %酵母纲。

图4 不同香型大曲样真菌群落分析图
在属水平上分析不同温度大曲样品真菌群落结构差异,由图4(b)可知,中高温大曲与高温大曲的优势菌种均为嗜热霉菌属(Thermomyces),中高温大曲中曲霉属(Aspergillus)也为主要菌群,清香型白酒大曲的优势菌种为覆膜孢酵母属(Saccharomycopsis),群落多样性明显高于中高温大曲和高温大曲。清香型白酒大曲中酵母包括覆膜孢酵母属(Saccharomycopsis)、伊萨酵母属(Issatchenkia)、异常威克汉姆酵母(Wickerhamomyces)等。酵母在生产中起到产酯、生香、发酵的作用,根据制曲顶温的控制要求,培菌温度越低,酵母数量越多。
2.2 南北方清香型白酒大曲微生物多样性
2.2.1 细菌多样性分析
对所有样品进行有效序列97%的一致性OTU聚类分析,16s rRNA V4 区高通量测序结果经过滤和有效拼接后,南方清香型大曲样品共得到60718条有效序列,聚类得到236 个OTU,北方清香型大曲样品共得到48612 条有效序列,聚类得到326 个OTU。物种分布如图5 所示,南方清香型大曲样品特有OTU 为112 个,北方清香型大曲样品特有OTU 为202 个,共有的OTU 为124 个。由表3 南北方清香型白酒大曲样细菌Alpha 多样性指数表可知,QX1 较QX2 细菌群落丰富度低,群落多样性高。

图5 南北方清香型白酒大曲样细菌Venn图
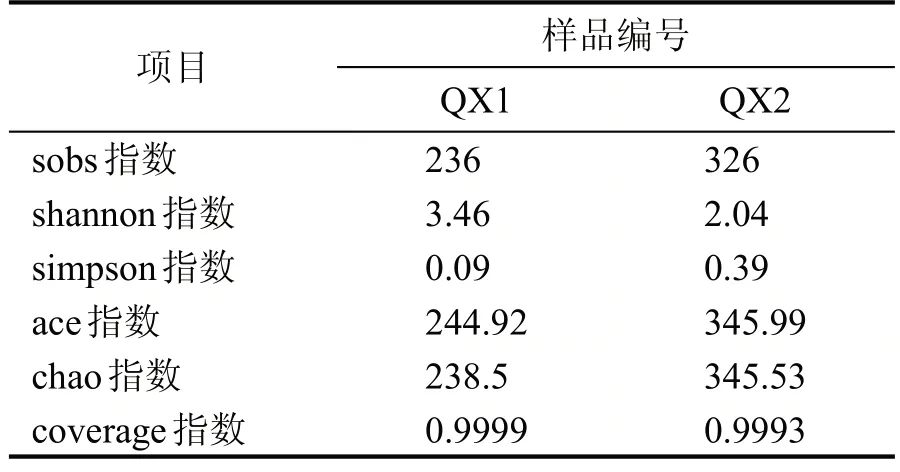
表3 南北方清香型白酒大曲样细菌Alpha多样性指数表
2.2.2 细菌群落结构差异性分析
在属水平上分析南北方清香型白酒大曲样品细菌群落结构差异,图6(a)中明显颜色对比可验证QX1 中群落均匀度高于QX2,但群落丰富度低;由图6(b)可知,QX1 与QX2 的优势菌种均为芽孢杆菌属,QX1 中乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)等乳酸菌较QX2更丰富,QX1 中的高温放线菌属(Kroppenstedtia)也明显占比较大。

图6 南北方清香型白酒大曲细菌分析图
周森等[7]通过对比11 种清香型白酒大曲微生物的组成,结果显示不同大曲细菌优势菌群为乳酸菌或芽孢杆菌且无规律性。乳酸菌属于非芽孢杆菌,乳酸与酒精酯化后生成乳酸乙酯,具有独特香味,但过量会使酒体呈现涩味,并使曲块生化能力下降,曲坯酸败。乳酸菌可将己糖转化为乳糖、酒精和CO2,也可将果糖发酵成甘露醇,但有些乳酸菌分解成丁酸,会导致酒臭。大曲中乳酸菌的产生是在制曲高温转化时,乳酸菌作用于己糖同化成乳酸,当顶点品温不足,热曲时间不足时,乳酸菌会大量生成。清香型白酒大曲中乳酸菌与芽孢杆菌占比对成品酒质量高低影响很大。
2.2.3 真菌多样性分析
对所有样品进行有效序列97%的一致性OTU聚类分析,ITS1区高通量测序结果经过滤和有效拼接后,南方大曲样品共得到60718 条有效序列,聚类得到30个OTU,北方大曲样品共得到48612条有效序列,聚类得到56 个OTU。根据图7 南北方大曲样真菌Venn 图可知南方清香型大曲样品特有OTU 为13 个,北方清香型大曲样品特有OTU 为39个,共有的OTU 为17 个。由表4 南北方清香型白酒大曲样真菌Alpha 多样性指数表可知QX2 真菌群落丰富度与多样性均大于QX1。
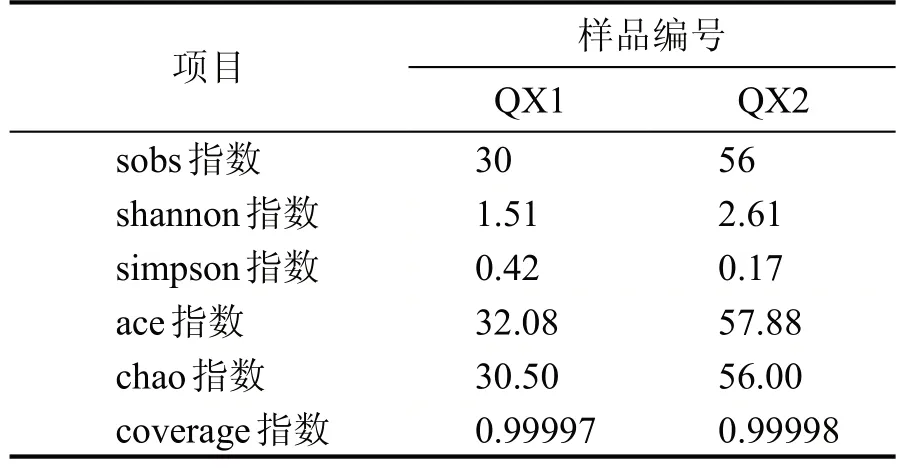
表4 南北方清香型白酒大曲样真菌Alpha多样性指数表
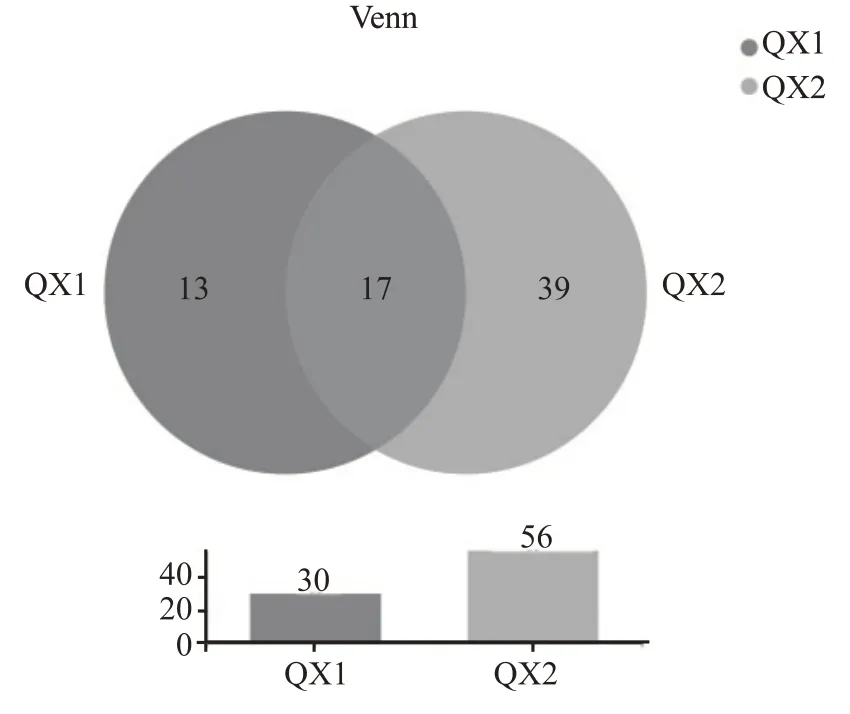
图7 南北方清香型白酒大曲样真菌Venn图
2.2.4 真菌群落结构差异性分析
由图8 可知,在属水平上分析南北方清香型白酒大曲样品真菌群落结构差异,QX1 与QX2 的优势菌种均为酵母属,QX2 群落丰富度高于QX1,但南方清香型白酒大曲中酵母属除了优势菌种覆膜孢酵母属(Saccharomycopsis)外,还包括弯曲假丝酵母(Apiotrichum)、伊萨酵母属(Issatchenkia)、异常威克汉姆酵母属(Wickerhamomyces)等,霉菌中曲霉属(Aspergillus)占比最多;北方清香型白酒大曲中酵母属主要包括覆膜孢酵母属(Saccharomycopsis)和弯曲假丝酵母(Apiotrichum),霉菌种类较QX1 多,包括曲霉属(Aspergillus)、被孢霉属(Mortierella)、枝孢属(Cladosporium)、赤霉菌属(Gibberella)等。
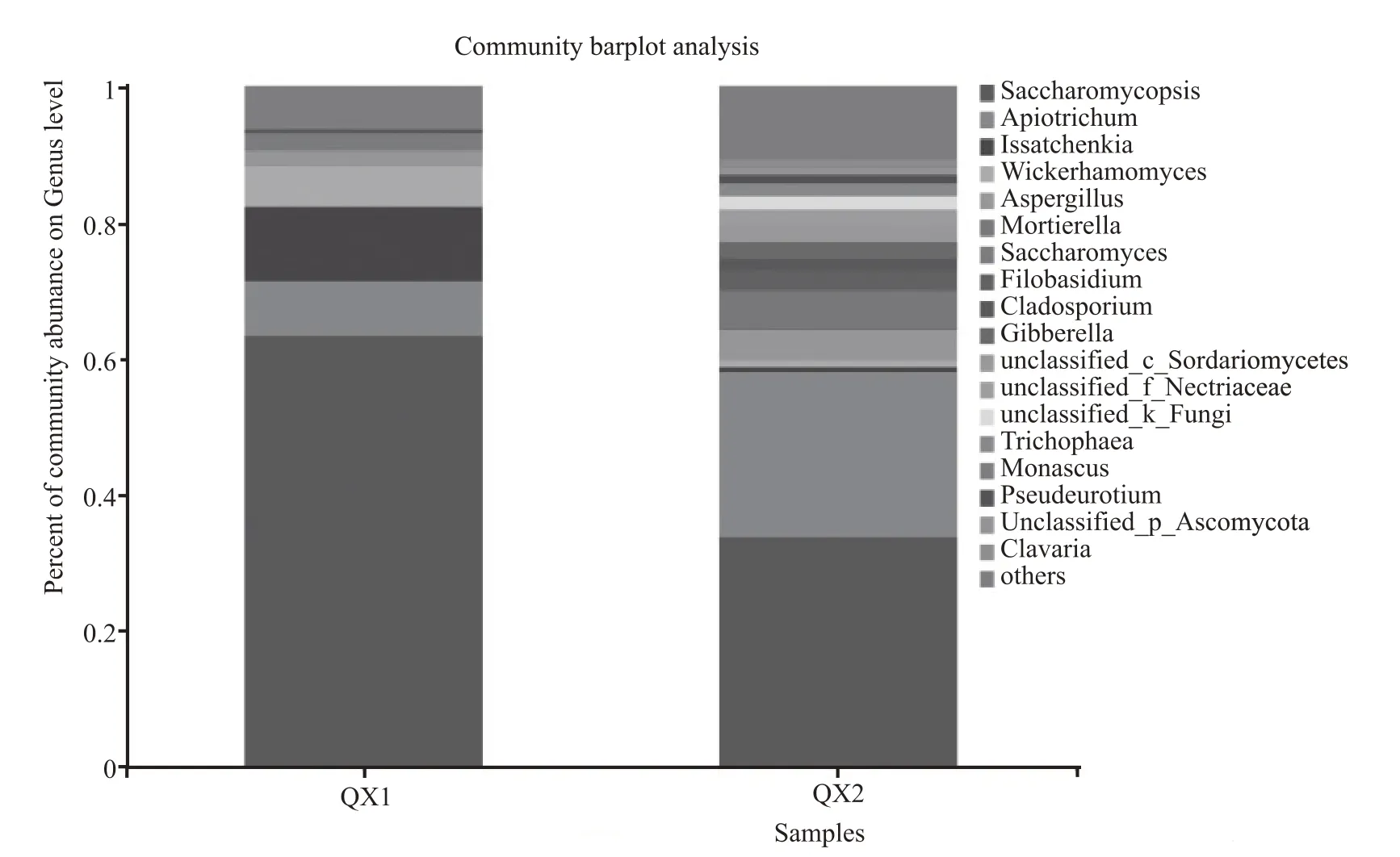
图8 南北方清香型白酒大曲样品真菌柱形图(属水平)
南北方清香型大曲高通量测序结果表明南方清香型白酒大曲细菌群落丰富度高于北方清香型白酒大曲,真菌群落丰富度则相反。气候条件是影响物种丰富度的重要因素,南方空气湿润,有利于微生物繁殖活动,北方地形复杂、起伏大,生物种类丰富。真菌的细胞大小通常比原核生物大,一些真菌甚至可以形成多细胞结构并附着在环境介质上,导致真菌的传播能力通常弱于原核生物,但真菌对环境变化的适应性和抵抗力通常比原核生物强,因此北方清香型白酒大曲中真菌群落丰富度高于南方清香型白酒大曲。
2.3 南北方清香型白酒酒质分析
对南北方清香型白酒进行气质分析,对风味物质成分进行GC-MS 分离定性分析,由于色谱柱填料主要成分为硅氧烷,剔除检测结果中含有硅氧烷成分的物质以及匹配度小于70 的物质后,南方清香型白酒共鉴定出52 种挥发性风味物质,包括酸类物质3 种,醇类物质6 种,酯类物质24 种,醛类物质3 种,芳香族化合物7 种,酚类4 种,其他物质5种;北方清香型白酒共鉴定出49 种挥发性风味物质,包括酸类物质3 种,醇类物质8 种,酯类物质17种,醛类物质2 种,芳香族化合物9 种,酚类2 种,其他物质3 种。白酒中主要风味呈现物质结果见表5,南方清香型白酒中酯类相对含量最高的是乙酸乙酯,有苹果和香蕉的生果香气,较北方清香型白酒高约0.25 g/L,能促进酒体放香呈味,清香型白酒中另一个主体香味成分乳酸乙酯,与北方清香型白酒相差无几,适当时使酒体微带甜香,味醇、稠密、净,含量过高则会有生涩感,起到压香的反作用;醇类中异戊醇较北方清香型白酒低约0.27 g/L,作为白酒中典型的高级醇,适量可为白酒增大香度,浓甜顺口,过量则使酒刺激感变大,甚至带有涩臭;正丙醇较北方清香型白酒高约0.14 g/L,似酒精气味,香气清雅,在白酒中没有苦涩的气味,有浓厚陈酿风味,南方清香型白酒中特有的浓陈味,使酒体多了一丝厚重。
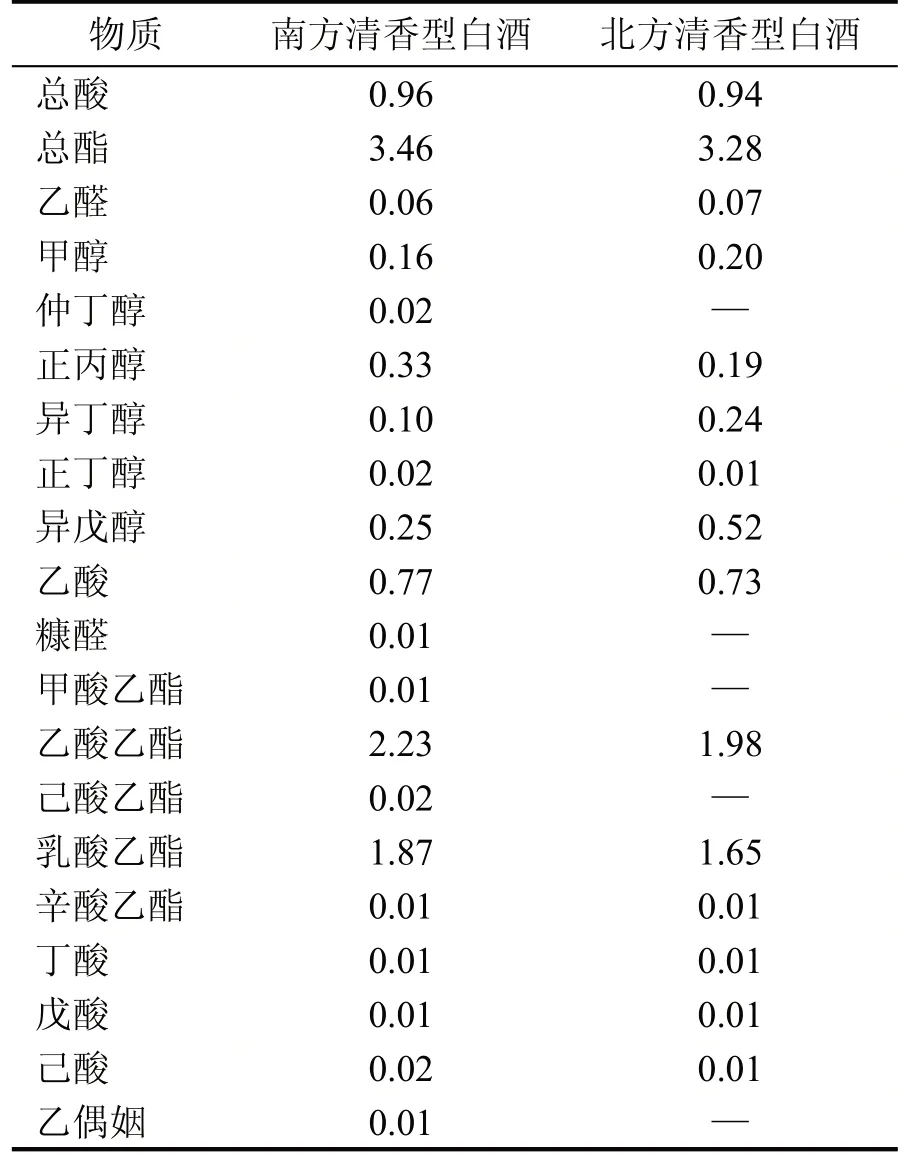
表5 南北清香型白酒风味组成分析(g/L)
清香型白酒特点为清香醇正,入口绵甜,尾净,酒体协调。在酒体酯类化合物中乙酸乙酯和乳酸乙酯是人们长久以来关注的重点,由上述结果可知,南方清香型白酒的乙酸乙酯∶乳酸乙酯约为1∶0.84;北方清香型白酒的乙酸乙酯∶乳酸乙酯约为1∶0.83。南北方清香型白酒酒质分析结果表明,乳酸菌的种群数量对酒体风味影响较大,过多会在后续酯化过程中生成乳酸乙酯,使酒体变得酸涩,不协调。各类呈香物质丰富则使南方清香型白酒酒体风味富有层次感,在清甜爽口中增添了陈酿的浓厚感,但目前由于微生物代谢途径复杂且存在彼此之间的相互作用,与风味物质组成或形成机制的相关性有待后续深入研究。
3 结论
本研究通过高通量测序分别对不同温度大曲与南北方清香型白酒大曲做了分析,结果表明,清香型大曲细菌物种多样性和物种丰富度较中高温曲和高温曲高,芽孢杆菌(Bacillus)为优势菌群,魏斯氏菌属(Weissella)、片球菌属(Pediococcus)及其他乳酸菌(Lactobacillus)为主要菌群;清香型白酒大曲的真菌群落多样性最高,中高温大曲的真菌群落丰富度最高,优势菌种为覆膜孢酵母属(Saccharomycopsis),其次是伊萨酵母属(Issatchenkia)、异常威克汉姆酵母(Wickerhamomyces)等酵母属。
结果表明,南方清香型白酒大曲较北方清香型白酒大曲细菌群落丰富度低,群落多样性高;南方清香型白酒大曲与北方清香型白酒大曲的优势菌种均为芽孢杆菌属,其次为乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)等乳酸菌属;南方清香型白酒大曲真菌群落丰富度与多样性均低于北方清香型白酒大曲,南方清香型白酒大曲中酵母属除了优势菌种覆膜孢酵母属(Saccharomycopsis)外,还包括弯曲假丝酵母(Apiot-richum)、伊萨酵母属(Issatchenkia)、异常威克汉姆酵母属(Wickerhamomyces)等其他酵母属。
以上研究系统了解了各类大曲及不同地域清香型白酒大曲在微生物群落上的相同及差异,对于曲样高通量测序结果的应用还需结合传统微生物研究进一步分析,包括部分不可培养分离微生物,现实应用具有一定难度,但具有一定的理论指导意义。

