长链非编码RNA LINC00601调控肝细胞癌奥沙利铂耐药的分子机制研究
胡可舒,刘文凤,张 锋,权 冰,殷 欣
1.复旦大学附属中山医院肝肿瘤内科,上海 200032;2.复旦大学附属中山医院肝癌研究所,上海 200032
中国是当今世界上肝癌发病人数最多的国家,其中绝大多数的病理学类型为肝细胞癌(hepatocellular carcinoma,HCC)[1]。本课题组前期的回顾性临床研究[2]发现,近半数中晚期HCC患者在接受反复的肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗后,表现为化疗耐药和介入治疗抵抗,严重影响此类患者的预后,但其中的具体机制仍不清楚。奥沙利铂是目前HCC患者使用较广泛的化疗药物之一[3],本研究旨在探索HCC发生奥沙利铂耐药的分子机制,为HCC的临床治疗决策提供新的理论依据和治疗靶点。
长链非编码RNA(long non-coding RNA,lncRNA)是长度不少于200个核苷酸且不具有编码蛋白质功能的一类基因转录RNA产物[4]。近年来,lncRNA在包括HCC在内的多种肿瘤的发生、发展过程中的作用被逐渐揭示。本课题组于2017年在奥沙利铂耐药HCC细胞系中鉴定到了表达显著上调的LINC00601基因[5]。后期多项研究发现,LINC00601在食管癌[6]和高恶性程度的胶质瘤[7]中表达上调,且与肿瘤患者预后不良相关。2020年,Wang等[8]研究发现,相较于癌旁组织,LINC00601在HCC组织中表达显著上调,并且LINC00601通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路促进HCC的发展。尽管LINC00601在HCC奥沙利铂耐药细胞中高表达,但其诱导奥沙利铂耐药的机制仍不明确。
1 材料和方法
1.1 细胞、试剂及仪器
人HCC细胞株MHCC-97H(97H)细胞由复旦大学附属中山医院肝癌研究所建立和储存,人HCC细胞株Hep-3B(3B)细胞购自中国科学院典型培养物保藏委员会细胞库。97H细胞培养所需的DMEM培养基和3B细胞培养所需的MEM培养基均购自浙江吉诺赛百尔生物科技有限公司,胎牛血清购自上海博升生物科技有限公司,奥沙利铂购自江苏恒瑞医药股份有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQPCR)试剂盒购自苏州英泽生物医药科技有限公司,PCR相关引物由生工生物工程(上海)股份有限公司合成,LINC00601过表达慢病毒、靶向LINC00601的小干扰RNA及Cy3荧光标记的探针购自吉满生物科技(上海)有限公司,转染试剂LipofectamineTM3000购自美国Thermo Fisher Scientific公司,Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(prodium iodide,PI)凋亡染色试剂盒购自美国BD Bioscience公司,兔抗人Cleaved-caspase-3抗体(Cat.ab32042)、兔抗人GADD45A抗体(Cat.ab180768)、羊抗兔二抗(Cat.ab205718)、羊抗兔AF555荧光二抗(Cat.ab150078)均购自英国Abcam公司,鼠抗人β-actin抗体(Cat.AA128)、鼠抗人Histone3抗体(Cat.AF0009)、细胞核蛋白与细胞质蛋白抽提试剂盒、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)试剂均购自上海碧云天生物技术有限公司,羊抗鼠二抗(Cat.ARG65350)购自中国台湾省Arigo公司。RNA pull-down实验及RNA免疫共沉淀(RNA immunoprecipitation,RIP)实验试剂盒均购自广西艾西龙生物科技有限责任公司。
PCR仪及反转录仪、酶标仪均购自美国Thermo Fisher Scientific公司,荧光显微镜购自日本Olympus公司,流式细胞仪购自美国BD Bioscience公司,化学发光成像仪购自上海天能科技有限公司。
1.2 细胞培养
97H细胞系使用添加10%胎牛血清、1%青霉素/链霉素/两性霉素B的DMEM培养基,3B细胞系使用添加10%胎牛血清、1%青霉素/链霉素/两性霉素B的MEM培养基,均在37 ℃、CO2体积分数为5%的条件下培养,细胞密度达到90%以上后1∶2至1∶3传代。
1.3 奥沙利铂耐药细胞株的建立
向HCC细胞的培养体系中添加终浓度为1 μmol/L的奥沙利铂进行同上所述的细胞培养,持续培养、传代2个月后检测细胞对奥沙利铂的半数抑制浓度(half inhibition concentration,IC50)较普通培养的HCC细胞明显升高,提示成功诱导建立奥沙利铂继发耐药细胞株97H-OXR和3B-OXR。
1.4 CCK-8实验
将细胞以5 000个/孔的密度接种到96孔板中,在37 ℃、CO2体积分数为5%的培养箱中放置过夜待其贴壁,第2天向每孔中加入奥沙利铂溶液使孔中奥沙利铂终浓度分别为0、1、2、3、5、10、15、20、30和40 μmol/L,置于培养箱中培养48 h后,将上清液替换为1∶10配置的CCK-8试剂∶完全培养基混合溶液110 μL,在培养箱中放置2 h后用酶标仪检测450 nm波长处的吸光度(D),绘制IC50曲线。实验重复3次。
1.5 RTFQ-PCR实验
按照RNA提取试剂盒、反转录试剂盒及PCR试剂盒中的说明提取细胞总RNA、反转录cDNA并进行RTFQ-PCR检测。PCR条件为:热启动酶活化95℃ 5 min;PCR扩增95℃ 10 s,60℃ 30 s共40个循环;溶解曲线检测95℃ 15 s,60℃ 1 min,95 ℃ 30 s,60℃ 15 s。β-actin上游引物序列为5’-CATGTACGTTGCTATCCAGGC-3’,下游引物序列为5’-CTCCTTAATGTCACGCACGAT-3’;LINC00601上游引物序列为5’-AAACCTTAATTGCCAATGTGA-3’,下游引物序列为5’-GCACCTCTTTTGTAAGGAC-3’。实验重复3次。
1.6 细胞转染
将细胞以4×105个/孔的密度接种于6孔板中,当细胞生长至30%~ 40%密度时开始转染。吸去孔中培养基,无菌1×磷酸缓冲盐溶液(phosphate-buffered saline,PBS)洗涤2次,向每孔培养基中加入聚凝胺1 μL以增加病毒转染效率。加入过表达LINC00601基因的慢病毒悬液使每孔中病毒的感染复数(multiplicity of infection,MOI)为10,混匀后将板置入培养箱中转染48 h。48 h后更换新鲜培养液,在培养液中加入10 μmol/L终浓度嘌呤霉素,混匀后放入培养箱48 h筛选过表达LINC00601的稳定株97H-LNC和3B-LNC。小干扰RNA的转染准备同上,按6孔板每孔2 mL体系分两Eppendorf试管配制转染体系如下:Opti-MEM培养液125 μL+LipofectamineTM3000 7.5 μL,Opti-MEM培养液125 μL+LINC00601 siRNA(20 μmol/L)10 μL,两管混匀后室温静置15~ 30 min后加入孔中,摇匀后放入培养箱中转染48 h。
于给药后7 d采用改良Garcia法[19]对大鼠进行神经功能学评分,包括自主运动(0~3分)、鼠笼攀援(1~3分)、前肢对称性(0~3分)、活动对称性(0~3分)、触摸触须反应(1~3分)、触摸双侧躯干反应(1~3分)等6项,总分为18分,分数越低表明神经功能损伤越严重。
1.7 流式细胞术
使用无乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)的胰酶溶液消化细胞,1 000 r/min离心5 min收集细胞。弃上清液后使用预冷的PBS洗涤细胞,按试剂盒说明使用Annexin Ⅴ-FITC和PI对细胞进行染色,室温避光温育15 min,染色结束后上机检测。实验重复3次。
1.8 蛋白质印迹法(Western blot)
使用RIPA裂解液提取细胞总蛋白或按细胞核蛋白和细胞质蛋白抽提试剂盒说明分别抽提细胞核蛋白和细胞质蛋白,使用二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒进行蛋白浓度定量。按照说明书配制10%的分离胶和浓缩胶进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE),80 V电泳1 h、120 V至电泳结束,湿转法300 mA转膜1 h,取出膜后使用快速封闭液室温封闭15 min。将一抗按照说明书比例稀释后与膜4 ℃温育过夜,第2天用含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline with Tween-20,TBST)洗膜3次,每次 10 min;二抗按照说明书比例稀释后室温温育1 h,TBST洗膜3次,每次10 min,然后使用电化学发光(electrochemical luminescence,ECL)试剂盒及化学发光成像仪成像。实验重复3次。
1.9 细胞免疫荧光
细胞以5×104个/孔的密度接种于12孔板中,待细胞贴壁后使用4%多聚甲醛溶液固定并用破膜液破膜,使用稀释后的一抗或Cy3荧光标记的LINC00601探针4 ℃温育过夜,第2天用含吐温-20磷酸缓冲盐溶液(phosphate-buffered saline with Tween-20,PBST)洗3次,每次5 min,如使用一抗则使用AF555荧光标记的对应二抗室温避光温育1 h后再用PBST洗3次,每次5 min。每孔加入200 μL DAPI染色液室温避光染色10 min,PBST洗3次后加入200 μL PBS,在荧光显微镜下观察成像。实验重复3次。
1.10 RNA pull-down实验
取30 μL生物素标记的RNA探针及空白对照探针置于90 ℃中水浴2 min,后转移冰浴2 min。加入50 μL预冷的RNA结构缓冲液和20 μL焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水,室温静置20 min。取40 μL磁珠,1 mL TES洗涤后,在磁珠中加入RNA探针和100 μL 2×TES,25 ℃旋转温育30 min,置于磁力架上去除上清液,然后加入500 μL TES洗涤磁珠。制备蛋白样品后,取100 μL作input,然后在蛋白样品中加入10 μL DNase,5 μL DNase salt stock,室温温育1 h。加入40 μL琼脂糖微球,4 ℃旋转温育30 min;4 000×g离心×1 min,取上清液分至两个Eppendorf试管中。分别将磁珠探针与蛋白样品混合,加入0.5 mL RIP缓冲液、5 μL RNase抑制剂、5 μL EDTA、2.5 μL乙二醇双2-氨基乙醚四乙酸(ethylene glycol bis (2-aminoethyl ether) tetraacetic acid,EGTA)和5 μL poly (dI-dC),室温旋转2 h。去除上清液后按说明书配制洗涤液,4 ℃洗涤4次,去上清液;加入30 μL Urea CHAPS缓冲液及0.3 μL二硫苏糖醇(dithiothreitol,DTT),37 ℃温育洗脱2 h后在磁力架上收集上清液。产物用于后续实验。
1.11 RIP实验
消化收集细胞后按说明书配制裂解液1和2,裂解后在4 ℃下以16 000×g离心10 min,转移上清液至无酶Eppendorf试管中。按每样品准备 28 μL蛋白A/G磁珠,洗涤磁珠2次。加入初始体积的裂解液3,将按上述方法制得的裂解液分为IP组、IgG组和Input组,加入实验抗体或IgG阴性对照抗体和磁珠,4 ℃垂直混匀4 h后收集磁珠。
配制洗涤液1和2,4 ℃洗涤5 min,收集磁珠。加入洗脱液重悬,55 ℃温育30 min洗脱RNA,收集上清液。提取RNA并按1.5中的方法行RNA的反转录及PCR。制取琼脂糖凝胶,取10 μL PCR产物,加入2 μL 6×上样染料和5 μL DL500 DNA标记物,80 V电泳40 min后用凝胶成像系统观察、拍照。
1.12 统计学处理
采用GraphPad Prism软件进行统计、绘图。样本间的假设检验采用t检验,多样本间的两两比较采用Bonferroni校正,P<0.05为差异有统计学意义。
2 结果
2.1 奥沙利铂耐药细胞株对奥沙利铂的敏感性显著降低
对所建立的奥沙利铂继发耐药HCC细胞株97H-OXR和3B-OXR进行了CCK-8实验的验证,结果显示,经不同浓度的奥沙利铂体外处理48 h后,奥沙利铂耐药细胞较对照细胞的增殖活性显著提高,其IC50显著高于对照细胞(图1),提示此法诱导建立的奥沙利铂继发耐药细胞株成功。进一步通过RTFQ-PCR实验也再次证实了97H-OXR和3B-OXR细胞中LINC00601 mRNA的表达水平较97H和3B细胞显著提高(图1)。

图1 奥沙利铂耐药细胞株97H-OXR和3B-OXR LINC00601的表达变化Fig.1 Oxaliplatin resistant cell line 97H-OXR and 3B-OXR,and the change of the LINC00601 expression
2.2 LINC00601表达对HCC细胞奥沙利铂耐药性的影响
为进一步验证LINC00601在HCC细胞中对奥沙利铂敏感性的影响,我们使用慢病毒转染97H细胞,构建过表达LINC00601的97H细胞(97H-LNC),同时利用靶向LINC00601 mRNA的小干扰RNA对97H-OXR中LINC00601的表达水平进行敲低(97H-OXR-siLNC),其RTFQPCR验证的结果见图2A。与此同时,我们分别将两组细胞进行了不同浓度奥沙利铂处理后的CCK-8实验,结果发现,过表达LINC00601能够显著地提高97H细胞对于奥沙利铂的耐受性(图2B);然而,当97H-OXR细胞中LINC00601的表达被下调后,其细胞的奥沙利铂敏感性显著恢复(图2C)。同时,我们在3B-OXR细胞中敲减了LINC00601的表达,也得到了一致结果(图2D、2E)。上述结果提示LINC00601可能对奥沙利铂耐药性的调控具有重要意义。

图2 LINC00601表达改变对HCC细胞奥沙利铂耐药性的影响Fig.2 The effect of LINC00601 expression on the sensitivity to oxaliplatin of HCC cells
2.3 LINC00601表达改变对HCC细胞奥沙利铂处理后凋亡水平的影响
进一步使用流式细胞术观察奥沙利铂处理后HCC细胞发生凋亡的改变。结果显示,当使用100 μmol/L高浓度的奥沙利铂分别处理对照组、耐药组和敲减LINC00601后的耐药组细胞24 h后,97H、3B、97H-OXR-siLNC和3B-OXR-siLNC细胞发生凋亡的比例显著上升,而97H-OXR和3B-OXR这两株耐药细胞中的凋亡水平却并无明显变化(图3),这与以上发现这几株细胞对奥沙利铂的敏感性相一致,提示LINC00601的表达水平与细胞凋亡水平呈负相关。

图3 LINC00601对奥沙利铂处理后HCC细胞凋亡水平的影响Fig.3 The impact of LINC00601 on the apoptotic level of HCC cells after oxaliplatin treatment
2.4 LINC00601表达改变对HCC细胞奥沙利铂处理后caspase 3蛋白活化水平的影响
Caspase 3蛋白活化是发动细胞凋亡的关键步骤之一,因此我们进一步地通过Western blot对caspase 3的活化水平进行探究。结果显示,活化的caspase 3切割体蛋白表达量表现出奥沙利铂剂量依赖的相关性(图4),且各株细胞中caspase 3的活化程度与上述流式细胞术测得的凋亡程度相一致。综上,LINC00601可能通过调控caspase 3蛋白的活化,从而抑制HCC细胞的凋亡,进而影响其对奥沙利铂的敏感性。

图4 LINC00601对奥沙利铂处理后caspase 3蛋白激活的影响Fig.4 The impact of LINC00601 on the activation of caspase 3 protein
2.5 LINC00601在细胞中的定位及对GADD45A表达的调控
为能够进一步探索LINC00601在细胞中发挥的生物学功能,我们首先通过Cy3红色荧光标记的LINC00601探针对其在细胞中的定位进行观察。荧光显微镜观察结果显示,LINC00601绝大部分定位于HCC细胞的细胞质中(图5A)。通过RTFQ-PCR实验发现,GADD45A基因的mRNA水平在高表达LINC00601的97H-LNC和3B-LNC细胞中均显著下降(图5B、5D);然而Western blot实验结果却显示,GADD45A的表达量却与mRNA水平并不一致(图5C、5E),提示可能还有其他因素参与调控GADD45A相关信号转导通路。

图5 LINC00601在HCC细胞中的定位及对GADD45A基因表达的影响Fig.5 The location of LINC00601 in the HCC cells and its impacts on the expression of GADD45A gene
2.6 LINC00601对GADD45A核转位的影响
考虑到GADD45A是一种主要定位于细胞核中的蛋白,而我们发现LINC00601主要位于细胞质中,我们推测LINC00601可能通过调控GADD45A的核转位过程,从而起到调控GADD45A功能的作用。我们首先使用细胞免疫荧光染色观察了不同细胞中GADD45A的分布情况。结果显示,在97H-OXR、97H-LNC、3B-OXR和3B-LNC这几株高表达LINC00601细胞的细胞质中观察到了显著的GADD45A富集,而在LINC00601相对低表达的对照组和OXR-siLNC细胞的细胞质中GADD45A分布较少(图6A,红色荧光)。为进一步验证这一结论,我们分别抽提了不同细胞的细胞核/细胞质质白,并进行了Western blot实验。结果显示,97H-OXR和97H-LNC细胞质中GADD45A的表达量显著增加,而在97H和97H-OXR-siLNC细胞核中观察到了更为显著的GADD45A富集(图6B)。我们也在3B细胞系的对应细胞株中观察到了相同结果(图6B)。上述结果提示LINC00601的高表达对GADD45A的核转位起到了负调控的作用。
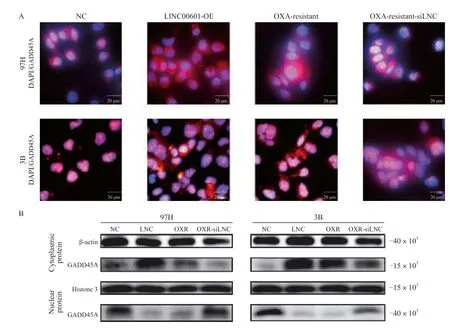
图6 LINC00601影响GADD45A的核转位Fig.6 The nuclear translocation process of GADD45A was interfered with LINC00601 expression
2.7 LINC00601对GADD45A调控机制的探索
为进一步探索LINC00601对GADD45A核转位的调控机制,我们进一步通过RNA pull-down和RIP实验观察LINC00601是否与GADD45A存在结合。通过LINC00601的RNA pull-down结果显示,结合的蛋白中存在GADD45A(图7A)。另一方面,我们使用GADD45A抗体进行免疫共沉淀,通过RTFQ-PCR和琼脂糖凝胶电泳,在产物中发现了LINC00601 mRNA的富集(图7B)。上述结果提示LINC00601能够与GADD45A结合,从而发挥对后者的调控作用。

图7 LINC00601与GADD45A的结合Fig.7 LINC00601 might bind to GADD45A
3 讨论
对于中晚期HCC患者,以奥沙利铂为基础的HCC局部治疗如TACE[12]或肝动脉灌注化疗[13]是目前临床主要的治疗策略,但治疗带来的生存获益尚未达到令人满意的程度。HCC细胞对于以奥沙利铂为基础的化疗或介入治疗抵抗是临床尚未解决的瓶颈问题。近年来,对奥沙利铂耐药机制的研究涉及药物在细胞内的运输、解毒、DNA损伤反应与修复、细胞死亡和表观遗传学机制[14]等多个方面。对细胞这些功能的深入探索和挖掘有助于进一步推动奥沙利铂和其他铂类化疗药物在临床上的实践应用。
LncRNA虽然不编码、翻译成蛋白质,但近年来研究[4]显示,lncRNA可以靶向mRNA、miRNA、cirRNA或蛋白,通过调控表观遗传学、转录及转录后调控等途径影响细胞内的信号转导通路,发挥不同的生物学功能。既往有研究[15]鉴定出了74种与HCC相关的lncRNA,近年来亦不断发现新的lncRNA参与调控HCC的化疗耐药[16-20]。在食管鳞状细胞癌和高恶性程度胶质瘤中,LINC00601与多种分子联合可以作为不良预后指标[6-7]。也有研究[8]报道,LINC00601在HCC组织中表达增加,并通过激活细胞的MAPK信号转导通路参与HCC的发生、发展。为进一步验证LINC00601在奥沙利铂化疗耐药的HCC中的作用,我们进行了一系列体外实验,结果表明,LINC00601在HCC细胞中的高表达能够调控GADD45A的核转位,抑制HCC细胞凋亡,进而导致HCC细胞对于奥沙利铂耐药。
GADD45A基因是p53和MAPK信号转导通路的关键组成部分,可能诱导细胞周期阻滞[21]、DNA修复和细胞凋亡[22],其主要在细胞核中发挥生物学功能。GADD45A作为P53基因下游分子,被视为促进细胞凋亡的重要基因之一[23]。近期有研究[24]证实,下调GADD45A的表达可以显著抑制caspase 3蛋白的激活,抑制细胞凋亡的发生;而另一方面,过表达GADD45A可以直接改善HCC细胞对奥沙利铂的耐药,其具体机制是通过抑制AKT信号转导通路并参与调控凋亡相关蛋白Bax和Bcl-2的表达[25]。以上实验探索的均是GADD45A表达水平对于凋亡或耐药性的调控,然而我们在实验中首次发现,LINC00601能与GADD45A结合,通过非表达水平负调控GADD45A翻译后的核转位,从而干扰GADD45A在细胞核中的正常定位和功能,最终导致奥沙利铂耐药性的产生。这提示我们GADD45A存在表达水平以外的调控机制和信号转导通路,然而,LINC00601调控或修饰GADD45A更深入的分子机制有待于进一步探索。
综上所述,我们发现了在奥沙利铂耐药细胞中高度表达的LINC00601基因,其可以抑制DNA修复蛋白GADD45A的核转位,干扰GADD45A在细胞核内的功能,从而减少奥沙利铂诱导的细胞凋亡,最终导致奥沙利铂化疗耐药。进一步深入研究靶向LINC00601/GADD45A信号转导通路的药物,有望为克服HCC奥沙利铂耐药提供新的临床治疗策略。
利益冲突声明:所有作者均声明不存在利益冲突。

