油菜糖基转移酶BnIRX14基因家族鉴定及遗传转化
靳丰蔚,董 云*,杨晓明,方 彦,刘婷婷,王 毅
(1 甘肃省农业科学院作物研究所,兰州 730070;2 甘肃农业大学干旱生境作物学重点实验室,兰州 730070)
糖基转移酶是多糖合成中的关键酶,参与多种物质的糖基化,催化糖供体和受体结合产生新的化合物,其供体多是激活状态的核苷二磷酸糖,如UDP-葡萄糖、GDP-甘露糖和UDP-半乳糖等[1]。植物体内存在大量的天然次生代谢物,这些次生代谢物的产生是植物在进化过程中对生态环境适应的结果,是植物生理状态在代谢水平上的反映[2]。糖基化是这些次生代谢产物的主要修饰之一,糖基化修饰是植物体内普遍存在的生理生化反应,可以提高天然化合物的溶解度和稳定性,使化合物便于储存在植物细胞中,是调节细胞代谢平衡的重要机制[3];糖基化修饰可以改变化合物毒性和生物活性[4],在植物响应逆境胁迫等方面具有重要作用[5]。
根据序列同源性和催化机制,在碳水化合物活性酶数据库CAZy(Carbohydrate-Active Enzymes database) 中,根据GT序列相似度、催化底物的特异性和催化产物化学结构,将糖基转移酶分为114个家族。根据糖基转移酶三维结构的折叠特征,将糖基转移酶被分为GT-A、GT-B、GT-C和GT-D等4种类型[5]。糖基转移酶家族多使用NDP-戊糖和NDP-己糖作为供体底物,催化UDP-糖的糖基转移酶称为UDP-糖基转移酶(UGTs)[6]。
关于UGTs的研究,有学者分别在芸薹属植物白菜(Brassicarapa)、甘蓝型油菜(Brassicanapus)和甘蓝(Brassicaoleracea)中鉴定到140、251和154个UGTs[7],这些糖基转移酶主要参与合成次生代谢物质响应生物非生物胁迫。水稻超表达OsUGT90A1能保护冷胁迫下细胞膜的完整性[8];而有学者研究UGT84A17能够调控杨树对逆境做出积极响应[9];拟南芥UGT85U1/2和UGT85V1通过改变吲哚衍生物参与应答盐和活性氧胁迫抗性[10];甘蓝型油菜UGT84F1和白菜BrGUGT也被发现通过抑制芥子酸来适应非生物胁迫[11]。
木聚糖是存在于植物细胞壁中的一种异质多糖,是植物半纤维素的主要成分。模式植物拟南芥遗传和生物化学分析表明,一些来自糖基转移酶GT43家族的BnIRX14 (IRX9I9H/IRX9-L、IRX14、I14H/IRX14-L)和GT47(IRX10、IRX10-L) 家族基因是木糖键延伸所必须的。木糖基转移酶除了参与木聚糖的合成,还在拟南芥[12]和南荻(Miscanthuslutarioriparius)[13]种皮粘液合成中起作用,糖基转移酶生物功能具有多样性和保守性,影响植物的生长发育、逆境应答等功能[14]。油菜是中国重要的油料作物,次生物质代谢和抗逆机理解析是油菜育种的重要基础研究。目前糖基转移酶调控的油菜抗性研究还相对滞后。甘肃省农业科学院作物研究所前期克隆了一个与甘蓝型油菜抗性有关的β-1,4-木糖基转移酶基因BnIRX14(NCBI登录号KP100641),发现该基因在细胞质中表达,属非分泌性蛋白[15]。本研究利用生物信息学方法对甘蓝型油菜BnIRX14家族成员进行鉴定,从基因组水平上分析了甘蓝型油菜BnIRX14基因数目、进化和结构以及在染色体上的分布,并构建BnIRX14的干扰载体转化油菜,为进一步发掘BnIRX14基因在油菜抗性育种中的利用价值提供基础。
1 材料和方法
1.1 材 料
1.1.1 油菜品种供试材料为甘蓝型油菜(BrassicanapusL.)春性品种Westar,由华中农业大学生命科学学院提供。
1.1.2 其他材料农杆菌GV3101、大肠杆菌(Escherichiacoli)感受态细胞DH5α、植物RNAi载体pKANNIBAL、植物表达载体pART27以及Taq DNA聚合酶2×fast pfu master mix、限制性内切酶XhoⅠ、KpnⅠ、XbaⅠ、HindⅢ、NotⅠ,T4连接酶,质粒提取试剂盒Plasmid Mini Kit Ⅰ(OMEGA),基因组提取试剂盒Trans Direct Plant Tissue PCR Ki均购自陕西博瑞德生物科技公司。其他化学药品均为国产分析纯试剂。
1.2 方 法
1.2.1 油菜BnIRX14基因家族成员鉴定根据BnIRX14氨基酸序列,利用Clustal W 默认设置进行多重序列比对,并在MEGA 6 软件中使用邻接法(Neighbour-Joining,NJ) 构建系统进化树[16]。利用GSDS2.0绘制BnIRX14基因结构[17]。通过MEME分析BnIRX14蛋白保守元件[18]。
1.2.2 油菜BnIRX14基因干扰载体构建利用Primer Premier 6.0软件设计BnIRX14基因靶位点序列扩增引物(表 1),扩增后用百泰克胶回收试剂盒回收目的片段,回收后置-20 ℃保存备用。用XhoⅠ和KpnⅠ双酶切质粒pKANNIBAL载体,切取载体大片段对应条带的凝胶,百泰克胶回收试剂盒回收酶切产物。将胶回收的正向片段和线性化pKANNIBAL载体以9∶1摩尔比加到EP管中进行重组反应,混匀后在37 ℃放置30 min进行转化[19]。进行单菌落PCR阳性克隆鉴定,挑取阳性菌落测序验证。将测序正确的质粒用XbaⅠ和HindⅢ双酶切pKANNIBAL正向片段载体,回收大片段。

表1 本实验所用引物Table 1 Primers in this test
将胶回收的反向片段和线性化pKANNIBAL正向片段载体以9∶1摩尔比加到EP管中进行重组反应,连接、转化、鉴定方法同正向片段。将测序正确的含有正反向片段的pKANNIBAL载体和表达载体pART27用NotⅠ酶切,T4连接酶连接(图 1),转化至DH5α感受态细胞,菌落PCR进行阳性克隆鉴定。

图1 干扰载体pART27-485-6构建Fig.1 The structure of interference vector pART27-485-6
利用Plasmid Mini Kit Ⅰ提取测序正确的pART27-485-6质粒转化农杆菌GV3101,转化参照董云等[19],待单菌落长出后,选3~5个单菌落做菌落PCR验证,引物见表1,PCR反应体系和条件与靶位点序列扩增相同。
1.2.3 油菜BnIRX14基因干扰载体转化参照刘宏波[20]以及CARDOZAD等[21]、DE BLOCK等[22]和MAHESHWARI等[23]关于农杆菌介导的转基因方法。以栽培品种Westar为受体材料,用转化了pART27-485-6质粒的农杆菌GV3101侵染油菜下胚轴,当抗性芽在诱导分化培养基上长到2 cm时,切芽并将其转入生根培养基中,待形成完整小植株时切取叶片,使用Trans Direct Plant Tissue PCR Kit试剂盒提取基因组DNA,用4对基因特异引物(表 1)检测阳性植株。参照方彦等[24]方法,依据BnIRX14基因的cDNA全长序列设计特异RT-PCR引物,Actin作为内参基因对阳性植株的花、角果、叶片进行实时荧光定量PCR分析,实时荧光定量PCR引物见表 1。
2 结果与分析
2.1 油菜BnIRX14基因家族成员鉴定
根据前期获得的BnIRX14基因序列[15],在PFAM数据库中预测基因保守结构域,结果表明,BnIRX14包含一个糖基转移酶家族结构域。根据保守结构域在甘蓝型油菜基因组注释序列中检索家族基因,得到11个家族成员。
氨基酸序列系统进化树分析表明,甘蓝型油菜BnIRX14家族成员被分成3个亚家族(图2,A),第一个亚家族包括IRX9-L-1、IRX9-L-2、IRX9-L-4、IRX9-L-5、IRX9-L-7、IRX9-L-8,第二个亚家族包括IRX9-L-3、IRX9-L-6,第三个亚家族包括IRX14-L-1、IRX14-L-2、IRX14-L-3。其中,有8个BnIRX14基因家族成员分别分布在6条染色体上(图 2,B),分别为A07、A08、A09、C03、C07和C09染色体,除C07染色体有3个基因外,其余染色体均有1个基因,根据染色体定位分布信息和序列比对分析,发现IRX14-L-2和IRX14-L-3串联重复。第一亚家族基因有3~4个外显子,第二亚家族基因有7~9个外显子,第三亚家族基因有2~4个外显子,IRX14-L-1只有2个外显子,且内含子最短(图 3,A)。
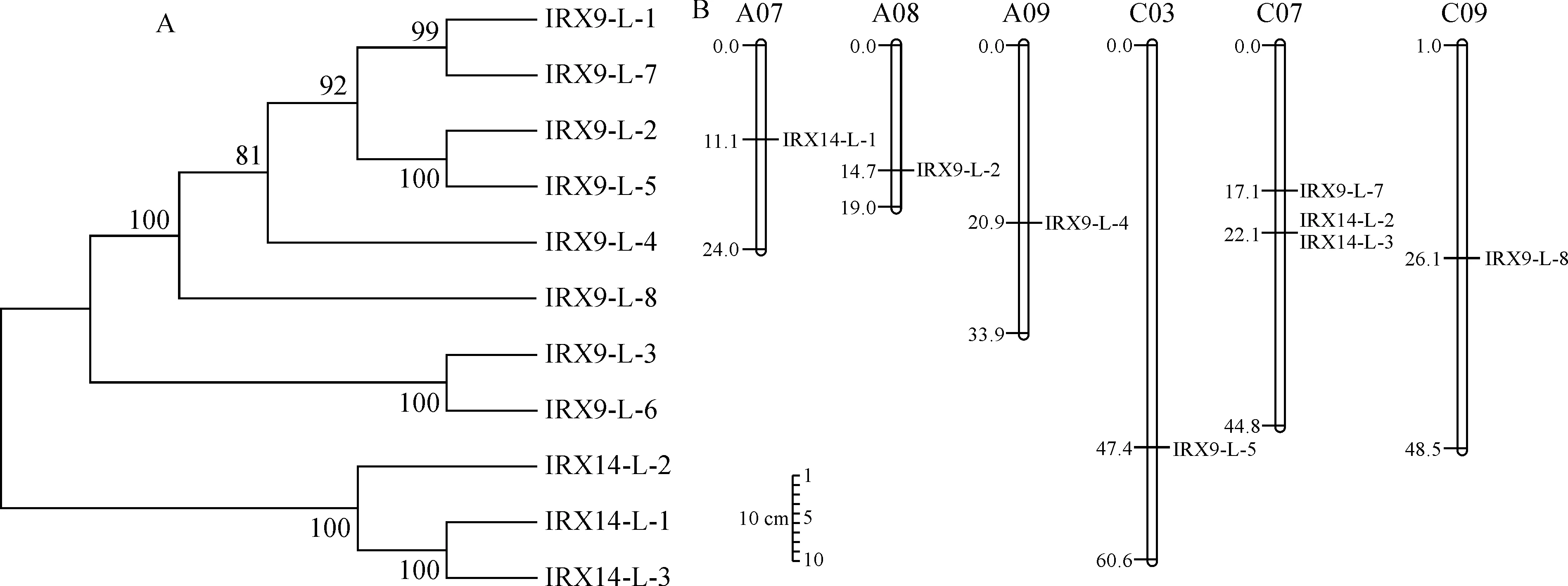
图2 BnIRX14家族氨基酸序列系统进化树(A)和染色体分布(B)Fig.2 Phylogenetic tree of amino acid sequences (A) and chromosome distribution (B) of BnIRX14 family members
在BnIRX14蛋白中预测出10个保守元件(图 3,B),第一亚家族蛋白有2~8个保守元件,其中:IRX9-L-4有2个,IRX9-L-8有5个,其余4个蛋白均有8个相同的元件;第二亚家族蛋白只有1个保守元件;第三亚家族蛋白有1~4个保守元件,其中IRX14-L-2仅1个保守元件,IRX14-L-1和IRX14-L-3存在4个相同元件。元件1除IRX9-L-4和第三亚家族外,在其他两个亚家族蛋白中均存在;元件2在第一、第三亚家族蛋白中存在;元件3仅在第一亚家族蛋白中存在;元件9、10只有IRX14-L-1、IRX14-L-3存在。3个亚家族在基因结构和保守元件中具有较大特异性。

图3 BnIRX14基因家族结构(A)和蛋白保守元件(B)Fig.3 Family structure (A) and protein conserved element (B) of BnIRX14
2.2 油菜BnIRX14基因干扰载体构建
利用BnIRX14基因靶位点序列设计的正向片段扩增引物F485-6-F/F485-6-R和反向片段扩增引物R485-6-F/R485-6-R进行PCR扩增,扩增产物分别为340和336 bp(图4,A),胶回收目的片段。XhoⅠ和KpnⅠ双酶切线性化质粒pKANNIBAL载体,与胶回收的正向片段进行重组后转化大肠杆菌,用正向片段扩增引物进行单菌落PCR鉴定得到4个阳性克隆(图4,B)。
XbaⅠ和HindⅢ 双酶切测序正确的质粒pKANNIBAL 正向片段载体,与胶回收的反向片段进行重组转化大肠杆菌,用反向片段扩增引物进行单菌落PCR鉴定得到2个阳性克隆(图4,C)。NotⅠ酶切含有正反向片段的pKANNIBAL载体和植物表达载体pART27,胶回收目的片段后用T4连接酶连接,转化至DH5α感受态细胞,用反向片段扩增引物单菌落PCR鉴定得到1个阳性克隆(图4,D)。提取测序正确的pART27-485-6质粒转化农杆菌GV3101,利用485F/485R进行单菌落PCR,扩增条带743 bp,验证得到4个阳性克隆(图4,E)。

A.正反向片段PCR扩增:1、2.F485-6;3、4.R485-6;B.F485-6连接载体pKANNIBAL菌落PCR鉴定:1-4.pKANNIBAL-F485-6;C.R485-6连接载体pKANNIBAL-F485-6菌落PCR鉴定:1、2.pKANNIBAL- F485-6- R485-6;D.pART27-485-6转大肠杆菌菌落PCR鉴定;E.pART27-485-6转农杆菌菌落PCR鉴定;M.DL2000图4 BnIRX14基因干扰表达载体构建和农杆菌转化PCR鉴定A.PCR amplification of positive and reverse fragments:1 and 2 were positive fragments F485-6,3 and 4 were reverse fragments R485-6;B.Positive colony PCR identification of the forward fragment F485-6 linked to the vector pKANNIBAL:1-4 were pKANNIBAL-F485-6;C.Positive colony PCR identification of the reverse fragment R485-6 linked to the vector pKANNIBAL-F485-6,1 and 2 were pKANNIBAL-F485-6-R485-6;D.Colony PCR identification of plasmid pART27-485-6 transfected Ecoli;E.Colony PCR identification of plasmid pART27-485-6 transfected agrobacterium tumefaciens;M.DL2000Fig.4 PCR identification of BnIRX14 gene interference expression vector and agrobacterium transgenics
2.3 油菜BnIRX14基因RNA干扰表达载体遗传转化和表型分析
2.3.1 遗传转化通过农杆菌介导侵染油菜下胚轴进行BnIRX14基因干扰表达载体 pART27-485-6的遗传转化,侵染油菜下胚轴300个(图5,A),出愈率67%,分化培养和Kan抗性筛选,获得抗性芽60个(图5,B),通过生根培养得到再生植株20个(图5,C),用4对特异性引物JDF1/JDR1、JDF2/JDR2、JDF3/JDR3和JDF4/JDR4进行PCR检测后,扩增条带分别为1 500、1 500、1 000和1 000 bp(图5,D~G),确定5株为阳性转化体。

A.GV3101侵染油菜下胚轴共培养;B.诱导分化培养;C.生根培养;D-G.PCR鉴定:M.DL5000;2#、5#、6#、9#、10#。阳性转化体;N.阴性对照图5 干扰表达载体 pART27-485-6的遗传转化及PCR鉴定A.Coculture of rapeseed hypocotyls infected by agrobacterium Gv3101;B.Resistant buds grown on induced differentiation medium;C.Resistant buds grown in rooting medium;D-G.PCR identification of positive plants:2,5,6,9 and 10# were transformation events;M.DL5000;N.Negative controlFig.5 Genetic transformation of expression vector pART27-485-6 and PCR identification
2.3.2 表型分析通过BnIRX14基因在不同器官中表达量的分析(图 6)在油菜5个转化干扰表达载体 pART27-485-6阳性植株的花、角果、叶中,BnIRX14基因表达量均低于野生型,且差异显著,说明BnIRX14基因在花、角果和叶中的表达受到抑制。BnIRX14基因在野生型油菜的花、角果、叶片中的表达量基本一致,但在油菜转化干扰表达载体pART27-485-6阳性植株的花、角果、叶片中的表达量是依次降低。表型鉴定发现,编号为9#和10#的阳性转化株花的柱头至花柱中央为一孔状的空腔,子房较野生型明显膨大,在柱头表面授粉后,不能结实,表现雌性不育(图7),其他3个阳性株花器结构发育正常,但植株茎、枝表皮有液体渗出,呈露珠状粘附在茎、枝表面。
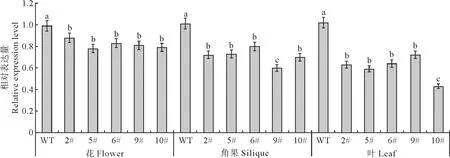
WT.野生型;2#、5#、6#、9#、10#.阳性株系;下同。小写字母表示差异显著(P≤0.05)图6 BnIRX14基因在阳性植株不同器官中的表达WT.Wild type;2,5,6,9 and 10#.The positive plant;The same as below.Different normal letters meam significant difference at 0.05 level (P≤0.05)Fig.6 Expression of BnIRX14 gene in different organs of positive plants

A.株系;B.株系花蕾、花器和角果;C.WT柱头;D.9#阳性转化株柱头图7 转化干扰表达载体阳性株雌性不育表型A.Strains;B.Flower bud,floral apparatus,silique;C.Chapiter of WT;D.Chapiter of positive strain 9#Fig.7 Female sterility phenotype of rape positive strains of the expression vector transferred
3 讨 论
木聚糖是一种存在于植物细胞壁中的异质多糖,约占植物细胞干重的15%~35%,是植物半纤维素的主要成分[25]。β-1,4-木糖基转移酶是糖基转移酶家族GT43成员[26],大多以UDP-木糖作为专一性的糖供体,GT43家族中所含成员多与植物的次级代谢和逆境胁迫相关[27]。糖基转移酶GT43家族成员在模式植物中有许多报道,像拟南芥IRX9、IRX9L、IRX14、IRX14L等[28]都参与了木糖的合成。木聚糖糖基转移酶在植物生长发育、调节次生代谢及参与相应逆境胁迫有重要意义[29]。有学者从南荻(Miscanthuslutarioriparius)中鉴定到了7个GT43成员[13],在水稻中发现了10个GT43成员[30],这些功能基因冗余具有多样性。
董云通过RACE技术从甘蓝型油菜中克隆到了β-1,4-木糖基转移酶基因BnIRX14,保守结构域和亚细胞定位表明BnIRX14属于油菜糖基转移酶GT43家族成员[15]。本研究通过同源序列比对,在甘蓝型油菜中检索到了11个BnIRX14基因家族成员,分别定位在A07、A08、A09、C03、C07和C09染色体上,其中IRX14-L-2和IRX14-L-3串联重复,可能来自于远缘杂交的甘蓝基因组。IRX9-L-1、IRX9-L-7、IRX9-L-2和IRX9-L-5结构域十分保守,都存在8个保守的结构域,进化树结果也表明IRX9-L-1和IRX9-L-7,IRX9-L-2和IRX9-L-5分别聚为一类,说明在进化上的保守性。
通过农杆菌介导的遗传转化方法,构建了油菜BnIRX14干扰表达载体转化油菜下胚轴,通过生根培养得到转化株系20个。qRT-PCR检测T0代阳性转基因油菜,相比野生型BnIRX14在花,角果和叶中均下调表达,其中叶中下调最为明显,可能的原因在于BnIRX14参与木糖调节的半纤维素的合成,而叶中相比花和角果中本底水平的BnIRX14表达量就低,导致干扰BnIRX14转基因株系中BnIRX14基因低表达,但具体的原因还需要进一步分子水平的证据。
研究发现干扰BnIRX14转基因株系9#和10#花器柱头至花柱中央为一孔状的空腔,子房较野生型明显膨大,在柱头表面授粉后,不能结实,表现雌性不育。其他2#、5#和6#阳性干扰BnIRX14转基因株系花器结构发育正常,但植株茎、枝表皮有液体渗出,呈露珠状粘附在茎、枝表面。原因可能是转基因株系中基因被干扰的程度不同所致,这种情况在转基因实验中常常发现[31],不同的转基因株系因对基因插入位点不同而造成基因表达量不同[32]。qRT-PCR检测在9#和10#株系角果中BnIRX14基因表达低于其他转基因干扰株系,也符合观察到的结实发育的异常。2#、5#和6#转基因株系植株茎、枝表皮有液体渗出,呈露珠状粘附在茎枝表面的原因可能在于下调了BnIRX14基因的表达导致次生代谢物质的异常所致,但具体的分子机制和确凿的证据正在进行后续的研究。本研究在甘蓝型油菜中发现了11个BnIRX14基因家族成员,进化上高度保守且存在多样性,功能缺失研究表明这些木糖基转移酶家族基因能够参与雌蕊的发育和次生物质代谢,该研究为油菜杂交育种和抗逆育种提供理论依据。

