夏季广东省鲎保护区潮间带大型底栖动物群落研究
李银康, 鲍虞园, 林吴颖, KWAN Kit Yue, 饶义勇, 颉晓勇
夏季广东省鲎保护区潮间带大型底栖动物群落研究
李银康1,2,3, 鲍虞园1,2, 林吴颖4, KWAN Kit Yue5, 饶义勇1,6, 颉晓勇1,3,*
1. 中国水产科学研究院南海水产研究所, 农业农村部南海渔业资源开发利用重点实验室, 广州 510300 2. 上海海洋大学水产与生命学院, 上海 201306 3. 南方海洋科学与工程广东省实验室, 广州 511458 4. 广西生物多样性研究和保护协会, 广西 南宁 530012 5. 北部湾大学海洋学院, 广西北部湾海洋生物多样性养护重点实验室, 广西 钦州 535011 6. 厦门大学环境与生态学院, 厦门 361102
广东省划设有6个鲎保护区, 但对鲎种群具体分布位置、数量及趋势数据几近空白, 阻碍了科学管理策略制定和保护行动推进。为此, 采用野外调查方法分别对该6个鲎保护区幼鲎资源现状展开调查, 并对保护区潮间带大型底栖动物群落进行分析。结果表明, 广东省6个鲎保护区中仅遂溪中国鲎保护区和徐闻圆尾鲎保护区发现有幼鲎分布, 其中徐闻圆尾鲎保护区内幼鲎丰度极低, 调查整个保护区仅发现2只幼鲎; 遂溪中国鲎保护区幼鲎丰度为6.45 ind·100 m–2, 但低龄期幼鲎个体数量明显低于高龄期。保护区潮间带大型底栖动物功能群分析显示, 遂溪大型底栖动物以浮游生物食者为主, 徐闻以植食者为主, 浮游动物、微藻类以及浮游植物等天然饵料资源充足, 符合幼鲎的摄食习性。此次鲎保护区资源调查表明广东省鲎资源现状严峻, 鲎保护区管理亟待改善。提升鲎的保护等级、科学的人工放流、行之有效的保护区管理措施等行动已势在必行。
鲎; 资源调查; 保护区; 大型底栖动物; 功能群
0 前言
鲎, 俗称马蹄蟹(Horseshoe crab), 是古老的大型海洋底栖节肢动物, 隶属于肢口纲(Merostomata)剑尾目(Xiphosura)。鲎在医学、食物、科学研究及海洋生态保护为人类提供了重要的服务价值。它曾是海鲜美食, 同时也广泛用作中药材料[1–2]。鲎血细胞制备的鲎试剂则是目前检测内毒素应用最广泛、最有效的试剂[3–4]; 鲎壳和剑尾可提取甲壳素且其含量比虾蟹甲壳高一倍以上[5], 同时鲎也是生态环境指标物种[6]。
中国海域分布的鲎有中国鲎()和圆尾鲎()[4, 7–8]。中国鲎又称中华鲎、东方鲎或三棘鲎, 圆尾鲎又称圆尾蝎鲎。20世纪70年代以前, 在中国长江口以南广大海域包括浙江、福建、广东及广西北部湾等沿海地区均有大量中国鲎分布。随着鲎试剂开发、鲎甲壳素利用以及栖息生境破坏, 中国鲎资源急剧减少[1, 3–5, 9–11]。目前珠江口以北海域已极少发现中国鲎, 仅在广东雷州半岛和北部湾沿海地区发现有中国鲎和圆尾鲎存在, 但资源量也大为减少[1, 4, 9, 12–13]。
2019年度IUCN正式宣布中国鲎“濒危”。鲎栖息地破坏是中国鲎资源面临枯竭的主要原因之一[4], 建立鲎保护区是保护鲎资源的首选措施[10]。截至2012年底广东省共有6个鲎自然保护区[14], 分别是位于潮汕地区的濠江企望湾南方鲎保护区、田心湾南方鲎保护区、揭阳海龟、鲎保护区, 位于雷州半岛的遂溪中国鲎保护区、徐闻圆尾鲎保护区, 以及南三岛鲎类保护区(图1)。由于缺乏科学管理和有效监控, 6个保护区鲎资源数据一片空白。底栖动物是潮间带生态系统的重要组成部分, 其群落结构变化能够很好地表征潮间带环境状况和变化[15], 同时也影响着幼鲎的分布[8]。本文通过对广东省6个鲎保护区幼鲎资源调查以及底栖动物群落结构研究, 旨在明确目前广东省鲎保护区幼鲎资源现状, 为中国鲎资源恢复、管理和栖息地保护提供基础数据。
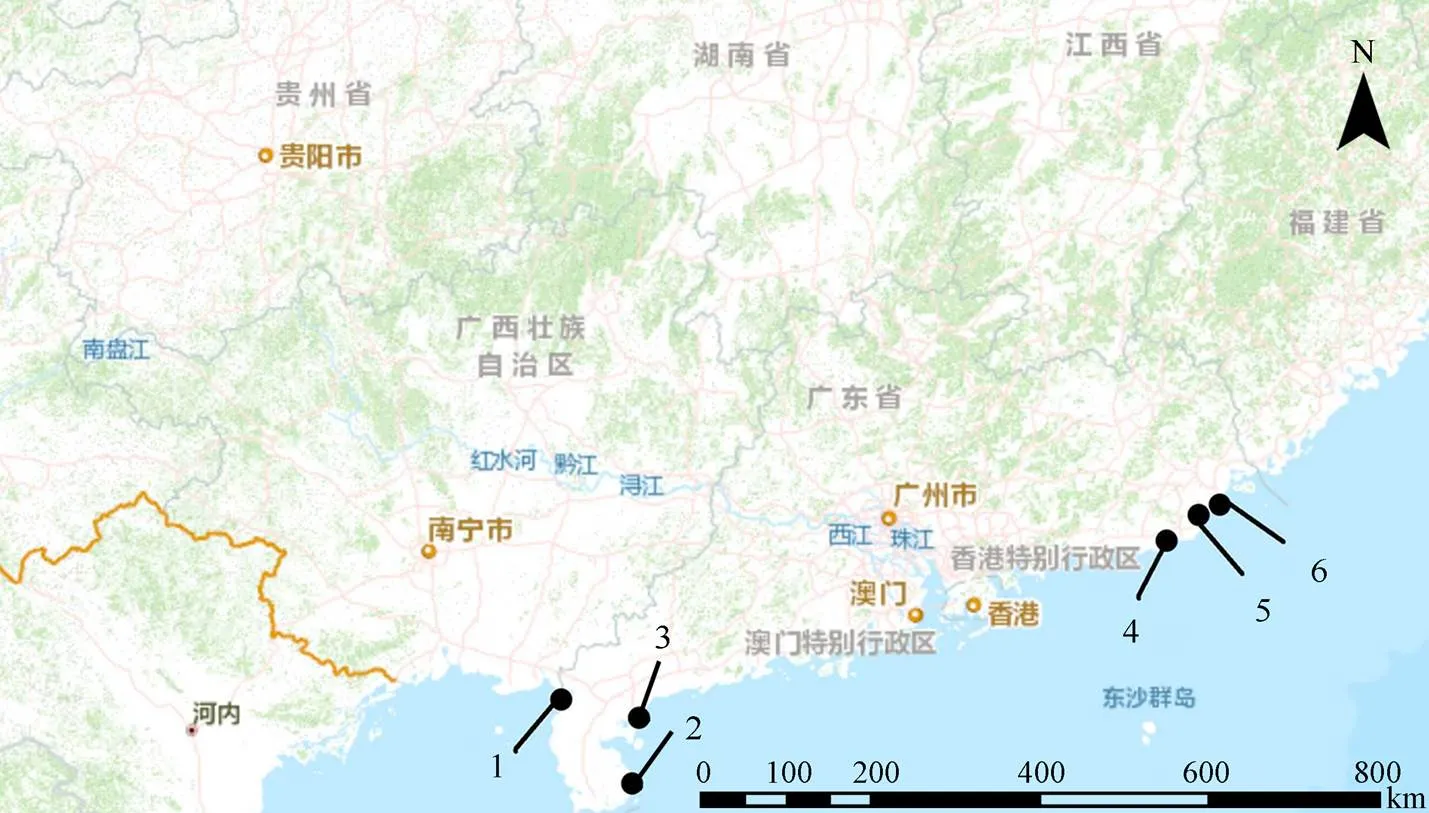
注: 1.遂溪中国鲎保护区; 2.徐闻圆尾鲎保护区; 3.南三岛鲎类保护区; 4.揭阳海龟、鲎保护区; 5.田心湾南方鲎保护区; 6.濠江企望湾南方鲎保护区。
Figure 1 Location distribution of horseshoe crab reserves in Guangdong Province
1 材料和方法
1.1 广东省鲎保护区鲎资源调查
在中国南海夏季被认为是幼鲎丰度调查的最佳时机, 经过冬季和早春越冬之后, 鲎在夏季低潮时摄食行为较为活跃[16–17]。Lee和Morton[18]在实验室研究发现当水温低于20 ℃时幼鲎会一直掩藏于底质中。鉴于幼鲎这种生活习性, 此次对广东省鲎保护区幼鲎资源调查于2019年7—8月白天低潮时进行。
1.1.1 幼鲎丰度调查
参考Shin et al[19]、Morton和Lee[16]对幼鲎种群丰度调查的随机样方法, 在全面扫描整个鲎保护区潮间带区域基础上, 设置4条平行于海岸线的样线, 4条样线均间隔100 m。每条样线随机取10个8 m·8 m的样方, 样方间距100 m。对每个样方内鲎进行种类区分和计数, 并测量其头胸甲宽。为了避免重复计数, 每个调查位点均在一个潮汐周期内完成调查。
1.1.2 种类区分和龄期划分
根据剑尾截面和表面是否光滑对中国鲎和圆尾鲎种类进行区分, 中国鲎剑尾截面为三角形, 且腹甲末端有3个明显的棘突, 而圆尾鲎剑尾截面呈圆形, 且表面光滑[20]。参照Sekiguchi[21]、Chen[22]、Hu[23]和Kwan[24]研究结果, 对中国鲎平均头胸甲宽数据进行龄期划分, 圆尾鲎则参照Sekiguchi[21]、Hu[23]和Kwan[24]相关报道。
1.2 潮间带大型底栖动物调查
对2个有幼鲎分布的鲎保护区潮间带开展底栖动物调查, 与鲎调查同步进行。潮间带大型底栖动物调查方法按照《海洋监测规范》[25](GB17378.1—2007)和《海洋调查规范》[26](GB/T 12763.1—2007)进行。每个调查地点设1条采样断面, 在每条断面的高、中、低三个潮区进行随机采样, 每个潮区的随机样方数量为3个, 样方大小为25 cm×25 cm, 采样深度30 cm, 在当日最低潮时进行采样。潮间带生物样品用75%酒精固定5天后进行种类鉴定, 标本按种计数, 称重(湿重)。
1.3 数据分析
潮间带大型底栖动物依据采样面积, 将Excel记录表中各种数据换算为单位面积的生物量(g·m–2)和密度(ind·m–2)。群落多样性指数分析采用以下计算公式[15, 27–29]:
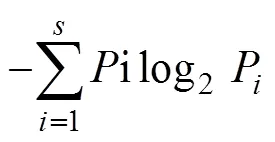
物种丰富度指数()(Margalefs species richness index):=(-1)/log2;
物种均匀度指数()(Pielou’s evenness index):=/ log2;
优势度=(n/)f。
式中,为所有种的个体总数;为总种数;P为种的个体数占总个体数的比例;n为第种的个体数;f为该种在各地点出现的频率。
大型底栖动物功能群是指具有相同生态功能的底栖动物组合, 本文根据潮间带大型底栖动物食性类型将其划分为5个功能群[30–32]: 浮游生物食者(planktophagous group,Pl)、植食者(phytophagous group,Ph)、肉食者(carnivourous group,C)和碎屑食者(detritivorous group,D)。大型底栖动物ABC曲线用Primer 5.0软件包绘制。
2 结果与分析
2.1 广东省鲎保护区幼鲎资源状况
2.1.1 幼鲎数量和丰度
经过为期两个月对广东省内鲎保护区调查, 6个保护区中仅有2个发现幼鲎分布。其中遂溪中国鲎保护区幼鲎数量较多, 共发现165只幼鲎; 徐闻圆尾鲎保护区幼鲎数量极少, 全面扫描整个保护区仅发现2只中国鲎幼体, 无法根据样方法计算其丰度。其余4个鲎保护区均未发现幼鲎分布。在此次调查中发现遂溪中国鲎保护区是圆尾鲎幼鲎和中国鲎幼鲎共存的栖息地, 共发现122只中国鲎(4.77 ind·100 m–2), 43只圆尾鲎(1.68 ind·100 m–2)(表1)。
2.1.2 幼鲎年龄结构
根据鲎头胸甲宽即可判断幼鲎龄期。由于徐闻保护区幼鲎数量太少, 无法进行统计分析。遂溪中国鲎保护区中国鲎幼鲎头胸甲宽最小为11.10 mm, 最大为71.80 mm; 圆尾鲎幼鲎头胸甲宽最小为13.05 mm, 最大为43.55 mm。对中国鲎和圆尾鲎平均头胸甲宽数据进行龄期划分, 结果如表2、3所示。遂溪中国鲎保护区中国鲎幼鲎在3—11龄连续分布, 未发现1—2龄幼鲎; 圆尾鲎幼鲎在5—10龄连续分布, 其中5龄个体最少仅有一只。由图2、3可知遂溪中国鲎幼鲎主要集中于6—10龄, 其中10龄个体数量最多; 圆尾鲎幼鲎主要集中于6—9龄, 其中7龄个体数量最多。两个幼鲎种群年龄结构均不稳定, 较大龄期个体数量明显高于低龄期个体数量, 种群呈现衰退型龄期结构, 幼鲎种群较脆弱。

表1 遂溪中国鲎保护区鲎的数量和丰度分布

图2 中国鲎年龄结构
Figure 2age structure
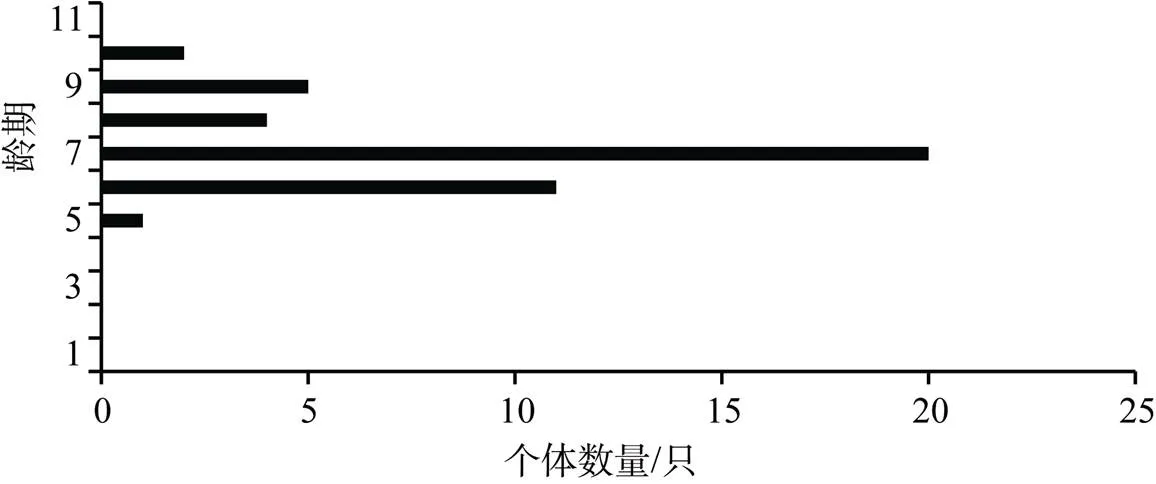
图3 圆尾鲎年龄结构
Figure 3age structure
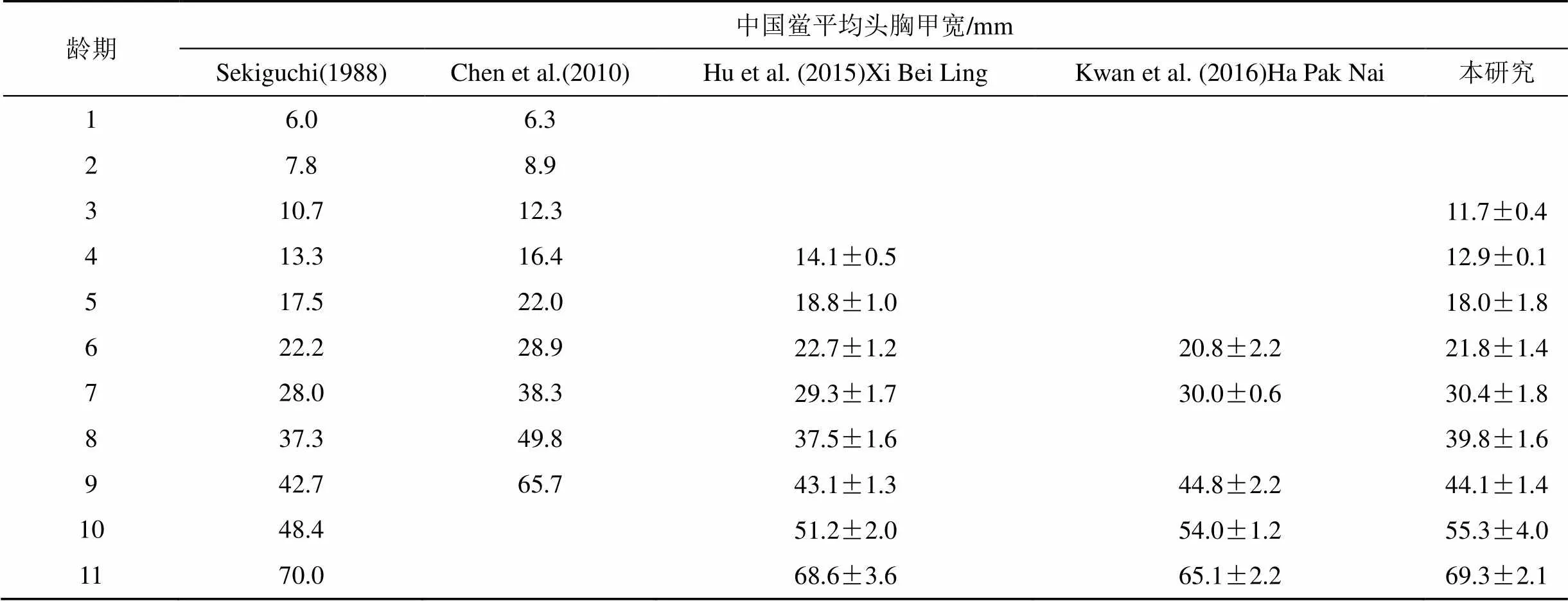
表2 各龄期中国鲎平均头胸甲宽
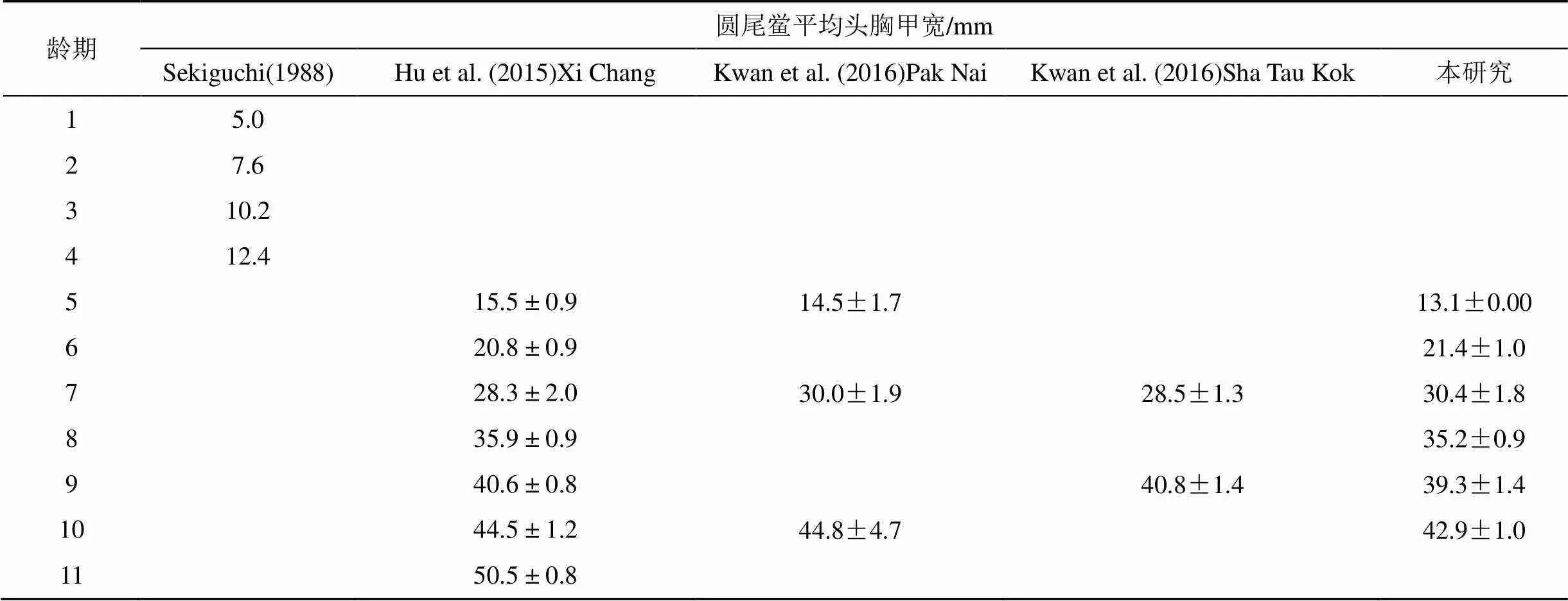
表3 各龄期圆尾鲎平均头胸甲宽
2.2 广东省遂溪和徐闻潮间带大型底栖动物优势种
按大型底栖动物优势度≥0.02划分, 如表4所示, 遂溪潮间带共有10种优势种, 其中软体动物5种, 环节动物3种, 节肢动物2种; 优势度最高的为琴文蛤(0.77)。徐闻潮间带优势种明显少于遂溪, 共有4种优势种, 均属节肢动物, 优势度最高的为短指和尚蟹(0.13)。两地优势种差异较大, 没有相同的优势种。

表4 潮间带大型底栖动物优势种及其优势度
2.3 广东遂溪和徐闻潮间带大型底栖动物多样性
遂溪和徐闻潮间带大型底栖动物多样性存在一定的差异。其中, 遂溪的物种多样性指数()高于徐闻, 分别为2.06和1.73; 遂溪和徐闻的均匀度指数()较为接近, 分别为0.66和0.69; 遂溪的丰富度指数为4.73, 徐闻的丰富度指数为3.23(表5)。
2.4 广东遂溪和徐闻潮间带大型底栖动物功能群
2.4.1 大型底栖动物功能群组成与空间分布
对遂溪和徐闻鲎保护区大型底栖动物功能摄食类群进行分类分析, 遂溪大型底栖动物, 浮游生物食者种类最多, 为10种; 其次是肉食者和碎屑食者, 均为6种; 植食者相对较少, 仅有1种。徐闻大型底栖动物植食者种类最多, 为5种; 碎屑食者3种; 浮游生物食者和肉食者均为2种(图4)。
2.4.2 大型底栖动物功能群栖息密度组成
遂溪、徐闻鲎保护区大型底栖动物功能群栖息密度如图5所示。遂溪潮间带大型底栖动物总平均栖息密度为186.65 ind·m–2, 其中浮游生物食者最高, 为145.77 ind·m–2, 占总栖息密度的78.10%; 其次是碎屑食者, 平均栖息密度为23.11 ind·m–2; 肉食者平均栖息密度为15.99 ind·m–2; 最低的是植食者为1.78 ind·m–2。徐闻潮间带大型底栖动物总平均栖息密度为53.32 ind·m–2, 其中植食者平均栖息密度最高为40.89 ind·m–2, 占76.69%; 碎屑食者的平均栖息密度为5.33 ind·m–2; 浮游食者和肉食者平均栖息密度相同为3.55 ind·m–2。

表5 遂溪、徐闻潮间带大型底栖动物群落多样性指数
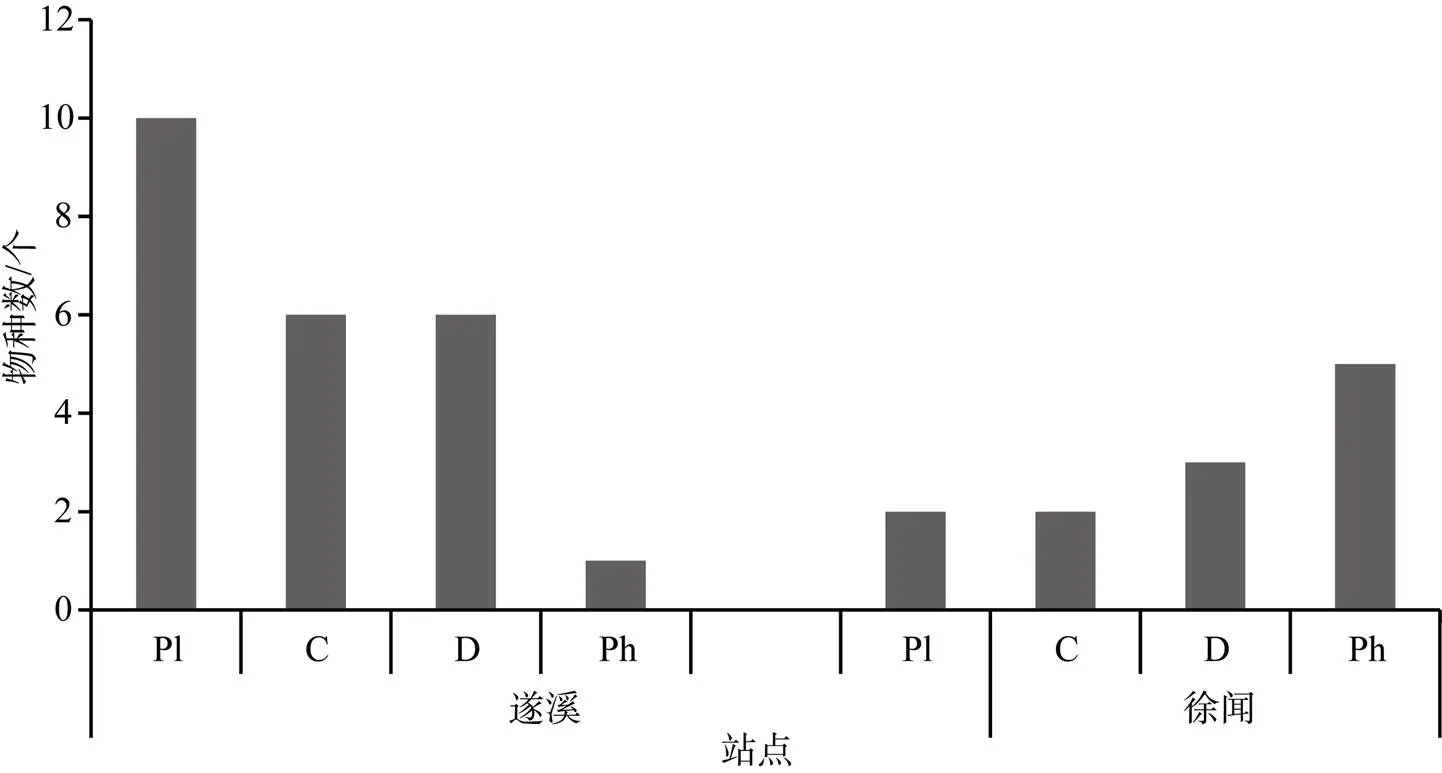
图4 遂溪、徐闻潮间带大型底栖动物各功能摄食群物种数分布
Figure 4 Distribution of species number of macrobenthic functional feeding groups in the Suixi and Xuwen intertidal zones
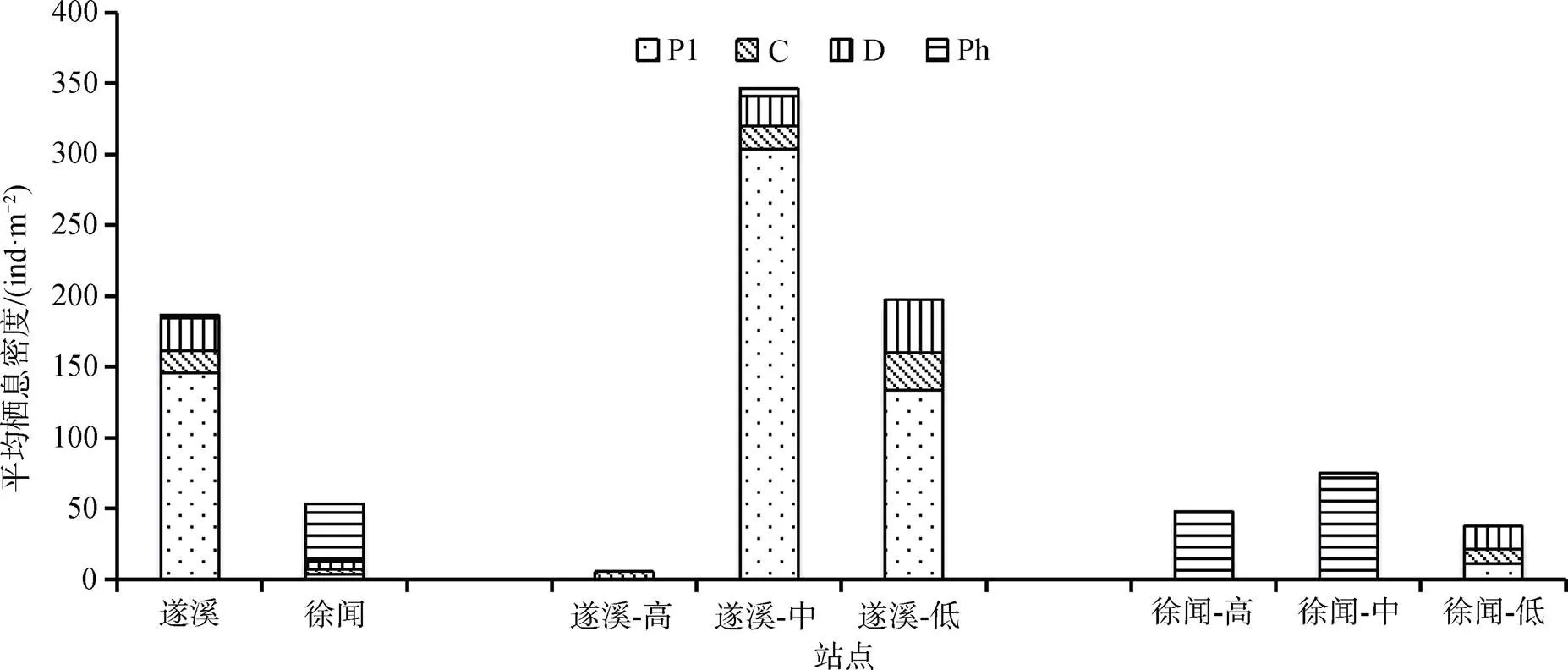
图5 遂溪、徐闻潮间带大型底栖动物各功能摄食群平均栖息密度组成
Figure 5 The composition of average biological density of macrobenthic functional feeding groups in the Suixi and Xuwen intertidal zones
遂溪、徐闻鲎保护区中潮区大型底栖动物功能群平均栖息密度均高于高潮区和低潮区; 徐闻3个潮区间平均栖息密度分布相对均匀, 遂溪3个潮区间平均栖息密度差异较为明显。总体来看, 遂溪大型底栖动物平均栖息密度明显高于徐闻。
2.4.3 大型底栖动物功能群生物量组成
如图6所示, 遂溪潮间带大型底栖动物总平均生物量为592.39 g·m–2, 其中, 浮游生物食者最高, 为570.54 g·m–2, 占总生物量的96.31%; 其次是碎屑食者, 平均生物量为16.20 g·m–2; 植食者平均生物量为3.89 g·m–2; 最低的是肉食者为1.76 g·m–2。徐闻潮间带大型底栖动物总平均生物量为19.29 g·m–2, 其中植食者平均生物量最高为18.58 g·m–2, 占96.32%; 浮游生物食者的平均生物量为0.43 g·m–2; 碎屑食者和肉食者平均生物量相同为0.14 g·m–2。遂溪、徐闻两地大型底栖动物的总平均生物量相差较大, 遂溪底栖动物总平均生物量明显高于徐闻。
2.4.4 大型底栖动物功能群生物多样性
遂溪、徐闻潮间带大型底栖动物功能摄食类群多样性指数(表7), 其中遂溪浮游生物食者和肉食者的Shannon-Wiener()指数、Pielou均匀度指数()、Margalef丰富度指数()相对较高, 碎屑食者的多样性指数相对较低。徐闻潮间带高潮区和中潮区植食者的多样性指数最高; 低潮区碎屑食者多样性指数最高, 浮游生物食者和肉食者次之。
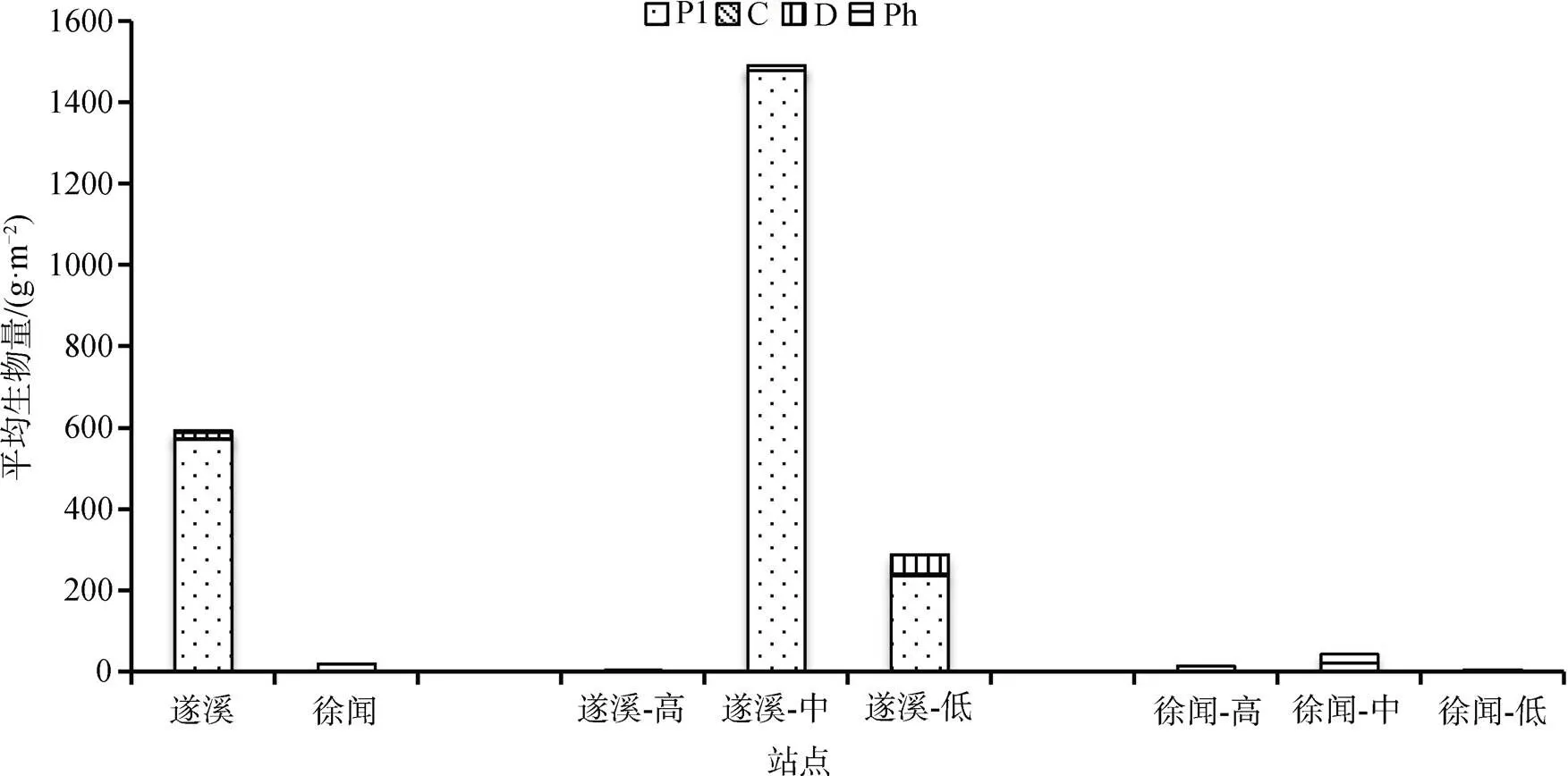
图6 遂溪、徐闻潮间带大型底栖动物各功能摄食群平均生物量组成
Figure 6 The average biomass composition of each functional feeding group of macrobenthos in the Suixi and Xuwen intertidal zones

表6 遂溪、徐闻潮间带大型底栖动物分布状况

续表
注: Mol. 软体动物门; Ann. 环节动物门; Art. 节肢动物门; Ech. 棘皮动物门; Coe. 腔肠动物门; Nem. 纽形动物门; Sip. 星虫动物门。Pl: 浮游生物食者(planktophagous group,)、Ph.植食者(phytophagous group,)、C.肉食者(carnivourous group,C)、D.碎屑食者(detritivorous group,D)“+ ”. 表示物种个体生物量<总生物量的 1%; “ + + ”. 占总生物量的 1%—10%; “ + + + ”. >总生物量的 10% ; H. 高潮区; M.中潮区; L. 低潮区。
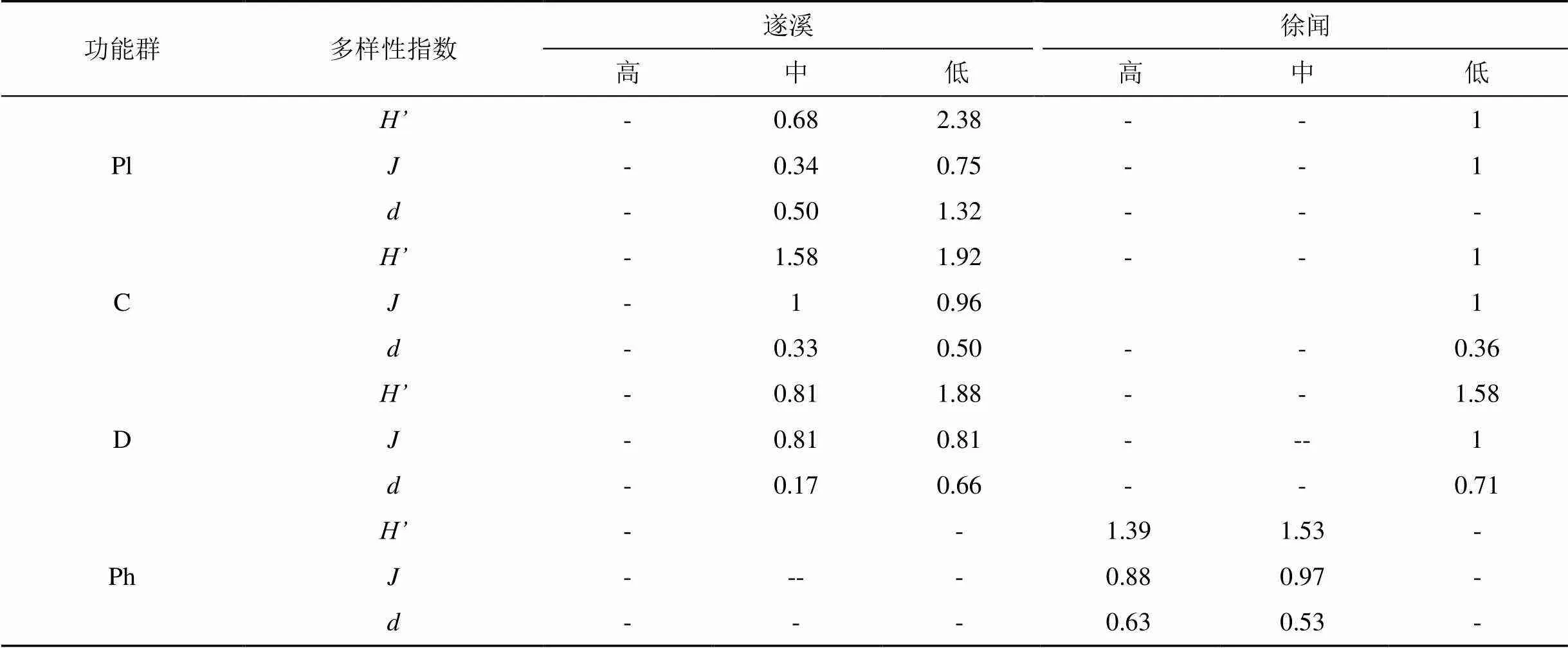
表7 遂溪、徐闻潮间带大型底栖动物功能群生物多样性
2.5 ABC曲线
ABC曲线通常能反映大型底栖动物群落的稳定性, 一般认为正常稳定的群落其生物量曲线始终位于栖息密度曲线的上方, 丰度比生物量具有更高的多样性, 一旦两条曲线相互交叉或重叠, 说明群落受扰动, 群落稳定性下降[27, 31]。根据遂溪和徐闻潮间带大型底栖动物栖息密度和生物量数据, 绘制出ABC曲线。如图7、8所示, 两地生物量曲线绝大部分位于栖息密度曲线上方, 但在末端均出现重叠现象, 表明遂溪、徐闻潮间带大型底栖动物群落结构不稳定, 受到一定程度的干扰。

图7 遂溪潮间带大型底栖动物ABC曲线
Figure 7 ABC curve of macrobenthos in Suixi intertidal zone
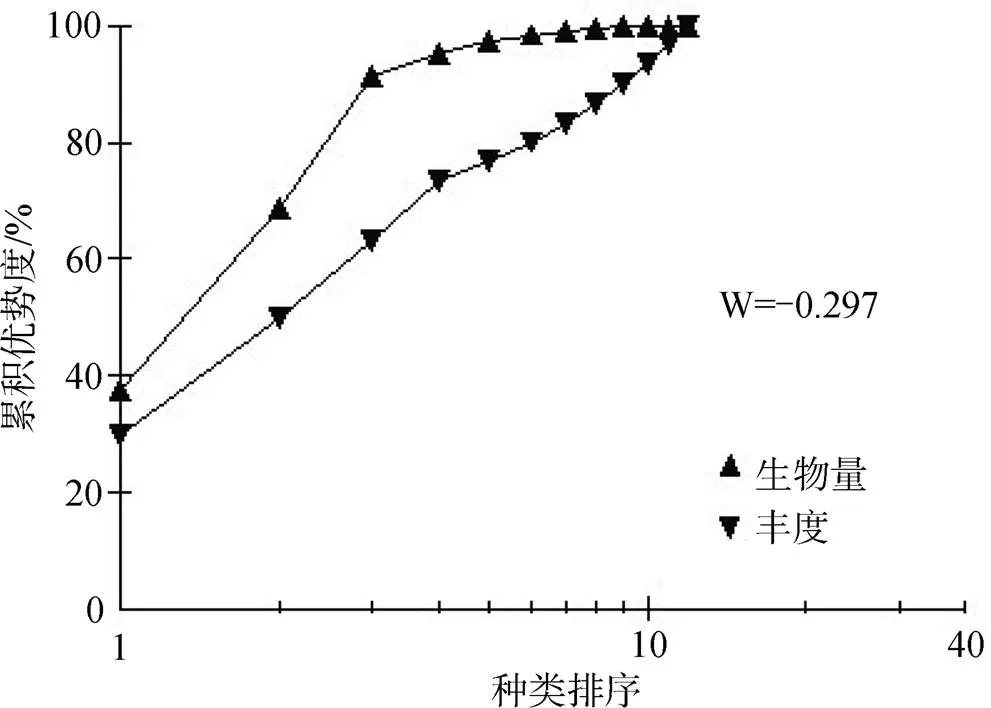
图8 徐闻潮间带大型底栖动物ABC曲线
Figure 8 ABC curve of macrobenthos in Xuwen intertidal zone
3 讨论
3.1 广东省鲎保护区幼鲎资源现状堪忧
中国鲎曾经广泛分布于长江口以南, 直至北部湾的广大近海区域, 只要是泥沙质的海滩和风浪较为平静的海湾, 曾经都是中国鲎的栖息地, 如浙江、福建、广东和广西沿海海域, 历史上都有大量中国鲎分布[3]。自20世纪80年代后, 随着经济快速发展、过度捕捞、栖息地环境破坏等造成中国鲎资源快速衰退。翁朝红[3]在2006—2007年对浙江、福建、广东、广西、海南和台湾金门岛沿海海域27个海滩进行了鲎资源走访调查, 结果显示雷州湾、珠江口海域以及潮汕地区海域, 已极少见到上岸产卵的中国鲎, 潮汕地区中国鲎近乎绝迹。本次对广东省现有6个鲎保护区调查显示, 从前海滩随处可见成对中国鲎上岸产卵的盛况已经消失, 位于粤西的遂溪、徐闻鲎保护区现今还有幼鲎分布, 但位于潮汕地区的3个鲎保护区和湛江南三岛鲎保护区内没有发现一只幼鲎或成鲎分布。相较于粤西地区, 粤东鲎资源衰退的程度更加明显, 这可能与地区的经济发展差异有关, 粤东经济发展较快, 海洋污染和鲎栖息生境破坏较为严重。其中, 潮汕地区的3个南方鲎保护区始建于2004年, 但历史调查资料显示中国海域没有南方鲎()物种自然分布, 仅有中国鲎和圆尾鲎[24]。故推测南方鲎保护区的名称可能是相对地理方位的表达, 即在划设保护区时当地确实有大量鲎自然分布, 相对中国广大陆地区域而言潮汕处于传统意义上的南方地区, 故命名为南方鲎保护区。因本次调查该地区未发现有鲎分布, 南方鲎物种是否在该地区曾经分布依然成谜, 有待更多调查研究验证。可以确认的是, 该3个鲎保护区缺乏长期有效管理策略和措施, 致使保护区内鲎种群呈现类似周边其它地区局域性灭绝状况。遂溪鲎保护区幼鲎丰度统计显示其中国鲎丰度为4.77 ind·100 m–2, 圆尾鲎丰度为1.68 ind·100 m–2, 中国鲎丰度明显高于圆尾鲎。由于未见此鲎保护区相关历史调查资料, 故无法获得其幼鲎丰度的时间差异信息。与同处于北部湾海域沿岸的其他调查相比, Hu[23]等对北部湾沿岸西背岭、金海湾、下村3个地方鲎调查显示, 中国鲎幼鲎平均丰度为0.88—3.19 ind·100 m–2, 圆尾鲎幼鲎平均丰度为0.14—1.73 ind·100 m–2, 与遂溪鲎保护区幼鲎分布相似, 但遂溪鲎保护区中国鲎幼鲎丰度更高。与Kwan[24]报道的香港18个鲎产卵场/育幼场调查相比, 遂溪鲎保护区中国鲎和圆尾鲎的幼鲎丰度明显较高, 说明靠近北部湾海域的遂溪鲎保护区适宜作为后期中国鲎保护行动的首选核心区域。但该地区的幼鲎年龄结构显示(如图2、3所示), 低龄幼鲎相对较少, 调查没有发现1—2龄幼鲎, 5龄以下幼鲎数量明显低于7—10龄。这可能与低龄期幼鲎个体较小不易被发现有关。结果显示幼鲎种群较脆弱, 局部灭绝的可能性较高, 急需切实可行的鲎资源保护方式和科学有效的保护区管理措施。在国家公园试点统一管理各类自然保护地起点上, 重新评估适宜鲎生存的栖息地, 对一些鲎种群分布变化较大的区域进行调整, 将保护价值低的建制城镇、或人口密集区域、社区民生设施等调整出鲎保护区范围; 同时在适宜鲎生存的地区增设保护地, 比如雷州半岛西海岸线, 并定期对保护区鲎资源进行调查, 及时了解其种群变化, 为保护区建设提供一手资料。
3.2 鲎保护区大型底栖动物群落结构特征
幼鲎栖息的潮间带是生物圈中最敏感的生态系统之一, 同时又是人类活动和干扰最为严重的区域。大型底栖动物是潮间带生态系统的重要组成成分, 其群落结构变化能够很好地表征潮间带环境状况和变化[15,27, 33–34]。本次鲎保护区潮间带大型底栖动物调查结果显示, 遂溪大型底栖动物种类明显多于徐闻, 遂溪共采集到23种, 徐闻采集到12种。均低于平潭中国鲎保护区的山岐澳(38种)和坛南湾(34种)、西背岭(31种), 接近于竹林盐场(16种)[32,35]。各摄食功能群落结构显示, 遂溪大型底栖动物主要功能群为浮游生物食者, 双壳类软体动物较多, 如菲律宾蛤仔()、琴文蛤()、丽文蛤()等, 这可能与遂溪鲎保护区泥沙质的底质有关, 为双壳类生存提供了适宜环境; 徐闻主要功能群为植食者, 以甲壳类动物为主, 如短指和尚蟹()、韦氏毛带蟹()等, 这可能与该地丰富的有机质和藻类有关, 为其生长提供了充足的天然饵料。李国强调查显示, 平潭中国鲎保护区山岐澳和坛南湾大型底栖动物以植食者为主, 肉食者次之; 西背岭大型底栖动物肉食者占比最高, 浮游生物食者次之; 竹林盐场大型底栖动物以植食者为主[32]。鲎资源调查显示这几个地区均有幼鲎分布[23], 说明在鲎生存地区潮间带大型底栖动物中浮游生物食者和植食者相对丰富, 浮游动物、微藻类以及浮游植物等天然饵料资源充足。研究发现自然状态下幼鲎主要以这些天然饵料为食物[36–38], 符合幼鲎的摄食习性, 为幼鲎生长提供了充足食物。2009年李琼珍、龚竹林[8]等对广西北海西背岭中国鲎幼鲎栖息地环境因子(溶氧、pH、盐度和温度)以及底质中大型底栖动物调查表明环境因子不是影响幼鲎分布密度的重要因素, 栖息地生物群落组成和其潜在饵料生物生物量大小很可能是影响幼鲎分布的主要因素。由此可见, 可通过对幼鲎栖息地潮间带大型底栖动物群落结构分析间接评价该栖息地对幼鲎的适宜性, 为鲎栖息地保护提供理论依据。但底栖动物群落结构特征是否与幼鲎的分布以及丰度存在直接的联系, 有待更多的研究。
3.3 对保护区管理和鲎资源恢复的建议
海洋保护地划定是为了避免人为因素导致鲎繁殖和觅食生境的直接丧失。我国海洋保护地数量从1990年的5处增加至2014年的249处[39], 但由于管理资金投入不足、执法力度低、管理体系复杂等因素的影响, 导致保护区生物资源仍呈持续下降的趋势, 保护效果极不理想。本次调查的6个广东省鲎保护区, 其中4个鲎资源几乎绝迹, 2015年李国强[35]对平潭岛中国鲎保护区潮间带调查也未发现鲎幼体和成体, 表明仅凭借设立保护区对鲎栖息地保护是远远不够的。自然保护区从建立到管好需要一个过程, 在中国当前全面推进生态文明建设背景下, 要加快完善自然保护区管理机制, 既要从严追责自然保护区生态破坏行为, 又要对符合调规条件的自然保护区科学优化空间布局。提请国家早日修改完善《自然保护区管理条例》等有关法律法规, 协调保护区行政、执法、人事、财务等方面关系, 明确保护区管理权责, 使其适应鲎保护区建设和管理。
近20多年随着中国经济快速发展, 人类活动范围不断向海岸线扩展以及海平面缓慢上升, 沿海沙滩面积不断减少[40], 使依赖沙滩生存的野生动物栖息地遭到了严重破坏, 母鲎产卵场面积大大减少。美国学者对鲎产卵场修复实验表明, 通过对遭到破坏的栖息地以添加粗粒沙子方式进行修复后, 鲎产卵量明显增加[41]。对我国鲎栖息地管理应以保护为前提, 辅以修复的方式进行。保护现存适宜鲎生存的栖息地, 以北部湾沿海地区为主[40]; 修复历史上鲎大量存在的栖息地, 比如南三岛鲎保护区、珠江口沿海区域、潮汕沿海区域等。对鲎保护区的管理, 不仅要重视对鲎资源保护, 还应重视鲎保护区植被、鱼类、底栖生物和其他野生动物保护, 一方面有利于维持生态平衡及物质良性循环, 另一方面潮间带沉积物中叶绿素a及总有机碳含量是决定幼鲎密度与生长的重要因素[42]。中国目前海洋保护区数量众多, 但将鲎列入保护区管理主要对象的却很少, 随鲎保护等级升级, 建议将鲎列入更多海洋保护区野生动物保护名单。
由于鲎生活史较长, 从受精卵发育到成鲎需要10多年[8]。如果仅仅通过建立鲎保护区, 依靠鲎自然繁殖的方式恢复原有鲎种群数量, 则恢复周期长, 成效缓慢。目前必须以人工手段补上鲎繁殖和生长发育过程中被破坏的重要环节, 而最有效、最迅速的方法就是开展鲎人工育苗, 选取适宜海区和地点人工放流[8]。本调查显示, 广东省鲎保护区几乎没有上岸产卵的成鲎, 导致鲎“无处可生, 无苗可长”。为弥补这一重要环节, 鲎的人工繁殖和幼苗培育显得尤为重要。目前国内对中国鲎的人工繁育技术研究已获得成功, 笔者团队已熟练掌握此项技术, 并成功培育出了大批量幼鲎种苗, 有望进一步推广, 通过增殖放流方式在一定程度上恢复中国的鲎资源。
4 结论
基于对广东省鲎保护区幼鲎资源调查和大型底栖动物群落分析, 结论如下:
广东省划设的6个鲎自然保护区, 其中濠江企望湾南方鲎保护区、田心湾南方鲎保护区、揭阳海龟、鲎保护区和南三岛鲎类保护区内2019年夏季调查均未发现幼鲎自然分布; 徐闻圆尾鲎保护区调查仅发现2只幼鲎; 遂溪中国鲎保护区幼鲎丰度为6.45 ind·100 m–2, 是中国鲎和圆尾鲎共生的栖息地, 幼鲎丰度相对较高, 适宜作为今后广东省中国鲎保护行动的首选核心区域。
对有幼鲎分布的遂溪和徐闻鲎保护区潮间带大型底栖动物功能群分析显示, 遂溪中国鲎保护区底栖动物以浮游生物食者为主, 徐闻圆尾鲎保护区底栖动物以植食者为主。总结国内鲎栖息地大型底栖动物的研究, 笔者认为可通过对幼鲎栖息地潮间带大型底栖动物群落结构分析间接评价该栖息地对幼鲎的适宜性, 为鲎栖息地保护提供理论依据。
基于目前广东省鲎保护区幼鲎资源现状, 对保护区管理提出以下几点建议:
重新评估适宜鲎生存的栖息地, 合理划设保护区, 将保护价值低的建制城镇、或人口密集区域、社区民生设施等调整出鲎保护区范围; 同时在适宜鲎生存地区增设保护地, 提升鲎保护等级, 将其列入更多海洋保护区名单。
对鲎栖息地管理应以保护为前提, 辅以修复的方式进行。同时还应重视鲎保护区植被、鱼类、底栖动物和其他野生动物保护。
完善自然保护区管理机制和野生动物保护的相关法律法规。从严追责自然保护区生态破坏行为, 科学优化自然保护区空间布局。协调保护区行政、执法、人事、财务等方面关系, 明确保护区管理权责, 使其适应鲎保护区建设和管理。
开展鲎的人工繁殖和幼苗培育, 进行科学有效的增殖放流。
致谢:北部湾大学海洋学院的吴宙、符益健、欧尚佳等同学和岭南师范学院的陈晓海、杨家顶、巫鸿艺等同学, 以及湛江爱鸟会的庄礼凤、陈世倩、莫艳华老师等参与了本文野外调查工作, 谨在此一并向他们表示感谢!
[1] 廖永岩, 李晓梅. 中国海域鲎资源现状及保护策略[J].资源科学, 2001(2): 53–57.
[2] 廖永岩, 叶富良, 洪水根. 鲎, 一种珍贵的海洋药用动物[J] .中国海洋药物, 1998(4): 34–40.
[3] 翁朝红,谢仰杰,肖志群,等.福建及中国其他沿岸海域中国鲎资源分布现状调查[J].动物学杂志, 2012, 47(3): 40–48.
[4] 李裕红, 颉晓勇, 关杰耀.活化石中国鲎濒危现状及抢救性保护宣言[J].湿地科学, 2018, 16(5): 690–692.
[5] 廖永岩, 叶富良.中国鲎资源已告危急[J].中国水产, 2000(10): 11–12.
[6] WIDENER J W, BARLOW R B. Decline of a Horseshoe Crab Population on Cape Cod[J]. Biological Bulletin, 1999, 197(2): 300–302.
[7] 廖永岩, 洪水根, 李晓梅.中国南方海域鲎的种类和分布[J].动物学报, 2001, 47(1): 108–111.
[8] 洪水根. 中国鲎生物学研究[M].厦门:厦门大学出版社, 2011.
[9] 李琼珍, 胡梦红.广西北海中国鲎资源现状以及保育工作进展[J].海洋环境科学, 2011, 30(1): 131–134.
[10] 鲍虞园, 叶国玲, 颉晓勇.中国鲎人工繁育及1龄稚鲎形态性状对体质量的影响[J].渔业科学进展, 2020, 41(4): 77–84.
[11] 翁朝红, 肖志群, 谢仰杰, 等.创设厦门海域中国鲎自然保护区[J].集美大学学报(自然科学版), 2008(1): 40–44.
[12] 陈章波, 范航清, 廖永岩, 等.面临生存困境的动物活化石—鲎[J].科学, 2015, 67(3): 60–62.
[13] 陈秋明.厦门海域中国鲎资源的研究与保护[J].环境科学与管理, 2009, 34(6): 9–11.
[14] MEE (Ministry of Ecology and Environment of the People’s Republic of China). Nature Reserves in Guangdong Province[EB/OL].http://www.mee.gov.cn/ stbh/zrbhq/qgzrbhqml/201605/t20160522_342675_wap.shtml. 2019-12-11.
[15] 李轶平, 王小林, 郭栋, 等.辽东湾潮间带夏季大型底栖动物群落结构研究[J].海洋环境科学, 2016, 35(2): 214–220.
[16] MORTON B, LEE C N. Spatial and temporal distributions of juvenile horseshoe crabs (Arthropoda: Chelicerata) approaching extirpation along the northwestern shoreline of the New Territories of Hong Kong SAR, China[J]. Journal of Natural History, 2010, 45(3/4): 227–251.
[17] HU Menghong, WANG Youji, Chen Yan, et al. Summer distribution and abundance of juvenile Chinese horseshoe crabsalong an intertidal zone in southern China[J]. Aquatic Biology, 2009, 7: 107–112.
[18] LEE C N, MORTON B. Emergence Behavior of JuvenileUnder Simulated Tidal Conditions in the Laboratory and at Two Different Sediment Temperatures[M]. Boston, MA:Springer US, 2009.
[19] SHIN P K S, LI H, CHEUNG S G. Horseshoe Crabs in Hong Kong: Current Population Status and Human Exploitation[M]. Boston, MA:Springer US, 2009.
[20] CHIU H M C, MORTON B. The morphological differentiation of two horseshoe crab species,and(Xiphosura), in Hong Kong with a regional Asian comparison[J]. Journal of Natural History, 2003, 37(19): 2369–2382.
[21] Sekiguchi K S.Post-Embryonic Development of the Horseshoe Crab. Biological Bulletin, 1988, 174(3), 337–345.
[22] CHEN Y, LAU C W, CHEUNG S G, et al. Enhanced growth of juvenile(Chelicerata: Xiphosura) in the laboratory: a step towards population restocking for conservation of the species[J]. Aquatic Biology, 2010, 11(1): 37–46.
[23] HU Menghong,KWAN K Y. Population Structure and Growth of Juvenile Horseshoe Crabsand(Xiphosura) in Southern China[J]. Changing Global Perspectives on Horseshoe Crab Biology, Conservation and Management, 2015(8): 167–180.
[24] KWAN B K Y, HSIEH H, CHEUNG S G, et al. Present population and habitat status of potentially threatened Asian horseshoe crabsandin Hong Kong: a proposal for marine protected areas[J]. Biodiversity and Conservation, 2016, 25(4): 673–692.
[25] 国家海洋局发布.海洋监测规范[M].北京: 海洋出版社, 1991.
[26] 国家技术监督局. 海洋调查规范[M].北京: 中国标准出版社,2007.
[27] 金文育, 彭欣, 王宁, 等.渔山列岛夏季潮间带大型底栖生物群落结构研究[J]. 海洋科学, 2017, 41(3): 17–25.
[28] 朱四喜, 王凤友, 杨秀琴, 等.浙江大、小长涂岛潮间带大型底栖动物的群落结构研究[J].生态科学, 2014, 33(1): 51–55.
[29] 曾雷,陈国宝,李纯厚,等.大亚湾湾口游泳生物群落季节异质特征与生态效应分析[J].南方水产科学, 2019, 15(3): 22–32.
[30] 赖廷和,何斌源,黄中坚,等.防城河口湾潮间带大型底栖动物群落结构研究[J].热带海洋学报, 2019, 38(2): 67–77.
[31] 陈梓林,李纯厚,肖雅元,等.江门近岸海域大型底栖动物群落结构的分布特征[J].南方水产科学, 2020, 16(4): 18–27.
[32] 李国强.中国鲎栖息的沙质潮间带基于大型底栖动物的生态监测与评价[D]. 厦门:厦门大学, 2017:17–45.
[33] 李亚芳,杜飞雁,王亮根,等.基于生物性状分析方法的不同恢复阶段无瓣海桑人工林湿地大型底栖动物生态功能研究[J].南方水产科学, 2018, 14(3): 10–19.
[34] 刘开珍, 杜飞雁, 李亚芳, 等.大亚湾大型底栖动物近30年次级生产力变化特征[J].南方水产科学, 2018, 14(2): 1–9.
[35] 李国强, 叶伟鹏, 余怀勇, 等.平潭岛中国鲎保护区沙质潮间带的大型底栖动物群落[J]. 海洋环境科学, 2017, 36 (2): 179–185.
[36] LOVELAND B R E. Abundance and dispersal potential of horseshoe crab () larvae in the Delaware estuary[J]. Estuaries, 2003, 26(6):1472–1479.
[37] ZHOU H,MORTON B. The diets of juvenile horseshoe crabs,and(Xiphosura),from nursery beaches proposed for conservation in Hong Kong[J]. Journal of Natural History, 2004, 38(15): 1915–1925.
[38] CARMICHAEL R H, RUTECKI D, VALIELA I. Abundance and population structure of the Atlantic horseshoe crabin Pleasant Bay, Cape Cod[J]. Marine Ecology Progress Series, 2003, 246: 225–239.
[39] 曾江宁, 陈全震, 黄伟, 等.中国海洋生态保护制度的转型发展—从海洋保护区走向海洋生态红线区[J].生态学报, 2016, 36(1): 1–10.
[40] 朱俊华, 吴宙, 冯炳斌, 等. 全球中华鲎资源保护现状及对策建议[J].生物多样性, 2020, 28(5): 621-629.
[41] SMITH J, NILES L, HAFNER S. Beach restorationimproveshabitat quality for American horseshoe crabs and shorebirds in the Delaware Bay, USA[J]. Marine Ecology Progress Series, 2020, 645: 91–107.
[42] XIE Xiaoyong, WU Zhou, WANG Chunchieh, et al. Nursery habitat for Asian horseshoe crabs along the northern Beibu Gulf, China: implications for conservation management under baseline gaps[J]. Aquatic Conservation: Marine Freshwater Ecosystems, 2020, 30: 260–272.
Summer investigations on intertidal macrobenthic communities within horseshoe crab protected areas in Guangdong Province
LI Yinkang1,2,3, BAO Yuyuan1,2, LIN Wuying4, KWANKit Yue5, RAO Yiyong1,6, XIE Xiaoyong1,3,*
1. Key Laboratory of South China Sea Fishery Resources Exploitation &Utilization, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China 2. College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou, 511458, China 4. Guangxi Biodiversity Research and Conservation Association, Nanning 530022, China 5. College of Marine Sciences, Guangxi Key Laboratory of Beibu Gulf Marine Biodiversity Conservation, Beibu Gulf University, Qinzhou 535011, China 6. College of the Environment and Ecology, Xiamen University, Xiamen 361102, China
There are six horseshoe crab marine protected areas (MPAs) in Guangdong Province. However, the baseline information on distribution, size and trend of horseshoe crab populations is virtually unknown. The lack of information has hindered the formulation of scientific management strategies and conservation actions. In this study, field surveys were conducted to investigate the current status of horseshoe crab populations in each of the six MPAs, and to analyze the macrobenthic communities in the intertidal zone. The results showed that juvenile horseshoe crabs were only found in Suixi Chinese horseshoe crab and Xuwen mangrove horseshoe crab MPAs. The abundance of the juveniles within Xuwen MPA was considerably low, i.e., only two juveniles were found. The abundance in Suixi MPAs was 6.45 ind·100 m–2, but the number of individuals in young size group was much lower compared to that of elder groups. The analysis of functional groups of macrobenthos in the MPAs intertidal areas demonstrated that those from Suixi were mainly plankton feeders, while those from Xuwen were primarily phytoplankton feeders. Plankton, microalgae, phytoplankton and other natural food sources are abundantly available, which can fulfill the feeding requirements of the juveniles. The population surveys within the horseshoe crab MPAs revealed the unsatisfactory situation of horseshoe crabs in Guangdong Province, and the management of these MPAs should be improved urgently. Conservation actions such as upgrading the protection level of the horseshoe crab, establishing scientifically-sound restocking program and effective management measures are imperatively required.
horseshoe crab; population survey; protected area; macrobenthos; functional group
李银康, 鲍虞园, 林吴颖, 等. 夏季广东省鲎保护区潮间带大型底栖动物群落研究[J]. 生态科学, 2023, 42(1): 83–94.
LI Yinkang, BAO Yuyuan, LIN Wuying, et al. Summer investigations on intertidal macrobenthic communities within horseshoe crab protected areas in Guangdong Province[J]. Ecological Science, 2023, 42(1): 83–94.
10.14108/j.cnki.1008-8873.2023.01.010
S932.8
A
1008-8873(2023)01-083-12
2020-10-27;
2020-12-17
深圳市质兰公益基金项目(2019040441B); 南方海洋科学与工程广东省实验室(广州)人才团队引进重大专项(GML2019ZD0605); 广东省科技计划项目(2019B121201001)
李银康(1997—), 男, 硕士研究生, 研究方向为中国鲎生物学, E-mail: lykangkang1021@163.com
颉晓勇(1976—), 男, 副研究员, 研究领域为水产养殖和种质资源保护, E-mail: xyxie@scsfri.ac.cn

